基于机理模型的锂电池最佳放电策略研究
2024-01-10吴新华刘林萍季青锋杜倩昀李祖鑫张锋
吴新华,刘林萍,季青锋,杜倩昀,李祖鑫,张锋
(国网浙江省电力有限公司丽水市供电公司,浙江 丽水 323000)
0 引言
随着传统能源供应日趋紧张,全球新能源的应用日趋广泛[1-2],对新能源技术的开发日趋迫切,储能技术的研究成了重中之重。锂离子电池具有能量密度高、循环寿命长、标准电压高等优点,在电动汽车储能电池[3]和电网储能系统[4]等领域备受青睐。
为了对大量可调可控却无序发电的清洁能源进行有效利用,并降低对电网的影响,浙江丽水某县通过配置锂电池储能站设计了县域微网,并需要根据当地资源特性指定储能电站充放电优化策略。锂电池的充放电过程中,电池内部电化学副反应导致电池组内部劣化,进一步导致循环寿命降低,直接影响着锂电池技术的发展和应用。考虑到锂电池的更换成本[2],如何最大限度地减少退化量来尽可能延长电池的循环寿命显得非常重要。
国内外对锂电池充电和放电循环寿命退化机制进行了多方面研究[5]。虽然每次循环的放电容量随着放电电流的增加而降低,但是循环寿命不一定遵循相同的模式。寿命总累积可提取能量是影响电池寿命的另一个因素。Laman和Brandt报告称,Li/MoS2电池在最佳放电电流下显示出最大循环寿命[6],两个方向上的较大偏差导致其最大循环寿命损失超过1/3。作者通过实验确定了低、中、高放电电流的3个不同区域,并提出了不同的退化机制组合。
低放电率的退化归因于开路时,自放电反应之外的电流在电极上触发的与时间相关的不可逆的电解质分解。Denis得出结论[7]:当溶剂渗透通过电极钝化膜上的裂纹时,可能发生小规模电解质分解,其中可循环锂会产生不可逆的损失。在充电状态下,两个电极都具有最高的反应倾向,因为在这样的电压下,碳酸亚乙酯(EC)和碳酸二甲酯(DMC)等常用电解质的稳定性较低,其氧化和还原机制均已通过实验得到充分证明[8],并且在充电和放电循环中均相同,仅取决于过电位值。
针对锂电池放电优化问题,张华栋等人[9]提出了多种旨在提高锂电池放电容量的放电方案并进行了实验分析。实验结果表明,在多芯电池系统中,使用开环和闭环复用方法的放电容量比使用顺序放电方法的有所提高。多芯电池系统中的多路复用允许将事先确定的可变负载分配到电池组中适当的并联电池组。Adany等人提出了一种基于惩罚的切换算法[10],该算法使用每个电池的优化电流(Iopt),根据需求选择电池的一个优化子集,其惩罚值为0,偏离此最佳电流将相应增加惩罚值。虽然Iopt值是事先设置的,但所提出的算法可以减少惩罚函数的计算量。对于高于和低于Iopt的电流,惩罚模型均为线性。虽然这种线性化惩罚的假设在模拟中很简单,可以作为算法的概念证明,但它没有考虑电池放电循环中的非线性退化元素,尤其是在低电流区域。
本文分析了放电过程中的退化机制,并提供了一种确定Iopt值的方法。 这项工作的动机是基于电化学第一性原理来研究外部刺激(由控制器控制的放电电流)是如何影响和最小化降解量的。因此,这项工作的重点是研究每周期最佳电流的趋势,以及最佳电流是如何随着电池老化而变化的,以用于电气工程中电池控制器的设计,而不是开发新的电池模型。本文研究使用索尼18650锂电池,通过同时模拟在低电流放电期间导致电解质溶解的两个电极中的氧化还原副反应,将得到的结果与已知的高电流降解效应相结合,进而确定锂离子电池在其生命周期不同阶段的Iopt趋势。
1 锂电池老化机理
锂离子电池的充放电反应不可避免地伴随着正负极材料、电解质溶液和隔膜之间的电化学反应,其主要特点是正负电极材料发生氧化腐蚀[11]。由于锂离子的连续嵌入和脱嵌,电极中活性物质的连续还原与降解,电解质溶液可能出现层析或分离现象。锂离子电池在老化过程中逐渐退化,电接触不良和内部极化等问题严重影响电池的性能;在电解质溶液的分解过程中,电极的导电性能逐渐下降,在电极的破损表面形成更多固态电解质膜,锂离子电池性能逐渐退化、容量逐渐减小。嵌在正极和负极的锂离子数量减少,最终导致容量变小。
电池在放电过程中容量下降的主要原因是锂离子沉积,用活性物质的体积分数变化来表征电池的容量衰减特性,活性锂的损失是导致锂离子电池性能下降的主要原因。固体电解质膜(solid electrolyte interphase,SEI)是电解质溶液在石墨负电极界面反应形成的保护膜,SEI的形成及增厚将减少可循环锂的数量。
不可逆的副反应涉及碳、LiCoO2电极材料和可用反应表面积的损失,导致了容量的损失。本文通过模拟这些副反应的累积效应来研究低电流退化机制,以便于进一步研究最佳放电电流。
2 锂电池机理模型
基于电化学的锂离子电池建模技术得到了广泛的发展[12-13]。锂离子电池负极通常由石墨衍生物组成,正极是锂离子金属氧化物。正极和负极中活性物质的主要成分发生化学反应,使电池具有充放电功能。根据欧姆定律,多孔碳阳极在充电过程中形成的薄膜会导致电位下降。
在静态、完全带电状态下,两个电极都受到钝化膜的保护,防止电解质在亚稳定状态下通过氧化还原反应分解。在低电流放电速率下,存在钝化层减弱的情况,而电极保持最高的氧化还原活性。Adany等人得出结论[10],放电电流足够使电池处于部分带电状态才是最优的。
考虑固相中锂离子的质量输运和电荷输运,基于物理的锂离子插层数学模型已经得到很好的发展[14],其中的电化学反应、传质等过程也是众所周知的。
为模拟低电流降解效应,考虑的电化学反应为文献[15]中报道的电池处于带电状态时,电极与电解质之间的双电子电解质溶液氧化还原过程,反应式如下。
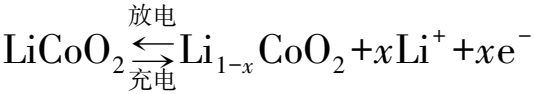
(1)
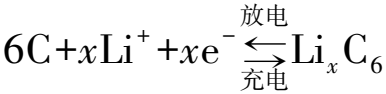
(2)
在零放电电流下,电池还原和氧化能力最大化,但保护钝化层阻碍了反应;在低电流时,钝化层被电流削弱,但氧化还原电位仍接近最大值。
本文采用一种基于机理模型的锂离子电池模型分析方法,探究电池在循环周期内的模型参数变化规律。该模型考虑到电解质和电池老化的物理过程,将正负电极近似为单个球形粒子,并描述了固态和电解质相的锂浓度动力学。锂离子电池的机理模型示意如图1所示,它由正极、隔膜和负极组成,锂化有机溶液不仅填充多孔元件还充当电解质;在放电期间,锂离子从负极流动,插入到正极。
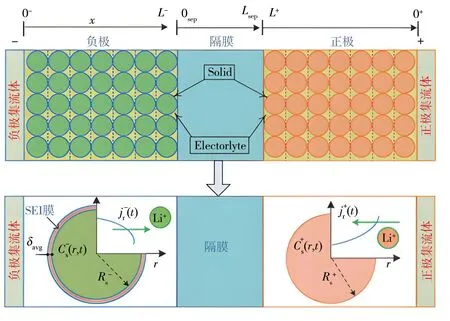
图1 锂电池机理模型结构图
此外,两电极间的寄生氧化还原反应也不可忽略。Butlere-Volmer方程用于描述电极/电解质界面上的界面反应动力学,但由于假设副反应是不可逆的,因此可以将其简化为Tafel方程。
(3)
式中:Jpara为电极电流的密度;J0,para为交换电流密度;αc为正极(阴极)方向电荷传递系数;F为法拉第常数;ηpara为活化过电位;T为热力学温度;R为气体常数。
本文采用的过电位计算式如下:
ηpara=Φ1-Φ2-Ue-jRfilm
(4)
其中电阻Rfilm定义为:
Rfilm=RSEI+RP(t)
(5)
(6)
(7)
式中:RSEL为反应过程中固体电解质界面膜的电阻;Rp(t) 是副反应产物形成的电阻;δfilm为成膜率;Φ1为电极电势;Φ2为电解质溶液电势;Ue为额定电势;j为单位电流密度。
因此,在周期N处的薄膜电阻为:
Rfilm|N=Rfilm|N-1+Rp(t)|N
(8)
该模型在Windows下的COMSOL6.0中进行仿真。
3 研究方法
不同运行参数对电池的老化机制影响也有所不同[16]。电极材料的损失与高放电速率相关,可以通过改变两电极的初始荷电状态(state of charge,SOC)来降低损失,而电解质的分解导致溶液相有效扩散系数降低。相对于离子的速率,副反应非常缓慢,并且可以假定在每个循环中电池参数都处于准稳态。
本文采用电解质溶液浓度损失来量化各种老化机制的老化效果,保持放电深度(depth of discharge,DOD)恒定,而不是保持放电端电压恒定,每个充放电周期通过电池的电荷量保持恒定,以隔离材料损耗的影响,即0.5 C放电的时间是1 C放电的2倍(“C”表示C-rate,是衡量电池充放电速率的单位,用于描述在1 h内充电或放电到额定容量的速率),计算固定的电荷量也有助于设计应用级的燃料计和电荷控制器。本文假设电池带控制器放电电流小,不考虑高放电速率下过充、体积变化和热效应引起的表面损伤所导致的退化机制。虽然在充电循环中也会出现同样的电解质损失机制,但本文侧重于优化放电循环,没有考虑这一机制。充电电流一般由充电电路根据所需的充电时间决定,在充电周期到达恒压充电阶段前保持恒定。
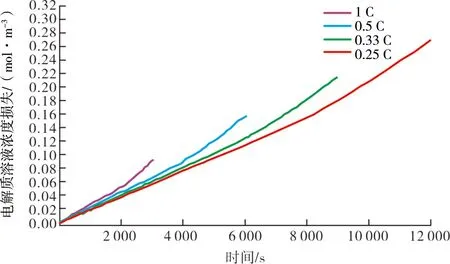
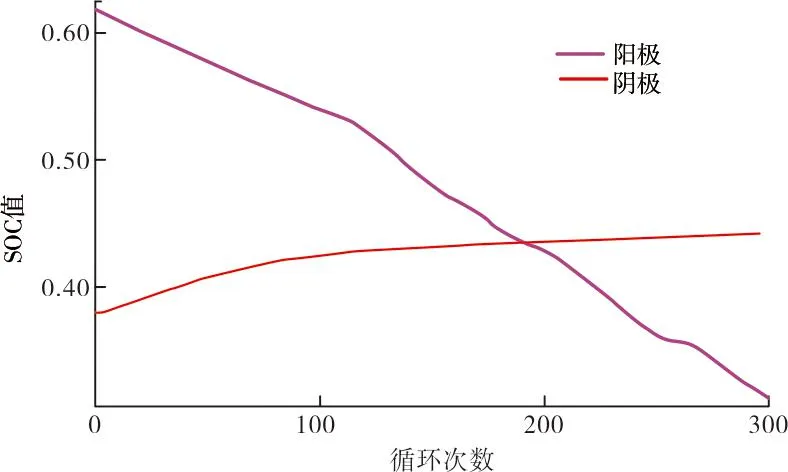
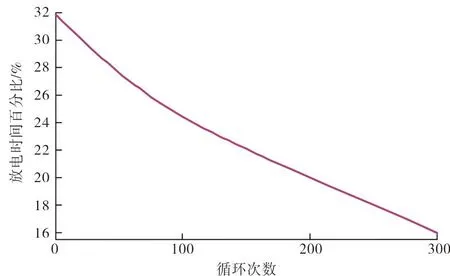
两个电极的SOC(x0,pos,x0,neg)和阴极的体积分数(εpos),会随着单体循环而波动[17]。阴极和阳极的起始SOC分别增加和减少,表明电荷水平较低,活性物质减少。阴极的体积分数也随着电池循环而降低,表明可用于循环的活性物质出现损失[18]。图2显示了上述3个参数随反应周期的变化情况,模型中利用这些参数来研究Iopt随单体周期的变化情况。已知在极低放电速率( 图2 模型参数初值随循环的变化 为了将结果与上述多电池组中的多路复用型放电方案相关联,选择放电率为C值的分数。随着最佳电流的减小,要获得等效负载就需要并联更多的电池。 模型中使用的18 650单元的其他通用建模参数见表1。 表1 阴极和阳极材料的参数 第一次放电循环(循环1)结束时阴极电解质溶液的浓度损失曲线如图3所示,其中x轴是无量纲的。从分离器/电极界面开始,沿阴极的电解质溶液损失量相对恒定,并在集电器附近下降。本文研究的目的是建立基于电池外部控制的有效放电策略,为了一致性,阴极中电解质损失的数据点取x=2.5。 图4为不同电流水平下阴极循环1后溶剂损失浓度,由于副反应,损失率相对平稳,这种损失率在放电循环结束时略微增加。每个图的末端代表相同的放电容量,从图中可以看出,随着放电电流的减小,电解质总损失增加。在0.5 C时,阴极电解质溶液的总损失比1 C时的损失增加了1.69倍,在0.33 C处损失增加了2.43倍,在0.25 C处损失增加了2.89倍。在放电循环的前一阶段,阴极不同放电电流之间的损失率非常相似,后期的偏差也相当小。这表明放电循环是一个主要依赖于时间的过程。 图4 不同电流水平下循环1后阴极电解质溶液损失浓度 图5显示了在不同电流水平下阳极处循环1之后溶剂损失的浓度。与阴极侧一样,电解质的总损失随着放电电流的下降而增加。然而,在放电的后半部分,损耗量大约低一个数量级,并且损耗率趋于平稳。这表明,就材料损失率而言,存在两个截然不同的操作区域。 图5 不同电流水平下循环1后阳极电解 质溶液损失浓度 这两个区域的行为表明,最小化低电流退化的策略应集中在阳极处的反应。在平坦区之前的第1阶段中,所有图中的损失率非常相似,并且在绝对时间尺度上,1 C放电最快地到达低损失的第2区。这是因为副反应的超电势随着放电电流的增加而以更高的速率降低,从而在更短的时间范围内有效地终止副反应。 当阳极的SOC接近0.62时,4个放电循环达到最大电解质损失的90%,这是一个一致性的选择点,同时也表明了电池的状态;当电池保持在平坦电压区域时,在全放电周期的32%达到该点。表2显示了循环1中该特定点不同放电率的特定端子电压,这表明阳极是主要的限制电极。 表2 循环1中90%最大电解质溶液损失时的 终端电压 根据曲线图的形状可以推断,在每个循环开始时,初始最佳放电电流可高达1 C,因为不同电流水平下的损耗率相似,同时不会触发先前工作中描述的高电流相关降解。 当电池接近低电流相关退化损耗减慢的SOC时,降低放电电流将减少物理损伤导致的退化量,而低电流相关过程导致的退化已经逐渐减少。第2个区域的放电电流可以安全地降低到0.25 C或更低。最佳电流的减少取决于多电池组的配置及所涉及的额外开关所需的电气设计的复杂性,这超出了当前研究的范围。较低的放电电流会增加每个周期的放电容量,在本例中增加约5%,这表明如果使用基于惩罚的模型通过最小化长期退化和最大化寿命放电容量来优化电池的循环寿命,那么零惩罚电流(Iopt)实际上不是单个周期内的常数,并且应该随着电池的放电而降低。然而,基于惩罚的低电流模型所建议的线性特性是合理的,因为电解质损失与放电电流水平几乎成反比。 电解质溶液降解损失的速率随着电池循环而降低。图6显示了1 C放电电流的3个特定循环,其他低放电电流遵循相同的趋势,因为薄膜形成的欧姆电阻和初始SOC的降低,会降低阳极处的还原电位和电解质解离速率。对于每个循环的所有放电电流,图5中平坦区域之前的两个电极的SOC都在彼此的2%以内。 图6 1 C放电率下3个不同放电循环的电解质溶液损失 图7显示了两个电极最大损耗90%时的SOC值。随着电池周期的进行,两个电极的起始SOC根据图2发生变化,起始SOC和90%水平SOC之间的差异继续减小。在循环1中,阳极SOC从循环开始到第2个区域的变化为-0.23;而在循环300中,此变化下降了一半,至-0.11。从阴极的SOC可以得出类似的结论。 图7 阴极和阳极在90%损耗水平下SOC随循环数的变化 达到低损耗区域的SOC变化率的降低表明在阳极处达到平坦第2区域的放电时间更短,放电时间百分比如图8所示。不同放电电流的全放电时间成比例且不同,但到达平坦区域的时间百分比是一致的。 图8 每次循环达到最大电解质溶液损失90%所用的放电时间百分比 随着电池周期的不断推进,达到低损耗条件所需的放电时间百分比几乎减少了一半,在第300次循环中,从32.23%下降到16.61%。考虑到第300次循环中较低放电电流区域的降解率小于第1次循环中降解率的10%,再加上其他研究的有力证据足以表明,在1 C以下,高电流降解效应显著减弱,每个循环开始时的最佳电流随电池循环而减少。 本文采用锂离子电池机理模型,通过荷电状态和循环数对低放电电流相关的退化机制进行了研究,确定了一般锂离子电池的最佳放电电流及其变化规律。 研究结果表明,锂电池在充放电过程中,副反应在阳极侧占主导地位,并且在阳极的每个放电循环中有两个不同的降解阶段。 为了最大限度地减少电解质溶液损失引起的电池退化,并提高综合放电容量锂电池在使用过程中最佳放电电流应保持在放电循环开始时的1 C水平,当荷电状态SOC达到阳极中副反应速率显著降低的点时,应降低放电电流。 本文研究仍有不足之处,随着电池数量的增加,多电池组所涉及的东西越来越多,损耗也是不断增加,在未来的研究工作中应增加对此类问题的考虑。

4 研究结果
4.1 单次循环优化


4.2 放电循环优化

5 结论
