UiO-66 对种菌唑装载量的高效液相色谱分析
2024-01-10张奇珍刘小芳高图强石鑫刘鹏飞
张奇珍,刘小芳,高图强,石鑫,刘鹏飞
(中国农业大学植物保护学院,北京 100193)
种菌唑(ipconazole,IPC)为日本吴羽化学公司于20 世纪90 年代初开发的新型三唑类杀菌剂,CAS 登录号为125225-28-7,CIPAC 编码为798,化学名称2-[(4-氯苯基)甲基]-5-(1-异丙基)-1-(1H-1,2,4-三唑-1-基甲基)环戊醇,化学式:C18H24ClN3O[1],结构式见图1。种菌唑通过抑制病原菌麦角甾醇的生物合成而致效,对水稻恶苗病、胡麻斑病和稻瘟病表现出较好的防治效果,具有杀菌谱广、活性高,兼具内吸和保护活性,且对单子叶和双子叶作物均安全等特点[2]。
图1 种菌唑结构式
金属有机骨架(metal organic frameworks,MOFs)是以金属原子为连接点,有机配位体支撑构成的一维、二维或三维骨架结构。作为一种新型多孔晶体材料,因其具有高孔隙率、结构多样等特点,可被作为纳米粒子载体使用[3-6]。本研究前期从众多MOFs材料中选择已在农业领域中显示出良好应用潜力的UiO-66[7]作为载体,将种菌唑进行包载,制备出IPC@UiO-66 纳米载药颗粒,对种菌唑具有优秀的靶向运输和控缓作用(未发表)。
目前已有文献报道了种菌唑原药、微乳剂以及悬浮剂的高效液相色谱和液质联用技术的检测分析方法[8-10]。高效液相色谱简单、快速、重复性好,为常量分析的主流检测手段。液质联用方法的检出限通常优于高效液相色谱法,多用于残留检测分析。IPC@UiO-66 中有效成分的定量分析目前尚无公开报道。与原药和常规制剂分析不同,纳米载药体系中有效成分的准确定量对方法的前处理过程要求较高,需要筛选合适的溶剂对有效成分进行充分提取。因此,本文建立了一种测定IPC@UiO-66 中种菌唑装载量的高效液相色谱分析方法,具有省时、经济、准确、重现性好的优势,可满足定量分析要求。
1 材料与方法
1.1 供试药剂和试剂
种菌唑标准品(纯度94.4%,BEPURE,北京曼哈格生物科技公司);甲醇(色谱纯,美国FISHER公司);IPC@UiO-66 纳米载药颗粒(中国农业大学制备)。
1.2 仪器
Agilent 1100 型高效液相色谱仪(美国安捷伦科技有限公司);Quintix224-1CN-1 电子天平(德国SARTORIUS 公司);针筒过滤器:孔径0.45 μm 滤膜(天津市科亿隆实验设备有限公司);KQ-250DE型数控超声波清洗器(昆山市超声仪器有限公司);Arium comfortⅡ型超纯水系统(德国SARTORIUS公司)。
1.3 高效液相色谱操作条件
紫外检测器:DAD G1315A;色谱柱:Agilent Eclipse XDB-C18反相色谱柱(4.6 mm×250 mm,5µm);流动相:甲醇∶纯水=80∶20(体积比),流速:1 mL/min;进样体积:5.0 μL;柱温:室温(温度变化应不大于2 ℃)。
1.4 样品前处理
对IPC@UiO-66 进行不同提取溶剂(甲醇、乙腈、纯水)和不同超声时间(5、10、20、30、50、70 min)的提取处理,筛选种菌唑的最佳提取条件。
1.5 测定步骤
1.5.1 标样溶液的配制
称取种菌唑标准品(50±0.5)mg,置于50mL的棕色容量瓶中,用甲醇超声溶解,定容至50 mL。将上述标准溶液分别稀释至0.005、0.1、0.2、0.3、0.4、0.5 g/L 系列质量浓度,上机检测用于工作曲线的建立。配制用于样品定量计算的标准样品溶液,称取种菌唑标准品(12±0.5)mg,置于10 mL的棕色容量瓶中,准确移取2.0 mL上述溶液于10 mL棕色容量瓶中,甲醇定容。
1.5.2 试样溶液的配制
准确称取IPC@UiO-66试样(40±0.5)mg于25 mL的棕色容量瓶中,加入适量甲醇超声波振荡处理,冷却至室温,用甲醇定容至刻度,摇匀,过0.45 μm滤膜后待测。
1.5.3 测定
按1.3 节仪器参数及条件运行液相色谱,待仪器基线稳定后,连续注入数针标样溶液,直至相邻2 针的峰面积变化小于1.5%后,以标样溶液、试样溶液、试样溶液、标样溶液的顺序进样分析。
1.5.4 装载量计算
将测得的2 针相邻试样溶液及前后2 针标样溶液中的种菌唑峰面积分别进行平均,其中种菌唑有由异构体I (1RS, 2SR, 5RS)和异构体II (1RS, 2SR,5SR)组成[9-11],计算峰面积时将异构体I 和异构体II 的峰面积相加,根据下式计算。
IPC@UiO-66 中种菌唑的装载量X(%):
式中:X为试样中种菌唑的装载量(%);A1为标样溶液中种菌唑峰(异构体I+异构体II)面积的平均值;A2为试样溶液中种菌唑峰(异构体I+异构体II)面积的平均值;m1、m2分别为称取的种菌唑标样和试样的质量(mg);P为种菌唑标准品的纯度(%);k为种菌唑标样和试样的配制体积比值。
1.6 方法学考查
1.6.1 工作曲线建立
HPLC 检测质量浓度为0.005、0.1、0.2、0.3、0.4、0.5 g/L 的种菌唑系列标准溶液,待仪器基线稳定后,在优化的色谱分离条件下按低质量浓度到高质量浓度的顺序测定种菌唑系列标准溶液峰面积,根据标样浓度及其对应峰面积建立标准曲线,进行线性回归,得到方程。
1.6.2 添加回收率测定
平行称取15 份(40±0.5)mg不含种菌唑的空白金属骨架UiO-66 试样(同批次)于1.5 mL 离心管中,分别添加0.1 mL 质量浓度为20、40、80 g/L的种菌唑标准溶液,每个质量浓度水平重复5 次,混匀并静置2 h 后,全部转移至25 mL 棕色容量瓶中,按照1.3、1.4 节中甲醇超声提取方法和色谱检测条件进行提取和检测,计算平均回收率以及相对标准偏差。
1.7 样品检测
平行称取10 份(40±0.5)mg的IPC@UiO-66 试样(同批次)于25 mL 棕色容量瓶中,按照1.3 节和1.4 节中甲醇超声提取方法和色谱检测条件进行提取和检测,根据1.5.4 节中的公式,计算IPC@UiO-66 中的种菌唑装载量。
2 结果与讨论
2.1 检测器波长的筛选
在1.3 节色谱条件下,种菌唑2 个异构体的保留时间约为9.7、10.7 min。使用高效液相色谱仪检测器检测种菌唑在210~400 nm 吸收波长范围内的紫外吸收峰,得到种菌唑的紫外吸收光谱图,发现种菌唑在222 nm 波长处有最大紫外吸收峰(图2a),在该波长下,仪器响应较好,试样色谱图中未显示其他杂质峰(图2b),因此选择222 nm 作为种菌唑的检测波长。
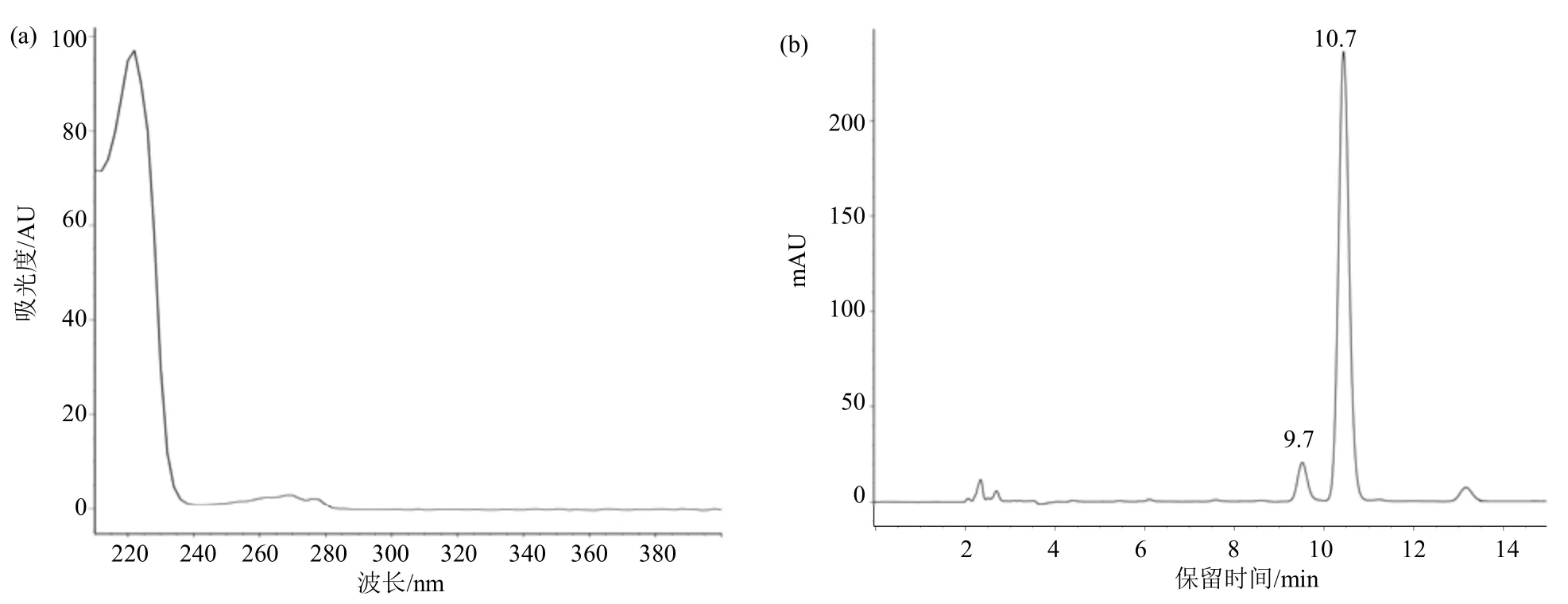
图2 种菌唑的紫外吸收谱图(a)及试样(b)高效液相色谱图
2.2 方法的线性相关性
以种菌唑的质量浓度为横坐标,峰面积为纵坐标建立标准曲线,拟合得到线性方程y=9 903x-32.914,相关系数R2=0.999 9。说明在质量浓度为0.005~0.5 g/L 内,种菌唑的质量浓度与峰面积线性关系良好(图3)。
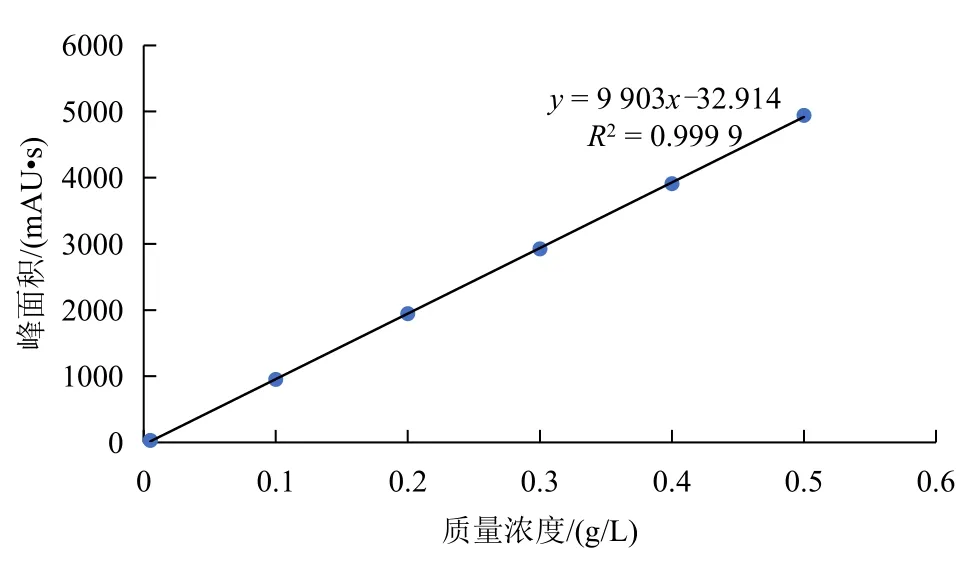
图3 种菌唑峰面积与质量浓度关系图
2.3 提取溶剂和超声时间的筛选
对IPC@UiO-66 进行不同介质(甲醇、乙腈、纯水)和不同超声时间(5、10、20、30、50、70 min)的处理,结果见图4。可见,超声处理后,IPC@UiO-66 在甲醇和乙腈有机相中能较好分散,但在纯水中聚集成块,最终导致无法将种菌唑充分提取。甲醇超声30 min 种菌唑的装载量相较于超声50、70 min 几乎没有差异。用乙腈作为提取介质,在70 min 内不能充分提取有效成分,提取效率仅为理论装载量的72.21%。因此本研究最终选择甲醇为提取介质,超声时间为30 min。
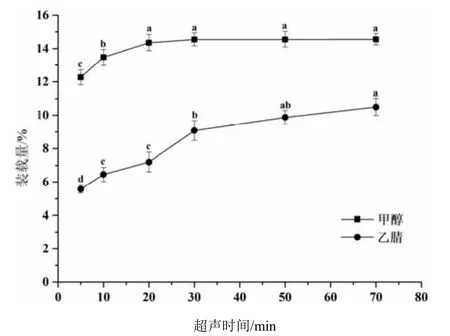
图4 溶剂与提取时间对UiO-66 提取效率的影响
2.4 方法准确度
在不含种菌唑的空白金属骨架UiO-66 试样中添加3 种不同质量浓度水平的种菌唑标准溶液,混匀并静置2 h 后用甲醇定容,超声时间为30 min,在上述色谱条件下进行分析测定,结果见表1。实测值是IPC@UiO-66 中种菌唑的检出量,理论添加量和实际检出量与农药残留分析的固定添加水平表述方式不同,主要原因在于添加的种菌唑的质量相比于载体质量不能忽略。通过计算,得到UiO-66中种菌唑的加标回收率为98.71%~99.34%,相对标准偏差为0.62%~1.62%,说明该方法对IPC@UiO-66中种菌唑具有良好的提取率,满足检测要求。
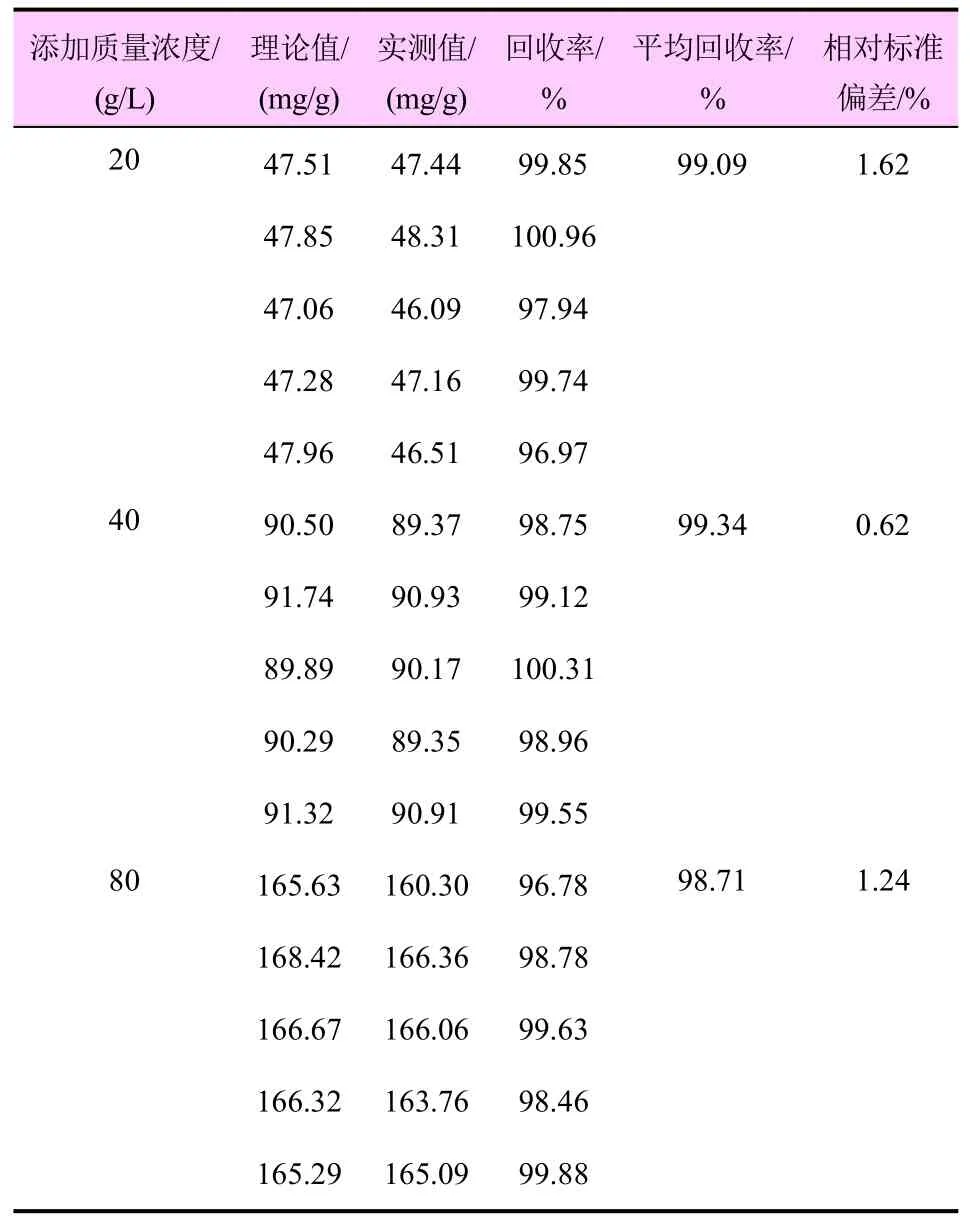
表1 UiO-66 中种菌唑添加回收率
2.5 样品检测
在同一批次IPC@UiO-66 样品中平行称取10 个试样,进行色谱分析,分别计算其种菌唑装载量,结果见表2,含量分布范围为14.47%~14.61%。
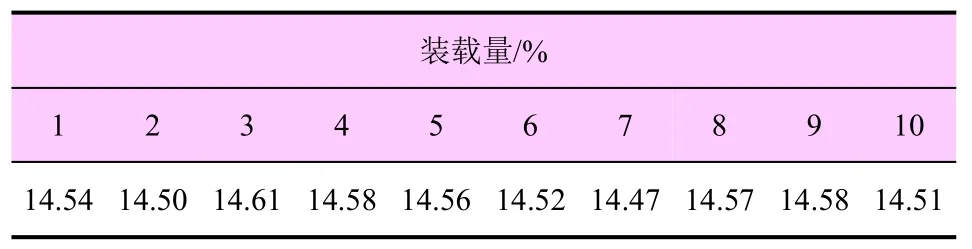
表2 IPC@UiO-66 样品中种菌唑装载量检测
3 结论
本研究采用高效液相色谱仪建立了一种检测IPC@UiO-66 中有效成分种菌唑的方法。该方法准确、重现性好,且操作简便,可以应用于含有种菌唑的UiO-66 金属骨架中有效成分包封率和装载量的分析,同时也为UiO-66 装载其他种类农药的检测提供了技术参考。
