超微/普通粉碎下香蕉粉及其抗性淀粉的性质比较
2024-01-09涂师运王娟盛鸥
涂师运,王娟,盛鸥
(1.华南理工大学食品科学与工程学院,广东广州 510641)(2.广东省农业科学院果树研究所,农业部南亚热带果树生物学与遗传资源利用重点实验室,广东省热带亚热带果树研究重点实验室,广东广州 510640)
1992 年,欧洲抗性淀粉研究协会(European Flair Concerted Action on Resistant Starch,EURESTA)将抗性淀粉(Resistant Starch,RS)定义为不被健康个体小肠所吸收的淀粉及其降解产物的总称[1]。目前,抗性淀粉也被细分为5 个类型:RS1、RS2、RS3、RS4、RS5[2]。RS1代表植物种子和根茎中普遍存在的物理包埋淀粉[2],RS2为具有抗酶消化性的淀粉颗粒[2],RS3为回生淀粉[2],RS4是化学改性淀粉,具有不同于α-(1-4)或α-(1-6)以外的新化学键[2],RS5是淀粉-脂质复合物[2]。在蔬菜和水果中,青香蕉是主要的天然抗性淀粉来源,香蕉的抗性淀粉含量与品种、成熟程度有关,青香蕉中的抗性淀粉RS2型抗性淀粉,含量明显高于成熟香蕉[3],具有调节肠道健康、控制体重增长、缓解高血糖等生理功能,在食品工业中应用前景广阔[3,4]。
当下,食品原料的制粉方法主要包括:石磨研磨、钢磨研磨以及超微粉碎等[5],各种研磨方式的温度和强度不同,处理得到的食品粉体的表面形态和特性也有很大差别,主要体现在淀粉粒度、营养物质、晶体结构上[6]。超微粉碎是利用机械力或流体动力的方法将毫米级别(3 mm 以上)的物料颗粒粉碎至粒径10 μm 以下的粉碎加工技术[7]。Niu 等[8]对小麦淀粉进行了超微粉碎,发现小麦淀粉颗粒尺寸越小,其表观黏度越低,糊化稳定性越好。关倩倩[9]研究说明了粉碎方式对于物料抗性淀粉含量的影响,超微粉碎处理的山药粉比普通粉碎处理的具有更低的抗性淀粉含量。李璐等[10]报道超微粉碎提高了雷竹笋的可溶性膳食纤维的含量。
本研究对比普通粉碎和超微粉碎对香蕉粉、香蕉抗性淀粉的颗粒形貌、香蕉粉升糖指数以及香蕉抗性淀粉热糊化性质的影响,以期为香蕉制粉方式的选择提供参考。
1 材料与方法
1.1 原材料与设备
香蕉(Musaspp.,Dajiao ABB Group),表皮青绿,果指饱满,购于广州五山农贸市场。白面包为曼可顿无糖切片面包,曼可顿食品(上海)有限公司。
实验试剂:抗性淀粉快速检测试剂盒,爱尔兰Megazyme 公司;猪胰酶(P7545)、胃蛋白酶(P7012)、淀粉葡萄糖苷酶(A7095),美国Sigma-Aldrich 公司;复合果胶酶(Pectinex XXL)、淀粉酶(Amylase AG 300L),诺维信生物技术有限公司;其他试剂均为国产分析纯。
设备:大德DFT-200 钢磨粉碎机,温岭市林大机械有限公司;电子扫描显微镜,ZEISS 公司;D8 ADVANCE X-射线衍射分析仪,德国BRUKER 公司;DSC 214 Polymer 差式扫描量热仪,德国耐驰公司;Vanox BHS-2 偏光显微镜,日本OLYMPUS 公司;THZ-82A 恒温水浴振荡器,荣华公司;HWS28 电热恒温水浴锅,上海一恒科技有限公司;SL 16R 离心机,ThermoFisher 科技公司;BP 221S 万位电子分析天平,德国Sartorius 公司;722S 紫外/可见分光光度计,上海菁华公司;PHS-25 pH 计,上海虹益仪器仪表有限公司。
1.2 实验方法
1.2.1 香蕉干片的制备及其超微粉碎、普通粉碎工艺
香蕉干片的制备:选用果皮青绿色,果指饱满,棱角分明的香蕉,去皮、切片,采用热风干燥的方式,在60 ℃烘干72 h,制得香蕉干片[11]。
超微粉碎工艺:将500 g 的香蕉干片加入超微粉碎机,开启低温设备,控制温度至10 ℃,进行超微粉碎,粉碎时间100 min,然后用100 目筛过筛,得到超微粉碎香蕉粉,储存于干燥器中备用[12]。
普通粉碎工艺:称取60 g 香蕉干片置于钢磨粉碎机中,研磨3 min,过100 目筛网,取筛下物,得到普通粉碎香蕉粉,存放于干燥器中保存备用。
1.2.2 香蕉抗性淀粉的提取工艺
取超微粉碎后的香蕉粉10 g,与蒸馏水配成10%(质量分数)浆液,调节pH 值为2.5,往其中添加0.15%(质量分数)果浆酶(10 000 PECTU/g)、0.15%(质量分数)Amylase 酶(300 AGU/mL),40 ℃条件下酶解2 h,然后离心分离,取沉淀,在50 ℃下干燥12 h,经100 目筛网筛分,取筛下物,得到超微粉碎的香蕉抗性淀粉。取普通粉碎的香蕉粉10 g,按同样方法制得普通粉碎的香蕉抗性淀粉[13]。
1.2.3 抗性淀粉含量测定
参考团体标准T/GDIFST 001-2021 进行香蕉粉抗性淀粉含量测定[14]。称取100 mg 香蕉粉,加入α-胰淀粉酶和淀粉葡萄糖苷酶(AMG)混合工作液,放入37 ℃水浴摇床中振荡孵育16 h;离心后得到的絮状沉淀即为样品中的RS,通过GOPOD 使样品中RS 显色,进而测定RS 含量。
1.2.4 香蕉抗性淀粉的结构特征
1.2.4.1 显微结构和偏光特性观察
将适量的试样配成甘油溶液中,滴在载玻片内,并盖上盖玻片,置于显微标本台上,利用光学显微镜和偏光显微镜,对其结构进行观察,并记录[15]。
1.2.4.2 扫描电镜观察
用小匙将样品平整地置于粘有电导胶的载物台上,经离子溅射喷金后,于2.0 kV 的加速电压下,放大至500 倍进行观察和拍摄[15]。
1.2.4.3 X-射线衍射分析
利用X-射线衍射仪对样品进行分析,实验条件为:40 kV、2θ:4~60°、40 mA、步长0.04°、17.7 s/步,进行扫描[15]。结晶度按照Cleven 等[16]的方法,在X-衍射图谱中绘制一条光滑的基线,计算衍射峰面积与总衍射面积比值得到。
1.2.4.4 红外光谱分析
采用溴化钾压片法,将香蕉抗性淀粉样品与溴化钾细粉末按1:50 的比例混匀,用压片机压成薄片,而后置于傅里叶变换红外光谱仪下,在4 000~400 cm-1的扫描范围内,以4 cm-1的分辨率,扫描累加次数为64 次,测定红外图谱[15]。
1.2.5 香蕉抗性淀粉的理化性质测定
1.2.5.1 碘吸收曲线
精确称取50 mg 的香蕉抗性淀粉,放入50 mL 容量瓶中,加入10 mL 90%(质量分数)二甲基亚砜溶液,在60 ℃下浸泡10 min,立即冷却,用蒸馏水定容。取2 mL 该溶液置于50 mL 容量瓶中,加入25 mL的蒸馏水和1 mL 碘液,定容到50 mL,立即混匀,显色10 min。用紫外-可见分光光度计扫描,波长500~800 nm[17]。
1.2.5.2 差式扫描热分析
将10.00 mg 的试样称重,加入40%(质量分数)的蒸馏水,密封于铝托盘中,室温下平衡24 h,采用差式扫描量热仪进行分析[15]。
1.2.6 预计升糖指数
参考蔡攀福[18]的方法,利用体外消化的方法研究香蕉粉的预计升糖指数。
称取0.25 g 香蕉粉,置于100 mL 锥形杯中,加入30 mL 的蒸馏水,在37 ℃水中浸泡10 min。取出锥形瓶,将pH 值调至2.5,加入0.8 mL 2%(质量分数)的胃蛋白酶(≥2 500 units/mg)溶液,置于磁力搅拌器上,调整转子旋转速度至130 r/min,孵育30 min,吸取1 mL 该反应液并收集于装有4 mL 无水乙醇的锥形瓶中。往该锥形瓶中加入1 mL 1 mol/L NaHCO3,将pH 值调整到6.2,再加入5 mL 的胰腺酶-葡萄糖转苷酶,加蒸馏水至总溶液量为55 mL。将锥形瓶置于37 ℃恒温水浴锅中,在0、20、60、120 和180 min时,取1 mL 的瓶中溶液加入已添加4 mL 无水乙醇的离心管中。将离心管置于离心机中,在3 000g下离心10 min,后取0.1 mL 的上清液,用GOPOD 试剂盒测定葡萄糖质量浓度。取0.25 g 白面包,按上述相同方法操作,作为标准参照物。
淀粉水解率按以下公式进行计算:
式中:
A——淀粉水解率,%;
Cg——取样点葡萄糖当量,g;
Cs——样品总淀粉含量,g。
以淀粉水解率为纵坐标,以时间为横坐标,绘出淀粉水解曲线。计算曲线下面积(Area Under Curve,AUC),进而得出样品的淀粉水解指数(Hydrolysis Index,HI),从而根据计算公式得到预计升糖指数(Predicted Glycemic Index,pGI)[18]。
计算公式为:
式中:
B——香蕉粉的淀粉水解指数(HI),%;
D1——样品淀粉的水解曲线下面积;
D0——白面包淀粉的水解曲线下面积;
E——香蕉粉的预计升糖指数。
1.2.7 数据分析
使用Origin 2018 绘制图像。使用SPSS 21 进行数据统计分析,实验重复三次,用平均值±标准偏差表达结果,通过独立样本t检验分析数据间差异性。
2 结果与分析
2.1 超微粉碎和普通粉碎对香蕉粉抗性淀粉含量、非抗性淀粉含量的影响
由表1 可知,普通粉碎和超微粉碎处理的香蕉抗性淀粉含量分别为51.96、48.76 g/100 g,非抗性淀粉含量分别为20.87、21.93 g/100 g。通过独立样本T 检验的方法,分析了两种粉碎方式处理的香蕉粉在抗性淀粉含量、非抗性淀粉含量上的差异。结果显示,超微粉碎和普通粉碎对香蕉粉的抗性淀粉、非抗性淀粉含量影响显著(P<0.05)。傅金凤等[19]研究表明,香蕉抗性淀粉含量为40.00~70.00 g/100 g,非抗性淀粉含量为20.00~40.00 g/100 g。两种粉碎方式处理后香蕉的抗性淀粉含量:超微粉碎<普通粉碎,曹英等[12]报道:超微粉碎可使天然木薯淀粉的抗性淀粉含量从51.38 下降到47.21 g/100 g,本研究中超微粉碎对香蕉粉的影响也表现出同样规律。超微粉碎方式处理后香蕉粉表现出更低抗性淀粉含量的原因可能是,一方面,超微粉碎处理影响了淀粉中直链淀粉-支链淀粉的比例,减小了直链淀粉的分子链段,导致其难以形成双螺旋结构,从而降低抗性淀粉含量[20],另一方面,超微粉碎会破坏淀粉的双螺旋结构,使淀粉暴露出更多的官能团,增加淀粉与酶分子的反应位点[12],从而导致抗性淀粉含量降低。

表1 普通粉碎和超微粉碎对香蕉粉的抗性淀粉和非抗性淀粉含量的影响Table 1 Effects of ordinary grinding and superfine grinding on resistant starch and non-resistant starch content of banana powder
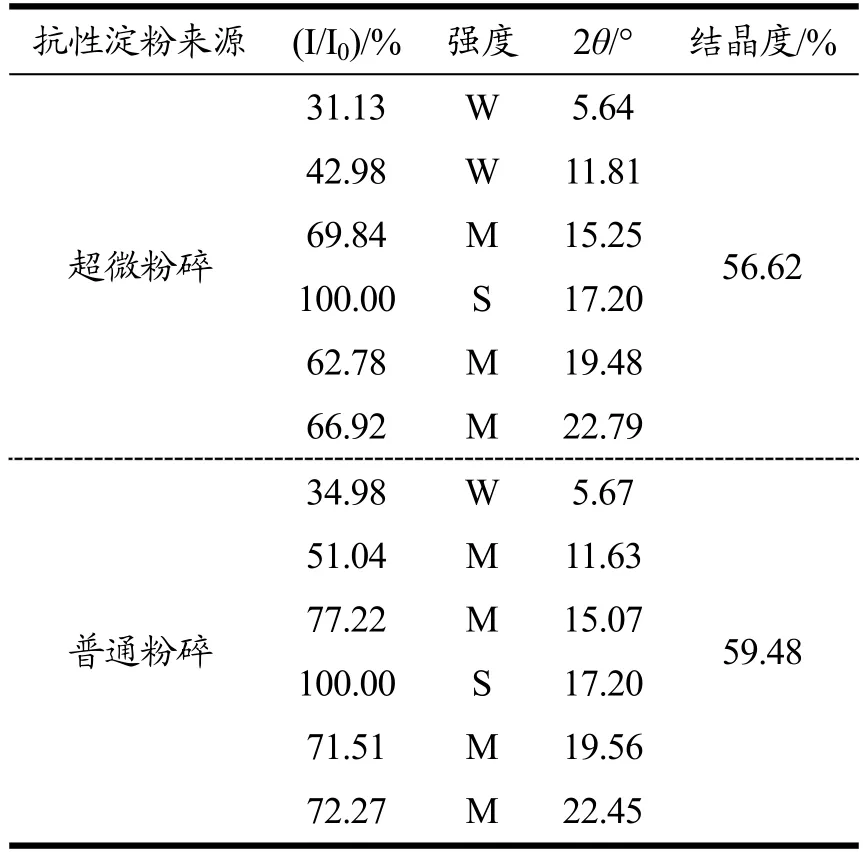
表2 香蕉抗性淀粉结晶性能参数Table 2 Crystal performance paraments of banana resistant starch
2.2 超微粉碎和普通粉碎对香蕉粉和香蕉抗性淀粉结构的影响
2.2.1 显微镜和偏光显微镜
从图1a、c 可以看出,香蕉粉、香蕉抗性淀粉颗粒呈长椭圆形,均有偏心的环纹,环纹为淀粉粒的生长环(即轮纹),表现了可用于淀粉沉积的碳水化合物来源的每日波动,表示着周期性的生长(见右下角放大图)[21]。从图1a、b 对比可以发现,经过超微粉碎处理的香蕉粉部分颗粒表面变得模糊,出现不完整颗粒,并伴随着黑色杂质也增多(见右下角放大图),说明淀粉颗粒受到了破坏。变化产生的原因在于:超微粉碎会破坏淀粉颗粒的结构,使其表面更加粗糙,结构更加松散[12]。

图1 普通粉碎和超微粉碎处理后的香蕉粉、抗性淀粉光学显微镜照片(×200)Fig.1 Optical microscope photos of banana powder and resistant starch after ordinary grinding and superfine grinding
通过对比图1 的c、d 可以发现,超微粉碎处理后香蕉抗性淀粉颗粒表面发生了结构模糊,颗粒集聚现象,说明超微粉碎对于颗粒结构的影响同样存在于香蕉抗性淀粉中。
对比图2a、b 可以发现,普通粉碎的香蕉粉颗粒表现出明显的偏光现象,说明该淀粉具有完整颗粒结构。淀粉颗粒主要包括结晶区和无定型区[22],与普通粉碎相比,超微粉碎的香蕉粉颗粒表现出外部暗区增加,颗粒内部偏光十字交点(脐点)和非偏光十字区域的暗区范围扩张现象(详见红色框区域)。闫斯亮[22]在研究低温等离子处理对香蕉淀粉的理化特性及颗粒结构的影响中指出偏光十字交点处暗区的增加说明等离子处理的活性组分通过淀粉颗粒的表面对其渗透了,破坏了脐点附近区域,而淀粉颗粒双折射现象的减少反映了淀粉颗粒表面双螺旋区域受损。这表明,超微粉碎后,香蕉粉的晶体结构发生了改变,颗粒结构中径向有序排列的双螺旋结构确定受到了破坏,双螺旋区域的有序性发生了降低。

图2 普通粉碎和超微粉碎处理后的香蕉粉、抗性淀粉偏光显微镜照片(×200)Fig.2 Polarized microscope photos of banana powder and resistant starch after ordinary grinding and superfine grinding
图2 可见,图2c 中香蕉抗性淀粉颗粒具有明显的偏光十字,说明其与图2a 图中香蕉粉颗粒一样具有完整的颗粒结构。但经过超微粉碎处理的香蕉抗性淀粉,其暗区增加,偏光十字交点(脐点)和非偏光十字区域的暗区增加明显,偏光亮度降低,表明其淀粉颗粒受到了一定程度的破坏。
2.2.2 扫描电镜
从扫描电镜照片可以清晰地观察淀粉颗粒的外观。从图3 可以看出,普通粉碎方式处理的图3a 香蕉粉、图3c 香蕉抗性淀粉表面光滑,都具有完整的颗粒结构。香蕉粉颗粒多为细长椭圆形,粒径为10~50 μm;超微粉碎处理后的香蕉粉表面粗糙、颗粒小,粒径多为5~10 μm。普通粉碎的香蕉抗性淀粉为10~50 μm 的细长卵形,粒径大小与香蕉粉相似;超微粉碎方式处理后的的香蕉抗性淀粉外形不规则,粒径多为5~25 μm。这与杨盈盈等[23]对超微粉碎的马铃薯颗粒形貌变化类似。已有研究发现,细小圆形的微粒在酶作用下易于水解[24],观察抗性淀粉的图片推测,超微粉碎后的香蕉抗性淀粉的抗酶解性可能下降。

图3 普通粉碎和超微粉碎处理后的香蕉粉、抗性淀粉扫描电镜照片(×500)Fig.3 Scanning electron microscope photos of powder and resistant starch after ordinary grinding and superfine grinding
分析扫描电镜照片可知,经过超微粉碎的香蕉粉、香蕉抗性淀粉比普通粉碎处理的,颗粒更小,表面更粗糙。
2.2.3 X-射线衍射图谱
由图4 可看出,超微粉碎和普通粉碎处理的香蕉抗性淀粉的X-射线衍射谱线显示出相似的形状,衍射峰的位置无明显差异。通常认为不同结晶类型淀粉具有不同的X-射线衍射特征峰,A 型淀粉在入射角(2θ)为15°、17°、18°和23°存在强衍射峰,通常存在于谷物中,如小麦淀粉、玉米淀粉等[25]。B 型淀粉在5.6°、17°、22°和24°的入射角(2θ)处有较强的衍射峰,是马铃薯淀粉、茎淀粉、甘薯淀粉等常见峰型[25]。C 型淀粉的衍射峰存在于5.7°、15°、17°、19°和23°等入射角(2θ),这类淀粉为A 型和B 型混合结晶型,存在于一些茎类淀粉[25],而超微粉碎与普通粉碎的香蕉抗性淀粉2θ在5.7°、15°、17°、19.5°、23°附近呈现较强的吸收峰,与C 型晶体相似,该结果与前人报道的香蕉抗性淀粉为C 型结晶相符[26]。说明超微粉碎和普通粉碎处理后,淀粉衍射峰保持C 型晶体结构,没有出现新的特征峰。
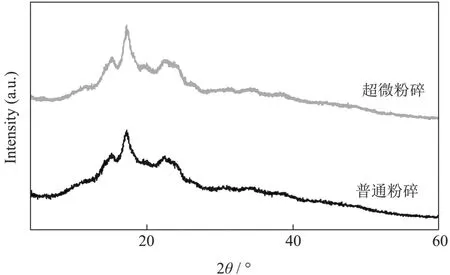
图4 X-射线衍射图谱Fig.4 X-ray diffraction pattern

图5 普通粉碎和超微粉碎处理后的香蕉抗性淀粉红外光谱图Fig.5 Infrared spectrum of banana resistant starch treated by ordinary grinding and superfine grinding
I/I0值代表该入射角的衍射峰强度与最强衍射峰强度的比值,通过对比图谱以及各入射角对应的I/I0值,可以发现超微粉碎比普通粉碎发生了衍射强度的降低,同时结晶度由59.48%下降到56.62%。其可能原因为:香蕉抗性淀粉在超微粉碎过程中遭受了更强烈机械力作用,引起分子内部局部晶格畸变错位和晶面扭转滑移,淀粉内部结晶结构由多晶态转向无定形态发生转变,非晶区增加[23]。
超微粉碎和普通粉碎处理后的香蕉抗性淀粉结晶类型一致,都为C 型,但超微粉碎会引起淀粉结晶度降低。
2.2.4 红外光谱图
在红外光谱图中,约3 300 cm-1的吸收峰属于分子内或分子间-OH 的交互作用;3 000~2 800 cm-1处的吸收峰表征的是C-H 的伸缩振动;1 650 cm-1附近的吸收峰反映了淀粉内部的结晶水;1 080 cm-1附近的吸收峰由C-H 键的弯曲振动产生;1 020 cm-1处的吸收峰代表了C-O 键的伸缩振动[27]。波峰特征显示,超微粉碎后,香蕉抗性淀粉无新的特征吸收峰,说明超微粉碎后无官能团改变。而超微粉碎后,其吸收峰强度在3 000~2 800 cm-1范围内呈下降趋势,这表明淀粉分子之间C-H 键的伸缩振动减小,这说明超微粉碎可能会破坏淀粉的分子结构,从而导致淀粉分子链断裂[12]。超微粉碎后,1 080 cm-1的吸收峰值强度减弱,这表明淀粉分子的氢键结合能力变弱,而氢键作用力则是淀粉分子有序结构的体现,可能由于超微粉碎使淀粉分子的结晶区域被破坏,使其有序度下降[12]。红外光谱结果说明,超微粉碎可能会降低分子有序性,但大体上超微粉碎与普通粉碎处理后的香蕉抗性淀粉官能团一致。
2.3 超微粉碎和普通粉碎对香蕉抗性淀粉理化性质的影响
2.3.1 碘吸收曲线
由图6 可以看出,普通粉碎的香蕉抗性淀粉与超微粉碎的抗性淀粉的碘吸收曲线都具有类似的波长区间,二者最大吸收峰都是581 nm,在560~620 nm 之间,且经过超微粉碎,抗性淀粉最大吸收峰波长没有发生偏移。说明普通粉碎与超微粉碎处理后,抗性淀粉中都含有直链淀粉以及支链淀粉[28],该结果与谭思敏等[29]报道的香蕉抗性淀粉最大吸收波长接近。对比普通粉碎和超微粉碎处理方式,可以发现,超微粉碎处理后的香蕉抗性淀粉表现出更小的碘吸收峰强度以及更宽的吸收峰。吸收峰强度变小的原因可能是淀粉经超微粉碎处理后,直链淀粉聚合度降低,而碘吸收曲线只能测定出聚合度在30 以上的直链淀粉,与实际的直链淀粉含量还有一定的差异,从而导致了峰强度下降[30]。同时,吸收峰的宽窄程度与抗性淀粉分子量的分布有相关性,赵力超等[31]对比了压热处理前后宜糖米抗性淀粉的碘吸收曲线,观察到压热处理后的抗性淀粉的吸收峰比原淀粉的窄,说明宜糖米抗性淀粉的分子量分布比较集中。普通粉碎的香蕉抗性淀粉吸收峰较窄,说明其抗性淀粉分子量分布比较集中,超微粉碎的香蕉抗性淀粉吸收峰较宽,说明其分子量的分布较为分散。因此,超微粉碎与普通粉碎处理的香蕉抗性淀粉中都含有直链淀粉和支链淀粉,并且,经过超微粉碎处理,抗性淀粉中直链淀粉的聚合度可能降低,分子量分布得更加分散。

图6 普通粉碎和超微粉碎方式处理后的香蕉抗性淀粉碘吸收曲线Fig.6 Iodine absorption curve of resistant starch after ordinary grinding and superfine grinding
2.3.2 差式扫描热分析
如表3 所示,超微粉碎处理的抗性淀粉表现出了更低的相转变起始温度T0,普通粉碎的香蕉抗性淀粉T0为60.6 ℃,而超微粉碎的为51.8 ℃;同时,与普通粉碎相比,超微粉碎香蕉抗性淀粉的相转变峰值温度Tp、相转变结束温度Tc、温度差值ΔT(Tc-T0)以及ΔH均有不同程度的升高,分别提升了1.0 ℃、3.8 ℃、12.6 ℃以及909.4 J/g。更低的相转变起始温度T0说明,超微粉碎处理后,抗性淀粉在更低的温度就开始了相转变,这可能是由于超微粉碎后抗性淀粉颗粒结构松散引起的。而提高的相转变峰值温度Tp、相转变结束温度Tc、温度差值ΔT以及焓变值ΔH表明,超微粉碎淀粉完成完全相转化所需温度更高,这个结果和已有的结论是一致的[20]。以上分析结果可以看出,与普通粉碎方式相比,超微粉碎对于抗性淀粉颗粒结构的破坏使得其更易于开始相转变过程,但另一方面,其完全完成相转变过程对于热量的需求也增大了。
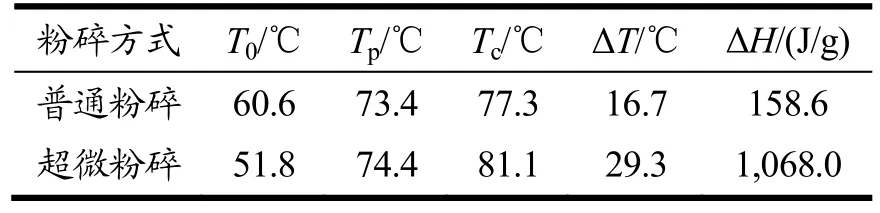
表3 普通粉碎和超微粉碎处理后的香蕉抗性淀粉的差式扫描热分析结果Table 3 Differential scanning calorimetry results of banana resistant starch after ordinary grinding and superfine grinding
2.4 超微粉碎和普通粉碎对香蕉粉预计升糖指数的影响
食物的升糖指数是人体在进食后的餐后血糖水平的一个重要指标。低升糖指数食物对维持人体健康、降低血糖含量有重要作用,可延迟葡萄糖吸收,使糖尿病人的血糖值维持在一个稳定的状态[18]。按GI 值的大小,食品pGI 值可划分为3 个水平:低GI 食品(GI<55)、中等GI 食品(55~70)、高GI 食品(GI>70)[32]。
如表4 所示,普通、超微粉碎香蕉粉的pGI 值分别为17.12、21.92,在超微粉碎下,香蕉粉的pGI 值明显升高,提高了21.90%。已有研究表明,机械处理会改变淀粉颗粒结构,进而影响其消化性[33],破损的淀粉相对于天然完整的淀粉分子具有更强的淀粉酶敏感程度,一方面,较高的破碎淀粉含量会导致较多的淀粉分子溶解在水中,易被淀粉酶水解消化,另一方面,破损淀粉具有较大的比表面积,其暴露在外的内部结构增多,与淀粉酶的作用位点增多,这会加快淀粉的酶解速度[34]。超微粉碎处理的香蕉粉pGI 值更高的原因可能是超微粉碎后的香蕉粉结构出现破损,有利于淀粉与酶的反应,进而提高香蕉粉的pGI 值。由此可见,超微粉碎对于淀粉的消化有促进作用,并会提高淀粉的预计升糖指数。Kathirvel 等[35]的研究阐述了类似结果:采用改良的Englyst 法对淀粉进行体外消化,并测定了不同粒径淀粉的生扁豆粉、烘焙扁豆粉的葡萄糖释放量差异,发现淀粉颗粒被粉碎得越小,越会引起葡萄糖释放量增加。但是,普通粉碎和超微粉碎处理后,香蕉粉的pGI 值分别为17.12 以及20.92,都远远小于55,属于低GI 的食品原料。

表4 普通粉碎和超微粉碎处理后的香蕉粉预计升糖指数(pGI)值Table 4 pGI value of banana powder treated by ordinary grinding and superfine grinding
3 结论
(1)超微粉碎相比于普通粉碎,会造成香蕉粉的抗性淀粉含量降低、非抗性淀粉含量增加。
(2)微观结构观察表明,经过超微粉碎,香蕉粉、抗性淀粉结构变得松散,部分颗粒出现降解现象。超微粉碎会引起抗性淀粉结晶度下降,但对官能团基本没有影响。
(3)理化性质研究表明,与普通粉碎相比,经过超微粉碎的香蕉抗性淀粉相转变起始温度降低、相转变峰值温度、相转变结束温度和焓变值升高。
(4)超微粉碎相比于普通粉碎,使香蕉粉预计升糖指数升高,但两种方式处理后的香蕉粉都属于低GI值食品原料范围。
