人工肠道模拟系统在微凝胶体外模拟消化中的应用
2024-01-09林安娜张正怡刘淳王玉先周春鸣江凌
林安娜,张正怡,刘淳,王玉先,周春鸣,江凌,3*
(1.南京工业大学食品与轻工学院,江苏南京 211816)(2.南京工业大学生物与制药工程学院,江苏南京 211816)(3.南京工业大学材料化学工程国家重点实验室,江苏南京 211816)
随着食品行业的不断发展,人体消化系统越来越成为研究热点[1]。体外人胃肠模拟系统是一种基于人体胃肠道生理机能进行模拟食物消化行为的生物研究系统,常用于生物活体的替代试验研究,具有操作简单、便捷、安全、快速且不受医学研究伦理限制等优点[2-4],在食物重金属残留安全性评价、食物胃肠代谢动力学、营养物质生物利用度量化评估等方面有广泛应用[5-7]。目前,体外肠道消化模型大致分为静态单室、动态单室、动态双室以及动态多室模型。其中,由荷兰瓦赫宁根大学研制的TIM(TNO Intestinal Model,TIM)模型[8]是肠道模拟消化最系统和全面的动态多室模型,该系统分为胃、小肠模拟器(TIM-1)和大肠模拟器(TIM-2),可非常接近地再现动物和人体内的消化动态情况。国外Venema 等[9]利用TIM-1 模型研究了乳酸杆菌和双歧杆菌在胃和小肠内的存活率,国内晓东宜健(苏州)仪器设备有限公司开发的第四代动态体外仿生人胃肠消化系统(Dynamic Human Stomach Intestine-IV,DHSI-IV)也被用来模拟食物在消化过程中对益生菌肠道存活特性的影响[10]。TIM 模型作为一种更接近人体胃肠道体内消化的体外动态模型,广泛应用于营养物质的消化研究及功能性食品的开发。
多糖是一类存在于动植物中的生物大分子,其作为天然活性成分,如何被人体消化利用以发挥其功能逐渐成为近年来多糖领域的研究热点[11]。一些具有生理功能的多糖常于食品工业中被用以调节肠道健康[12]。结冷胶是一种阴离子多糖,具有凝胶性能强、耐酸、热稳定性好的特点[13]。结冷胶与钙离子结合可形成凝胶网状结构,在药物及生物活性物质的缓控释方面具有广泛应用[14]。壳聚糖是自然界中唯一的阳离子多糖,质子化的壳聚糖可与阴离子多糖结冷胶通过静电作用形成复配体,加强单一结冷胶微凝胶体系的强度[15-17]。研究诸如结冷胶、壳聚糖等天然多糖在人体肠道中的消化过程对于开发这类功能性食品具有指导意义。
本研究在TIM 动态多室体外消化模拟系统的基础上,通过摇床消化实验和人工肠道模拟系统的对比,评估以多糖形成的微凝胶在体外的模拟消化过程。首先通过检测无菌生理盐水在人工肠道模拟系统中跟随压力系统蠕动过程是否产生菌体,评估该肠道消化模拟系统主腔室的密封性能。同时,进一步考察结冷胶、结冷胶@壳聚糖微凝胶在体外模拟胃肠道的消化情况,考察人工肠道模拟系统消化模式的优缺点,以期为人工肠道模拟系统在食品、医药等行业的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
乙醇、氯化钠、氯化钾、氯化钙、碳酸氢钠、醋酸钠、盐酸、氢氧化钠、壳聚糖(脱乙酰度≥80%)、磷酸氢二钠、二甲基亚砜(DMSO)、罗丹明B,以上试剂均为分析纯,均购于国药集团化学试剂有限公司。结冷胶、吡啶、月桂酸二丁基锡均为化学纯,均购于生工生物工程(上海)股份有限公司。胰酶、胰蛋白酶、胃蛋白酶、荧光素-5-异硫氰酸酯(FITC)均为生物试剂,均购于上海阿拉丁生化科技股份有限公司。
1.2 实验设备
人工肠道模拟系统由实验室自制的肠道反应器(图1)和开发的软件系统(图2)组成,主要硬件设施包括:水路电磁阀(型号2SA)、气动控制电磁阀(型号多种),亚德客(中国)有限公司;G301K pH电极,上海汉兴机电有限公司;TX215 蠕动泵,保定创锐泵业有限公司;S7-1200 可编程逻辑控制器,西门子;肠道反应器的模块搭建设计图纸详见已授权专利[18,19]。其它实验设备有:DF-101S 集热式加热磁力搅拌器,南京文尔仪器设备有限公司;Scientz-18N 真空冷冻干燥机,宁波新芝生物科技股份有限公司;RE-2000A 旋转蒸发器,上海亚荣生化仪器厂;PHS-25 pH 计,上海仪电科学仪器股份有限公司;BKQ-B50ll高压灭菌锅,济南童鑫生物科技有限公司;Biolum 手持式ATP 荧光检测仪,西安天隆科技有限公司;WMS-1037 生物显微镜,上海无陌光学仪器有限公司;HT-211C 卧式恒温摇床,江苏新春兰科学仪器有限公司;Leica TCS SP8 激光共聚焦扫描显微镜,徕卡显微系统(上海)贸易有限公司;Malvern Mastersizer 2000激光粒度仪,英国马尔文仪器有限公司;Malvern Zetasizer Nano ZS90 纳米粒度及Zeta 电位分析仪,英国马尔文仪器有限公司。

图1 人工肠道模拟系统机械加工组装模型图(左)和实物图(右)Fig.1 Schematic diagram (left) and physical map (right) of mechanical assembly of in vitro intestinal digestion simulation system
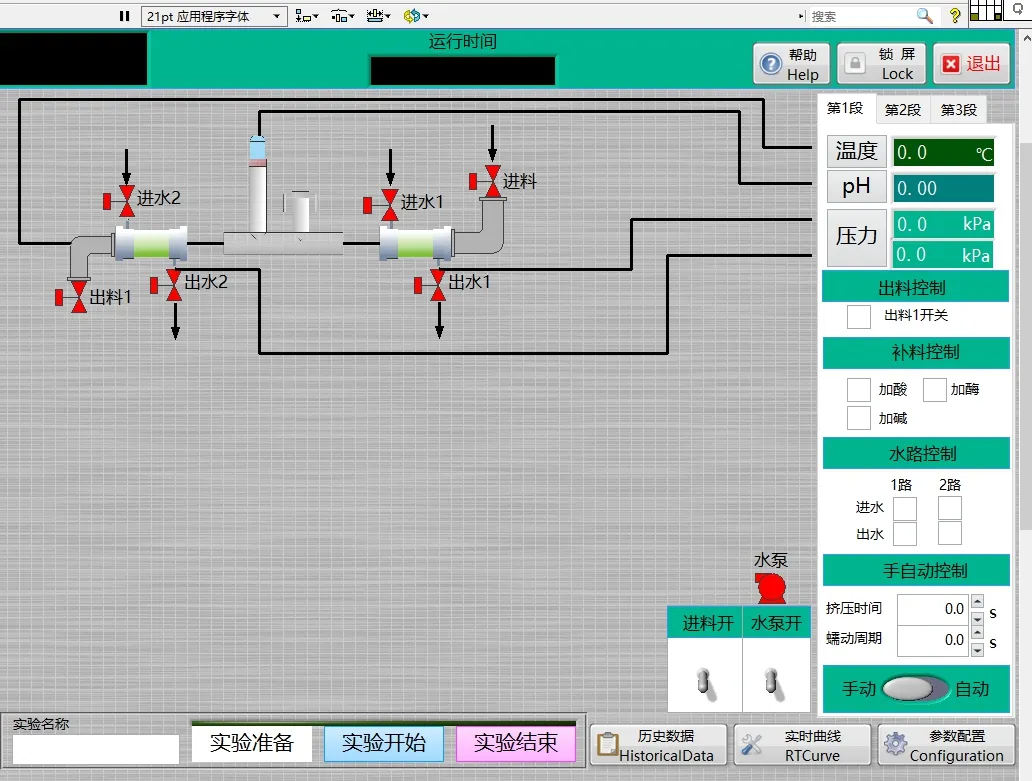
图2 人工肠道模拟系统软件界面Fig.2 Software interface of in vitro intestinal digestion simulation system
1.3 实验方法
1.3.1 生理盐水无菌验证实验
在如图2 的计算机界面进行人工肠道模拟系统的软件操作,实验具体操作如下:首先,关闭出料口,向软管中通入φ=75%的乙醇,使其充满软管,再用保鲜膜将进料口顶部密封静置20 min。然后,同时打开进料口和出料口,向进料口通入无菌生理盐水(121 ℃灭菌20 min)至乙醇被全部排出。最后,关闭出料口,让生理盐水充满软管内部,打开全自动开关,使得无菌生理盐水充分洗涤硅胶软管内部,2 min 后关闭,生理盐水静置其中24 h。期间使用ATP 检测仪测量三个阶段的微生物含量,分别是刚倒入生理盐水时,实验12 h 后,实验结束时。后续测量值与第一次ATP检测仪测得的值做对比,如果相差较大,则需要使用电子显微镜观察是否染菌。实验结束后,再次灌入75%的乙醇进行消毒灭菌。灭菌结束后,通入3 min 氮气,然后关闭进料口与出料口,从而达到保护的效果。
1.3.2 微凝胶的体外消化模拟实验
1.3.2.1 微凝胶的制备
根据文献[20]的方法,用雾化喷嘴将1%的结冷胶溶液(m/V)挤出到3%的CaCl2(m/V)溶液中,200 r/min磁力搅拌30 min 制备微凝胶。然后,通过0.037 mm的筛子过滤收集备用。
将制备得到的结冷胶微凝胶,加入到0.5%的壳聚糖溶液(m/V)中搅拌30 min,分散均匀,制备得到结冷胶@壳聚糖微凝胶,通过0.037 mm 的筛孔过滤收集备用。
1.3.2.2 微凝胶的体外消化模拟
采用文献方法配置模拟胃液和肠液:取3.1 g NaCl、1.1 g KCl、0.12 g CaCl2、0.6 g NaHCO3和0.236 g胃蛋白酶(酶活约为2 500 U/mg)溶于1 L 蒸馏水中,用0.1 mol/L 的HCl 将pH 值调为3,获得模拟胃液[17]。取5.4 g NaCl、0.65 g KCl、0.33 g CaCl2·2H2O、1.4 g胰酶(约为1 000 U/mg)、0.13 g 胰蛋白酶(约为2 500 U/mg)、40 g 胆盐溶于1 L 蒸馏水,6 000 r/min离心5 min,取上清液,用0.1 mol/L NaOH 溶液将pH值调至7.5,获得模拟肠液[21]。
将微凝胶和模拟胃液按1:4 的质量比混合,在摇床(37 ℃,150 r/min)和人工肠道模拟系统中,分别进行2 h 的胃部模拟消化。取上述模拟肠液按微凝胶:模拟胃液:模拟肠液为1:2:3 的质量比配置好后,进行4 h 的肠道模拟消化反应。
1.3.2.3 微凝胶的表征
使用激光粒度仪通过激光衍射技术测定微凝胶粒径大小。使用生物显微镜观察微凝胶的表面形态。
根据文献[22]的方法,使用荧光素-5-异硫氰酸酯(FITC)与结冷胶共价标记,罗丹明B 染料与壳聚糖共价标记,用488 nm 和543 nm 激光线分别激发FITC和罗丹明B 荧光团,采集图像。
根据文献[21]的方法,使用Zeta 电位分析仪进行动态光散射测定。为了保证微粒的稳定性,将10%(m/m)微凝胶分散在水溶液中制备悬浮液。
1.3.3 数据分析
以上实验测定均重复3 次,结果以平均值±标准差(Mean±SD)表示。采用软件SPSS 进行单因素方差分析,P<0.05 为样本平均值之间存在显著性差异,使用Origin 软件对统计数据进行评估。
2 结果与讨论
2.1 生理盐水无菌验证实验分析
如表1 所示,在第0、12 和24 小时使用ATP 检测仪检测出的RLU 值均为0,一般认为人体肠道消化模拟系统处于无菌状态[23]。由图3 可知,在第0、12和24 h取出的样品经过培养后在培养基上均无菌落形成,说明人工肠道模拟系统具有良好的密封性、抗菌性,具备体外消化模拟系统的使用条件。
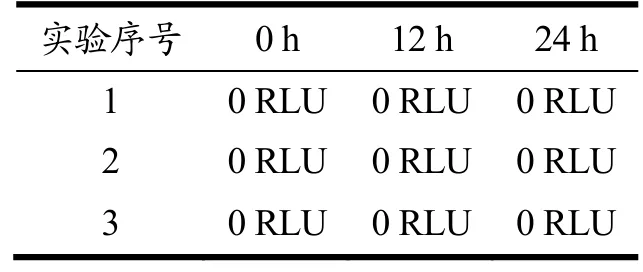
表1 ATP 检测仪的RLU 值Table 1 RLU value of ATP detector
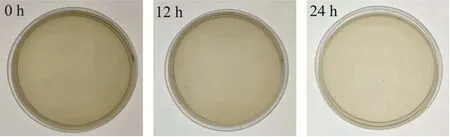
图3 无菌实验验证结果Fig.3 Verification results of sterility test
2.2 微凝胶的结构表征
图4 为结冷胶微凝胶和结冷胶@壳聚糖微凝胶在不同pH 值下的Zeta 电位图。由图可知,结冷胶微凝胶表面的Zeta 电位值为负值,随着pH 的升高,Zeta 电位绝对值增大,说明微凝胶体系越稳定[24]。但因为壳聚糖是一种聚阳离子多糖,壳聚糖包覆结冷胶表面后,微凝胶的Zeta 电位为正值,且pH 值越高,所带正电荷越少,说明壳聚糖与结冷胶结合更紧密。在pH 值为6 时,结冷胶微凝胶的Zeta 电位为-14.30 mV;壳聚糖包覆后,Zeta 电位值为22.43 mV,通过对比包裹前后Zeta 电位由负变正,充分的说明了壳聚糖成功包覆在了结冷胶微凝胶的表面,结冷胶@壳聚糖微凝胶制备成功。图5 为微凝胶荧光标记后的激光共聚焦显微镜图,488 nm 光源下结冷胶呈现绿色(图5a),543 nm光源下壳聚糖呈现红色(图5b),自然光源下的微凝胶的显微镜图片如图5c 所示,微凝胶荧光显微镜图很好的证实了壳聚糖包覆在结冷胶表面[20]。

图4 结冷胶微凝胶和结冷胶@壳聚糖微凝胶在不同pH 值下的Zeta 电位图Fig.4 Zeta potentials of gellan gum gel microgel and gellangum@chitosan gel microgel at different pH value

图5 微凝胶的激光共聚焦显微镜图Fig.5 Confocal laser microscopy of microgel
2.3 微凝胶的体外消化模拟实验
2.3.1 两种体外模拟消化系统消化时的Zeta电位变化
图6a 所示为结冷胶微凝胶在摇床和体外模拟消化系统中反应的Zeta 电位变化。在消化的前2 h,即模拟胃部消化,结冷胶微凝胶的Zeta 电位呈缓慢变化趋势。在消化的后4 h,即模拟肠道消化,结冷胶微凝胶的Zeta电位下降明显加快,说明结冷胶在人体消化过程的反应大多集中在肠道中。在整个模拟胃肠道连续消化的反应过程中,结冷胶微凝胶,在摇床反应中的Zeta 电位从-3.56 mV 降低到-16.10 mV;人工肠道模拟消化系统中的Zeta 电位从-3.26 mV 降低到-17.97 mV,可知在人工模拟肠道消化系统对结冷胶微凝胶的消化程度更高,消化更彻底。
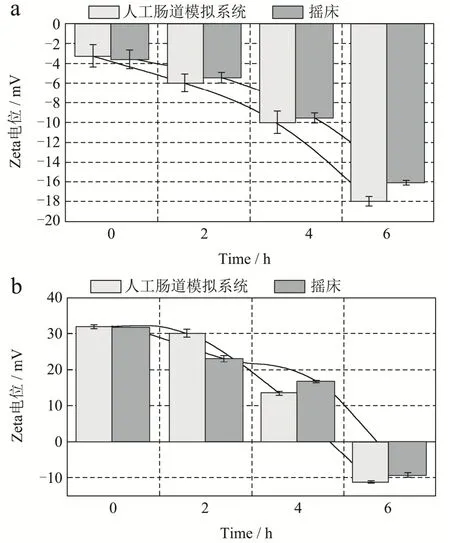
图6 摇床和体外模拟消化系统消化微凝胶前后Zeta 电位变化Fig.6 Zeta potential changes before and after gellan microgel was digested by the shaking table and in vitro simulated digestive system
图6b 所示为摇床和体外模拟消化系统消化结冷胶@壳聚糖微凝胶前后Zeta 电位变化。由图可知,在消化的前2 h,即模拟胃部消化,在体外模拟消化系统消化系统中结冷胶@壳聚糖微凝胶的Zeta电位没有显著性变化,而摇床消化系统中结冷胶@壳聚糖微凝胶的Zeta 电位显著下降,说明包裹在结冷胶表面的壳聚糖已经开始被消化。在消化的后4 h,即模拟肠道消化,体外模拟消化系统中结冷胶@壳聚糖微凝胶的Zeta电位显著下降;而摇床消化系统中的Zeta 电位下降较缓。在消化结束时,两种模拟消化系统中结冷胶@壳聚糖微凝胶的Zeta 电位均从开始的正值变为负值,在摇床反应中,结冷胶@壳聚糖微凝胶Zeta 电位从31.57 mV 降低到-9.37 mV;人工模拟肠道消化系统中,Zeta 电位从31.97 mV 降低到-11.26 mV,电位下降值更大,这说明微凝胶的破碎程度更大,导致表面暴露的电荷更多。
2.3.2 两种体外模拟消化系统消化时的粒径变化
图7 所示为两种消化系统中结冷胶微凝胶和结冷胶@壳聚糖微凝胶随时间改变的微凝胶粒径分布。可以看出在消化过程中,凝胶的粒径随着消化时间的延长而变小。如图7a 所示,在摇床消化系统消化中结冷胶微凝胶所占百分比最多的粒径,从初始的114 μm(0 h)减小到94 μm(6 h),而在摇床消化系统中结冷胶@壳聚糖微凝胶分布最多的粒径从109 μm(0 h)减小到83 μm(6 h)。在人工肠道体外模拟消化系统消化中,结冷胶微凝胶分布最多的粒径从127 μm(0 h)减小到79 μm(6 h)。与图6a 摇床消化结果相比,人体肠道体外模拟消化系统消化的结冷胶微凝胶粒径变化更大,说明人工肠道体外模拟消化系统消化更加充分,使得微凝胶粒径可以变得更小,这与Zeta 电位变化结果相一致。图7d 为人工肠道体外模拟消化系统消化结冷胶@壳聚糖微凝胶粒径变化图,与图7b 摇床消化结果相比,粒径同样呈减小趋势,也说明人工肠道体外模拟消化系统消化更加充分;且与人工肠道体外模拟消化系统消化结冷胶微凝胶对比,最终的粒径并无较大差距,说明人工肠道体外模拟消化系统的消化功能较稳定。
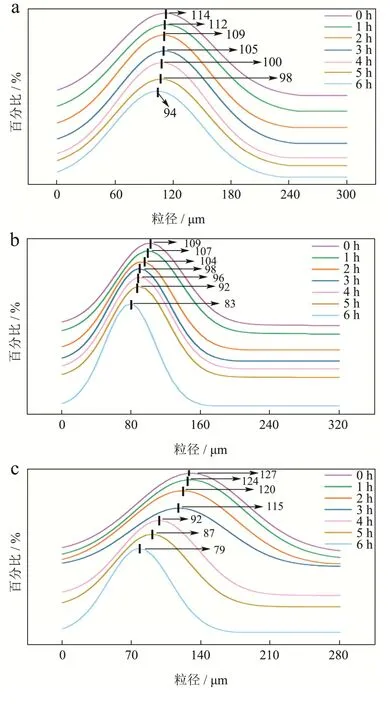
图7 两种消化系统中结冷胶微凝胶和结冷胶@壳聚糖微凝胶最大粒径的变化趋势Fig.7 Variation trend of maximum particle size of gellan gum gel microgel and gellangum@chitosan gel microgel digested by two digestive systems
图8 所示为摇床和体外模拟消化系统消化两种微凝胶前后体积平均粒径(D32)变化。在两种模拟消化系统中,结冷胶微凝胶和结冷胶@壳聚糖微凝胶的平均尺寸大小均呈现下降趋势,这也与zeta 电位的变化规律一致,微凝胶被消化破碎后平均尺寸变小。由图可知,在包裹壳聚糖后,结冷胶@壳聚糖微凝胶的平均尺寸与结冷胶微凝胶相比显著变小,这与文献[22]中报道的结论一致。在消化结束时,摇床消化系统中的微凝胶与体外模拟消化系统中的平均尺寸相比更大,这说明体外模拟消化系统对于微凝胶的消化更彻底。
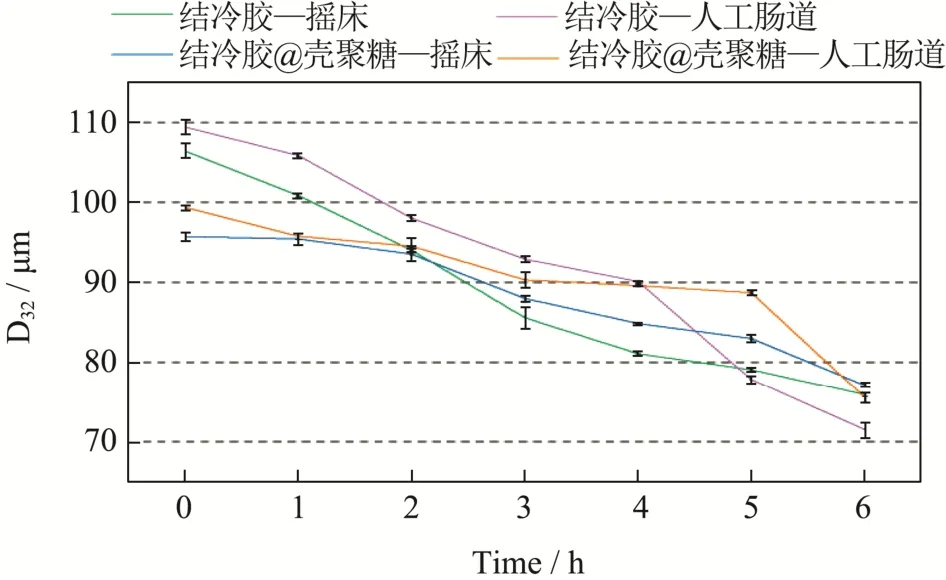
图8 摇床和体外模拟消化系统消化微凝胶前后体积平均尺寸的变化Fig.8 Average size changes of microgel before and after digestion on a rotary shaker and in vitro simulated digestive system
2.3.3 两种模拟消化系统消化前后的光学显微镜图的对比
图9a 和9c 所示为体外模拟消化系统和摇床中结冷胶微凝胶光学显微镜图。由图可知,结冷胶微凝胶消化前在显微镜下呈现透明的圆形,摇床模拟系统消化后1 h,凝胶形态变化不明显;2 h 后凝胶形状明显变小,但仍呈现圆形;在第3~6 h,凝胶破碎,呈无规则形状,结果说明结冷胶微凝胶在胃反应下较稳定,反应集中在肠道中。

图9 摇床和体外模拟消化系统消化过程中微凝胶的显微镜图Fig.9 Microscopic images of a rotary shaker and in vitro microgels simulating digestion of the digestive system
图9 b和9 d所示为体外模拟消化系统和摇床中结冷胶@壳聚糖微凝胶光学显微镜图。结冷胶@壳聚糖微凝胶消化前在显微镜下同样呈现圆形、透明,大小均匀。摇床模拟系统消化后2 h 内,凝胶形态变化不明显;在第3 h,凝胶形态变小,在显微镜下仍呈现圆形;在消化后的第6 h,凝胶形态明显变小,凝胶部分破碎,但仍可见凝胶边缘。这是由于壳聚糖涂层结冷胶微凝胶后,正负电荷之间相互结合,使得微凝胶结构更加稳定。
关于模拟肠道消化步骤对壳聚糖-结冷胶微凝胶的影响,可以观察到两个过程。首先,模拟肠液的pH值可以破坏壳聚糖-结冷胶微凝胶的表面电荷,之后随着壳聚糖的水解,凝胶发生了崩解。虽然所有样品在肠道消化后都出现了结构破坏,但粒径分布、光学显微镜观察和Zeta 电位结果都表明壳聚糖包裹微凝胶的破碎程度较低。因此,外层壳聚糖层的存在减少了微凝胶颗粒的崩解,延缓了微凝胶被模拟肠液的消化。
3 结论
本研究提供了一种接近动态生理条件下的TIM动态多室体外模拟消化评估系统,与传统体外消化模式相比,本研究所用模型具有高仿真、易于操作、体系稳定等特点。研究结果显示,该人体肠道消化模拟系统具有良好的密封性、抗菌性,具备体外消化模拟系统的使用条件。接着,结冷胶和壳聚糖制备的微凝胶在模拟消化过程中Zeta 电位、粒径大小以及微观结构的变化结果表明,结冷胶微凝胶在胃部消化时部分水解,而结冷胶@壳聚糖微凝胶在胃部模拟消化时不易水解,说明结冷胶@壳聚糖具有良好的耐胃酸性能;经过肠道消化后的微凝胶结构均有破碎,结冷胶微凝胶破碎程度更大。其中,经过人工肠道模拟系统的结冷胶和结冷胶@壳聚糖微凝胶的尺寸、形貌都发生明显变化,表明人工肠道体外模拟系统对微凝胶形式的活性多糖的消化更为彻底。综上所述,本研究所使用的人工肠道消化模拟系统可用于食品营养物质的消化研究,在人体消化过程中未消化成分的去向及肠道管腔内微生物代谢和生态的影响方面具有良好的应用前景。
