二氧化硫对采后葡萄果皮酚类物质合成及其抗氧化能力的调控作用
2024-01-09姜丽巍吴斌魏佳单晴张洁仙刘雪艳张平
姜丽巍,吴斌,魏佳,单晴,张洁仙,刘雪艳,张平*
(1.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)(2.新疆农业科学院农产品贮藏加工研究所,新疆农产品加工与保鲜重点实验室,新疆乌鲁木齐 830091)
木纳格葡萄(VitisviniferaL.)因其味美、多汁和富含天然抗氧化剂而深受消费者欢迎[1]。鲜食葡萄中的酚类化合物,如黄烷醇、花青素和类黄酮,在抗炎、缓解阿尔茨海默症和预防心血管疾病中具有重要作用[2]。果皮不仅是葡萄果实抵御外界压力的物理屏障,且富含丰富的酚类化合物。目前,关于果皮中酚类含量的研究多集中在葡萄浆果成熟过程中[3],对采后贮藏中果皮酚类物质含量的变化知之甚少。
黄烷醇是葡萄果皮中丰富的酚类化合物之一,(+)-儿茶素、(-)-表儿茶素、(-)-表没食子儿茶素和(-)-表儿茶素没食子酸酯是黄烷醇的主要组成成分[4]。黄烷醇对采后果实品质具有重要作用,可减少葡萄果实贮藏期间霉菌和酵母菌菌落的生长[5]。此外,黄烷醇含量与抗氧化能力高度相关,如:蓝莓果实中黄烷醇含量与1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-Picrylhdrazyl,DPPH)、2,2'-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[2,2'-Azino-Bis(3-Ethylbenzothiazoline-6)-Sulphonicaciddiammonium Salt),ABTS]自由基清除活性以及铁离子还原能力(Ferric Ion Reducing Antioxidant Power,FRAP)呈显著正相关[6]。此外,高含量的(+)-儿茶素、(-)-表儿茶素和(-)-表没食子儿茶素提高了鲜食葡萄ABTS+·和DPPH·的清除能力[7]。在1-甲基环丙烯和丙烯处理的李子中,观察到果皮中(+)-儿茶素和(-)-表儿茶素含量的增加和果肉中(+)-儿茶素和(-)-表儿茶素含量的减少[8]。黄烷醇不仅受外源物质的影响,还受内源基因的调控,黄烷醇的生物合成是通过苯丙烷途径来完成的。无色花色素还原酶基因(Leucoanthocyantin Reductase,LAR)和花青素还原酶基因(Anthocyanidin Reductase,ANR)是黄烷醇合成的关键基因,受病毒诱导的基因沉默抑制了TRV-VvANR感染葡萄叶片中VvANR表达,降低了(-)-表儿茶素和(-)-表没食子儿茶素的含量[9]。UV-B 和UV-C 辐照诱导了苯丙氨酸解氨酶基因(L-Phenylalanine Ammonia-Lyase,PAL)、查尔酮合酶基因(Chalcone Synthase,CHS)、VvANR和VvLAR的表达,促进了果皮中(+)-儿茶素、(-)-表儿茶素和(-)-表没食子儿茶素的合成[10]。
SO2在葡萄保鲜行业的商业化应用已有近一个世纪[11]。SO2对致病菌的抑制作用一直被认为是维持鲜食葡萄采后品质的关键因素[12]。前人研究表明SO2可上调亚硫酸还原酶基因(SulfiteReductase,SiR)、丝氨酸乙酰转移酶1 基因(SerineAcetyltransferase1,SAT1)、丝氨酸乙酰转移酶 2 基因(Serine Acetyltransferase2,SAT2)和O-乙酰丝氨酸硫醇-裂解酶基因(O-AcetylserineThiol-Lyase,OASTL)的表达,诱导亚硫酸盐还原来维持过氧化氢稳态,以减少鲜食葡萄中的氧化损伤[13]。此外,SO2可增加苯丙氨酸解氨酶(L-Phenylalanine Ammonia-Lyase,PAL)酶活性,上调VvCHI的表达,促进鲜食葡萄中总酚和类黄酮的积累[14]。然而,SO2是否调节酚类物质合成相关基因的表达以及如何调控的尚不明确。
本研究旨在评价SO2对木纳格葡萄果皮酚类化合物含量、黄烷醇单体含量及抗氧化活性的影响。通过测定低温贮藏期间酚类化合物生物合成相关基因的表达,了解采后SO2对葡萄果皮酚类物质合成的分子调控机制,可为鲜食葡萄采后保鲜技术的发展提供理论依据。
1 材料与方法
1.1 材料与试剂
商业成熟(可溶性固形物TSS≥19%;可滴定酸TA≥0.42%)的木纳格葡萄(VitisviniferaL.cv‘Munage’)于2021 年10 月从新疆阿图什市头塔格提云村的商业葡萄园中采摘,立即用冷藏车运回实验室。在(0±1)℃预冷12 h。选取大小均匀、无褐变、裂果及病害等损伤的葡萄串,将大约3.5 kg 鲜食葡萄有序摆放在内衬无纺布和吸水纸的周转筐(尺寸43 cm×30 cm×13 cm)中,置于(0±1)℃贮藏用于后续试验。
SO2气体(纯度≥99.9%),成都恒源气体有限公司;没食子酸、芦丁、福林酚,北京索莱宝科技有限公司;1,1-二苯基-2-三硝基苯肼、2,2'-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐、2,4,6-三吡啶基三嗪、(+)-儿茶素、(-)-表儿茶素、(-)-表没食子儿茶素和(-)-表儿茶素没食子酸酯,上海源叶生物科技有限公司;氯化铁、香草醛、亚硝酸钠、三氯化铝、过氧化氢,天津市致远化学试剂有限公司,以上试剂均为分析纯。RNAprep Pure Plant Plus 试剂盒、Fast Start Essential DNA Green Master Mix 试剂盒,天根生物技术有限公司。
1.2 仪器设备
T6-新世纪紫外分光光度计,北京普析通用仪器有限公司;Altus-10 高效液相色谱仪,美国PerkinElmer公司;CB4 1QB 凝胶图像分析系统,英国UVltec 公司;PCV-6000 微型离心机,英国GRANT 公司;DYY-6电泳仪,北京六一生物科技有限公司;LightCycler®96实时荧光定量PCR 仪,瑞士罗氏公司;Eppendorf 高速冷冻离心机,德国Hettich 科学仪器公司;ML204/02分析天平,梅特勒托力多国际贸易有限公司;MDF-682 低温冰箱,松下冷链(大连)有限公司。
1.3 试验处理方法
样品随机分为两组,每组各27 筐,每筐约装3.5 kg葡萄。在(0±1)℃条件下用500 μL/L SO2熏蒸箱(体积80 cm×70 cm×70 cm)熏蒸2 h,以空气熏蒸为对照。熏蒸后,将所有样品密封在聚乙烯袋中,熏蒸结束后48 h 取样,之后每隔7 d 取样一次,直至保存结束。在(0±1)℃、90%~95%相对湿度下保存44 d。从3个筐子中随机选取约100 粒完整葡萄果实,手工剥取葡萄皮立即放入液氮中,之后用研磨机研磨成粉末于-80 ℃保存。共计15 组样品,用于后续试验。
1.4 各指标测定方法
1.4.1 总酚、总黄烷醇、总黄酮和总花青素含量的测定
葡萄果皮酚类化合物含量的测定参照Sheng 等[7]的方法,略有改动。称取果皮1.5 g,加入5.0 mL 预冷的φ=80%甲醇(含2%盐酸),4 ℃过夜浸提。4 ℃条件下10 000 r/min 离心15 min,上清液用于测定总酚、总黄烷醇、总黄酮和总花青素含量。
1.4.1.1 总酚含量的测定
将200 μL 提取物混合到1.0 mL 福林酚试剂中,静置3 min 后,向混合物中加入0.8 mLm=7.5%无水碳酸钠,加入9.8 mL 去离子水,暗处放置1 h 后,于765 nm处测定吸光值,每个样品测定三次,以没食子酸(Galic Acid,GAE)为标准,结果以g/kg GAE 表示。
1.4.1.2 总黄烷醇含量的测定
吸取提取物100 μL,加入6.0 mL 40 g/L 的香草醛-甲醇溶液,缓慢加入3.0 mL 浓盐酸,30 ℃避光水浴30 min,于500 nm 处测定吸光值,每个样品平行测定三次,以儿茶素(Catechins,CAT)为标准,结果以g/kg CAT 表示。
1.4.1.3 总黄酮含量的测定
吸取葡萄果皮提取液100 μL,加入900 μL 去离子水,加入150 μL 50 mg/mL亚硝酸钠溶液,静置3 min后,加入300 μL 100 mg/mL 三氯化铝溶液和1.0 mL 40 mg/mL 氢氧化钠溶液,于510 nm 处测定吸光值,每个样品平行测定三次,以芦丁(Rutin,RE)为标准,结果以g/kg RE 表示。
1.4.1.4 总花青素含量的测定
吸取提取物500 μL 和2.0 mL 两种不同的缓冲液(pH 值1.0,0.025 mol/L 氯化钾和pH 值4.5,0.4 mol/L醋酸钠)分别混合均匀,在暗处放置15 min 后,在510 nm 和700 nm 处测定吸光值,结果以每千克样品的矢车菊素-3-O-葡萄糖苷(Cyanidin-3-O-Glucoside,C3G)的克数表示,即g/kg C3G,每个样品平行测定三次。
1.4.2 黄烷醇单体含量的测定
(+)-儿茶素、(-)-表儿茶素、(-)-表没食子儿茶素和(-)-表儿茶素没食子酸酯的测定参照Liang 等[15]方法,略有修改。取0.5 g 样品加入5.0 mLφ=70%甲醇(含2%甲酸)中,混合后超声提取30 min。4 ℃浸渍12 h后,在12 000 r/min 下4 ℃离心20 min。上清液经0.45 μm 有机微孔过滤膜过滤,采用高效液相色谱法,C18 柱(250 mm×4.6 mm×5 μm)分析。以φ=0.2%甲酸水溶液为溶剂A,甲醇为溶剂B,梯度曲线:92.5%A 持续5 min,75% A 到55% A 持续5~10 min,55% A到35% A 持续10 min。设置进样量10 μL,柱温30 ℃。流速为1.0 mL/min,洗脱峰在280 nm 处。按标准曲线计算(+)-儿茶素、(-)-表儿茶素、(-)-表没食子儿茶素和(-)-表儿茶素没食子酸酯的含量,各样品均平行测定三次,结果用g/kg 表示。
1.4.3 DPPH 自由基清除活性的测定
葡萄果皮DPPH·清除率的测定参照Shen 等[16]的方法,略修改。吸取上述1.4.1 中的提取物100 μL 加入到含有2.9 mL 0.1 mmol/L的DPPH溶液(甲醇制备)中,30 ℃黑暗环境下孵育30 min,于517 nm 处测定吸光值A1,以100 μLφ=80%甲醇和2.9 mL DPPH 甲醇溶液作为空白对照测定吸光值A0,平行测定三次,计算公式如下。
式中:
A0——空白对照组测定的吸光值;
A1——实验组测定的吸光值;
C——DPPH 自由基清除率,%。
1.4.4 ABTS+自由基清除活性的测定
ABTS+·清除率的测定参照Re 等[17]的方法测定。将7.5 μmol/L ABTS+·溶液和2.5 μmol/L 的过硫酸钾按体积1:1 混合均匀,暗处反应16 h,用无水乙醇稀释混合液在734 nm 处的吸光值为0.7,作为测试液。吸取上述1.4.1 中的提取物100 μL 加入到3.2 mL ABTS+·测试液中,暗处放置6 min 后,于734 nm 处测定吸光度,平行测定三次。
1.4.5 FRAP 还原能力的测定
FRAP 的测定参考Benzie 等[18]的方法,略改动。0.1 mol/L 乙酸盐缓冲液(pH 值3.6)、10 mmol/L 2,4,6-三(2-吡啶基)-1,3,5-三嗪和20 mmol/L 氯化铁按10:1:1(V/V/V)比例混合来制备FRAP 试剂,吸取上述1.4.1中的提取物100 μL 加入到4.9 mL FRAP 试剂中,在37 ℃孵育10 min,于593 nm 处测定吸光值,平行测定三次,以硫酸亚铁为标准计算FRAP 值。
1.4.6 酚类合成基因表达量的测定
按照RNAprep Pure Plant Plus 试剂盒说明书中的方法从葡萄果皮中提取总RNA。使用微量核酸分光光度计评估提取RNA 的质量,随后,用TIANScript II RT试剂盒进行cDNA 合成。从国家生物技术信息中心(NCBI)鉴定酚类生物合成相关基因的核苷酸序列,设计特异性引物,并由生物有限公司合成。使用实时荧光定量PCR 仪,参照Fast Start Essential DNA Green Master Mix 说明书进行RT-qPCR。VvActin作为参考基因,基因的相对表达量用2-△△CT方法计算[19],本研究使用的引物序列及登录号见表1。
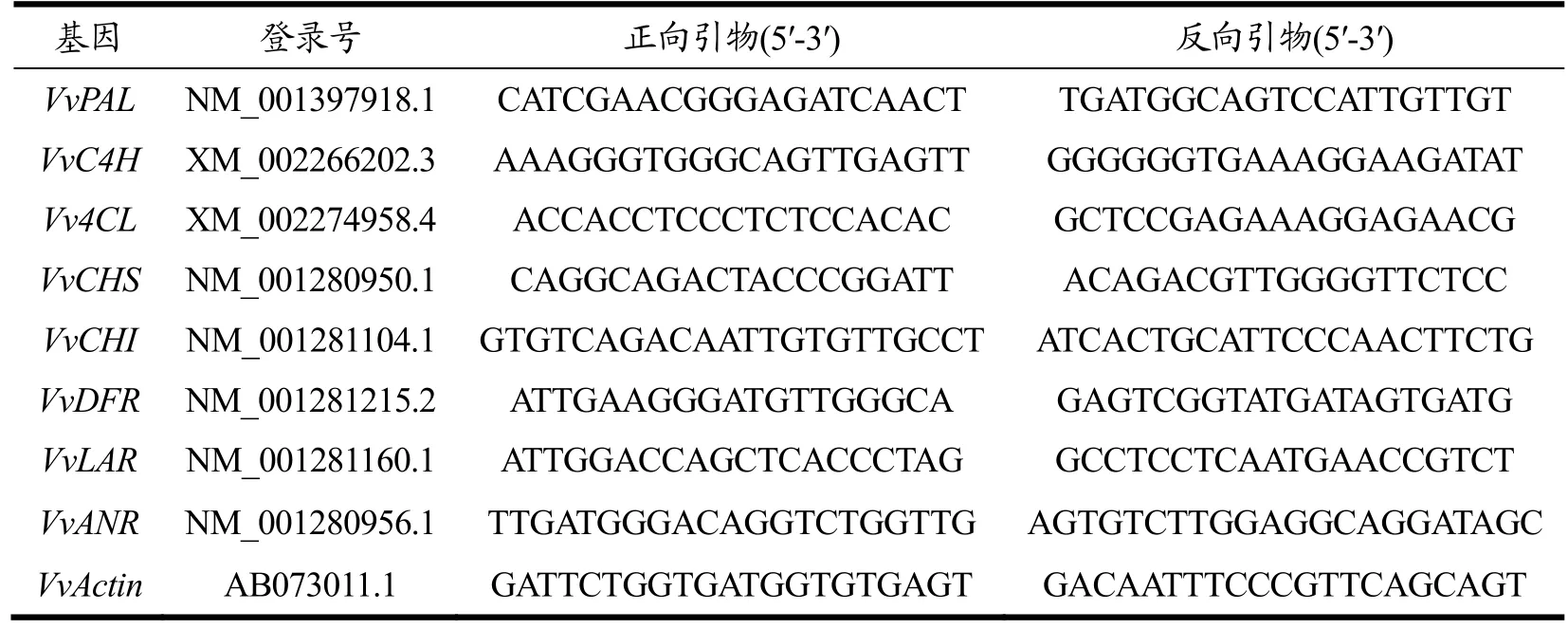
表1 酚类合成相关基因引物序列Table 1 Sequence of primers related to phenolic synthesis
1.5 数据分析
使用GraphPad Prism 8.0 软件作图,SPSS 20.0 进行分析数据,采用配对t检验进行显著性分析。其中P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结果与讨论
2.1 SO2 对葡萄果皮总酚、总黄烷醇、总黄酮和总花青素含量的影响
SO2对葡萄果皮总酚含量有影响,在贮藏前16 d SO2处理组和对照组无显著差异。总体呈下降-上升-下降趋势(图1a)。贮藏结束时,SO2处理组总酚含量为42.05 g/kg,比对照组高10.28%。这与SO2处理的玫瑰香葡萄结果是类似的[14]。SO2处理对葡萄果皮总黄烷醇含量的影响如图1b 所示,葡萄果皮总黄烷醇含量总体呈先上升后下降趋势,在贮藏2 d 后SO2处理组和对照组间存在显著性差异(P<0.05)。贮藏至第9 天时对照组总黄烷醇含量为27.15 g/kg,SO2处理组比对照组高10.55%。吴敏等[20]基于代谢组学解析发现,SO2可显著调控类黄酮的生物合成。在我们的研究中,对照组葡萄果皮的总黄酮含量在贮藏期间呈下降趋势(图1c),在贮藏2 d 后SO2处理组均显著高于对照组(P<0.05)。贮藏结束时,SO2处理组葡萄果皮的总黄酮含量比初始值低38.53%,是对照组的1.33倍。贮藏期间总花青素含量的变化如图1d 所示,呈上升-下降-上升-下降趋势。除第9 天外,SO2处理组与对照组均存在显著差异(P<0.05)。峰值出现在第9天和第23 天,其中,第23 天SO2处理组比对照组高20.24%。贮藏至第44 天,SO2处理组比对照组高33.12%。此外,SO2也可调控红地球葡萄的总花青素含量[21]。综上所述,SO2可在一定程度上延缓酚类化合物含量的下降。

图1 SO2对葡萄果皮总酚(a)、总黄烷醇(b)、总黄酮(c)和总花青素(d)含量的影响Fig.1 Effects of SO2 on the contents of total phenols (a),total flavanols (b),total flavones (c) and total anthocyanins (d) in grape peel
2.2 SO2对葡萄果皮黄烷醇单体含量的影响
黄烷醇是葡萄果皮中丰富的酚类化合物之一,Souquet 等[22]从葡萄果皮提取物中鉴定出四种主要的黄烷醇单体,(+)-儿茶素、(-)-表儿茶素、(-)-表儿茶素没食子酸酯和(-)-表没食子儿茶素。因此,本研究检测了葡萄果皮中这四种黄烷醇单体含量。实验发现,SO2对(+)-儿茶素、(-)-表儿茶素、(-)-表儿茶素没食子酸酯和(-)-表没食子儿茶素均具有一定的调控作用。如图2a 所示,SO2处理可显著提高9~37 d (+)-儿茶素的含量(P<0.05),第9 天出现峰值,SO2处理组比对照组高24.55%。在贮藏期间(-)-表儿茶素含量呈先上升后下降趋势(图2b),贮藏结束时,SO2处理组是对照组的1.79 倍,为初始值的39.54%。由图2c可以看出,(-)-表儿茶素没食子酸酯含量在贮藏期间呈先上升后下降趋势,峰值出现在第16 天,SO2处理组是对照组的1.37 倍。除第2 天和第44 天SO2处理均显著提高了(-)-表没食子儿茶素含量,第9 天出现峰值(图2d),SO2处理组比对照组高16.92%。这与卫颖等[23]对极早蜜葡萄的研究结果一致。四种黄烷醇单体中(+)-儿茶素含量最高,初始值为5.60 g/kg,(-)-表儿茶素没食子酸酯含量最低,初始含量为0.05 g/kg。在‘夏黑’葡萄中(+)-儿茶素含量最高,但未检测到(-)-表没食子儿茶素[7],这可能是因为葡萄品种差异造成的。

图2 SO2对葡萄果皮黄烷醇单体含量的影响Fig.2 Effect of SO2 on flavanol monomer content in grape peel
2.3 SO2对葡萄果皮抗氧化能力的影响
葡萄果皮的酚类物质含量和种类与其抗氧化活性密切相关[24]。为了评价木纳格葡萄果皮酚类物质的抗氧化效果,本试验采用DPPH·清除率、ABTS+·清除率和FRAP 来评价SO2处理后酚类提取物的抗氧化能力。除第2 天外,SO2处理组DPPH·清除率均显著高于对照组(P<0.05)。DPPH·清除率呈先上升后下降趋势(图3a),贮藏至第16 天时DPPH·清除率出现峰值,SO2处理组DPPH·清除率为43.73%,比对照组高6.16%。贮藏期间对照组葡萄果皮ABST+·清除率呈不断下降趋势(图3b),与总黄烷醇、总黄酮和(-)-表儿茶素含量变化趋势相一致,说明ABST+·清除率与总黄烷醇、总黄酮和(-)-表儿茶素含量可能相关。这与Sheng等[7]对‘夏黑’葡萄的研究结果一致。除第2 天外,ABST+·清除率处理组均显著高于对照组(P<0.05)。第44 天,对照组ABST+·清除率为10.87%,SO2处理组是对照组的1.20 倍。在贮藏期间SO2处理组葡萄果皮FRAP 均显著高于对照组(图3c)。FRAP 变化趋势与总花青素含量变化相似,说明FRAP 可能与花青素含量有关。贮藏结束时,SO2处理组FRAP 比对照组高4.98%,是初始值的1.05 倍。综上所述,与对照组相比,SO2处理组葡萄果皮在贮藏期间表现出更高水平的抗氧化能力,这可能是因为SO2处理提高了各酚类化合物含量。茉莉酸甲酯处理后龙眼果皮总酚和总黄酮含量的增加和DPPH·清除率的提高与本实验结果一致[25]。
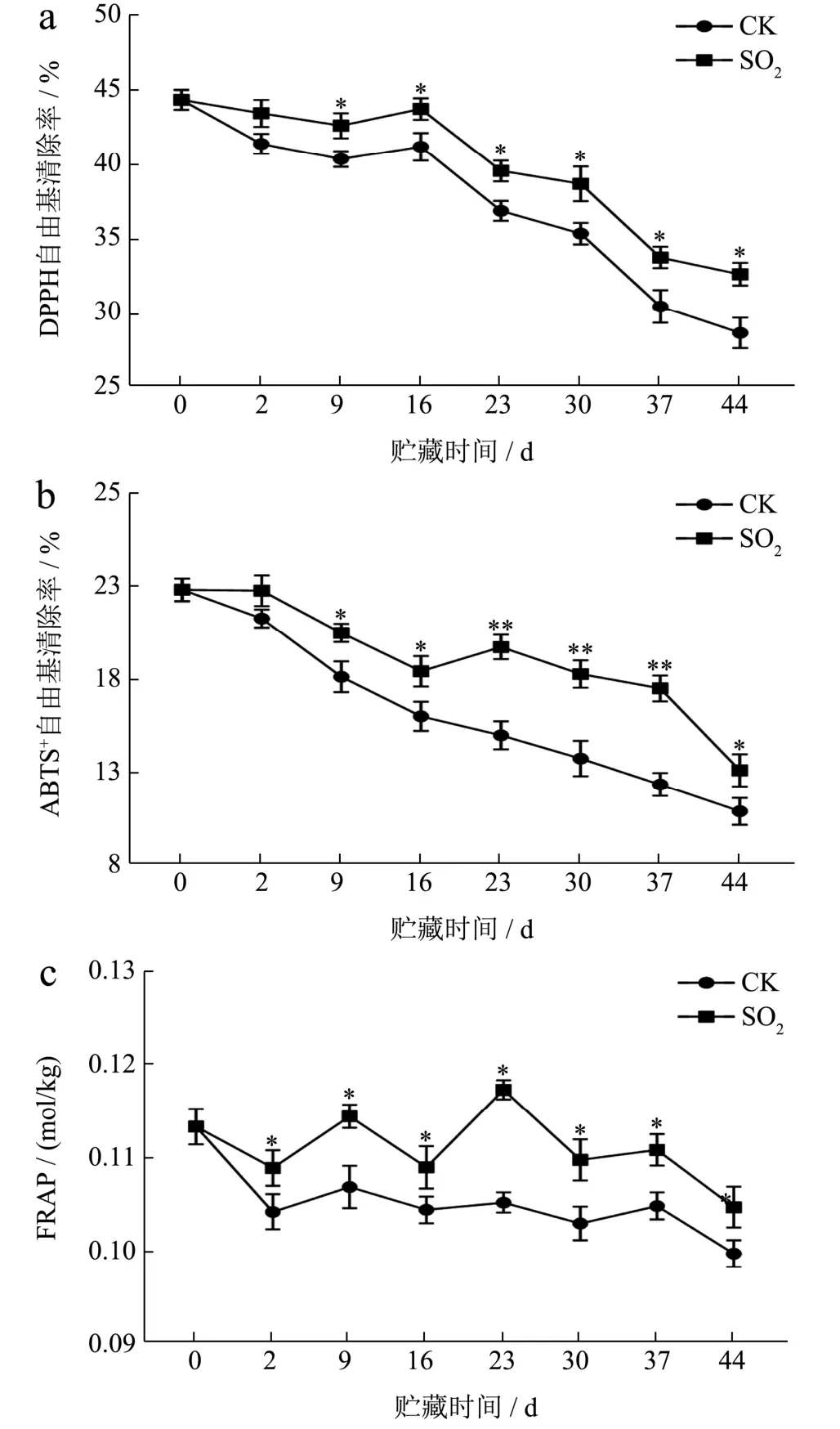
图3 SO2对葡萄果皮抗氧化能力的影响Fig.3 Effect of SO2 on antioxidant capacity of grape peel
2.4 SO2对葡萄果皮酚类合成基因表达量的影响
在SO2处理的葡萄果皮中检测到较高水平的酚类化合物,这取决于SO2诱导的苯丙烷途径[14]。PAL、肉桂酸-4-羟基化酶(Cinnamate 4-Hydroxylase,C4H)和4-香豆酸-辅酶连接酶(4-Coumarate:CoA Ligase,4CL)是苯丙烷途径中三种重要的酶[26]。如图4a 所示,葡萄果皮VvPAL表达量在2 d、23 d、30 d 和37 d SO2处理组均显著高于对照组(P<0.01)。处理组分别为对照组的1.82 倍、1.36 倍、1.33 倍和1.36 倍。SO2处理组肉桂酸-4-羟基化酶基因(Cinnamate 4-Hydroxylase,C4H)表达量在2 d、16 d、37 d 和44 d 与对照组有显著差异(P<0.05),SO2处理组第16 天表达量最高为5.58,是对照组的15.5 倍(图4b)。由图4c 所知,SO2处理组4-香豆酸-辅酶连接酶基因(4-Coumarate:CoA Ligase,4CL)表达量除第2 天和第30 天外均显著高于对照组(P<0.05),第16 天表达量为5.77,比处理组高387.08%,这可能是第16 天SO2处理组总酚含量显著高于对照组的原因。在本研究中SO2处理可能通过上调VvPAL、VvC4H和Vv4CL在果皮中的表达,而延缓总酚和总黄酮的下降。茉莉酸甲酯通过增强LbPAL、LbC4H和Lb4CL的表达,提高了百合总酚和总黄酮含量与本研究结果一致[27]。
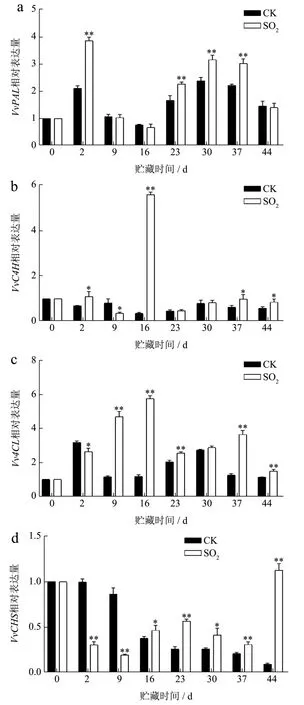
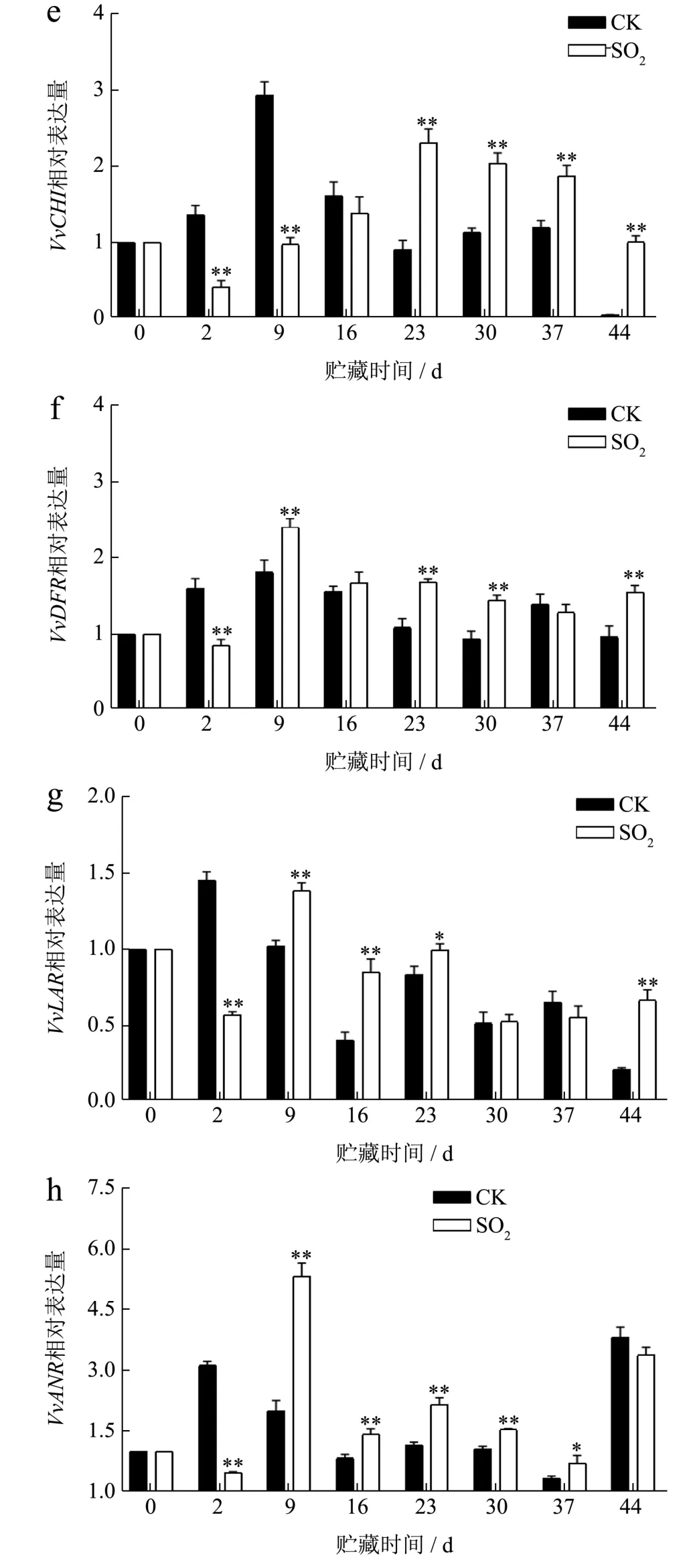
图4 SO2对葡萄果皮酚类合成基因表达量的影响Fig.4 Effect of SO2 on the expression of grape peel phenols synthesis genes
VvPAL、VvC4H和Vv4CL是苯丙烷途径开始的第一步基因,可能影响下游基因VvCHS、VvCHI、VvDFR、VvLAR和VvANR的表达。对照组VvCHS的表达量在贮藏前16 d 无明显变化(图4d),贮藏至第44 天时,SO2处理组表达量最高为1.12,是对照组的12.11 倍。由图4e 可知,查尔酮异构酶基因(Chalcone Isomerase,CHI)表达量在16 d 之后SO2处理组均显著高于对照组(P<0.01),第44 天对照组几乎不表达,SO2处理组是对照组的20.31 倍。同样,观察到SO2处理组酚类物质含量均显著高于对照组。VvCHS和VvCHI的表达可能为酚类合成提供了前体物质,这与褪黑素处理的‘Kyoho’葡萄结果相似[28]。值得一提的是,对照组VvCHS和VvCHI的表达在第2 天和第9 天均显著增加,而SO2处理组显著抑制了二者的表达(P<0.01)。说明SO2可以诱导VvCHS和VvCHI的表达,但这种诱导具有时间效应。
如图4f 所示,SO2处理组二氢黄酮醇-4-还原酶基因(Dihydroflavonol 4-Reductase,DFR)表达量仅在第2 天显著低于对照组(P<0.01),这与SO2对总花青素的调控模式类似,SO2处理组VvDFR的表达总体呈先上升后下降趋势,峰值出现在第9 天,SO2处理组比对照组高32.33%。DFR 是花青素生物合成的限速酶,控制花青素合成途径的碳通量方向,从而影响花青素的含量[29]。在UV-C 处理的甜樱桃中观察到PaDFR的表达增强,促进了花青素的生物合成[26]。因此,推测SO2处理总花青素含量高于对照组可能是因为VvDFR的表达量提高。
在图4g 中,SO2处理的VvLAR表达量在第9、16、23 和44 天均显著高于对照组(P<0.05),分别比对照组高36.28%、113.01%、19.10%和221.91%。同时,也相应提高了(-)表儿茶素和(-)表儿茶素没食子酸酯的含量。由图4h 可知,除第2 天和第44 天,贮藏期间SO2处理组VvANR表达量均显著高于对照组(P<0.05),且与(+)-儿茶素和(-)-表没食子儿茶素含量变化趋势总体一致,SO2处理组第9 天表达量为5.32,比对照组高164.09%。这与Liang 等[15]对‘早黑宝’葡萄的研究结果类似。LAR 和ANR 是负责黄烷醇合成的关键酶[9]。SO2处理可通过诱导VvANR和VvLAR的表达,提高果皮中黄烷醇的含量。有类似的研究表示可以通过调节VvANR、VvLAR1和VvLAR2的表达,而提高葡萄叶片中黄烷醇含量[9]。因此,SO2的应用可能是诱导VvANR和VvLAR的表达促进葡萄果皮黄烷醇合成的有效方式。
3 结论
SO2处理可激活木纳格葡萄果皮的苯丙烷代谢途径。SO2处理可通过上调VvPAL、VvC4H、Vv4CL、VvCHS、VvCHI、VvDFR、VvLAR和VvANR的表达,延缓果皮中总酚、总黄烷醇、总黄酮和总花青素含量的下降,增加黄烷醇单体(+)-儿茶素、(-)-表儿茶素、(-)-表没食子儿茶素和(-)-表儿茶素没食子酸酯的含量,维持采后葡萄果皮的抗氧化能力。然而,酚类化合物单体众多且结构复杂,SO2对其他酚类化合物单体的调控作用仍有待进一步研究。且不同浓度SO2对酚类化合物的影响尚不明确,本研究为SO2在葡萄果实采后酚类化合物合成方面的研究提供理论依据。
