氯化焙烧粉煤灰脱除Pb、Cd 的机理及其应用
2024-01-09黄齐真石林何柳青
黄齐真 ,石林 ,2,何柳青
(1.华南理工大学 环境与能源学院,广东 广州 510006;2.工业聚集区污染控制与生态修复教育部重点实验室,广东 广州 510006)
粉煤灰是煤炭燃烧过程中产生的一种固体废物,是我国目前产量最大的固体废物之一。2018年,中国粉煤灰年产量超过了5.5 亿t,由于不充分利用,粉煤灰总量已经超过了30 亿t。由于我国对能源需求的日益增长,且火力发电在短时间内难以被大规模替代,这将会产生更多的粉煤灰[1]。如不能有效提高粉煤灰的利用率,将会导致粉煤灰积累过多,进而造成严重的环境污染[2-3]。
目前,粉煤灰的主要消纳途径集中在建筑行业,其消耗量超过粉煤灰利用量的80%。然而,未来民用住房和基础设施建设的预期减少可能会导致建筑业粉煤灰使用量的减少[4]。因此,如何将粉煤灰进行高效、高值、可持续地利用是一个值得深入研究的问题。
粉煤灰含有Si,Ca,K,Mg,S,Cu,Mn,Zn 等多种有益于植物生长的营养元素[5-6]。但要使粉煤灰在农业领域得到高效利用,就必须提高其矿质养分有效含量以及尽可能降低其中重金属含量。从粉煤灰中去除重金属的方法有很多,如微生物浸出法、电渗析法、酸碱法、螯合剂化学分离法等[7-8]。但这类方法普遍存在着去除重金属效果差、运行费用高、废水处理成本高等缺点[9]。因此,寻找一种经济有效的脱除粉煤灰中重金属的方法是提高粉煤灰综合利用水平的关键。
由于金属氯化物沸点较低[10],可以通过氯化作用将重金属转化为金属氯化物,从而增加重金属的挥发性,因此氯化是去除重金属的一种有效方法。成熟的工业化氯化工艺在有色金属回收领域已有数十年的历史[11]。但通过氯化焙烧法去除粉煤灰中的重金属的研究较少。
氯化钙具有较高的氯化效率[12]且对于后续利用粉煤灰制备土壤调理剂具有积极的影响,本文采用氯化钙作为氯化剂进行实验,研究了焙烧温度、焙烧时间及CaCl2添加量对粉煤灰中Pb、Cd 去除率的影响。以实验结果和热力学计算相结合的方式,分析了氯化焙烧脱除粉煤灰中重金属的机理,并探讨了焙烧过程的动力学参数。同时利用粉煤灰基矿物质生产土壤调理剂[13],对调理剂理化性能进行了分析,并通过盆栽实验对其效果进行了探讨。
通过对粉煤灰氯化焙烧脱除重金属方法的研究,探讨了重金属脱除的机理,该方法可使粉煤灰在提高矿质养分有效含量的同时,降低其重金属的含量,即在以粉煤灰为原料制备土壤调理剂时,省去了对粉煤灰进行前处理降低其重金属含量的过程,从而大大降低了粉煤灰的综合利用成本,使粉煤灰在农业上得到更高效、高值、可持续的综合利用。
1 实验材料及方法
1.1 供试材料
本实验中使用的粉煤灰样品颜色为深灰色,含水率为1.95%,烧失量为0.23%,比表面积为1.282 m2/g,平均粒度5.762 µm,d0.9=37.530 µm。粉煤灰的XRD 见图1,该粉煤灰的主要成分为石英和莫来石。粉煤灰的SEM 显示大部分粉煤灰颗粒呈球形,大小不一且表面光滑,并有附着粘连现象。另外对样品进行X 射线荧光光谱分析,使用消解法对其重金属含量进行检测,得到粉煤灰主要化学成分及其重金属含量见表1。供试试剂无水氯化钙(CaCl299.00%)、尿素(N 46.20%)、磷酸二氢钾(K2O 34.61%,P2O552.16%)、氯化钾(K2O 63.00%)为分析纯试剂。供试土壤来自广州市番禺区新造镇农田,pH 值为4.84,有机质19.07 g/kg,交换性钙551.62 mg/kg,交换性镁42.57 mg/kg,有效硅12.68 mg/kg。供试作物为香葱。

表1 粉煤灰样品的主要成分/%Table 1 Chemical components of the CFA sample
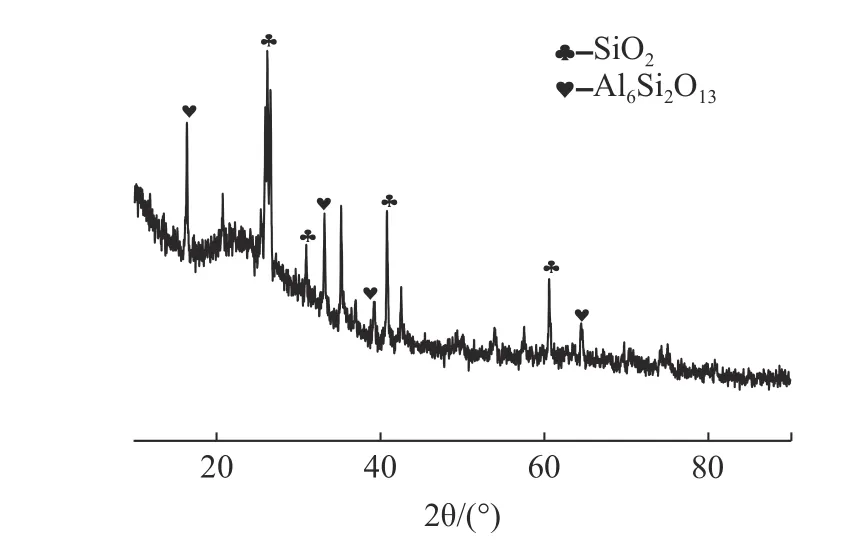
图1 粉煤灰的XRDFig.1 X-ray diffraction pattern of coal fly ash
1.2 实验设计
进行实验之前,将粉煤灰原料放入烘箱中进行烘干(105 °C),直至达到恒重,随后经过0.074 mm 筛网筛分后密封在干燥容器中。在粉煤灰中加入CaCl2,将样品混合均匀。CaCl2的添加量分别为0%、4%、8%、12%、16%和20%。将质量为(10±0.5)g 的混合物装入坩埚中,在管式炉中煅烧1 h,选取的煅烧温度分别为600、700、800、900 和1000 ℃。通过对焙烧后产物进行重金属全量分析,计算出Pb、Cd 的挥发率(Rv),并用来评价氯化效果。通过X 射线衍射、扫描电镜等表征分析方法对焙烧后产品进行表征分析,并从热力学和动力学方面探究Pb和Cd 的脱除机理。对实验中产生的氯化铅、氯化镉等气态污染物采取Ca(OH)2溶液进行吸收处理。
基于氯化焙烧实验以及先前的研究成果,在高温焙烧的条件下,粉煤灰与CaSO4、CaCO3、MgCO3、K2CO3进行配比制备土壤调理剂[14],引入CaCl2,选取焙烧温度为1000 ℃,探究CaCl2的加入对土壤调理剂理化性质的影响。选择效果较佳的土壤调理剂进行盆栽实验,将经处理的供试土壤装入花盆中,每盆装入土壤3 kg,施加尿素0.96 g、磷酸二氢钾0.28 g,氯化钾0.58 g 作为基肥。盆栽实验设置4 个处理,调理剂施加量为0.00,1.00,2.00,3.00 g/kg(以调理剂与土壤的质量比计),分别计为CK,T1,T2,T3,每个处理进行3 个平行。在定植生长130 d 后,采收香葱测量其株高、鲜重;采集土壤用于测定土壤pH 值、交换性钙、交换性镁和有效硅含量。
1.3 测定方法
1.3.1 挥发率
挥发率的计算公式为
式(1)中:Rv为重金属的挥发率,c0和m0分别为重金属浓度和初始混合物质量,c1和m1分别为氯化焙烧后的重金属含量和混合物质量。
1.3.2 土壤调理剂理化性质
重金属全量:按照行业标准NY/T 1978-2010中的方法测定土壤调理剂中的重金属含量;有效钙、有效硅、有效镁:按照行业标准NY/T 2272-2012 中的方法测定调理剂中钙、镁、硅含量。
1.3.3 土壤理化性质
土壤pH 值:采用电位法测定;交换性钙、交换性镁:以乙酸铵为提取剂,原子吸收分光光度法测定;有效硅:钼蓝比色法测定。
1.3.4 香葱生长情况指标
株高:选取地上部分采用直尺测量;鲜重:采用电子天平称量。
2 结果与讨论
2.1 重金属脱除机理讨论
2.1.1 煅烧温度的影响
氯化反应过程是一个吸热反应过程,提高反应温度有利于反应进行,但过高的焙烧温度会导致能耗增加,因此有必要探究焙烧温度对重金属去除率的影响,寻找合适的焙烧温度。将CaCl2添加量为16 %的试样在不同温度下进行焙烧,并对焙烧渣进行重金属全量测定,探讨焙烧温度对重金属Pb、Cd 挥发速率的影响。从图2 可以看出,不同温度下Pb 和Cd 的去除率随温度的升高而增大。结果表明,在700~900 ℃之间,Pb 和Cd 的去除率都有较大的提升,Pb 的挥发率从25.00%增加到75.72%,Cd 的挥发率从22.98%增加到66.06%。这是由于CaCl2的熔点为782 ℃,当煅烧温度达到782 ℃之前,CaCl2和粉煤灰都是固相,由于固-固反应界面的接触面积有限,反应速度慢,导致CaCl2和粉煤灰很难进行充分反应[15]。当焙烧温度高于782 ℃时,反应体系中的CaCl2转变为液相,粉煤灰与CaCl2之间的反应界面也由固-固反应界面变为液-固反应界面,有效接触面积迅速增加,导致反应速率迅速提高。在1 000 ℃时,铅和镉的脱除率分别高达89.26%和76.88%。煅烧残渣中铅和镉的含量分别为10.02 mg/kg 和0.54 mg/kg。
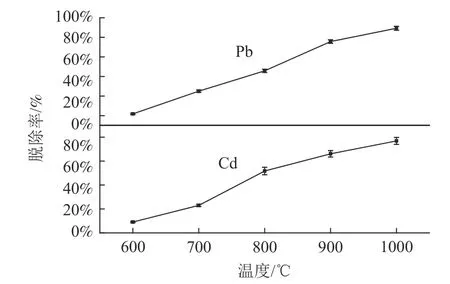
图2 焙烧温度对Pb、Cd 脱除率的影响Fig.2 Effect of roasting temperature on the removal rate of Pb and Cd
为了阐明焙烧过程中的反应机理,对焙烧产物进行XRD 分析,结果见图3。随着焙烧温度的升高,石英和莫来石的特征峰逐渐减弱;在700 ℃时焙烧产物中出现了钙长石、钠长石和硅酸钙的峰。根据图2 可知,焙烧温度从600 ℃提高到700 ℃时,Pb、Cd 的去除率有较大提升,表明钙长石、钠长石或硅酸钙的形成与重金属的脱除存在着一定的关系见图3。图3 表明,随着焙烧温度的升高,石英峰和莫来石峰逐渐减弱,钙长石、钠长石和硅酸钙峰逐渐增加,在焙烧过程中,CaCl2的引入能够破坏粉煤灰中莫来石和石英的结构[16],同时能够促进钙长石、钠长石和硅酸钙的形成。
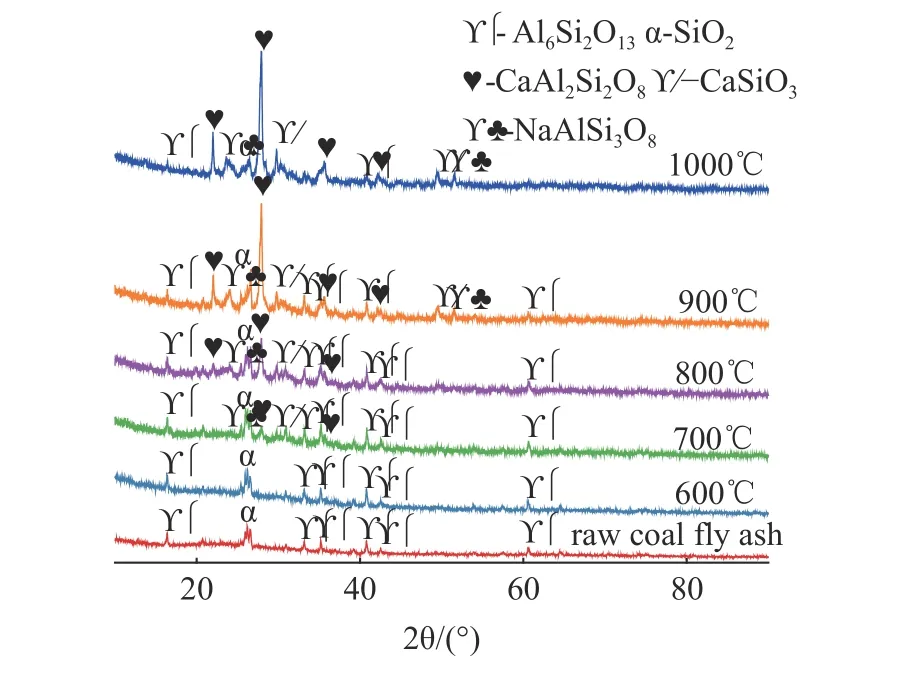
图3 在CaCl2 添加量为16%的条件下,焙烧温度为600~1000 ℃的样品及原始粉煤灰的XRDFig.3 XRD patterns of CFA and the samples obtained under the following conditions: roasting temperature from 600 ℃ to 1000 ℃ and 16% CaCl2 addition
2.1.2 CaCl2添加量的影响
在CaCl2添加量为零的条件下,粉煤灰中Pb 和Cd 基本不会在焙烧过程中挥发。由图4 可知,Pb 和Cd 的挥发对CaCl2的添加有很强的依赖性,增加CaCl2的投加量会提高Pb 和Cd 的去除率。随着CaCl2投加量从0 增加到20%,铅和镉的脱除率分别从0 提高到89.26%和76.88%。样品典型区域的SEM 见图5,焙烧后样品的形貌发生了很大的变化,原有的球状结构大部分被破坏,表面形成许多空洞,使得比表面积增大,这有利于重金属的挥发。同时,也表明粉煤灰与CaCl2在高温下发生了反应,形成了新的矿物相。由EDS图谱(图6)可知,焙烧后样品的原子百分比与原始粉煤灰的元素含量基本匹配,证明元素分析结果良好。另外样品中的氯含量很低,表明大部分的氯在高温焙烧过程中挥发。
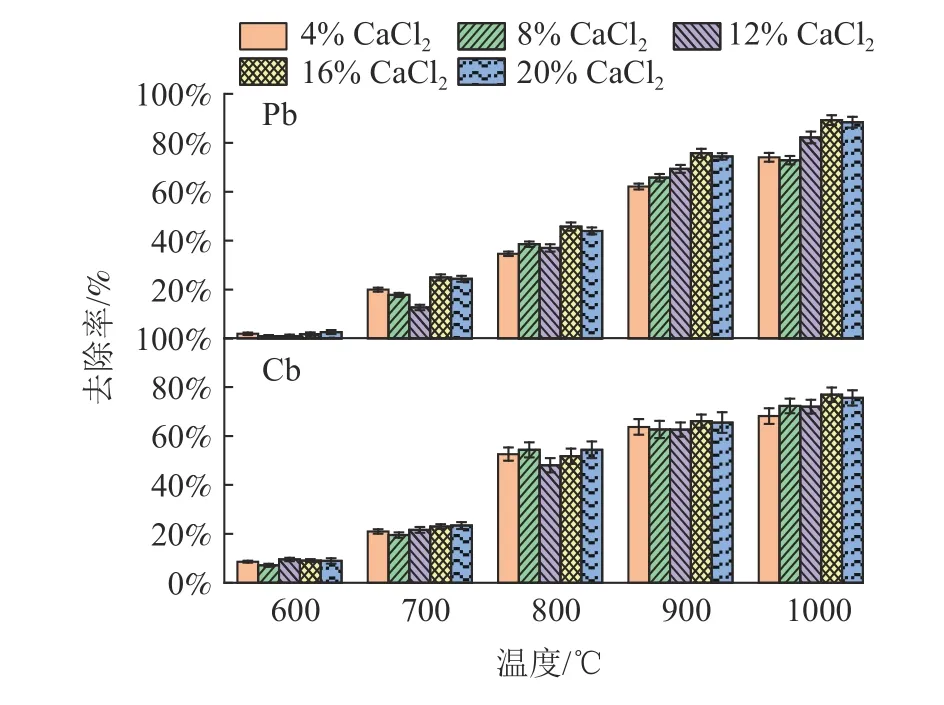
图4 CaCl2 添加量对Pb、Cd 去除率的影响Fig.4 Effect of CaCl2 dosage on the volatilization rate of Pb and Cd
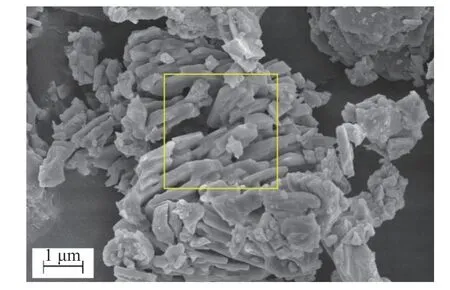
图5 样品(16% CaCl2 添加、1000 ℃焙烧)的SEMFig.5 SEM of the sample obtained under roasting of 1000 ℃and 16% CaCl2 addition
2.1.3 焙烧时间的影响
焙烧时间的长短直接影响氯化反应是否进行充分,但焙烧时间过长无疑增加生产成本和能耗,选择合适的焙烧时间显得尤为重要。在CaCl2添加量为16%条件下,探究了焙烧时间对Pb、Cd 脱除效果的影响,结果见图7。结果表明,在不同温度下Pb 和Cd 的去除率与焙烧时间有着密切联系。在0~40 min,去除率随焙烧时间的增加而增加,在焙烧时间为40 min 时达到较大值,焙烧时间从40 min 进一步增加到100 min,Pb 和Cd 的去除率没有显著提高,说明在40 min 时已经反应充分。
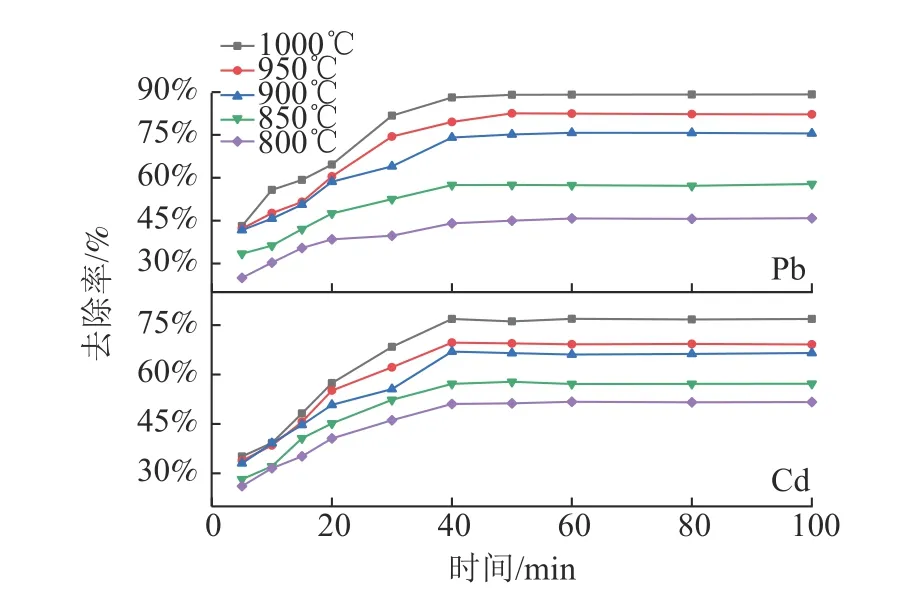
图7 焙烧时间对Pb、Cd 去除率的影响Fig.7 Effect of retention time on the volatilization rate of Pb and Cd
2.2 重金属挥发机理探讨
2.2.1 热力学平衡计算
利用HSC Chemical version 6.0 软件对氯化钙分解氯化重金属的过程进行热力学计算,探究重金属氯化物的挥发机理。CaCl2与粉煤灰反应有两种可能性[17]:一是直接与粉煤灰中的重金属反应,二是与粉煤灰中的O2、H2O 等组分反应生成HCl 或Cl2,然后再与粉煤灰中的重金属反应。粉煤灰中含有大量的SiO2、Al2O3和少量的Na2O,焙烧后产物有钙长石、钠长石和硅酸钙等。所以,粉煤灰与CaCl2在空气中高温煅烧时可能发生的反应如下:
以上反应自由能变化见图8、9。由于相关反应的吉布斯自由能在1 000 ℃以下为正值,CaCl2与O2或H2O (g)直接反应不会生成Cl2或HCl。然而,CaCl2会与粉煤灰中存在的SiO2、Al2O3和Na2O 等物质反应生成钙长石、钠长石、硅酸钙和氯化氢。在600 ℃以上,反应(13)和(14)的吉布斯自由能变为负值,这意味着反应在600 ℃左右开始,生成氯化氢。高温煅烧时,CaCl2与粉煤灰中的石英、氧化铝或莫来石反应生成CaAl2Si2O8和HCl。此外,由于相关反应的吉布斯自由能为负值,Na2O 有转化为NaCl 的趋势,同时CaCl2也有转化为CaO 的趋势。
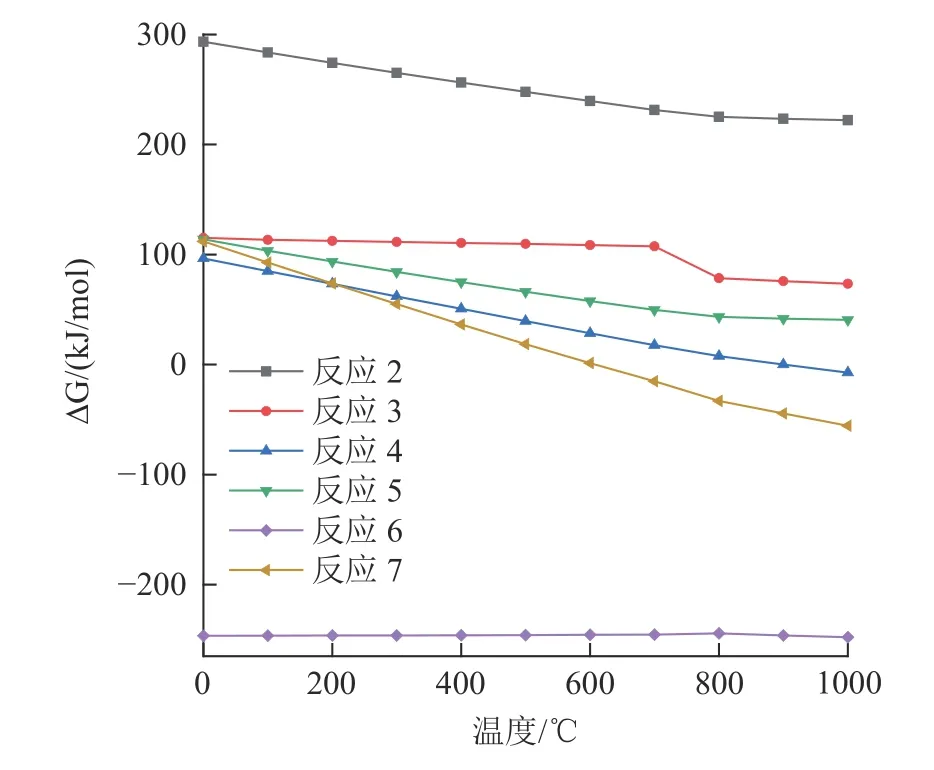
图8 反应(2)~(7)吉布斯自由能与温度的关系Fig.8 Relationship between the Gibbs free energy and temperature of the reactions(2)~(7)
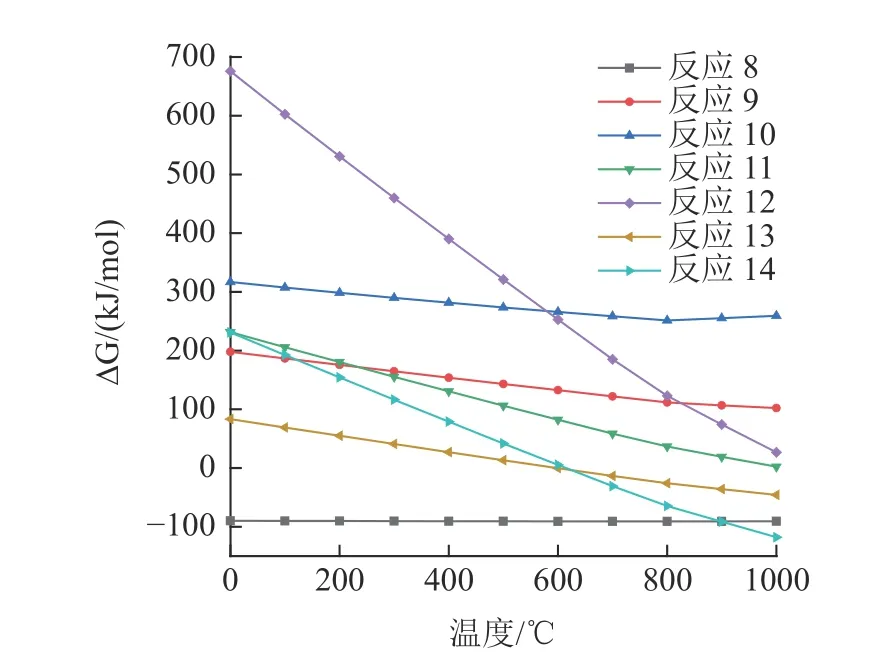
图9 反应(8)~(14)吉布斯自由能与温度的关系Fig.9 Relationship between the Gibbs free energy and temperature of the reactions(8)~(14)
由于反应(7)的吉布斯自由能为负值,反应(6)生成的CaO 与粉煤灰中存在的SiO2反应生成CaSiO3。由于反应(8)的吉布斯自由能在600 ℃以上为负,NaCl 将与粉煤灰中存在的Al2O3和SiO2反应生成NaAlSi3O8和HCl。此外,由于其他反应的吉布斯自由能为正值,反应不会自发进行。反应(8)、(13)和(14)产生的HCl 气体将进一步氯化粉煤灰中的重金属以挥发它们。
由于Pb 和Cd 在燃烧过程中转化为金属氧化物,Pb 和Cd 在粉煤灰中通常以PbO 和CdO 的形式存在。PbO 和CdO 在氯化焙烧过程中可能发生的几个反应如下,反应自由能变化见图10。
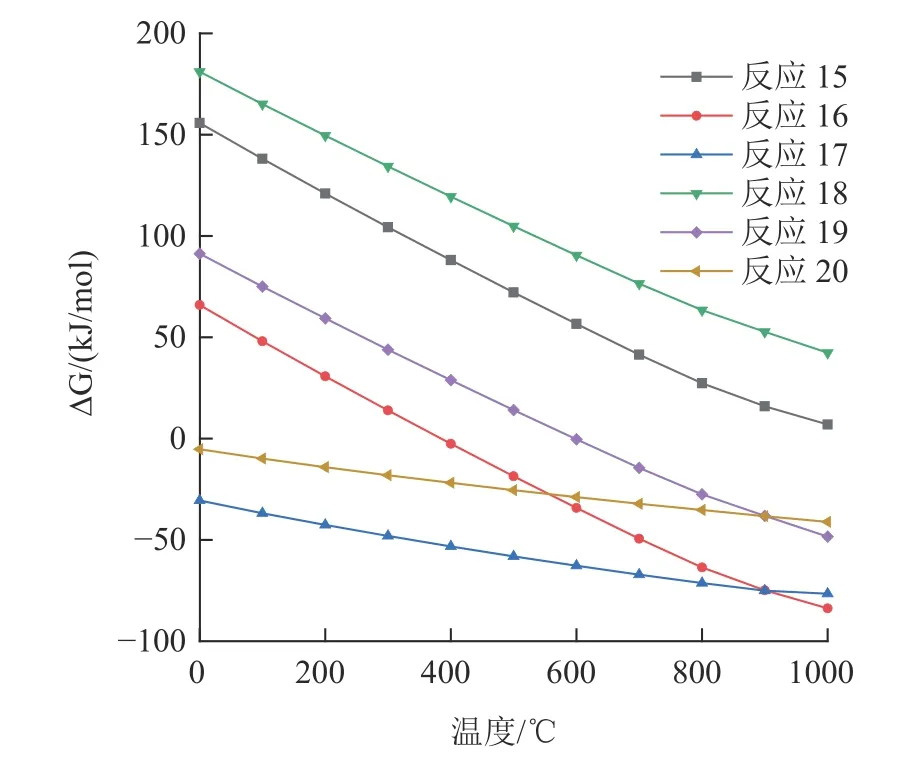
图10 反应(15)~(20)吉布斯自由能与温度的关系Fig.10 Relationship between the Gibbs free energy and temperature of the reactions(15)~(20)
在400 ℃以上时,反应(16)的吉布斯自由能为负,如果PbO 直接与粉煤灰中的SiO2反应,那么理论上Pb 在400 ℃时开始挥发,但实际上Pb 在600 ℃时,去除率几乎为零,说明PbO 并不是与粉煤灰中的SiO2直接反应。Pb 和Cd 在600 °C时都没有明显的挥发,这是由于反应(8)、(13)和(14)在600 ℃时的吉布斯自由能大于0,不能生成盐酸气体进一步与粉煤灰中重金属反应,并且固-固反应的接触面积不足,使得反应(16)、(19)反应速率缓慢,导致Pb、Cd 的挥发率较低。然而,当温度达到CaCl2的熔点782 ℃时,反应变为液-固反应,反应速率增加,相关反应产生的HCl 量增加,导致金属氧化物与HCl 之间的接触增加,从而使金属氧化物更容易转化为金属氯化物[18],这也很好地解释了Pb 和Cd 的去除率在700 ℃到800 ℃之间有较大提升的原因。综上,氯化焙烧脱除Pb 和Cd 的原因,主要是CaCl2与粉煤灰中的莫来石和石英反应,生成了HCl 间接促进了金属氧化物向金属氯化物的转化,导致重金属的去除。这和XRD 图谱中随着焙烧温度的升高,石英峰和莫来石峰逐渐减弱,钙长石、钠长石和硅酸钙峰逐渐增加结果相同。
2.2.2 动力学模型
由图6 可知,在CaCl2添加量为16%的条件下,在焙烧温度为800~1 000 ℃,焙烧时间在0~40 min 范围内,Pb 和Cd 的去除率随着焙烧温度的升高、焙烧时间的增加而增加,未出现停滞现象,表明在此温度段适用于动力学模型。在800~1000 ℃,反应属于液-固相反应过程。粉煤灰颗粒大多数为球形,且焙烧过程中有固体生成,反应符合收缩未反应核模型。为了进一步探讨Pb 和Cd 的氯化挥发行为的动力学参数和速率控制步骤,采用该模型进行动力学分析。根据此模型,Pb 和Cd 的挥发速率主要受以下步骤之一控制:
1)外扩散控制
2)内扩散控制
3)界面化学反应控制
式中,α 为重金属Pb、Cd 去除率;k 为反应速率常数,min-1;t 为焙烧时间,min。
2.2.3 动力学分析
在煅烧温度为800~1 000 ℃时,反应为液-固反应,在该温度范围进行动力学分析。将图7中较佳焙烧温度1000 ℃的实验数据分别代入式(21)、(22)、(23)中,得到不同控制过程的拟合曲线见图11。结果表明,由式(23)得到的曲线模型相关系数最大,说明Pb、Cd 的氯化挥发行为主要受界面化学反应控制。为了进一步判断Pb、Cd 氯化挥发行为的动力学参数,将图7 数据代入式(23),计算不同温度下的界面化学反应控制的F(x),结果见图12、13。可以看出对于Pb 和Cd 的氯化行为,1 -(1-α)1/3与时间t 有着良好的线性关系。根据图12、13 的数据,用ln k对1/T 绘制图像,见图14。结果表明,ln k 对于1/T 有着良好的拟合结果,再次验证了Pb、Cd 的氯化挥发行为主要受界面化学反应控制。根据阿伦尼乌斯公式ln k=ln A-Ea/RT 计算得到Pb 氯化挥发的表观活化能为84.54 kJ/mol,反应动力学方程为1-(1-α)1/3=30.22exp[-84540/RT]t;Cd 氯化挥发的表观活化能为44.96 kJ/mol,反应动力学方程为1-(1-α)1/3=0.5092exp[-44960/RT]t。
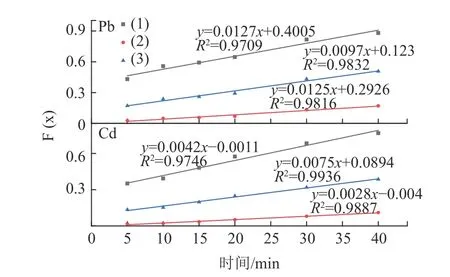
图11 1000 ℃时Pb、Cd 氯化反应F(x)与时间关系(曲线(1)F(x)=α;曲线(2)F(x)=1-2α/3-(1-α)2/3;曲线(3)F(x)=1-(1-α)1/3)Fig.11 Relationship between F (x) and time at 1000 ℃ for Chlorination of Pb and Cd
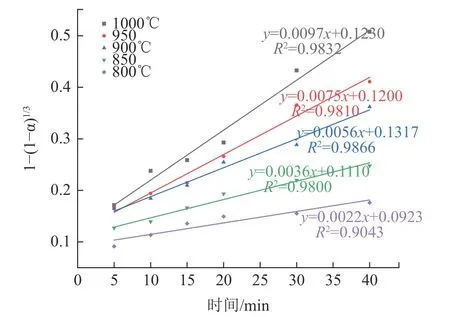
图12 Pb 的氯化挥发1-(1-α)1/3 与时间t 的关系Fig.12 Plots of 1-(1-α)1/3 as t for chlorination of Pb
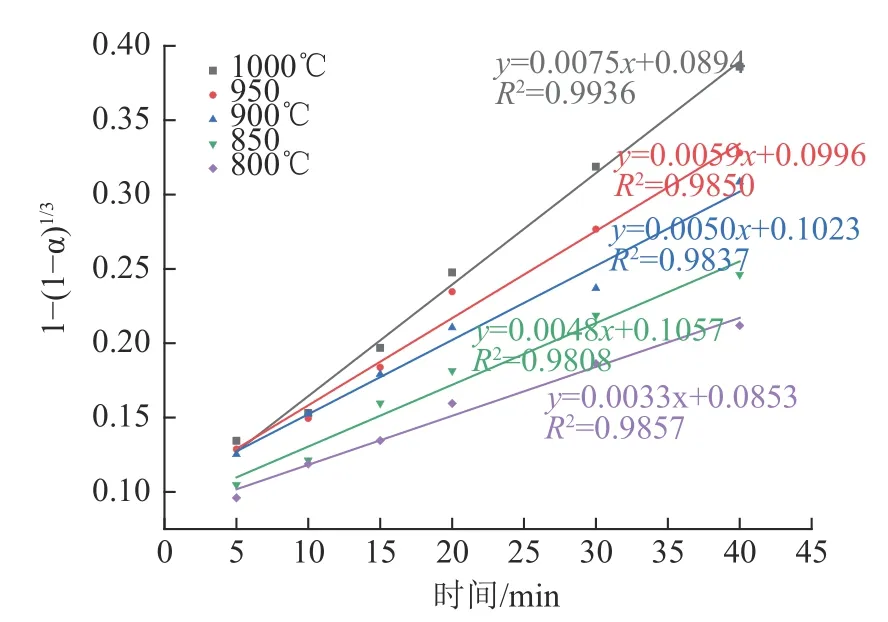
图13 Cd 的氯化挥发1-(1-α)1/3 与时间关系Fig.13 Plots of 1-(1-α)1/3 as t for chlorination of Cd
2.3 土壤调理剂的表征
进行制备调理剂的同时,加入CaCl2,其添加量为0~20 %(以CaCl2与粉煤灰的质量比计),煅烧温度选取为1 000 ℃。制备的土壤调理计XRD 见图15,可知其主要成分为钙铝黄长石、钙镁黄长石以及硫酸钙,加入CaCl2后主要成分并没有发生太大变化。
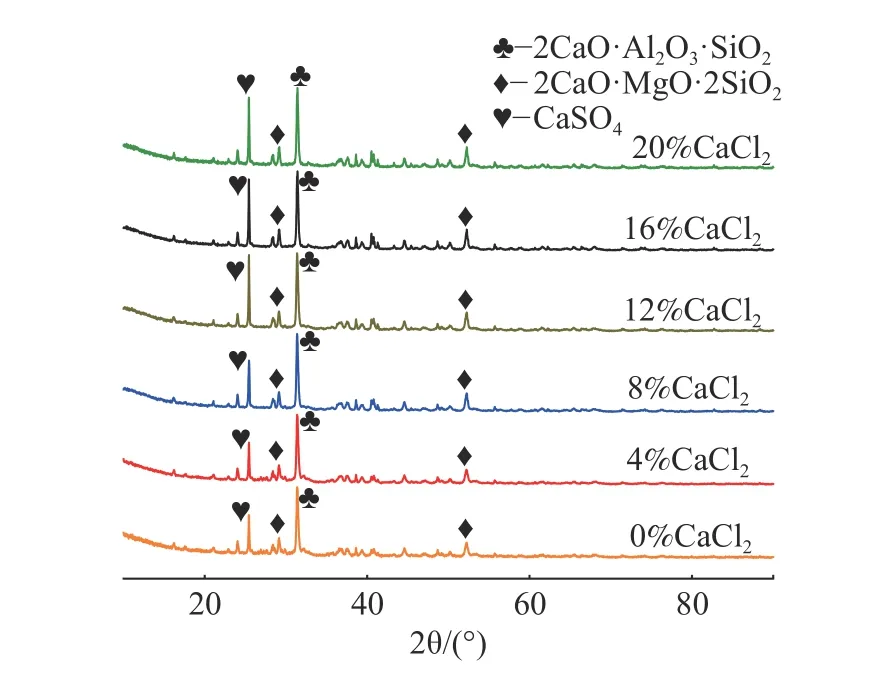
图15 不同条件下制备土壤调理剂的XRDFig.15 XRD patterns of soil conditioners obtained under different conditions
CaCl2对土壤调理剂有效硅、有效钙的影响见表2,结果表明,CaCl2的加入提高了土壤调理剂中有效硅、有效钙的含量。当CaCl2添加量为16%时,土壤调理剂的有效硅、有效钙分别为19.42%和31.48%。另外对样品进行X 射线荧光光谱分析,主要成分见表3。

表2 CaCl2 对土壤调理剂有效硅、有效钙的影响Table 2 Effect of CaCl2 on the content of the effective silicon content and the effective calcium in soil conditioner
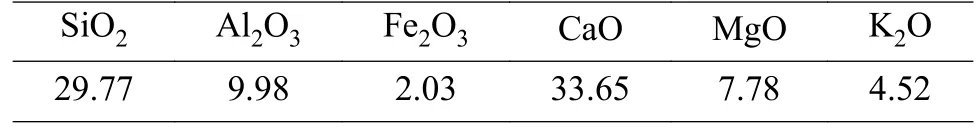
表3 土壤调理剂的主要成分/%Table 3 Main components of the soil conditioners
为了检验粉煤灰制成的土壤调理剂是否会对土壤造成重金属污染,对其重金属含量测定,结果见表4。结果表明,随着CaCl2添加量的增加,五种重金属含量不断降低,其中Pb 和Cd 的去除率分别达到69.13%~76.09%与35.29%~64.71%。其重金属含量远低于国家标准(GB/T 23349-2009)限值,不会对引起重金属毒害问题。
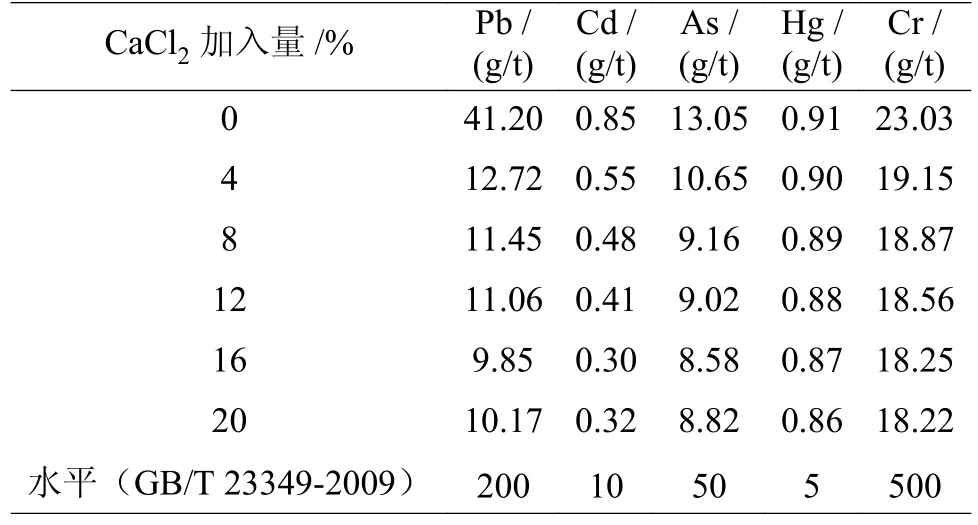
表4 CaCl2 对土壤调理剂中重金属全量的影响Table 4 Effect of the CaCl2 on the content of heavy metals in soil conditioners
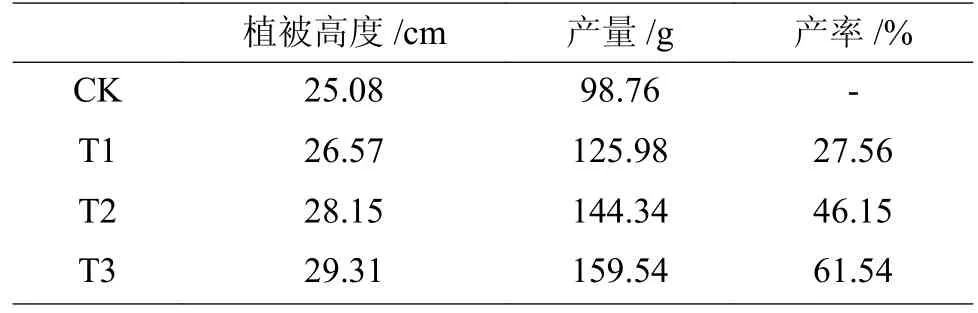
表5 土壤调理剂对香葱株高和产量的影响Table 5 Effect of soil conditioners on plant height and yield of chives
2.4 香葱盆栽实验
将CaCl2添加量为16%,焙烧温度为1000 ℃条件下制备的土壤调理剂用作于盆栽实验。
2.4.1 土壤调理剂对土壤pH 值的影响
土壤pH 值会直接影响土壤中的矿质养分有效含量,从而影响作物对矿物养分的吸收。由图16可知,随着土壤调理剂的施加量增加,土壤的pH 值随之提高。通过施加1~3 g/kg 的土壤调理剂,土壤的pH 值增加了0.47~1.49 个单位。这是由于土壤调理剂呈碱性以及其中存在着大量Ca2+,Mg2+等诸多碱性阳离子与土壤中H+、Al3+发生交换[19-20],使得土壤酸度降低。说明粉煤灰制成的土壤调理剂能够提高酸性土壤的pH 值,使得作物生长环境得到改善。
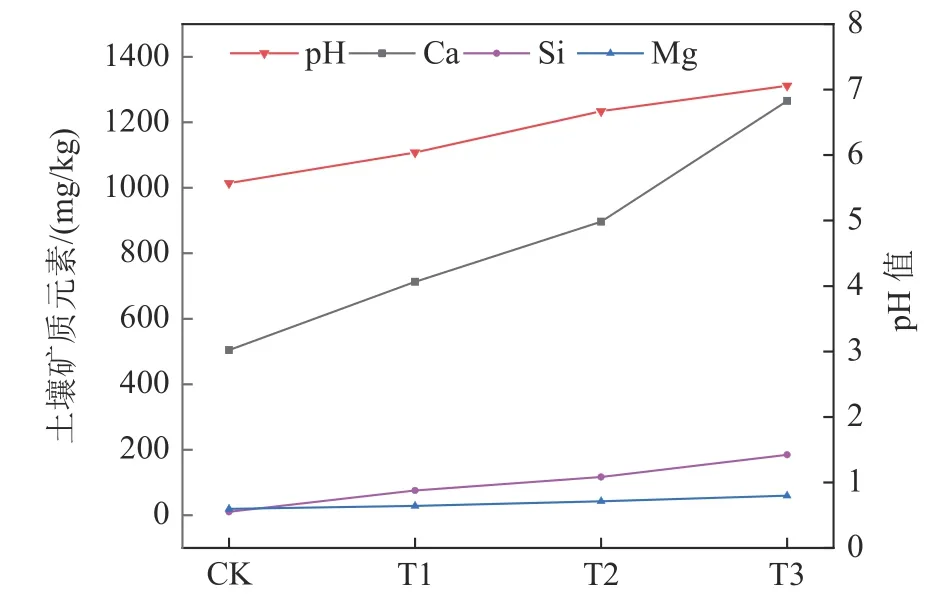
图16 土壤调理剂对土壤pH 值、矿质元素的影响Fig.16 Effect of soil conditioners on soil pH value and mineral elements
2.4.2 调理剂对矿质元素的影响
由图16 可以看出,土壤中Ca、Mg、Si 等矿质养分的有效含量随着土壤调理剂的投加量增加而增加。较空白对照,施加1~3 g/kg 土壤调理剂,能够使土壤交换性Ca 增加41.41%~150.96%,土壤交换性Mg 增加45.99%~207.19%,有效Si增加了6.19~16.54 倍。因此,该土壤调理剂不仅能够改良酸性土壤,还能够使土壤必需的矿质养分得到补充。
2.4.3 调理剂对香葱生长情况的影响
调理剂对香葱生长情况的影响见表6,从表6可知,香葱的株高、产量、叶绿素含量都随土壤调理剂的投加量增加而增大,株高较空白组增幅为5.94%~16.87%,产量增幅为27.56%~61.54%,这表明施用该土壤调理剂可以达到促进作物生长的效果。
3 结论
(1)研究了粉煤灰和CaCl2混合后的高温焙烧过程,并观察到对Pb 和Cd 存在着明显的去除效果。结果表明,混合物中Pb 和Cd 含量分别降低了89.26%和76.88%,余量分别只有10.22 mg/kg和0.54 mg/kg。从焙烧后产物的XRD 图谱以及热力学分析中可以推断出,在高温焙烧过程中,CaCl2是通过与粉煤灰中石英和莫来石反应,生成HCl 间接氯化对粉煤灰中的Pb、Cd,从而有效去除重金属。
(2)在782 ℃以上,粉煤灰与CaCl2混合物焙烧过程为液-固反应,从动力学分析可知,Pb 和Cd 的氯化挥发行为受界面化学反应控制,Pb 氯化挥发的表观活化能为84.54 kJ/mol,Cd 氯化挥发的表观活化能为44.96 kJ/mol。
(3)通过对制备的土壤调理剂的表征分析,可以说明添加CaCl2可以使产品的重金属全量降低,并使其有效硅、有效钙等矿物元素提高。在较佳条件下,Pb 和Cd 的去除率分别达到76.09%与64.71%,土壤调理剂的有效硅、有效钙分别为19.42%和31.48%,分别提高了0.64%与3.41%。
(4)香葱盆栽实验表明该土壤调理剂能够很好地改善酸性土壤的pH 值,与CK 相比,能够使土壤交换性Ca 增加41.41%~150.96%,土壤交换性Mg 增加45.99%~207.19%,有效Si 增加了6.19~16.54 倍,香葱株高较空白组增幅为5.94%~16.87%,产量增幅为27.56%~61.54%。
