刺五加苷B影响EMT进程抑制肺癌细胞迁移和侵袭的机制研究
2024-01-09曹雪婷陈静
曹雪婷,陈静
(1. 华北理工大学基础医学院,河北省慢性疾病基础医学重点实验室,唐山市慢性病临床基础研究重点实验室,河北 唐山 063210; 2. 华北理工大学生命科学学院,河北 唐山 063210)
刺五加,又名五加参、刺拐棒,是五加科植物的干燥根和根茎以及茎,根据中国药典的记录,刺五加是一种广泛用于益气、健脾、补肾、安神的中药[1],主要分布在俄罗斯以及我国东北三省、华北等地。刺五加苷B是刺五加中发挥药用活性的主要成分,现在已经被证实具有许多的药理活性,其中就有抗疲劳、抗炎、抗肿瘤作用等[2-3]。刺五加苷B 在体内外实验中均表现出良好的抗肿瘤活性,其中包含肺癌A549 细胞、宫颈癌Hela 细胞和乳腺癌MCF-7 细胞等,但刺五加苷B 对肺癌细胞的作用机制尚不清楚,本研究初步探究了刺五加苷B 对肺癌A549 和H460 细胞迁移侵袭的影响,为刺五加苷B成为临床用药提供实验依据。
1 仪器与材料
1.1 药品
细胞:人肺癌细胞株A549 和H460 细胞由中国医学科学院医药生物技术研究所馈赠。
刺五加苷B(美国MREDA 公司,批号:02009154),纯度不小于98%。刺五加苷B 是一种有生物活性酚苷类物质,其为白色结晶状,用DMSO 溶液将其制备成54 mmol/L浓度的溶液,并保存于-20 ℃冰箱中。
1.2 主要仪器
超净工作台(上海智城分析仪器制造有限公司,ZHJH-C1214B),CO2细胞培养箱(美国赛默飞ThermoFisher,),倒置显微镜(日本OLYMPUS,),酶标仪(瑞士TECAN,),凝胶成像系统(美国Alpha Innotech公司产品,AlapHa ImagerTM 2200),电泳仪(北京六一仪器厂)。
1.3 主要试剂
RPMI-1640 培养基(以色列BiologicalIndustries公司,批号:2131212);胎牛血清产品(德国Cegrogen 公司,批号:19042772);胰蛋白酶(中国Eallbio 公司,批号:F2303);细胞裂解液(中国碧云天生物技术公司,批号:060622220930);10 × SDS-PAGE 电泳液、20 ×Western 快速转模缓冲液、10 × TBST 洗涤缓冲液、4 ×分离胶mix、8 × 浓缩胶(中国庄盟生物公司,批号:2BD03LSXT1、AF08C、220H04C22)、22AB04C、21A008S);30%Acr-Bis、ECL 显影液(中国Report 公司,批号:A1010500、KF005);基质胶(中国ABW 公司,批号:20221514ZH);MTT(东京TCI公司,批号:)。
2 方法
2.1 A549细胞和H460细胞培养
使用含有10%胎牛血清和1%双抗(青霉素和链霉素)的RPMI-1640培养基置于37 ℃,5% CO2的培养箱中培养,该细胞为贴壁细胞,每隔2~3 d传代换液。
2.2 MTT法
将处于对数生长期的肺癌A549和H460细胞以每孔6 000个细胞的密度接种于96孔板中,每孔100 μL,培养24 h,之后吸掉上清,加入不同浓度的刺五加苷B,同时设置对照组(不加刺五加苷B,只加刺五加苷B的溶解液)和调零组(仅添加无血清的1640 基础培养基),每个药物浓度均设置3 个重复孔(包括对照组),培养24 h 后,吸掉上清,每个实验孔中加入含有10%的 5 mg/mL MTT,继续培养4 h,吸出上清并弃掉,每孔加入150 μL DMSO,96 孔板放到微型震荡器上充分震荡5~10 min,570 nm 测量每孔的吸光度OD 值。计算出细胞存活率及半抑制浓度IC50值。
2.3 细胞划痕实验
收集处于对数生长期的肺癌A549 和H460 细胞,调整细胞密度于5 × 105个/mL的密度接种于六孔板中,每孔2 mL培养24 h,使用100 μL移液头管头在单层制造划痕,以单次流体运动在细胞单层中画一条线。PBS缓冲液清洗1~2次被划下的细胞,倒置显微镜拍摄0 h的照片。对于H460细胞加入含有15、20、25 mmol/L刺五加苷B 的无血清1640基础培养基,对于A549细胞加入含有15、25、35 mmol/L 刺五加苷B 的无血清1640 基础培养基。药物作用24 h后在倒置显微镜下检测24 h的细胞迁移,注意要拍摄与0 h位置相同的地方再次拍摄24 h的照片。使用ImageJ软件分析。
2.4 Transwell细胞迁移侵袭实验
用预冷的无血清基础培养基将基质胶配成相应浓度的工作胶,每个Transwell 小室孔加入100 μL 工作胶(迁移实验此步省略),收集消化好的待处理细胞并制成细胞悬液,使H460细胞加入含有15、20、25 mmol/L刺五加苷B 的无血清1640 基础培养基中,使A549 细胞加入含有15、25、35 mmol/L 刺五加苷B 的无血清1640 基础培养基中,以每孔2 × 104个细胞的密度接种到Transwell 小室的上腔室中,下腔室中加入含有15%血清的1640 完全培养基。培养24 h 后,弃去旧培养基,4%多聚甲醛室温固定15 min 后,吸弃,PBS 缓冲液清洗1~2 次,用0.1%结晶紫染液室温下对迁移侵袭细胞瞬时染色,PBS 缓冲液清洗1~2 次,棉签轻轻擦去上腔室膜上的细胞并用倒置显微镜观察迁移到上腔膜下的细胞,并拍照记录。
2.5 Western Blot蛋白印迹法
收集经药物处理后的细胞,根据蛋白提取试剂盒说明书提取A549 和H460 细胞总蛋白后,用BCA 试剂盒测定蛋白浓度。金属浴变性后,电泳,转膜、封闭、孵育E-cadherin、Slug、Snail 抗体及显影,以β actin 为内参,凝胶成像分析系统分析目的蛋白表达水平。
2.6 统计学方法
每个实验均独立重复3 次及以上,结果以均数 ±标准差来表示,t检验分析方法用于两组间比较,单因素方差分析用于多组间比较,各组数值均应用ImageJ和Graphpad prism 8.0 软件统计学分析并绘图,P<0.05代表差异具有统计学意义。
3 结果
3.1 刺五加苷B对人肺癌细胞生长影响
用不同浓度(0、5、15、20、25、30、35、40、45 mmol/L)的刺五加苷B 作用于肺癌A549 和H460 细胞 24 h,MTT法测定刺五加苷B对人肺癌细胞生长的影响。实验结果显示,与0 mmol/L 组相比刺五加苷B 可明显抑制肺癌A549 和H460 细胞的增殖,刺五加苷B 诱导了肺癌细胞A549 和H460 的死亡,刺五加苷B 处理组细胞存活率明显降低,见图1。刺五加苷B作用于肺癌细胞A549和H460的IC50值见表1。
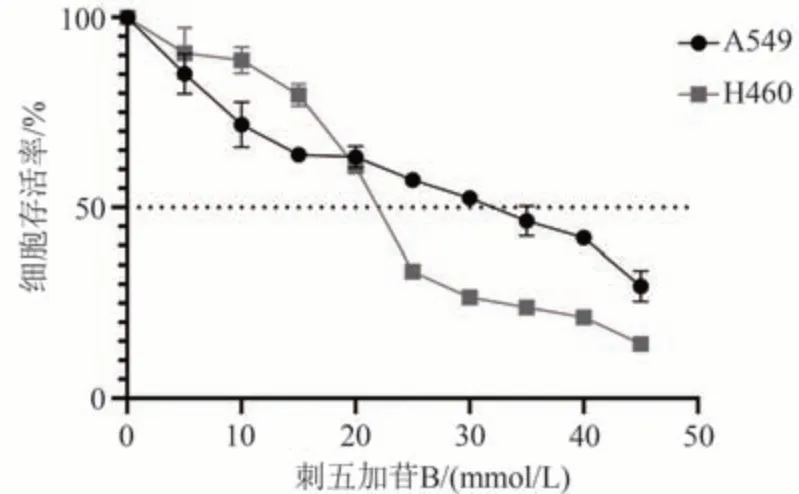
图1 MTT法检测刺五加苷B对肺癌A549和H460细胞存活率的影响
表1 刺五加苷B作用 A549和H460的IC50值比较(±s)
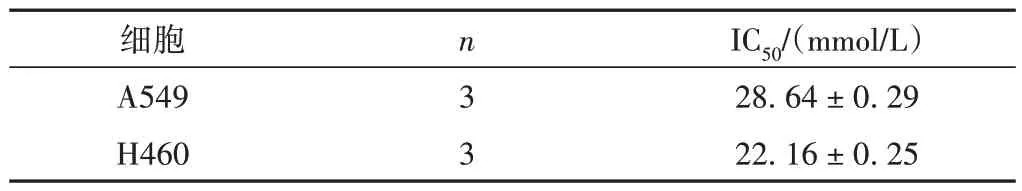
表1 刺五加苷B作用 A549和H460的IC50值比较(±s)
细胞A549 H460 n3 3 IC50/(mmol/L)28.64 ± 0.29 22.16 ± 0.25
3.2 刺五加苷B对肺癌细胞迁移侵袭的影响
不同浓度的刺五加苷B 作用于A549 和H460 细胞2 h后,划痕实验结果发现,对照组划痕面积最小,而实验组中随着药物浓度的增加划痕面积也随之增大,说明刺五加苷B可以抑制肺癌A549和H460细胞的迁移。
Transwell 迁移的结果示,在肺癌细胞A549 和H460中随着刺五加苷B 的浓度增加,通过Transwell小室膜孔的细胞数目减少,联系划痕实验的结果可以得出,刺五加苷B 能够抑制肺癌细胞A549 和H460 迁移。结果见图2~5及表2~3。

图2 A549细胞细胞划痕实验
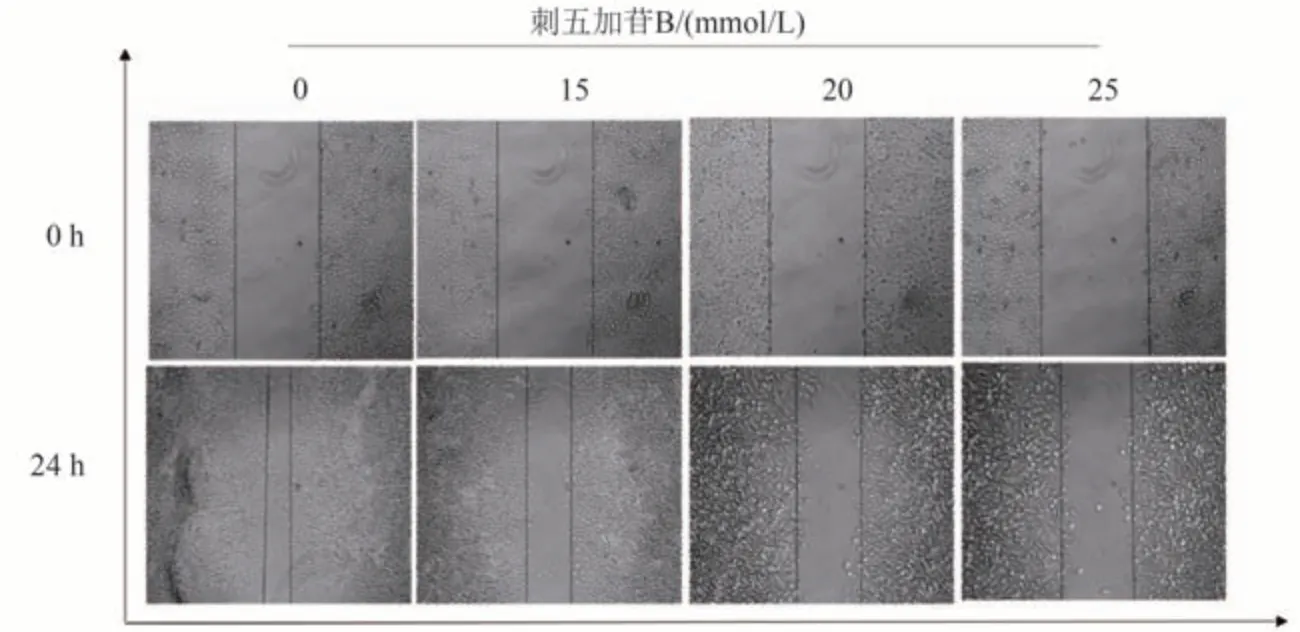
图3 H460细胞细胞划痕实验
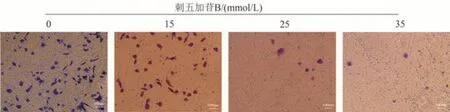
图4 Transwell细胞迁移实验检测刺五加苷B对A549细胞迁移的影响(×100)

图5 Transwell细胞迁移实验检测刺五加苷B对H460细胞迁移的影响(×100)
表2 刺五加苷B对A549细胞迁移侵袭的影响(±s))
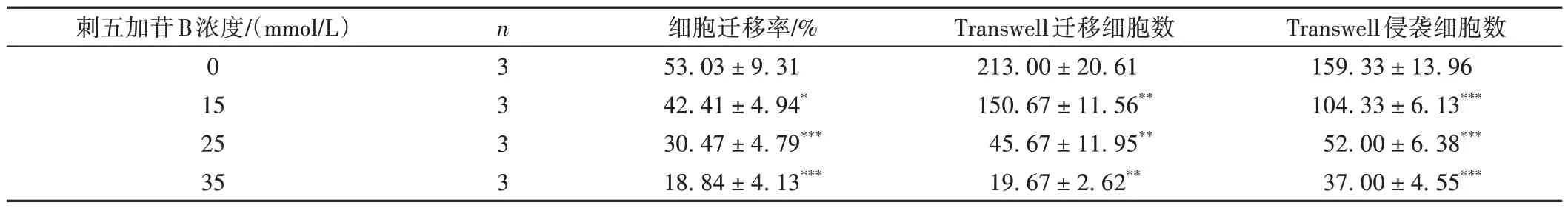
表2 刺五加苷B对A549细胞迁移侵袭的影响(±s))
注:与0 mmol/L组比较,*P < 0.05,**P < 0.01,***P < 0.001。
Transwell侵袭细胞数159.33 ± 13.96 104.33 ± 6.13***52.00 ± 6.38***37.00 ± 4.55***刺五加苷B浓度/(mmol/L)0 15 25 35 n3 3 3 3细胞迁移率/%53.03 ± 9.31 42.41 ± 4.94*30.47 ± 4.79***18.84 ± 4.13***Transwell迁移细胞数213.00 ± 20.61 150.67 ± 11.56**45.67 ± 11.95**19.67 ± 2.62**
表3 刺五加苷B对H460细胞迁移侵袭的影响(±s))

表3 刺五加苷B对H460细胞迁移侵袭的影响(±s))
注:与0 mmol/L组比较,**P < 0.01,***P < 0.001。
Transwell侵袭细胞数83.33 ± 7.59 57.67 ± 3.86**40.37 ± 3.09***22.00 ± 4.89***刺五加苷B浓度/(mmol/L)0 15 20 25 n3 3 3 3细胞迁移率/%71.76 ± 2.55 50.23 ± 1.88***40.46 ± 2.64***31.98 ± 1.87***Transwell迁移细胞数355.00 ± 31.32 154.00 ± 19.20***59.00 ± 4.55***33.33 ± 2.49***
为了探究刺五加苷B 对肺癌A549 和H460 细胞侵袭能力的影响,应用Transwell 侵袭实验进行观察。在Transwell 小室中首先铺上一层基质胶,待基质胶干至胶状,加入细胞,与0 mmol/L 组比较,加药组中通过小室的细胞数量呈剂量依赖性减少。结果见图6~7。
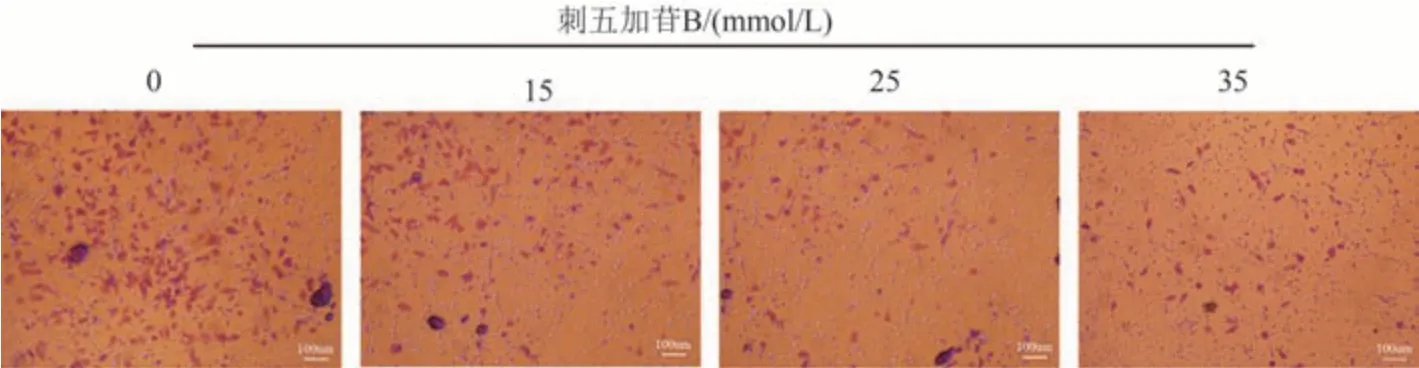
图6 Transwell细胞侵袭实验检测刺五加苷B对A549细胞侵袭的影响(×100)
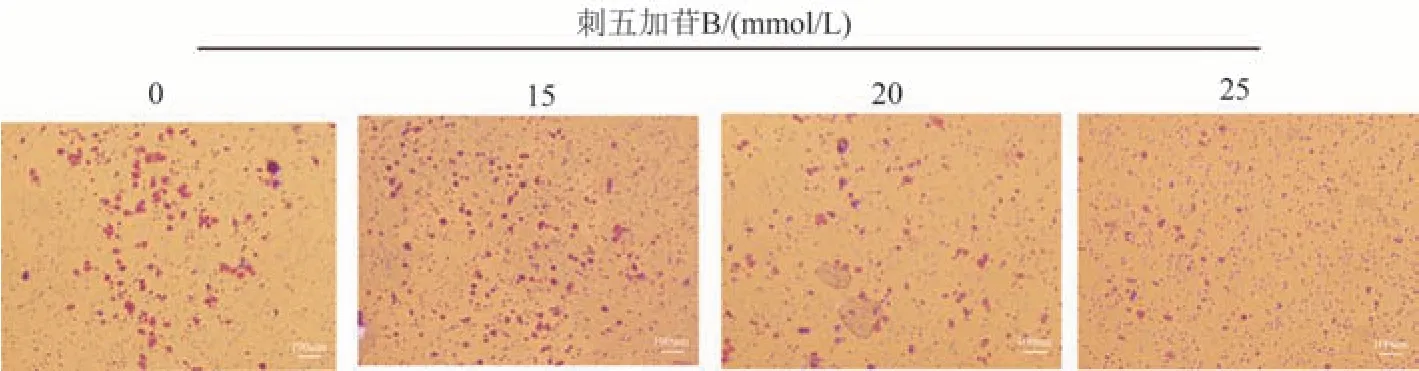
图7 Transwell细胞侵袭实验检测刺五加苷B对H460细胞侵袭的影响(×100)
3.3 刺五加苷B 对肺癌细胞E-cadherin、Slug、Snail蛋白表达水平的影响
EMT上皮间质转化过程在肿瘤的转移中扮演着重要的角色。上述实验已经证实刺五加苷B可以抑制肺癌A549和H460细胞迁移侵袭,接下来探究刺五加苷B是否通过EMT 过程调控迁移侵袭。Western blot 表明,刺五加苷B 使E-cadherin 蛋白表达水平上调,EMT 转录因子也使侵袭促进因子Slug和Snail表达水平以浓度依赖的方式被抑制。结果图8 和表4、5。因此结合划痕实验、Transwell 迁移侵袭实验以及Western blot 实验结果共同说明刺五加苷B以浓度依赖调控EMT进程抑制肺癌A549和H460细胞迁移侵袭。
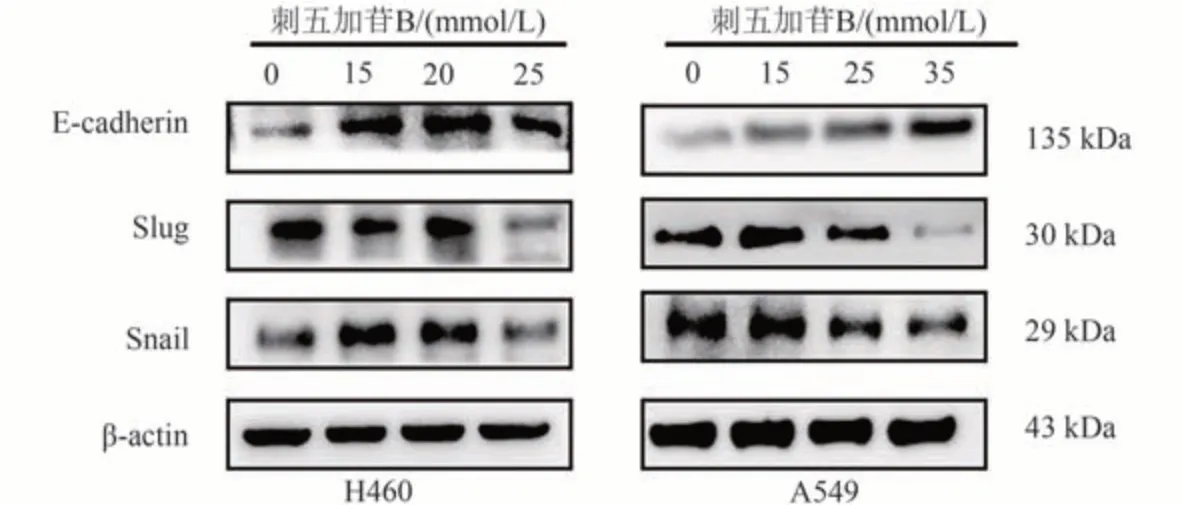
图8 蛋白质印迹法检测EMT相关蛋白表达情况
表4 刺五加苷B作用A549细胞EMT相关蛋白表达情况(±s))

表4 刺五加苷B作用A549细胞EMT相关蛋白表达情况(±s))
注:与对照组比较,*P < 0.05,**P < 0.01,***P < 0.001。
刺五加苷B浓度/(mmol/L)0(归一化)Snail蛋白相对水平1.00 ± 0.00 0.83 ± 0.02**0.57 ± 0.07***0.43 ± 0.04***15 25 35 n3 3 3 3 E-cadherin蛋白相对水平1.00 ± 0.00 1.87 ± 0.21*2.48 ± 0.31**2.95 ± 0.40***Slug蛋白相对水平1.00 ± 0.00 0.81 ± 0.03*0.66 ± 0.05**0.27 ± 0.11***
表5 刺五加苷B作用H460细胞EMT相关蛋白表达情况(±s))

表5 刺五加苷B作用H460细胞EMT相关蛋白表达情况(±s))
注:与对照组比较,*P < 0.05,**P < 0.01,***P < 0.001。
刺五加苷B浓度/(mmol/L)0(归一化)Snail蛋白相对水平1.00 ± 0.00 0.84 ± 0.05*0.77 ± 0.09**0.50 ± 0.02***15 20 25 n3 3 3 3 E-cadherin蛋白相对水平1.00 ± 0.00 2.56 ± 0.33**2.93 ± 0.28***3.24 ± 0.32***Slug蛋白相对水平1.00 ± 0.00 0.86 ± 0.05*0.69 ± 0.05***0.46 ± 0.05***
4 讨论
肺癌是世界范围内最常见的危害人类健康的一种恶性肿瘤,我国肺癌的发病率和病死率居于所有恶性肿瘤的榜首[4],肺癌患者确诊时大多都是处于肺癌晚期状态。常用的治疗肺癌的方法包括手术、化疗和放疗,这些治疗方法会造成患者的生活质量低下、不良反应增多同时也给患者造成沉重负担。中药及其活性成分被证实具有增强机体抗肿瘤作用,降低放化疗的不良毒副作用并改善患者的生活质量,延长患者生存期[5]。
上皮间质转化可以促进肿瘤细胞转移[6-7],也能够使肿瘤细胞获得侵袭性[8]。EMT 最重要的标志是E-cadherin 蛋白表达降低,大量文献报道E-cadherin蛋白表达水平降低可以促进肿瘤细胞的侵袭和转移[9-11],E-cadherin 蛋白是跨膜糖蛋白的成员,其有维持细胞稳固和粘连的作用,并发现其是通过介导钙依赖性细胞间黏附的形成来发挥作用。EMT 相关转录因子(EMT-TFs)Snail、Slug、ZEB1、Twist 等的过表达及异常激活占有重要地位[12-15],有研究已经报道,Snail、Slug 参与EMT 过程并调控细胞黏附蛋白,Snail通过调控组蛋白甲基化和去乙酰化进一步抑制上皮基因的表达,在肝癌细胞中通过稳定Slug 蛋白的表达可促进EMT发生[16]。
综上所述,刺五加苷B 具有抗肿瘤作用,本研究表明刺五加苷B 明显抑制肺癌A549 和H460 细胞生长、迁移侵袭,并发现其可通过影响EMT 进程发挥其药理作用。
