miR-93-5p对胰岛素抵抗细胞模型中HGF、GLUT4表达及GLUT4分布的影响*
2024-01-09干定云李广利侯以琳
周 曼, 吴 军, 干定云, 陈 婉, 曹 萍, 李广利, 侯以琳
武汉市第三医院(武汉大学附属同仁医院)内分泌科,武汉 430060
随着经济发展和人们生活方式的改变,糖尿病的发病率逐年升高,已成为威胁人类健康的主要疾病[1]。2型糖尿病是糖尿病中最常见的一种,以高血糖和胰岛素抵抗为特征[2]。目前,治疗2型糖尿病的药物多以降血糖为主,针对胰岛素抵抗的治疗方法较少[3]。由此可见,研究胰岛素抵抗的发生机制对2型糖尿病的预防和治疗具有重要意义。肝细胞生长因子(hepatocyte growth factor,HGF)是一种具有广泛生物学效应的多肽生长因子[4]。本课题组前期研究发现,HGF在胰岛素抵抗2型糖尿病患者肝组织中显著下调,提示HGF可能与胰岛素抵抗密切相关[5],但其在胰岛素抵抗进展中的作用机制尚不清楚。
外泌体可将大量调控分子如蛋白质、脂质和RNAs等传递到靶细胞,从而调控靶细胞的生物学功能[6]。最近的研究表明,外泌体可通过跨细胞传递参与胰岛素抵抗[7]。本课题组前期收集了胰岛素抵抗2型糖尿病患者的外泌体,通过高通量测序发现miR-93-5p在胰岛素抵抗指数高的患者样本中高表达,且miR-93-5p可能靶向HGF[5],基于此我们推测外泌体来源的miR-93-5p可通过调节HGF参与胰岛素抵抗。本研究构建胰岛素抵抗肝细胞模型,明确miR-93-5p对肝细胞HGF表达的影响,为2型糖尿病的临床治疗提供理论基础。
1 材料与方法
1.1 细胞与试剂
人肝癌细胞HepG2来源于中国科学院上海细胞库。MEM培养液、胎牛血清购于美国Gibco公司,PBS、0.25%胰蛋白酶、CCK-8、抗荧光衰减封片剂(含DAPI)、Triton X-100、5%BSA封闭液、BCA蛋白浓度测定试剂盒、RIPA(强)组织细胞快速裂解液购于中国Solarbio公司,葡萄糖购于阿拉丁公司,Trizol购于Ambion公司,SYBR FAST qPCR Master Mix购于KAPA Biosystems公司,逆转录试剂盒购于TaKaRa公司,氯仿、异丙醇、无水乙醇、甲醛购于国药集团化学试剂有限公司,葡萄糖检测试剂盒购于南京建成公司,PVDF转移膜购于Millipore公司,免疫荧光GLUT4抗体购于Invitrogen公司,Western blot一抗HGF、葡萄糖转运蛋白4(glucose transporter 4,GLUT4)、GAPDH、荧光基团594标记的山羊抗兔二抗、HRP标记的山羊抗兔IgG购于武汉Bioswamp公司。
1.2 细胞培养
HepG2细胞复苏后,接种在含10%胎牛血清、1%青霉素-链霉素双抗的DMEM高糖培养液中,置于37℃、5% CO2培养箱中培养。隔天换液,细胞融合率达到90%时胰酶消化,传代,取对数生长期细胞进行实验。
1.3 胰岛素抵抗模型的构建
收集细胞,调整细胞悬液浓度,接种于6孔板中,每孔5×105个细胞,置于37℃、5% CO2培养箱中培养24 h。细胞培养达到70%~80%汇合后,PBS洗涤2次,分别用含生理浓度葡萄糖(5.5 mmol/L)或高糖(30 mmol/L)培养液孵育48 h,建立高糖诱导的胰岛素抵抗细胞模型[5]。模型构建完成后取出细胞培养板,每孔加入10 μL CCK-8溶液,培养4 h后检测450 nm处的吸光度值,以此表示细胞增殖能力,鉴定模型构建是否成功。结果显示模型构建成功。
1.4 qPCR检测HepG2细胞中miR-93-5p、HGF、GLUT4 mRNA的表达
收集对照组和模型组细胞,PBS洗涤3次。Trizol法提取细胞总RNA,按照逆转录试剂盒说明书合成cDNA,进行PCR扩增。PCR引物由武汉天一华煜基因科技有限公司合成,引物序列见表1。分别以U6和GAPDH为内参,2-ΔΔCt法计算目的基因的相对表达量。

表1 引物信息
1.5 miR-93-5p mimics、inhibitor构建及实验分组
构建并合成miR-93-5p mimics、inhibitor相应对照(NC),转染至HepG2细胞中,qPCR验证转染效率。将细胞分为对照组、模型组、miR-93-5p inhibitor组、inhibitor-NC组、miR-93-5p mimics组和mimics-NC组。对照组不作处理,正常培养;模型组细胞用高糖培养液培养,构建胰岛素抵抗模型;其余组分别依次转染miR-93-5p inhibitor、inhibitor-NC、miR-93-5p mimics、mimics-NC,转染完成后再用高糖培养液培养构建胰岛素抵抗模型。处理完成后继续培养48 h,加入CCK-8溶液,检测细胞存活率。
1.6 细胞葡萄糖消耗量检测
设置测定孔、空白孔和标准孔,分别加入3 μL样本、双蒸水和标准液,每孔加入300 μL工作液,混匀,37℃孵育15 min,酶标仪检测505 nm处的吸光度(A)值。葡萄糖含量(mmol/L)=(各组A值/标准液A值)×标准液浓度。葡萄糖消耗量(mmol/L)=原葡萄糖含量-实验组葡萄糖含量。
1.7 qPCR和Western blot检测miR-93-5p、HGF、GLUT4的表达
提取细胞总RNA,qPCR检测HepG2细胞中miR-93-5p、HGF、GLUT4 mRNA的表达。提取细胞总蛋白,BCA法进行蛋白质定量,上样电泳,转膜,封闭过夜,加入一抗稀释液孵育,洗膜,加入二抗稀释液孵育,洗膜后ECL显色。读取条带灰度值,目的蛋白条带灰度值/GAPDH条带灰度值即为蛋白的相对表达量。
1.8 免疫荧光检测GLUT4的表达和分布
分组处理后的细胞以4%多聚甲醛室温固定30 min,PBS洗涤,加入0.5% Triton X-100室温通透30 min,PBS洗涤后用5%BSA封闭1 h,加入一抗稀释液孵育过夜,PBS洗涤后加入二抗稀释液孵育1 h,最后加入300 μL抗荧光淬灭封片液(含DAPI),荧光显微镜观察拍照。
1.9 统计学方法
用GraphPad Prism 8.0进行统计学分析,结果用平均值±标准差表示,多组间均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 高糖诱导的HepG2细胞中miR-93-5p、HGF、GLUT4 mRNA的表达
qPCR检测结果显示,与对照组相比,模型组细胞中miR-93-5p水平显著升高(P<0.01),而HGF、GLUT4 mRNA水平显著降低(均P<0.01)。见图1。

**P<0.01
2.2 miR-93-5p对高糖诱导的HepG2细胞活力和葡萄糖消耗的影响
CCK-8和生化实验结果显示,与对照组相比,模型组细胞存活率和葡萄糖消耗量均显著降低(均P<0.01);与inhibitor-NC组相比,miR-93-5p inhibitor组细胞存活率和葡萄糖消耗量均显著升高(均P<0.01);与mimics-NC组相比,miR-93-5p mimics组细胞存活率和葡萄糖消耗量均显著降低(均P<0.01)。见图2。

1:对照组;2:模型组;3:miR-93-5p inhibitor组;4:inhibitor-NC组;5:miR-93-5p mimics组;6:mimics-NC组;**P<0.01
2.3 miR-93-5p对高糖诱导的HepG2细胞中HGF和GLUT4 mRNA表达的影响
qPCR结果显示,与对照组相比,模型组细胞中miR-93-5p表达水平显著升高(P<0.01),HGF和GLUT4 mRNA表达水平显著降低(均P<0.01);与inhibitor-NC组相比,miR-93-5p inhibitor组细胞中miR-93-5p水平显著降低(P<0.01),HGF和GLUT4 mRNA表达水平显著升高(均P<0.01);与mimics-NC组相比,miR-93-5p mimics组细胞中miR-93-5p水平显著升高(P<0.01),HGF和GLUT4 mRNA表达水平显著降低(均P<0.01)。见图3。

1:对照组;2:模型组;3:miR-93-5p inhibitor组;4:inhibitor-NC组;5:miR-93-5p mimics组;6:mimics-NC组;**P<0.01
2.4 miR-93-5p对高糖诱导的HepG2细胞中HGF和GLUT4蛋白表达的影响
Western blot结果显示,与对照组相比,模型组细胞中HGF和GLUT4蛋白表达水平显著降低(均P<0.01);与inhibitor-NC组相比,miR-93-5p inhibitor组细胞中HGF和GLUT4蛋白表达水平显著升高(均P<0.01);与mimics-NC组相比,miR-93-5p mimics组细胞中HGF和GLUT4蛋白表达水平显著降低(均P<0.05)。见图4。
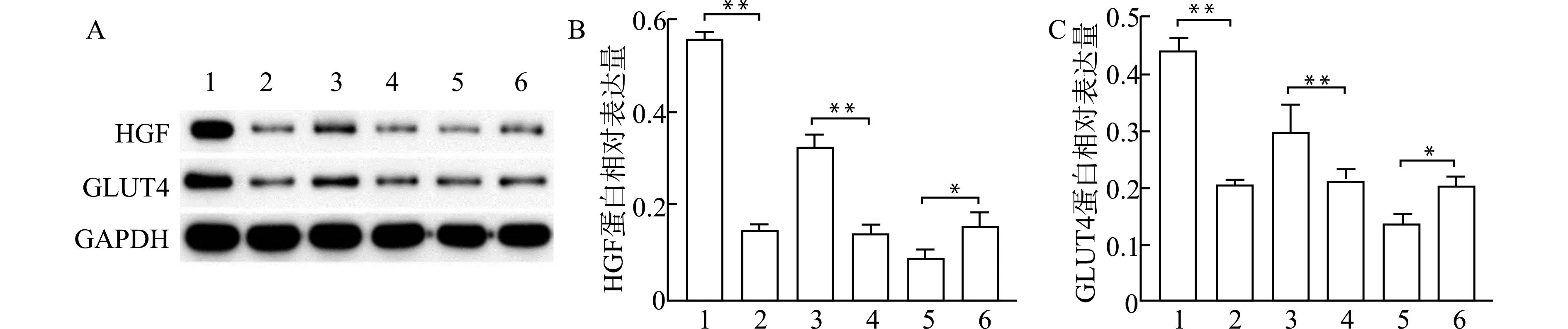
1:对照组;2:模型组;3:miR-93-5p inhibitor组;4:inhibitor-NC组;5:miR-93-5p mimics组;6:mimics-NC组;A:Western blot检测HGF和GLUT4蛋白表达条带图;B:HGF蛋白表达水平的比较;C:GLUT4蛋白表达水平的比较;*P<0.05,**P<0.01
2.5 miR-93-5p对高糖诱导的HepG2细胞GLUT4分布的影响
免疫荧光结果显示,与对照组相比,模型组GLUT4膜分布明显减少,荧光强度也明显减弱;与inhibitor-NC组相比,miR-93-5p inhibitor组GLUT4膜分布明显增多,荧光强度明显增强;与mimics-NC组相比,miR-93-5p mimics组GLUT4膜分布减少,荧光强度减弱。见图5。

1:对照组;2:模型组;3:miR-93-5p inhibitor组;4:inhibitor-NC组;5:miR-93-5p mimics组;6:mimics-NC组
3 讨论
HepG2细胞表面含有大量胰岛素受体,研究表明,高水平的胰岛素能够减少HepG2细胞表面的胰岛素受体,且HepG2细胞易于体外实验操作培养,因此本研究选择HepG2细胞为研究对象构建胰岛素抵抗细胞模型,研究外泌体miR-93-5p和HGF在胰岛素抵抗中的作用[8-9]。胰岛素抵抗主要表现为脂肪细胞、肌肉细胞和肝细胞对胰岛素的敏感性降低、胰岛素信号失调以及葡萄糖、脂肪和蛋白质代谢紊乱等[10]。外泌体中的miRNAs在包括细胞增殖、凋亡、炎症和糖脂代谢等多种与胰岛素抵抗密切相关的病理生理过程中发挥重要作用[11]。本研究结果显示,miR-93-5p在胰岛素抵抗细胞模型中的表达较正常细胞显著上调,证明miR-93-5p与胰岛素抵抗密切相关。
研究表明,HGF与胰岛素抵抗密切相关。高水平的HGF能够改善小鼠胰岛β细胞的功能,改善肥胖小鼠体内的葡萄糖稳态[12-13]。本课题组前期研究发现敲低HGF能够促进胰岛素抵抗HepG2细胞模型的增殖,而过表达HGF能够促进胰岛素抵抗细胞模型的凋亡[5]。本研究显示HGF mRNA在胰岛素抵抗细胞模型中的表达显著下调,表明HGF与胰岛素抵抗密切相关。Starbase V2.0数据库预测miR-93-5p可能靶向HGF,为了进一步明确外泌体miR-93-5p对HGF表达的影响,本研究结果显示转染miR-93-5p inhibitor后胰岛素抵抗细胞模型中HGF表达显著上调,而转染miR-93-5p mimics后HGF的表达显著下调。此外,转染miR-93-5p inhibitor后胰岛素抵抗细胞模型的细胞存活率和葡萄糖消耗量均显著升高,而转染miR-93-5p mimics后细胞存活率和葡萄糖消耗量均显著降低,进一步说明miR-93-5p可通过靶向抑制胰岛素抵抗细胞模型中HGF的表达来抑制葡萄糖的吸收,从而导致胰岛素抵抗,引起血糖失衡。
GLUT4是细胞膜上负责转运葡萄糖的一种载体蛋白,对维持机体葡萄糖的稳态具有重要作用[14-16]。本研究结果显示,转染miR-93-5p mimics后胰岛素抵抗细胞模型中GLUT4的表达下调,而转染miR-93-5p inhibitor后GLUT4的表达上调,提示miR-93-5p能够抑制GLUT4的表达,进而抑制葡萄糖的转运。研究表明,胰岛素能够使GLUT4从细胞内转运到细胞膜上,发挥转运葡萄糖的作用[17-18]。周晖等[19]发现GLUT4膜转位增加能够改善胰岛素抵抗。为了明确miR-93-5p对GLUT4分布的影响,我们又利用免疫荧光检测了GLUT4的表达和分布,结果显示,转染miR-93-5p inhibitor后胞质内GLUT4膜转位增加,荧光强度增强,而转染miR-93-5p mimics后GLUT4的膜分布减少,荧光强度也减弱,提示miR-93-5p能抑制GLUT4的表达,并减少GLUT4的膜分布,抑制葡萄糖的转运,进而破坏机体葡萄糖的稳态。
综上所述,miR-93-5p能够抑制胰岛素抵抗细胞模型中HGF和GLUT4的表达,并减少GLUT4的膜分布,从而抑制葡萄糖的转运和吸收,导致胰岛素抵抗。本研究的不足之处在于只对miR-93-5p与胰岛素抵抗的相关性进行了初步探索,未来还需深入研究或探讨miR-93-5p参与胰岛素抵抗的具体分子机制。
