circ_0038467靶向miR-495/NF-κB通路调控血管紧张素Ⅱ诱导的心肌细胞损伤*
2024-01-09夏桂玲胡鳞方
雷 蕾, 夏桂玲, 李 璐, 胡鳞方, 袁 露, 杨 辉
贵州省人民医院 1干部医疗科/老年医学科 2药剂科,贵阳 550002
急性心肌梗死等缺血性心肌病具有高发病率与高死亡率,严重威胁患者生命安全。心肌细胞损伤、心室重构等均可能引起急性心肌梗死[1-2]。环状RNA(circular RNA,circRNA)属于新型的非编码RNA,由前体mRNA反向剪接生成共价闭环结构,其与线性RNA不同,它具有稳定的结构不易被RNase R降解。研究表明circRNA与急性心肌梗死等多种心血管疾病有关[3-4]。circ_0038467在脂多糖(LPS)诱导的人胚肺成纤维细胞损伤中表达上调,沉默其表达可抑制LPS诱导的人胚肺成纤维细胞凋亡和炎症反应[5]。但circ_0038467与急性心肌梗死等心血管疾病的相关报道相对较少。生物信息学分析显示miR-495是circ_0038467的潜在靶点。研究表明miR-495过表达可抑制LPS诱导的人胚肺成纤维细胞凋亡[6]。但关于miR-495对血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)诱导心肌细胞损伤的影响研究较少。此外,抑制NF-κB信号通路可缓解急性心肌梗死的发展进程[7]。同时,miR-495已经被证实参与一些人类疾病中NF-κB信号的调控[8-9]。因此,本研究通过对大鼠心肌细胞H9C2进行AngⅡ诱导建立心肌细胞损伤模型,探究circ_0038467调控miR-495/NF-κB对AngⅡ诱导的心肌细胞损伤的作用机制。
1 材料与方法
1.1 材料与试剂
大鼠心肌细胞H9C2购自武汉普诺赛生命科技有限公司;AngⅡ购自上海酶联生物科技有限公司;Trizol试剂购自赛默飞世尔科技公司;Lipofectamine2000、反转录及荧光定量PCR试剂购自北京百奥莱博科技有限公司;si-NC、anti-miR-NC、si-circ_0038467、miR-NC、anti-miR-495、miR-495 mimics购自广州锐博生物公司;pcDNA、pcDNA-circ_0038467购自上海吉玛制药公司;双荧光素酶报告基因载体及其活性检测试剂盒购自美国Promega公司;LDH、MDA、SOD检测试剂盒购自南京建成生物工程研究所;细胞凋亡、兔抗鼠cleaved Caspase-3、cleaved Caspase-9、Bcl-2、p-P65、P65、p-IκBα及IκBα蛋白抗体购自武汉艾美捷科技公司。
1.2 方法
1.2.1 实验分组 AngⅡ组:在浓度为1 μmol/L的DMEM培养液中培养H9C2细胞,培养时间为24 h[10];Con组:正常培养的H9C2细胞。采用脂质体转染法将si-circ_0038467、miR-NC、si-NC、miR-495 mimics依次转染H9C2细胞,在转染成功的H9C2细胞内加入浓度为1 μmol/L AngⅡ的DMEM培养液培养24 h,并记为AngⅡ+si-NC组、AngⅡ+si-circ_0038467组、AngⅡ+miR-NC组、AngⅡ+miR-495组。采用脂质体转染法将si-circ_0038467和anti-miR-NC、si-circ_0038467和anti-miR-495依次转染H9C2细胞,在浓度为1 μmol/L AngⅡ的DMEM培养液中培养转染成功的H9C2细胞24 h,并记为AngⅡ+si+anti-miR-NC组、AngⅡ+si+anti-miR-495组。
1.2.2 采用qRT-PCR方法对circ_0038467、miR-495进行检测 利用Trizol试剂提取各组H9C2细胞总RNA,在42℃15 min,95℃3 min的反应条件下反转录,并加入RNase-Free ddH2O补足至20μL;按照qRT-PCR试剂盒说明进行扩增,反应条件为95℃ 20 s,60℃ 30 s;72℃ 30 s,共40个循环。相对表达量用2-ΔΔCt法计算。
1.2.3 MDA水平、LDH、SOD活性检测 收集各组H9C2细胞培养液上清,采用试剂盒检测LDH的活性;在H9C2细胞加入RIPA裂解液后,采用试剂盒检测MDA水平及SOD的活性。
1.2.4 流式细胞术 细胞分组培养48 h,收集后加入PBS冲洗,再加入结合缓冲液进行重悬,按照说明书中的指示先后加入10 μL的Annexin Ⅴ-FITC和PI 5 μL,再按照说明书中的温度要求进行避光染色,15 min后上流式细胞仪,检测细胞凋亡率。
1.2.5 双荧光素酶报告基因实验 Circinteractome预测circ_0038467与miR-495的靶向结合区域,合成野生型载体Wt-circ_0038467和缺失miR-495结合区域的突变型载体Mut-circ_0038467,采用脂质体转染法用miR-NC或miR-495对H9C2细胞进行转染,培养箱中孵育24 h,荧光素酶试剂盒测定基因荧光强度。
1.2.6 蛋白表达水平检测 RIPA裂解液提取细胞总蛋白,BCA法测定蛋白浓度。蛋白经SDS-PAGE、转膜、封闭后,加入稀释的一抗4℃孵育过夜,加入按照1∶3000稀释的HRP标记的二抗,室温摇床孵育2 h,ECL显色,暗室下X线胶片显影、定影。Quantity-One软件分析蛋白条带灰度值。
1.3 统计学方法
2 结果
2.1 circ_0038467和miR-495在血管紧张素Ⅱ诱导心肌细胞损伤中的表达
AngⅡ组circ_0038467水平为(2.82±0.23),相较于Con组,AngⅡ组circ_0038467水平显著升高(P<0.05);AngⅡ组miR-495水平为(0.34±0.03),相较于Con组,AngⅡ组水平(0.34±0.03)显著降低(P<0.05)。
2.2 干扰circ_0038467表达对血管紧张素Ⅱ诱导心肌细胞氧化应激的影响
与Con组比较,AngⅡ组LDH的活性和MDA水平升高(均P<0.05),SOD活性降低(P<0.05);与AngⅡ+si-NC组比较,AngⅡ+si-circ_0038467组LDH的活性和MDA的水平降低(均P<0.05),SOD的活性升高(P<0.05),见表1。

表1 干扰circ_0038467表达对血管紧张素Ⅱ诱导心肌细胞氧化应激的影响
2.3 干扰circ_0038467表达对血管紧张素Ⅱ诱导心肌细胞凋亡的影响
AngⅡ组细胞凋亡率、cleaved Caspase-3及cleaved Caspase-9蛋白水平较Con组升高(均P<0.05),Bcl-2蛋白水平较Con组降低(P<0.05);AngⅡ+si-circ_0038467组细胞凋亡率较AngⅡ+si-NC组降低,cleaved Caspase-3、cleaved Caspase-9表达也降低,,Bcl-2蛋白水平则升高(均P<0.05),见图1、表2。

A:凋亡相关蛋白表达;B:细胞凋亡流式图;1:Con组;2:AngⅡ组;3:AngⅡ+si-NC组;4:AngⅡ+si-circ_0038467组
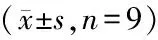
表2 干扰circ_0038467表达对血管紧张素Ⅱ诱导心肌细胞凋亡的影响
2.4 circ_0038467对miR-495表达的调控作用
图2显示circ_0038467与miR-495之间的结合位点。miR-495高表达能够抑制野生型载体Wt-circ_0038467的荧光素酶活性(0.58±0.05vs.1.05±0.09,P<0.05)。pcDNA-circ_0038467组miR-495的表达低于pcDNA组(0.44±0.04vs.1.00±0.00,P<0.05);si-circ_0038467组miR-495的表达高于si-NC组(2.86±0.24vs.0.98±0.06,P<0.05)。
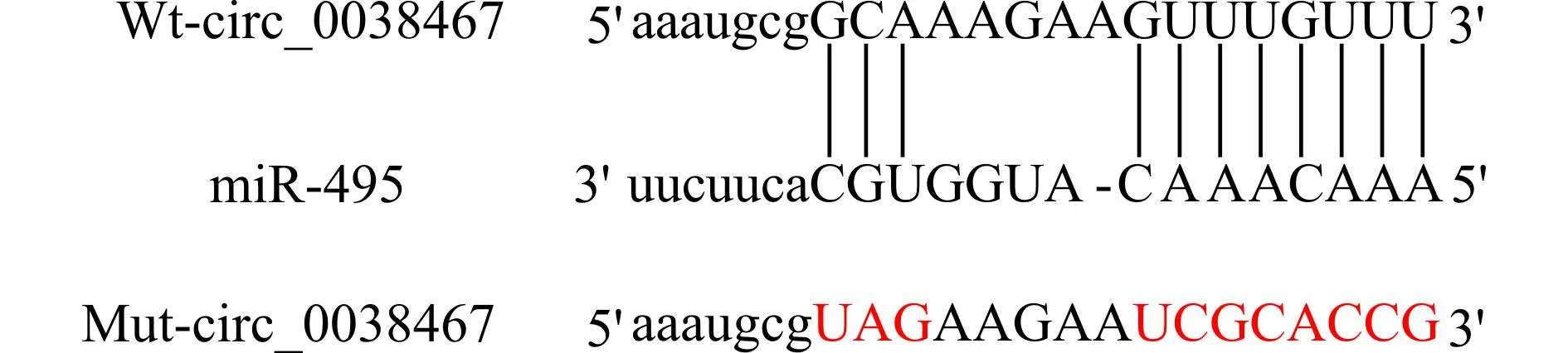
图2 miR-495与circ_0038467之间结合位点
2.5 miR-495过表达对血管紧张素Ⅱ诱导心肌细胞损伤的影响
与AngⅡ+miR-NC组比较,AngⅡ+miR-495组LDH的活性和MDA的水平降低(均P<0.05),SOD的活性升高,细胞凋亡率和cleaved Caspase-3、cleaved Caspase-9蛋白水平降低,Bcl-2蛋白水平升高(均P<0.05),见图3、表3。
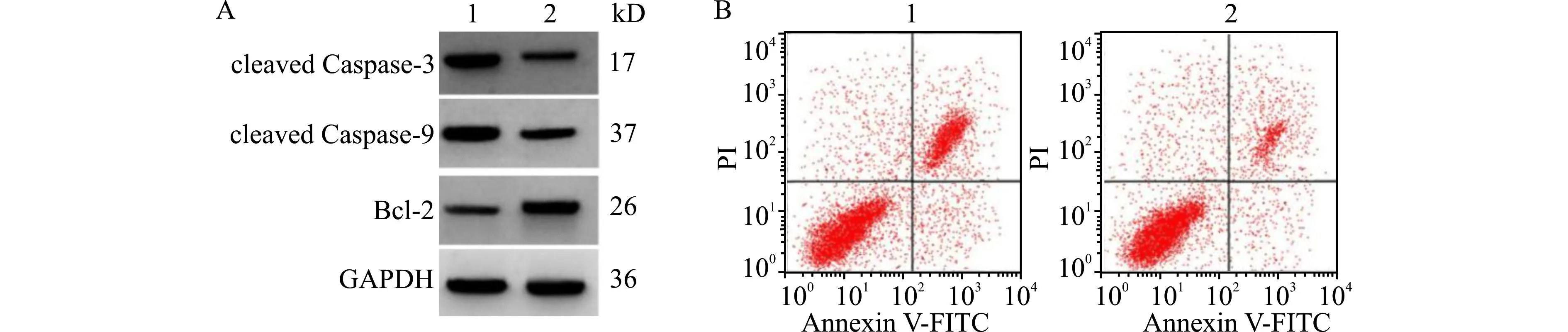
A:凋亡相关蛋白表达;B:细胞凋亡流式图;1:AngⅡ+miR-NC组;2:AngⅡ+miR-495组
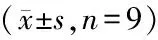
表3 miR-495过表达对AngⅡ诱导的心肌细胞凋亡和氧化应激的影响
2.6 下调miR-495表达可逆转circ_0038467敲除对血管紧张素Ⅱ诱导心肌细胞凋亡和氧化应激的影响
与AngⅡ+si-circ_0038467+anti-miR-NC组比较,AngⅡ+si-circ_0038467+anti-miR-495组LDH的活性、MDA水平、细胞凋亡率、cleaved Caspase-3及cleaved Caspase-9蛋白水平均明显提高(均P<0.05),但Bcl-2蛋白和SOD的活性降低(均P<0.05),见图4、表4。

A:凋亡相关蛋白表达;B:细胞凋亡流式图;1:AngⅡ+si-circ_0038467+anti-miR-NC组;2:AngⅡ+si-circ_0038467+anti-miR-495组
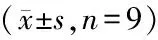
表4 下调miR-495表达可逆转circ_0038467敲除对血管紧张素Ⅱ诱导心肌细胞凋亡和氧化应激的影响
2.7 下调miR-495可逆转干扰circ_0038467对血管紧张素Ⅱ诱导心肌细胞NF-κB信号通路的影响
与AngⅡ+si-NC组比较,AngⅡ+si-circ_0038467组p-P65及p-IκBα蛋白水平降低(均P<0.05);AngⅡ+si-circ_0038467+anti-miR-495组p-P65及p-IκBα蛋白水平较AngⅡ+si-circ_0038467+anti-miR-NC组升高(均P<0.05),见图5、表5。
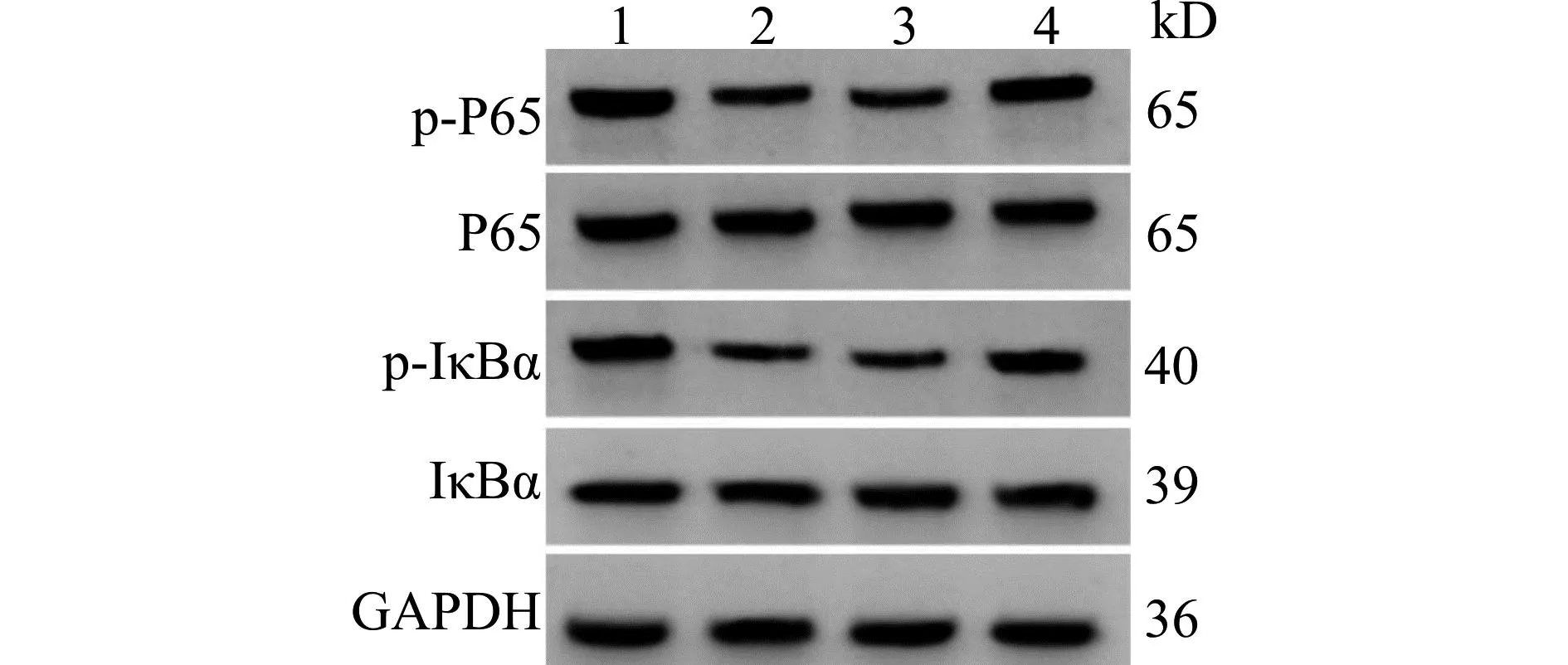
1:AngⅡ+si-NC组;2:AngⅡ+si-circ_0038467组;3:AngⅡ+si-circ_0038467+anti-miR-NC组;4:AngⅡ+si-circ_0038467+anti-miR-495组
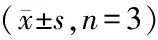
表5 下调miR-495可逆转干扰circ_0038467对血管紧张素Ⅱ诱导心肌细胞NF-κB信号通路的影响
3 讨论
AngⅡ可诱导心肌细胞氧化应激等反应,从而加重心肌细胞损伤,而circRNA异常表达可参与心血管疾病发生及发展[11-12]。circRNA具有稳定性与组织特异性,其广泛存在于真核生物体内,并可通过调节miRNA/mRNA表达对心肌细胞的活力及凋亡进行调控,可作为治疗心血管疾病的新型靶点[13-14]。
先前的研究表明降低circ_0038467的表达能够削弱LPS对支气管上皮细胞的损伤[15]。circ_0038467可促进PM2.5诱导的支气管上皮细胞损伤[16]。本研究发现在AngⅡ诱导的心肌细胞中circ_0038467表达升高,提示circ_0038467可能参与心血管疾病发生过程。研究表明心肌细胞损伤时抗氧化能力减弱,LDH、MDA的水平升高,而SOD的活性降低,并可加重心肌组织损伤[17]。本研究显示,在AngⅡ诱导的心肌细胞中,干扰circ_0038467表达可降低LDH的活性和MDA的水平,提升SOD活性,表明下调circ_0038467表达对AngⅡ诱导的心肌细胞氧化应激具有抑制作用。此外,心肌细胞凋亡率和cleaved Caspase-3、cleaved Caspase-9蛋白水平经AngⅡ作用后均显著提升,与杨丽红等[18]研究结果相符,而干扰circ_0038467表达可抑制AngⅡ诱导的心肌细胞凋亡。
miRNA和circRNA的相互作用是探索circRNA生物学功能的基础之一。目前的研究已经发现一些circRNA可以作为miRNA的海绵调节各靶基因的表达,从而参与心血管疾病的发生及发展过程。在本次实验中,我们发现circ_0038467直接结合miR-495并负调控其表达,提示circ_0038467可能通过靶向miR-495促进心血管疾病。早期的研究表明miR-495可减轻冠心病导致的内皮细胞炎症损伤[19]。miR-495通过抑制NLRP3炎症小体信号通路而抑制心脏微血管内皮细胞炎症反应从而减轻细胞损伤[20]。本研究结果表明,AngⅡ诱导组miR-495呈现低表达,其过表达会抑制心肌细胞氧化应激及细胞凋亡。由于过表达miR-495和干扰circ_0038467表达对AngⅡ诱导的心肌细胞损伤的抑制作用一致,且下调circ_0038467表达,提高miR-495的表达水平,这进一步证实circ_0038467可通过靶向miR-495参与AngⅡ诱导的心肌细胞损伤。此外,NF-κB通路在细胞生长发育、炎症、免疫和生存等多种生物学过程中发挥着重要作用,并参与了心肌细胞AC16细胞的缺血再灌注损伤[21-22]。抑制NF-κB信号通路可降低心肌细胞凋亡水平,保护心肌细胞免受外界刺激诱导的心肌损伤[23]。本研究证实了干扰circ_0038467可通靶向miR-495抑制NF-κB信号通路的激活,从而抑制血管紧张素Ⅱ诱导心肌细胞损伤。
综上所述,AngⅡ诱导的心肌细胞中circ_0038467呈现高表达,而miR-495呈现低表达,circ_0038467可靶向调控miR-495的表达,干扰circ_0038467表达可通过靶向促进miR-495表达介导NF-κB信号通路,从而对AngⅡ诱导的心肌细胞氧化应激及细胞凋亡具有抑制作用,进而降低细胞损伤。circ_0038467可能作为心血管疾病治疗的潜在靶点,但其具体作用机制尚需进一步探究。
