IL-6对小鼠胚胎心肌细胞增殖能力的影响及发育依赖性变化*
2024-01-09顾浩南孙惠美梁华敏
顾浩南, 王 淇, 孙惠美, 周 易, 梁华敏△
1华中科技大学基础医学院生理学系,湖北省药物靶点和药效学评价重点实验室,武汉 430030 2华中科技大学基础医学国家级实验教学示范中心,武汉 430030
近年来,诸多研究发现成年动物心脏仍然具有一定的心肌更新即分裂增殖[1-4],心肌再生科学研究的最重大突破是基本确立成年动物新生心肌细胞的确切来源。利用cre转基因老鼠准确追踪新生心肌细胞的来源,发现已经存在的心肌细胞是哺乳动物发育过程中或急性心梗后心肌再生的确切来源[2,4-6]。已经发现,哺乳动物发育过程中心肌细胞增殖能力逐渐下降,并伴随着心肌细胞核倍型的变化[7]:在哺乳动物出生后,具有增殖能力的单核二倍体心肌细胞伴随着血压或电生理学特点的变化逐渐发生多核/多倍体化,同时逐渐失去增殖能力。
心梗后心肌细胞增殖能力增强[8-9],而IL-6是心脏微环境中重要的细胞因子之一。已有研究发现,IL-6可上调新生鼠心肌细胞的增殖能力而促进新生鼠急性心梗后的心功能修复[10]。IL-6主要作用模式是和靶细胞膜受体或血液/组织液中可溶性受体结合后,进一步通过靶细胞膜表面的gp130蛋白激活JAK-STAT3、SHP2-RAS-ERK和PI3K-Akt信号转导系统,从而发挥生物学作用[11-13]。研究发现gp130蛋白激活不仅影响青春期和成年小鼠的心肌增殖,也影响急性心梗后的心肌细胞再生[14]。本课题组前期研究发现,小鼠个体发育过程中心脏内IL-6的浓度发生变化[15],并且哺乳动物心肌细胞类型以及增殖能力也在发生动态变化[7-8]。这些变化是否会影响IL-6对内源性心肌再生的作用仍需要进一步研究。
本课题旨在探讨IL-6对小鼠胚胎发育过程中心肌细胞增殖能力的影响,分析可能的发育依赖性变化及浓度性依赖性变化。这些研究结果不仅为心肌细胞的发育研究增加新的内容,也为探索成年动物急性心梗后内环境对内源性心肌再生影响提供线索,为有效激活内源性心肌细胞再生治疗心脏疾病提供新思路和理论依据。
1 材料与方法
1.1 胚胎心肌细胞的分离与培养
6~8周龄的C57BL/6雌性小鼠(华中科技大学同济医学院实验动物中心提供)以2∶1比例和雄性小鼠合笼一夜,第2天早上若受孕,则胚胎被记为0.5 d(embryonic day 0.5,E0.5)。胚胎发育早期(EDS,E10.5~E12.5)和发育晚期(LDS,E16.5~E18.5)的胚胎小鼠的心脏组织剪碎后于37℃恒温条件下在胶原酶Collagenase B solution(1 mg/mL,Roche,德国)中孵育20~25 min以获得单个细胞。心肌细胞在20%DMEM培养液中培养24 h后分别在培养液中加入10 ng/mL和50 ng/mL IL-6(Peprotech,美国)处理24 h。20% DMEM(100 mL)含有20 mL胎牛血清(Gibco,美国)和80 mL DMEM(Gibco,美国)。
1.2 免疫荧光技术检测心肌细胞增殖能力
在IL-6处理心肌细胞的同时,在培养液中添加BrdU(3 ng/mL)(Boster,中国)处理24 h;弃上清后预处理(4%多聚甲醛20 min,0.3%Triton X-100 15 min,3%BSA室温1 h),后将心肌细胞在兔抗小鼠α-actinin抗体溶液(1∶100,Proteintech,美国)和抗小鼠BrdU单克隆抗体溶液(1∶100,Proteintech,美国)中4℃孵育过夜。然后细胞在山羊抗兔IgG-FITC溶液(1∶50,Proteintech,美国)和山羊抗小鼠IgG-TRITC溶液(1∶50,Proteintech,美国)在室温下孵育1 h。最后用4′,6-二脒基-2-苯基吲哚(DAPI,Beyotime,中国)对细胞核染色10 min,之后使用ImmunoFloure(Olumpus,日本)进行拍照,计数BrdU+α-actinin+细胞核比例和BrdU+α-actinin+单核心肌细胞比例。
1.3 Western blot检测
利用Western blot技术检测信号通路关键蛋白的磷酸化水平。具体流程如下:收集IL-6处理后的心肌细胞,或不同发育时间点的心脏组织,使用RIPA裂解液[50 mmol/L Tris(pH=7.4),150 mmol/L NaCl,1%Triton X-100,1%脱氧胆酸钠,0.1%SDS和1 mmol/L苯甲基磺酰氟]制备可溶性标志蛋白的样品,继而使用BCA蛋白分析试剂盒(Pierce,美国)测定标志蛋白的浓度。制备SDS-PAGE凝胶,在每条泳道上添加30 μg蛋白质样品电泳后转移至PVDF膜上,最后加入抗体溶液进行孵育并使用Kodak BioMax ML胶片检测免疫反应条带。实验应用的抗体分别为:兔抗鼠ERK1/2单抗(1∶1000,杭州华安生物技术有限公司,中国)和兔抗鼠p-ERK1/2单抗(1∶2000,Cell Signaling Technology,美国),USA兔抗鼠Akt单抗(1∶1000,杭州华安生物技术有限公司,中国)和兔抗鼠p-Akt多克隆抗体(1∶1000,杭州华安生物技术有限公司,中国),兔抗STAT3鼠多克隆抗体(1∶200,杭州华安生物技术有限公司,中国)和鼠抗鼠p-STAT3单抗(1∶200,Santa Cruz Biotechnology,美国)以及鼠抗鼠GAPDH单抗(1∶5000,湖北百奥斯生物科技有限公司,中国)。
1.4 统计学方法
2 结果
2.1 IL-6影响胚胎心肌细胞的增殖能力并具有发育依赖性变化
随着心脏的发育成熟,小鼠心肌细胞逐渐从单核二倍体转变成双核四倍体[7-9]。而单核二倍体心肌细胞被认为是成年哺乳动物心肌再生能力的关键细胞来源[16-17]。因此,我们同时统计了IL-6对所有心肌细胞核以及对单核心肌细胞增殖能力的影响。我们发现小鼠胚胎心肌细胞增殖能力随着发育成熟逐渐下降(图1A、1B),主要体现为LDS的BrdU+α-actinin+细胞核比例和BrdU+α-actinin+单核心肌细胞比例均显著低于EDS。其中,LDS的BrdU+α-actinin+单核心肌细胞比例为0(图1B)。

A:免疫荧光技术检测BrdU+α-actinin+心肌细胞;B:胚胎心肌细胞增殖能力发育依赖性下降,n=5;C:IL-6对EDS心肌细胞增殖能力的影响,n=6;D:IL-6对LDS心肌细胞增殖能力的影响,n=5;EDS:胚胎发育早期;LDS:胚胎发育晚期;与对照组比较,**P< 0.01;##P< 0.01
IL-6对胚胎心肌细胞增殖能力的影响具有发育依赖性。10 ng/mL IL-6不改变EDS的BrdU+α-actinin+细胞核比例和BrdU+α-actinin+单核心肌细胞比例(图1C),但显著增加LDS的BrdU+α-actinin+细胞核比例和BrdU+α-actinin+单核心肌细胞比例(图1D)。
IL-6的作用具有浓度依赖性[18]。我们增加IL-6浓度至50 ng/mL,发现50 ng/mL IL-6减少EDS的BrdU+α-actinin+单核心肌细胞比例(图1C);但对LDS BrdU+α-actinin+单核心肌细胞促增殖作用显著强于10 ng/mL IL-6(图1D)。50 ng/mL IL-6对EDS和LDS的BrdU+α-actinin+单核心肌细胞比例的反向作用,再次提示IL-6对胚胎心肌细胞增殖能力的影响具有细胞发育程度依赖性。
2.2 IL-6对胚胎心肌细胞3种信号通路关键蛋白磷酸化水平的影响
IL-6的生物学作用主要通过靶细胞膜表面的gp130蛋白激活JAK-STAT3、SHP2-RAS-ERK和PI3K-Akt信号转导通路来实现[10-13],因此我们进一步利用Western blot技术检测IL-6作用下gp130蛋白介导的3条不同信号转导通路的关键蛋白质磷酸化水平。在EDS,10 ng/mL和50 ng/mL IL-6增加Akt、ERK和STAT3的蛋白总量,也增加3种蛋白的磷酸化水平(图2A);但只抑制pAkt/Akt比值,对心肌细胞的pERK/ERK比值和pSTAT3/STAT3比值并无显著影响(图2B)。在LDS,10 ng/mL和50 ng/mL IL-6对Akt、ERK和STAT3的蛋白总量,以及3种蛋白的磷酸化水平的影响与其对EDS的作用相似(图3A),但显著增加pSTAT3/STAT3比值(图3B)。这些结果提示IL-6并不同步影响JAK-STAT3、SHP2-RAS-ERK和PI3K-Akt信号转导通路,并且该作用与IL-6对胚胎心肌细胞的增殖能力的影响相似,同样具有发育依赖性。
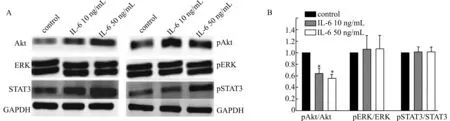
A:IL-6对心肌细胞ERK、Akt和STAT3的磷酸化水平的影响;B:半定量分析IL-6处理后ERK、Akt和STAT3的磷酸化水平的变化;n=3;与对照组比较,*P< 0.05

A:IL-6对心肌细胞ERK、Akt和STAT3的磷酸化水平的影响;B:半定量分析IL-6处理后ERK、Akt和STAT3的磷酸化水平的变化;n=3;与对照组比较,*P< 0.05
2.3 不同发育阶段gp130蛋白介导的信号转导通路基础状态不同
我们的前期研究发现二甲基亚砜(dimethyl sulfoxide,DMSO)对胚胎心肌细胞增殖能力的影响同样具有发育依赖性,并且和信号通路基础状态有关,即由于EDS心肌的基础STAT3磷酸化水平高于LDS,DMSO促进STAT3磷酸化的程度在LDS比EDS更显著,所以DMSO在增加LDS心肌细胞增殖能力的作用也显著高于EDS[19]。因此我们继续采用Western blot检测上述几个关键蛋白质在发育过程中的基础水平,发现随着胚胎发育成熟,ERK、Akt和STAT3的总蛋白和3种蛋白质磷酸化水平均呈发育依赖性下降(图4A)。通过半定量分析,pERK/ERK和pSTAT3/STAT3的比值也随着发育成熟逐渐下降,尤其是pSTAT3/STAT3比值在胚胎期已经出现明显下降;而pAkt/Akt比值随发育逐渐增加(图4B)。

EDS:胚胎发育早期,LDS:胚胎发育晚期,P7:出生后7 d;P14:出生后14 d;Adult:成年小鼠;n=3
3 讨论
我们的既往研究发现心脏成纤维细胞分泌IL-6的能力呈发育依赖性上升[15],在小鼠胚胎干细胞离体心肌分化过程中IL-6作用具有发育依赖性变化[18]。而自然情况下,随着个体发育成熟心肌细胞的分裂增殖能力逐渐下降[7]。本研究发现EDS心肌细胞的增殖能力显著高于LDS心肌细胞。尤为重要的是,我们发现IL-6对心肌细胞增殖的影响具有发育依赖性变化:10 ng/mL IL-6对EDS心肌细胞增殖能力并无明显影响,而50 ng/mL IL-6减少BrdU+单核心肌细胞数目;而10 ng/mL和50 ng/mL IL-6均增加LDS BrdU+α-actinin+细胞核比例和BrdU+α-actinin+单核心肌细胞比例。特别值得注意的是,50 ng/mL IL-6抑制EDS单核心肌细胞的增殖却促进LDS单核心肌细胞的增殖。单核二倍体心肌细胞被认为是不同物种,或者是同一物种不同背景动物之间心肌细胞再生能力差异的关键细胞基础[16-17]。这提示IL-6对单核心肌细胞增殖的作用是IL-6的重要生物学效应之一,会在生理状态和疾病发展过程中产生一定的积极作用。
上述IL-6作用的变化是因为IL-6对gp130蛋白介导的信号通路的影响不同,可能与JAK-STAT3通路有关。多项研究证实,心肌细胞增殖能力与下游ERK、Akt和STAT3的磷酸化水平有关[20-22]。我们发现10 ng/mL和50 ng/mL IL-6对EDS心肌细胞的ERK和STAT3磷酸化均无显著影响,但显著减少Akt的磷酸化水平。在LDS,10 ng/mL和50 ng/mL IL-6均抑制Akt的磷酸化,促进STAT3的磷酸化水平。这说明这三个信号通路不同程度地介导了IL-6对胚胎心肌细胞增殖能力的调节:在EDS,IL-6不能激活gp130蛋白介导的信号通路,所以未展现出促增殖作用,甚至出现抑制作用;在LDS,IL-6促进STAT3的磷酸化,进而促进心肌细胞增殖。这与已报道的IL-6上调STAT3磷酸化而促进新生鼠心肌细胞的增殖能力一致[10]。然而我们的数据并不能很好地解释IL-6对Akt磷酸化的抑制作用,以及这种抑制作用和IL-6对细胞增殖能力影响的相关性。
IL-6对EDS和LDS三个信号转导通路的影响不同,特别是STAT3磷酸化程度的不同,可能与不同发育阶段关键蛋白质的基础状态密切相关[19]:通过Western blot发现EDS、LDS、P7、P14和成年小鼠ERK、Akt、STAT3的总蛋白含量和磷酸化水平均随发育逐渐成熟而下降。此外,EDS和LDS心肌细胞表面的IL-6受体表达量、gp130蛋白表达量以及其他gp130蛋白介导的信号通路如Hippo、Notch和mTOR等信号转导系统[14]差异也可能导致了IL-6对EDS和LDS心肌细胞增殖能力影响的差异性。这些因素可能是50 ng/mL IL-6抑制EDS单核心肌细胞增殖和(或)促进LDS单核心肌细胞增殖的机制。
IL-6作为心脏细胞微环境中的一种重要细胞因子,已经被证实在慢性心力衰竭和心肌梗死等心肌细胞损伤时分泌大量增加,有利于促进心肌细胞的修复能力[23-25]。我们发现IL-6以发育依赖的方式影响心肌细胞增殖能力,这可能与IL-6在不同阶段的不同靶向通路有关。这些发现为心脏发育提供了新知识,也为细胞替代疗法的研究提供了新线索。
