BN作用于MOF电解质界面的改性修饰
2024-01-09李晨永许浩然董士花姚树玉
李晨永,许浩然,董士花,姚树玉
(1.山东科技大学 材料科学与工程学院,山东 青岛 266590;2.山东科技大学 储能技术学院,山东 青岛 266590)
化石能源的大量消耗导致能源危机与环境污染等一系列问题。从环境保护和能源利用的长远规划考虑,开发具有更高能量密度、安全性能更佳的储能电池有着十分重要的意义[1]。锂电池作为一种储能设备,在各种电子设备和汽车上得到了广泛的应用。但是传统锂电池使用有机电解液作为离子交换的载体,存在易燃、有毒等安全隐患[2-3]。固态电解质可从源头上杜绝这些隐患[4],且其能量密度较高[5],有望在未来市场上大放异彩。金属有机框架(metal organic framework, MOF)是一类以金属离子为中心,周围接枝有机官能团配体的有机-无机杂化材料。金属有机框架材料孔径可控,可以通过有机配体的选择来实现特定的功能,在气体的吸附、储存与分离,生化反应,催化,医药前驱体等领域都获得广泛应用。近年来,研究人员开始将其作为固态电解质的基体材料。但MOF材料应用于电解质中仍存在一些固有的缺点,会发生颗粒的团聚现象,容易造成材料出现缺陷[6]。Bastian等[7]将铜基MOF负载在高聚物薄膜,大大缩短了离子扩散距离,但薄膜局部也出现不同程度的团聚现象,导致界面阻抗变大、离子传输受限等问题。氮化硼是由硼原子和氮原子构成的一种无机材料,主要有金刚石立方相氮化硼、纤锌矿相氮化硼和六方相氮化硼3种不同的晶形结构。其中,六方相氮化硼作为一种二维材料,氮原子和硼原子交替排列,在平面上排列成网状结构[8]。在平面内,氮化硼原子之间以强共价键连接,层间以弱范德华力连接,结构类似于石墨,因此氮化硼与石墨性质上也具有相似之处,如材料的各向异性、良好的导热性和机械强度;且BN二维平面内的原子缺陷可以进行离子的传导[9]。BN表面有大量暴露出来的硼原子,电负性远小于氮原子,处于缺电子状态,极易与锂盐中的阴离子结合,提高锂离子的相对含量[10]。Yan等[11]根据六方氮化硼的特点,在铜基板上通过电化学沉积生长致密保护层,为锂金属提供保护,在大电流下可以稳定循环超50次。氮化硼的耐热性和机械强度都十分优异,在固态电解质的界面处引入氮化硼材料,可以有效抑制锂枝晶的生长,有效延长电池的使用寿命。
为了解决固态电解质与电极之间界面阻抗大和界面相容性差的问题,本研究采用简单的喷涂方法,在MOF电解质表面涂覆BN得到BN-MOF电解质,利用表面改性复合电解质组装成电池进行表征测试。
1 实验部分
1.1 电解质材料的制备
通过水热法合成金属有机框架材料。将ZrCl4(0.382 g)和99.8%乙酸(1 g)溶于64 mL N, N二甲基甲酰胺(N, N-dimethylformamide,DMF)中,加入2,5-二溴对苯二甲酸 (0.531 g),超声处理15 min;然后将混合物倒入100 mL特氟龙内衬的高压反应釜中, 120 ℃加热24 h。高压釜自然冷却至室温,以转速6 000 r/min离心5 min收集样品。用DMF洗涤3次,以去除未反应的原料。产物在80 ℃下烘干过夜,得到的粉末即为UIO-66-Br2。
将UiO-66-Br2、聚偏氟乙烯(poly(vinylidene fluoride),PVDF)和双三氟甲烷磺酰亚胺锂(lithium bis(trifluoromethanesulfon)imide, LiTFSI)按照一定的质量比在N-甲基吡咯烷酮(N-methylpyrrolidone,NMP)溶液中混合形成黏性浆料,搅拌12 h, PVDF和LiTFSI的质量比固定(分别占总质量的10%和5%);搅拌均匀后,将电解质浆料匀速涂到玻璃板上,80 ℃干燥12 h,得到MOF电解质。在制备好的MOF电解质膜表面均匀喷涂一层BN喷剂得到BN-MOF电解质。
1.2 表征方法
采用日本理学集团公司D/MAX-2500/PC X射线衍射仪(X-ray diffraction,XRD)分析样品物相组成,Cu 靶Kα射线, 40 kV, 200 mA,扫描速度为5°·min-1,扫描范围5°~50°;美国赛默飞世尔科技公司Apreo S HiVac高分辨场发射扫描电子显微镜(scanning electron microscope,SEM)分析样品微观形貌;美国赛默飞世尔科技公司Nicoiet 380傅里叶红外光谱仪得到材料的红外光谱,扫描范围为500~4 000 cm-1;瑞士Mettler TGA 2热重分析仪得到电解质的热重数据,升温速率为10 ℃·min-1,测试温度区间30~700 ℃。
复合电解质膜电化学性能采用上海辰华仪器有限公司CHI660E型电化学工作站表征,阻抗测试频率为0.1~100 000 Hz,测量温度为室温(约25 ℃)~80 ℃,每10 ℃进行1次测量,升温后保温30 min再进行测量;线性扫描伏安(linear sweep voltamere, LSV)测试在室温条件(约25 ℃)进行,测试电压范围2~6 V,扫描速率为5 mV·s-1;锂离子迁移数测试采用恒电位直流极化法与电化学阻抗谱(electrochemical impedance spectroscopy,EIS)相结合,在10 mV 的恒定电压下测试极化前后阻抗以及极化电流大小,计算锂离子迁移数tLi+值;循环伏安(cyclic voltammetry, CV)测试电压范围2.5~3.8 V,扫描速率0.1 mV·s-1。恒电流充放电循环测试使用新威电池测试系统,电极材料采用磷酸铁锂,测试温度为室温(约25 ℃),电压2.5~3.8 V;在新威电池测试系统上对锂对称电池进行不同电流密度下的锂沉积/溶出实验,充放电时间分别为1 h,测试温度为室温,电流密度为0.025和0.05 mA·cm-2。
2 结果分析与讨论
2.1 材料的结构和形貌特征
对制备的MOF电解质膜(图1(a))和BN-MOF电解质膜(图1(b))进行截面和表面的扫描电镜观察,MOF电解质膜在循环20次后与锂金属表面接触性较差,电解质与锂金属之间存在点接触现象;而BN-MOF电解质中,氮原子高度亲锂,与锂金属的界面处形成Li—N结合,其界面接触较为紧密,使锂离子能够通过较短的路径进行传输[12]。

(a)MOF在1 C倍率下循环20次后与锂接触面的截面电镜图;(b)BN-MOF电解质在1 C倍率下循环20次后与锂接触面的截面电镜图;(c)MOF电解质的表面形貌;(d)BN-MOF电解质的表面形貌;(e)MOF电解质的数码照片;(f)BN-MOF电解质的数码照片
由MOF电解质膜(图1 (c))和BN-MOF电解质膜(图1(d))的表面形貌可以看出,MOF电解质表面有较为明显的起伏现象,且有较多的孔洞,不利于锂离子的连续传导。BN-MOF电解质的表面平滑平整,没有明显的起伏现象,说明BN喷剂可以有效填充电解质表面的孔隙与孔洞,在电解质表面构建一层致密的保护层,通过增强电解质基体的连续接触性协助锂离子的传输。BN表面改性后的电解质仍能保持良好的柔韧性。由图1(a)可以得到,在大倍率下经过一定的循环后,MOF电解质与锂电极出现缝隙,造成离子传递受阻;而图1(b)显示,BN-MOF电解质与锂电极接触紧密,且表面未有被锂枝晶刺穿的迹象,表现出与锂电极的良好相容性和一定的强度。此外,如图1(e)和图1(f)所示,BN-MOF电解质仍保持了聚合物电解质的良好柔韧性,这给实现实际生产应用提供了可能。
2.2 材料的物理和化学性能
对制备的MOF电解质和BN-MOF电解质利用XRD进行结构表征。图2为两种电解质膜的XRD图像,与BN标准卡片对比,发现BN-MOF电解质峰位、峰强没有发生改变,MOF电解质与BN-MOF电解质的衍射峰基本匹配,说明BN的表面改性没有改变材料的结构。为了解BN喷剂对电解质基体的化学结构的影响,分别对 MOF电解质、BN-MOF电解质进行红外光谱测试。如图3所示,1 350 cm-1处出现峰位,对应六方氮化硼的B—N的面内伸缩振动[13]。对两种复合电解质进行热重测试,其热重曲线如图4所示。可以看出两种电解质膜分解过程大致相同,可分为3个阶段:第1阶段在350 ℃以下,电解质的质量缓慢下降,由于电解质膜在制备过程中内部会吸收一定量的含锂离子液体,并且在制备完成后会吸收部分空气中的水蒸气,因此该阶段会出现较为平缓的失重曲线;第2阶段在350~520 ℃,电解质的质量开始快速下降,质量损失的原因是电解质膜内部的PVDF首先分解[14],在500 ℃左右MOF颗粒开始分解[15],由于MOF含量占比较大,因此分解曲线下降较为迅速,在520 ℃附近几乎分解完毕;第3阶段在520 ℃以上,此时MOF和PVDF已分解完毕[16],因此质量变化曲线开始显著减缓。整体来看,BN-MOF电解质膜在任意阶段的失重程度都要比MOF电解质小,说明经表面改性,具有良好的导热性的氮化硼材料能够有效缓解温度的升高给电解质膜带来的影响[17],使得BN-MOF电解质具有良好的热稳定性。

图2 MOF和BN-MOF的X射线衍射图Fig. 2 XRD patterns of MOF and BN-MOF
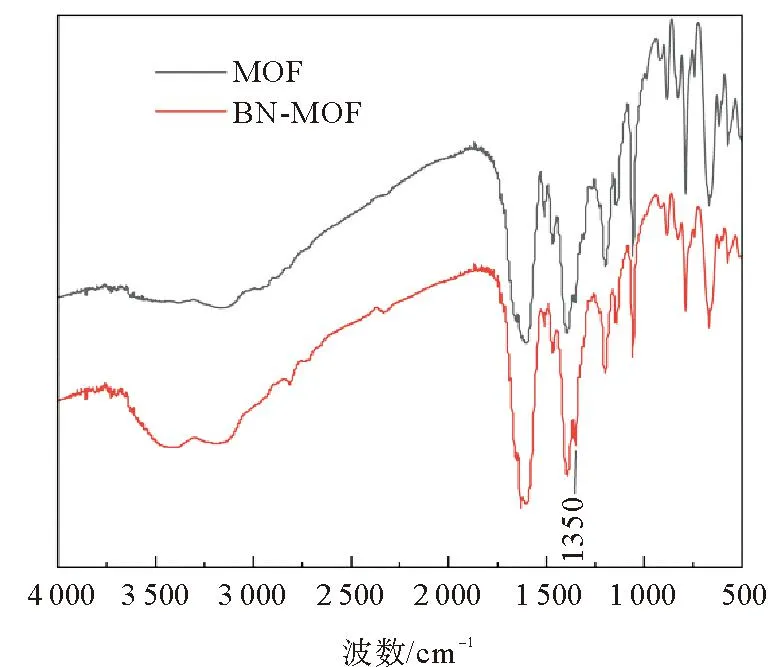
图3 MOF和BN-MOF的红外光谱图
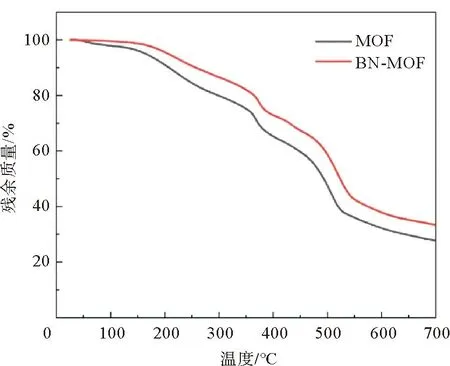
图4 MOF与BN-MOF电解质的热重曲线
通过MOF电解质与BN-MOF在不同温度下的阻抗曲线(图5)可以看出,同样温度下BN-MOF复合电解质膜的阻抗明显小于MOF复合电解质。计算可知,室温下BN-MOF电解质膜的离子电导率为1×10-3S·cm-1,而MOF电解质的离子电导率为3.19×10-5S·cm-1。引入阿伦尼乌斯公式:
(1)
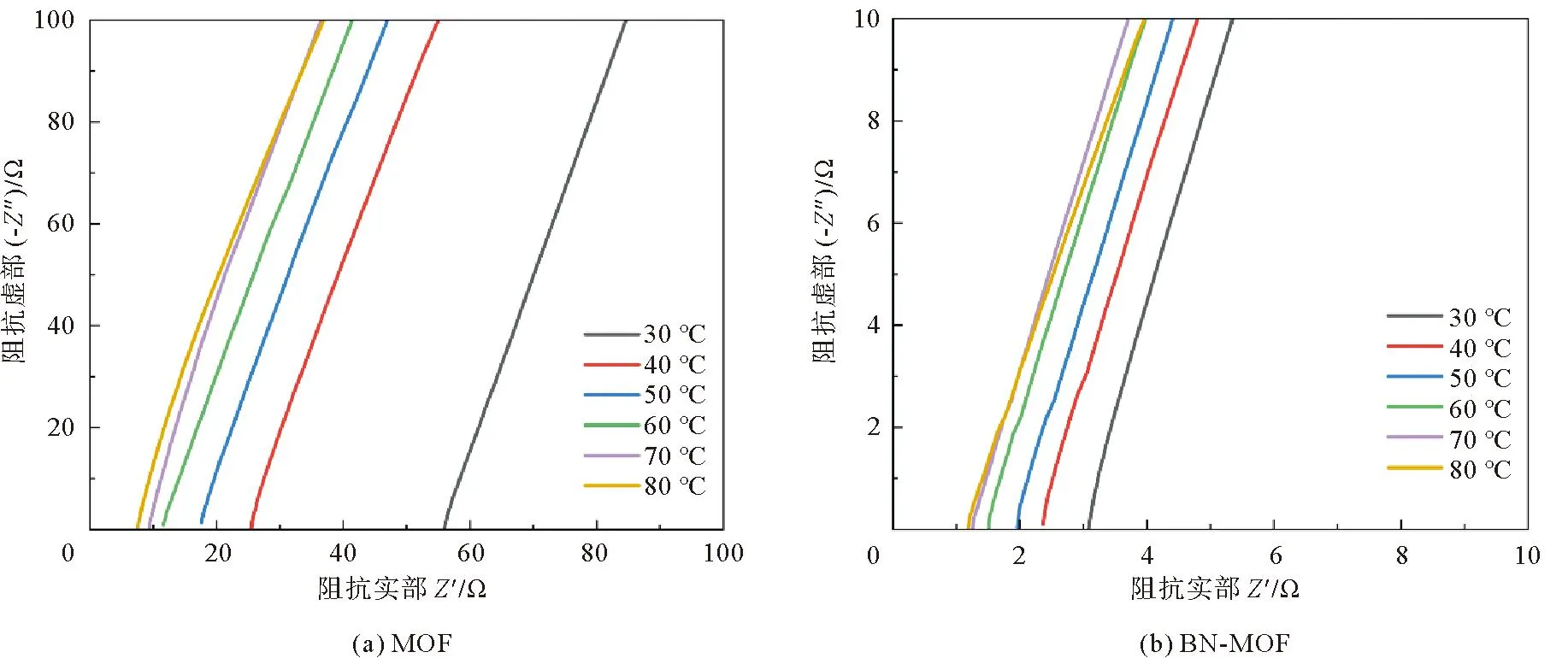
图5 电解质在不同温度下的电化学阻抗谱图
其中:σ为离子电导率,S·cm-1;A为指前因子;T为绝对温度,K;Ea为离子传输过程中的活化能(衡量原子状态变化的电势能),eV;kb为玻尔兹曼常数,1.38×10-23J·K-1。对式(1)两边取对数,得到:
(2)
以lg(σT)为纵坐标,以1 000/T为横坐标作图,如图6所示,通过拟合得到电解质的活化能。结果表明,BN-MOF电解质的活化能(0.216 eV)小于MOF电解质(0.393 eV),原因是BN颗粒的填隙,增加了锂离子传递的导通路径,并且BN之间存在的原子缺陷也能够传输锂离子,进而增加了锂离子的传输效率[18],因此BN的表面改性能够增加锂离子的迁移效率。
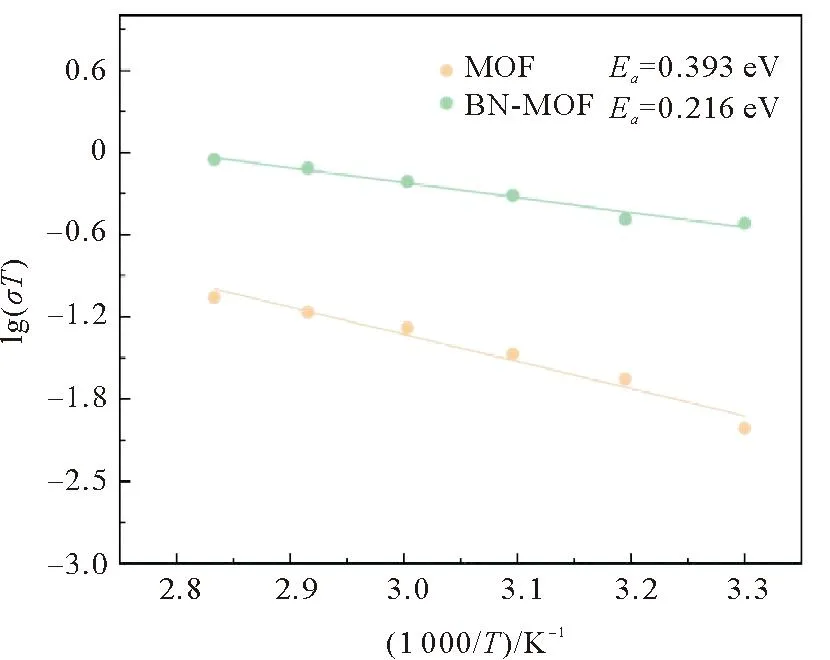
图6 MOF与BN-MOF电解质的阿伦尼乌斯图
由图7 MOF电解质与BN-MOF电解质的 CV曲线可以看到,3.25 V处的还原峰和3.6 V处的氧化峰之间的偏差很小,而且经过3次还原氧化过程后,BN-MOF电解质的CV曲线具有更好的重复性,证明了其可逆的锂离子输运过程和较好的循环稳定性。MOF电解质和BN-MOF电解质在10 mV电压下测试的时间电流曲线以及极化前后的阻抗如图8所示,拟合计算可以得出,MOF电解质膜的锂离子迁移数为0.38,小于BN-MOF电解质(图8(b))的0.59。证明经过BN表面改性,硼原子与阴离子结合,释放了更多的锂离子参与传导,增强了锂离子的传输效率,提高了电解质的电化学性能。为研究BN改性对于电化学窗口的影响,对MOF电解质和BN-MOF电解质分别进行线性扫描伏安测试。由图9可以看出,在初始较宽的电位范围内,电解质的极化电流基本保持平缓,没有电流响应,说明没有发生电化学反应。扫描电位至4.58 V时出现拐点,此时MOF电解质开始出现明显电流响应,原因之一是锂盐中阴离子的分解加速了电解质的分解;而BN-MOF电解质出现拐点的电压值为5.24 V,电化学窗口高于MOF电解质,说明经过BN的表面改性,硼原子将锂盐中阴离子吸附在一起,结合更加牢固,不易分解;另外,氮化硼本身具有较高的电化学稳定性,与MOF电解质结合后,构成更加稳定的复合体系,更不容易被分解,因此其电化学窗口更大[19]。
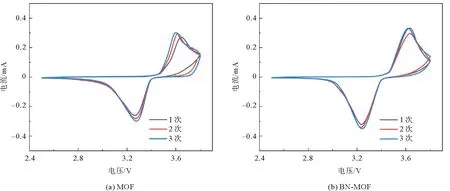
图7 电解质的循环伏安曲线
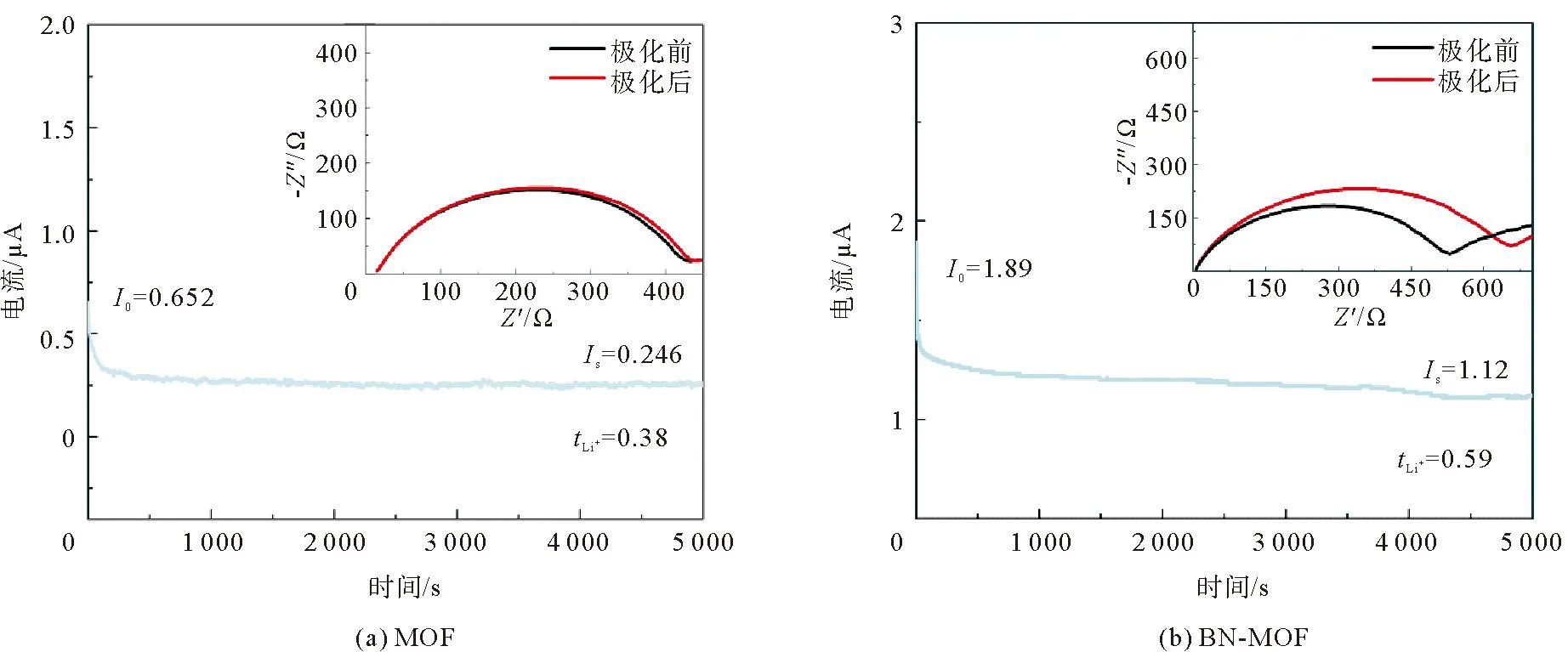
图8 电解质的时间-电流曲线和极化前后的阻抗图
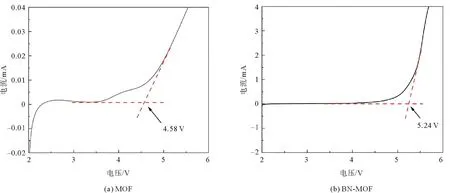
图9 电解质线性扫描伏安曲线
为了研究MOF电解质膜、BN-MOF电解质对金属锂电极的动态稳定性,进行了金属锂沉积/溶出的测试,如图10所示。电池循环初期,MOF电解质膜的极化电压随时间的延长而降低并趋于平稳。这一现象归因于电池循环初期界面接触不良,极化电压会有小幅波动;随着循环的进行,锂金属在氧化/还原的过程中会在电极上有一个二次分布的过程,过程中锂电极与固体电解质的界面接触越来越好,负极与电解质之间形成的固体电解质界面(solid electrolyte interface, SEI)层逐渐稳定,界面结合更加紧密,电池的极化电压趋于平稳。沉积溶出测试过程中,电流密度设置为0.025 mA·cm-2,循环初期Li|MOF|Li电池极化电压约为0.04 V,而Li|BN-MOF|Li电池极化电压稳定在0.01 V附近,Li|BN-MOF|Li极化较小;循环约200 h后,MOF电解质的极化电压出现快速增大至不可逆变化,随后电池损坏,而Li|BN-MOF|Li电池循环超过400 h,相较于MOF电解质性能有着很大的提升。在0.05 mA·cm-2的大电流密度时,BN-MOF电解质仍能保持较低极化电压(约0.025 V)且循环寿命超300 h,表现出较好的循环稳定性。根据沉积溶出数据,同MOF电解质膜相比,BN-MOF电解质通过表面BN改性增强电解质与锂金属电极的界面相容性,抑制锂枝晶生长,提高了电池在循环过程中的稳定性,有效提升了电池的循环寿命。
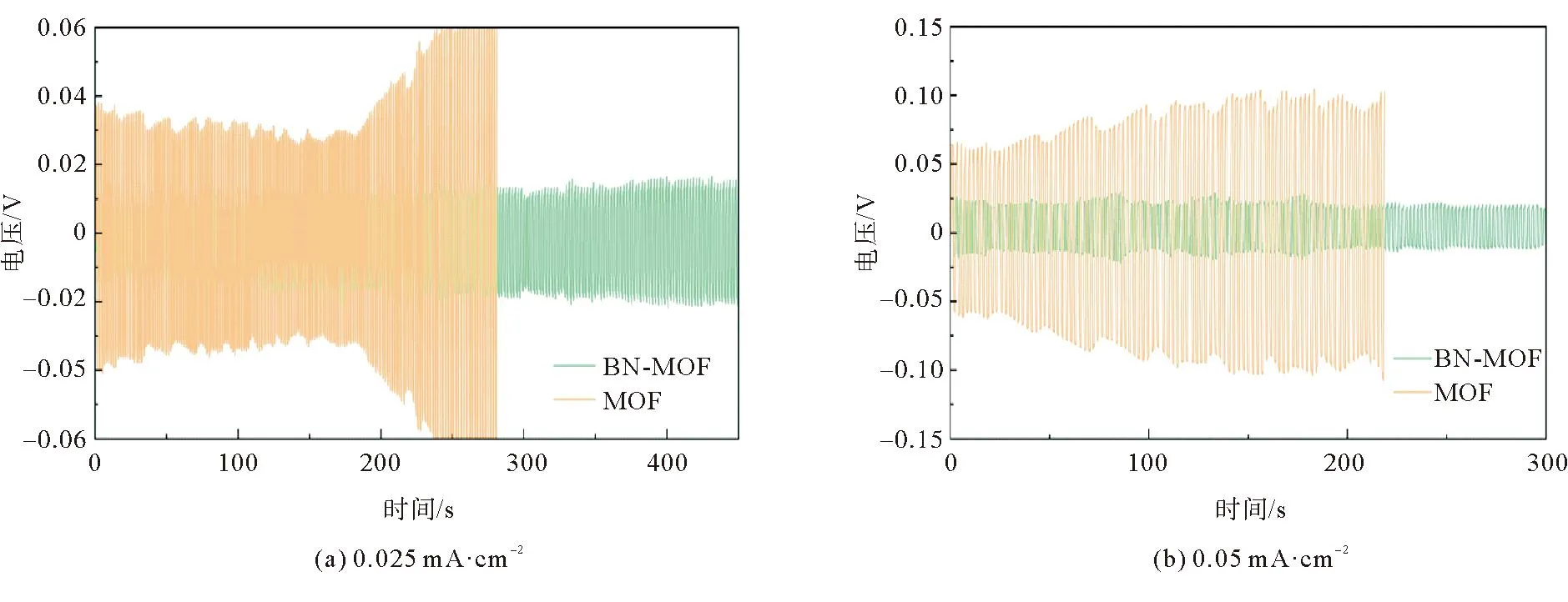
图10 MOF与BN-MOF电解质在不同电流密度下的沉积溶出测试
为研究MOF电解质、BN-MOF电解质与正极材料的匹配情况和离子在电池内传输机制,将电解质膜匹配LiFePO4(LFP)正极,组装成 LFP|MOF/BN-MOF|Li 电池后在不同电流下进行充放电测试。电池在室温下以0.2 C(图11(a))、0.5 C(图11(b))、1 C(图11(c))下进行恒倍率充放电测试时,MOF电解质膜在0.2 C的倍率下首圈放电比容量虽然也能够达到约160 mA·h·g-1,但是在循环7次后,放电比容量就开始显著下降,随后在约400 h后发生损坏。而BN-MOF电解质膜不仅首圈就能达到161 mA·h·g-1高放电比容量,并且在循环60次后仍达到160 mA·h·g-1的高放电比容量。在大倍率0.5 C、1 C的电流密度下,与MOF复合电解质膜相比,BN-MOF电解质均表现出更高的放电比容量和更稳定的循环性能。综上结果可以得出,MOF电解质循环初期,由于电解质与正极界面接触较差,与电极界面相接处的强度有限,并且在电极制备阶段,涂布完成后进行烘干,造成电极表面疏松多孔,结构强度不高,因此在循环至某个阶段时,电极上的活性物质发生部分脱落,活性物质无法重新回到电极上,也就无法重新参与到接下来的循环过程中,导致放电比容量下跌;而BN-MOF电解质膜中BN与电极的结合体具有一定的结构强度,且改性后的界面接触更好,在保持高放电比容量的同时,能够维持较高的离子迁移率,循环稳定性十分优异,能够在保持较高的放电比容量的同时稳定循环。

图11 不同倍率的MOF与BN-MOF电解质的放电比容量对比图
3 结论
通过水热法合成了MOF电解质材料,对MOF进行BN表面改性,制备了BN-MOF复合固态电解质,研究了两种电解质的结构、形貌和化学性能。
1) BN喷剂在MOF电解质表面构建出新的表面平滑平整的界面层,没有改变MOF材料的结构,且可有效协助锂离子的传输;BN-MOF电解质表现出良好的界面稳定性和界面相容性,在0.025 mA·cm-2的电流密度下稳定循环超过400 h。
2) BN的表面改性能够降低MOF电解质的阻抗,增加锂离子的迁移效率;室温下,BN-MOF电解质膜的离子电导率远高于MOF电解质的离子电导率;BN-MOF电解质膜的锂离子迁移数为0.59,高于MOF的0.38;BN-MOF电解质膜的电化学窗口为5.24 V,高于MOF的4.58 V。
3) Li|BN-MOF|LiFePO4电池的充放电循环测试表明,在0.2 C的倍率下循环充放电60次后,仍能达到160 mA·h·g-1的较高放电比容量;在倍率增至0.5 C和1 C时,BN-MOF复合电解质均比MOF电解质表现出更高的放电比容量和更稳定的循环性能。
