游泳调节纹状体突触结构可塑性改善Shank3基因敲除大鼠孤独症样行为
2024-01-08孟昀晨张伟南薛亚奇安莎莎甄志平
孟昀晨 ,徐 丹,张伟南,熊 信,薛亚奇,安莎莎,张 嵘,甄志平*
(1. 北京师范大学 体育与运动学院,北京 100875;2. 中国矿业大学(北京) 体育教研部,北京 100083;3. 北京大学医学部 神经科学研究所,北京 100191)
孤独症谱系障碍(autism spectrum disorder, ASD)是一种神经发育障碍疾病,通常发病于3 岁前,并持续终生(Xiao et al., 2014)。ASD 患者的行为表现具有高度异质性,除了社交互动障碍和重复刻板行为两种核心症状外,还表现出其他精神疾病症状,包括运动、语言、智力、感觉、睡眠等障碍,以及发育迟缓、癫痫、强迫症和注意力缺陷多动行为等(李明娟 等, 2021; Hewitson, 2013)。Shank3基因缺陷是ASD 最常见的单基因风险因素之一(刘春雪 等, 2022; 徐丹 等, 2020)。对由Shank3基因缺陷引起ASD 的患者和动物模型的深入研究为了解ASD 的潜在神经病理学机制提供了机会。SHANK3 是一种突触后的主支架蛋白,在兴奋性突触后致密部聚集,对突触生长和发育至关重要(Monteiro et al., 2017)。在中枢神经系统中,Shank3基因在多个脑区表达,其中在纹状体的表达最为丰富(Monteiro et al., 2017)。
研究表明,ASD 的多种症状与纹状体脑区的功能异常密切相关(孟昀晨 等, 2021;Li et al., 2019)。其中,背侧纹状体介导的运动和执行功能,可能与重复刻板行为和运动功能障碍有关(Langen et al., 2014)。腹侧纹状体主要介导奖励、认知和目标定向,与ASD 患者的强迫行为、僵化思维、执行功能和异常社会共存模式有关(Kohls et al., 2013)。ASD 的行为症状与纹状体突触可塑性的异常密切相关,突触可塑性又受兴奋-抑制性神经递质及靶向的受体调控。谷氨酸(glutamate,Glu)和γ-氨基丁酸(γ-aminobutyric acid,GABA)是中枢神经系统最重要的一对兴奋-抑制性神经递质。大多数的皮层区域,包括感觉、运动和边缘皮层,向纹状体发送兴奋性谷氨酸能突触投射(Hintiryan, 2016),这有助于各种感觉、运动和认知处理任务(Haber, 2016)。α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid,AMPA)受体和N-甲基-D-天冬氨酸(N-methyl-D-aspartate, NMDA)受体是重要的谷氨酸受体,其中AMPA 受体在兴奋性信息传递中起先导作用,由GluA1~4 4 种亚基组成同四聚体或异四聚体。NMDA 受体作为另一种接受Glu 信号传递的重要兴奋性受体,是影响神经可塑性的关键受体,包括NR1~3 3 种亚基,其中NR2 有A~D 4 种亚型。此外,纹状体中的GABA 信号传导也可以通过GABA受体的作用调节纹状体神经元功能。
体力活动和丰富环境是神经可塑性过程中的有利刺激(甄志平 等, 2020; Ball et al., 2019),而游泳将体力活动的运动刺激与丰富环境的多元感官刺激相结合,是促进神经发育和神经可塑性的有效锻炼方式之一(Musiyenko et al., 2020)。适宜负荷的游泳运动可以对神经系统、骨骼肌和心肺功能产生积极的影响,在维持身心健康、减少负面情绪以及提高学习和认知能力方面发挥重要作用(马春莲 等,2018)。游泳与其他运动相比具有较强的适龄性,尤其是其可以作为婴幼儿发育促进的有效运动手段。许多人群研究都证明了游泳干预有助于减轻ASD的症状(Ennis, 2011;Pan, 2010;Yanardag et al., 2013)。
综上所述,游泳可以作为干预ASD 的有效手段,但目前ASD 干预的相关研究中,干预年龄主要集中在青少年期,很少有研究关注游泳对幼年期ASD 患者行为的影响。本研究团队先前已经证明,Shank3基因敲除大鼠具有ASD 的典型症状——刻板行为,且纹状体脑区的突触蛋白表达异常(Song et al., 2019),且已有研究证明,纹状体功能障碍是ASD 刻板行为的基础(Wang et al., 2017)。因此,针对刻板行为和运动障碍症状,本研究聚焦纹状体脑区,对Shank3基因敲除大鼠进行早期游泳干预,通过检测纹状体脑区树突棘形态、支架蛋白表达和受体蛋白表达情况,探索早期游泳干预改善ASD 样行为的机制。
1 研究对象与方法
1.1 研究对象与分组
实验对象为8 日龄Shank3基因敲除ASD 模型雄性大鼠,SPF 级。大鼠每笼饲养2~4 只,保持12 h∶12 h 光/暗循环,室温20~25 ℃,湿度50%~60%,自由饮食和饮水。
采用PCR 法对幼鼠鼠尾进行基因型鉴定,鉴定中使用两种引物,F1(CTGTTGGCTGAGCCTGGCATAGAG)和R1(GCTGGAAAGAAACAACGAGAGCCAG)用于检测野生型鼠的等位基因(559 个碱基对),F2(TTGTGCACTGCCTATGTTGACCACT)和R2(TAGGCGAGAGAAGATGGTGTGATTTCC)检测突变体缺失的等位基因(688 个碱基对)。根据基因型J 鉴定结果将幼鼠随机分为4 组:Shank3基因敲除对照组(KC)、同窝野生型对照组(WC)、Shank3基因敲除游泳组(KS)、同窝野生型游泳组(WS),每组各20 只。为了尽量减少重复测试和处理的影响,每组大鼠进行的行为测试不超过3 个。
1.2 游泳干预方案
幼鼠产后第8 天(PND8)时,对WS、KS 组大鼠进行8 周游泳训练,每周游泳5 天,休息2 天。PND8 的大鼠对应大约1 岁的儿童(Andreollo et al., 2012)。本研究参照了de Santana Muniz 等(2013)的8 日龄SD 幼鼠早期游泳训练方法,并根据预实验中8 日龄ASD 幼鼠的游泳情况,制定游泳干预计划。PND8—10 为游泳适应阶段,在485 mm×350 mm×200 mm 矩形笼内进行游泳干预,水温提前预热,控制在(32±1)℃。在PND8 时,大鼠游泳2 min,水没过大鼠腿部,水深约3 cm。在PND9,大鼠游泳5 min,水没过大鼠肚子,水深约3.5~4 cm。在PND10,大鼠游泳10 min,水没过大鼠头部,水深约4.5~5 cm。PND13 后,在直径为150 cm 的圆形水箱中进行游泳干预,水位保持在50 cm。PND13—15期间,大鼠每天分别进行15、20、25 min的游泳训练。在PND16—26 期间,大鼠每天游泳30 min,PND27—60期间,大鼠每天游泳40 min(图1)。

图1 早期游泳干预和行为测试方案Figure 1. Early Swimming Intervention and Behavior Testing Protocol
1.3 行为学测试
抓力测试和转棒实验于大鼠PND61—63 的每天8∶00进行,两个行为学实验间隔1 h。旷场与自梳理行为学测试于19∶00 进行(图1)。
1.3.1 自梳理实验
自梳理实验用于分析大鼠的刻板、重复行为。实验大鼠被放置在一个矩形盒子(40 cm×34 cm×40 cm)内,先适应10 min,然后使用红外摄像机记录10 min 内大鼠在黑暗中的自我梳理行为(Song et al., 2019)。自我梳理行为包括大鼠舔舐自己的身体和头发、用前爪擦脸、抓挠躯干等。
1.3.2 旷场实验
旷场实验主要检测大鼠的自由活动与焦虑情绪(王莉颖等, 2019)。大鼠被放入矩形空旷盒子中(90 cm×90 cm×50 cm)并进行适应环境,实验区与外界隔音,光照均匀,环境温度维持在(24.0±0.5)℃。实验时用纸板将大鼠轻轻移入旷场中央并同时进行数据采集,视频录制10 min。每只大鼠测试完成后清理粪便、尿液,然后用75%酒精消除气味,待旷场完全干燥后放入下一只大鼠进行实验。整个过程实验者保持安静,并远离测试大鼠。通过视频采集系统采集实验录像,使用smart 3.0 软件对大鼠运动轨迹和速度进行分析。
1.3.3 抓力实验
抓力实验主要测试大鼠四肢力量。使用最大抓力测试仪(BIO-GS3 Grip strength,美国)进行实验。前2 天为适应阶段,第3 天进行正式测试。大鼠四肢抓住抓力测试仪上的金属网后,匀速向后拖拽大鼠尾巴,当大鼠前肢松开时记录最高值即为最大抓力。每只大鼠测试3 次,每次间隔30 min,记录3 次实验的最大值为最大抓力。最大抓力可反应肌肉力量、神经肌肉接头功能。
1.3.4 转棒实验
转棒实验用于评估大鼠的运动协调性。使用转棒测试仪(UGO BASILE)进行实验。前2 天为适应阶段,适应阶段转棒转速为4 r/min,大鼠在转棒测试仪上进行适应,掉落后,放回转棒继续实验,总适应时长为3 min/天。第3天正式测试,测试阶段5 min 内将转棒转速从4 r/min 匀速增加至40 r/min,大鼠从转棒上掉落,或者抓住转棒后连续旋转两圈而不在转棒上行走即停止实验,记录大鼠掉落的时间。每只大鼠测试3 次,每次实验间隔30 min,取3 次实验的最大值。
1.4 高尔基染色
大鼠完成行为学实验后24 h(PND64),使用10%水合氯醛麻醉致死,断头取脑。按照高尔基染色试剂盒(HTKNS1125, Hitobiotec)说明书,每cm3脑组织加入5 mL 等体积溶液1 和溶液2 混合液浸泡大鼠脑组织,室温避光浸泡12~24 h,次日更换浸泡液,同条件贮存14 d。之后转移至等体积溶液3 中,4 ℃避光贮存12 h,再更换等体积溶液3,同条件下储存48~72 h。将脑组织从溶液3 中取出,置于异戊烷中冷冻干燥。再将脑组织于-20 ℃以下冰冻切片机上进行切片,厚度为150 μm。脑组织切片在室温避光干燥后进行染色。使用激光共聚焦显微镜拍摄脑片中背侧纹状体脑区神经元树突形态。纹状体中等多棘神经元(medium spiny neurons, MSNs)的特征为:1)在形态上存在大量的棘突和相对较短的神经元分支;2)胞体为圆形或卵圆形,有3~8 个一级树突。每组选取3 只大鼠,每只大鼠在10×目镜下拍摄2 个神经元,每个神经元在40×目镜下拍摄2 个树突分支分析树突棘密度。使用Image J 软件对神经元进行Sholl 分析,并分析树突棘密度(姚涵 等, 2018)。
1.5 PSD蛋白提取及免疫印迹实验
各组大鼠在行为学实验后24 h(PND64)断头取脑,在冰上分离右侧纹状体组织,置于-80 ℃冰箱待用。将纹状体组织置于缓冲液1中(10 mmol/L HEPES,2 mmol/LEDTA,5 mmol/L Na3VO4,30 mmol/L NaF,20 mmol/L β-甘油磷酸酯,蛋白酶抑制剂)匀浆,4 ℃下500 rcf 离心5 min,取上层悬浊液。然后4 ℃下10 000 rcf 离心15 min,移去上清保留膜粗提取物。将膜粗提取物重悬于300~500 µL 缓冲液2中(50 mmol/L HEPES,2 mmol/L EDTA,2 mmol/L EGTA,5 mmol/L Na3VO4,30 mmol/L NaF,20 mmol/L β-甘油磷酸酯,1% Triton X-100,蛋白酶抑制剂),4 ℃下20 000 rcf 离心80 min,沉淀即为突触后致密部(postsynaptic density, PSD)颗粒。将PSD颗粒重悬于50 µL缓冲液3 中(50 mmol/L Tris,5 mmol/L Na3VO4,30 mmol/L NaF,20 mmol/L β-甘油磷酸酯,1% NaDOC,蛋白酶抑制剂),即得到PSD 蛋白提取物。
使用Bredford 试剂盒测定PSD 蛋白提取物中的蛋白浓度。按总蛋白10 µg 含量上样,经10% SDS-PAGE 分离胶分离后,转膜,封闭。在一抗溶液中孵育过夜,各指标一抗孵育浓度如下:SHANK2(1∶1 000)、PSD95(1∶2 000)、Homer1(1∶2 000)、GluA1(1∶2 000)、GluA2(1∶2 000)、NR1(1∶2 000)、NR2A(1∶2 000)、NR2B(1∶2 000)、mGluR(1∶1 000)、GABAR(1∶5 000)。TBST 漂洗后孵育二抗,再洗涤。之后在化学发光成像系统下使用ECL 发光液曝光。使用Image J 软件分析条带积分光密度值(IOD)。
1.6 统计分析
使用IBM SPSS 20 和GraphPad Prism 9.0 对数据进行统计分析与作图。数据进行方差齐性检验后,采用双因素方差分析(two way ANOVA)。所有数据均以平均数±标准差表示,P<0.05 为具有统计学差异的标准。
2 研究结果
2.1 基因型测定
Shank3基因敲除大鼠通过CRISPR-Cas9 技术删除种系中的Shank311~21 号位点产生(Song et al., 2019)(图2A)。实验中所有受试大鼠均来自杂合子繁殖对。通过PCR 对鼠尾DNA 进行鉴定,确认基因型(图2B)。为进一步分析Shank3基因敲除大鼠纹状体脑区SHANK3 蛋白的表达情况,使用针对SHANK3 富含脯氨酸结构域的抗体进行Western blot 印迹实验。结果表明,Shank3基因敲除大鼠纹状体脑区确认不存在SHANK3 蛋白,基因敲除成功(图2C)。

图2 Shank3基因敲除大鼠模型 (Meng et al., 2022)Figure 2. Shank3 Knockout Rat Model (Meng et al., 2022)
2.2 行为学实验结果
2.2.1 早期游泳对大鼠刻板行为的影响
重复刻板行为是ASD 的核心症状之一,表现为啮齿类动物的自我梳理行为(图3A)增加。分析不同组别大鼠的自我梳理时间发现,与WC 组相比,KC 组大鼠的自我梳理时间明显增加(P<0.001);KS 组大鼠的自我梳理时间明显低于KC 组(P<0.05);WS 组大鼠的自梳理时间相比WC 组有所增加,但并无显著差异(P>0.05)(图3B)。这些结果表明,Shank3基因敲除大鼠表现出重复刻板行为,早期游泳干预可以减少Shank3基因敲除大鼠的刻板行为,但对野生型大鼠并无影响。
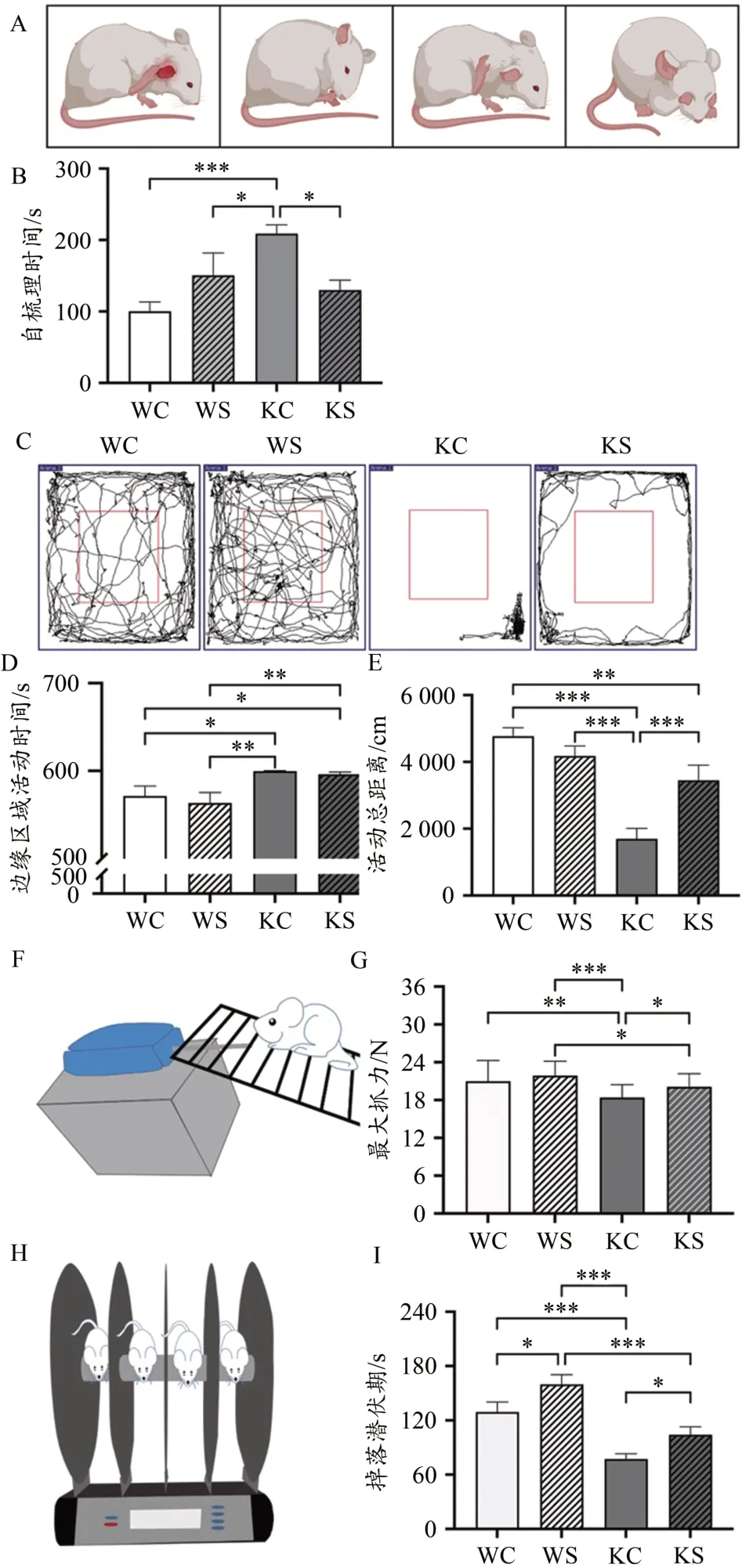
图3 早期游泳干预后大鼠行为学测试结果Figure 3. Behavioral Test Results after Early Swimming Intervention
2.2.2 早期游泳对大鼠焦虑情绪与自由活动的影响
旷场实验中大鼠运动轨迹可以反映大鼠的焦虑情绪,活动距离可以反映大鼠的自由活动情况。结果显示,KC组大鼠在旷场边缘区域的停留时间显著高于WC 组(P<0.05)和WS 组(P<0.01)(图3D),自由活动的总距离显著低于WC 组(P<0.001)和WS 组(P<0.001)(图3E)。早期游泳干预后,KS 组大鼠在边缘区域的停留时间与KC 组相比未发生显著变化(P>0.05)(图3D),但自由活动总距离显著增加(P<0.001)(图3E)。这些结果表明,Shank3基因敲除大鼠明显存在焦虑情绪,且自由活动度较低,早期游泳干预未能明显改善Shank3基因敲除大鼠的焦虑情况,但显著提升了其自由活动距离。
2.2.3 早期游泳对大鼠肌肉力量的影响
大鼠最大抓力测试结果显示,KC 组大鼠最大抓力显著低于WC 组(P<0.01)。在游泳干预后,KS 组大鼠最大抓力显著高于KC 组(P<0.05),与WC 组已无显著差异,但显著低于WS 组(P<0.05)(图3G)。这些结果表明,Shank3基因敲除大鼠的肌肉力量显著降低,早期游泳干预可以改善Shank3基因敲除大鼠的肌肉力量,且早期游泳干预对野生型大鼠的肌肉力量也有一定的强化效果。
2.2.4 早期游泳对大鼠运动协调能力的影响
在转棒实验中,大鼠在转棒上掉落的潜伏期越长,代表大鼠的运动协调能力越好。结果显示(图3I),KC 组大鼠在转棒掉落的潜伏期显著低于WC 组大鼠(P<0.001)。早期游泳干预后,KS 组大鼠转棒掉落潜伏期显著高于KC组(P<0.05),与WC 组已无显著差异(P>0.05)。WS 组大鼠转棒掉落潜伏期显著高于WC 组(P<0.05),且显著高于KS 组(P<0.001)。这些结果表明,Shank3基因敲除导致大鼠的运动协调能力显著降低;早期游泳干预后,基因敲除大鼠和野生型大鼠的运动协调能力均得到了显著提高。
2.3 纹状体脑区树突形态检测结果
激光共聚焦扫描显微镜下观察各组大鼠纹状体MSNs 树突分支与树突棘密度(图4)。结果显示,KC 组大鼠纹状体树突分支数在距离胞体60~100 µm 段显著低于WC 组和WS 组,在60 µm 处显著低于KS 组(图4B)。KC组大鼠纹状体树突分支数量显著低于WC 组(P<0.05),早期游泳干预后,KS 组大鼠纹状体树突分支数量显著多于KC 组(P<0.01)(图4C)。从纹状体树突分支总长度看,KC 组大鼠纹状体树突分支总长度最短,显著低于WC组(P<0.01),早期游泳干预后,KS 组和WS 组大鼠纹状体树突分支总长度显著大于KC 组(P<0.05),与WC 组无显著差异(图4D)。这些结果表明,Shank3基因敲除导致大鼠纹状体MSNs 树突分支数量和总长度减少,早期游泳干预改善了Shank3基因敲除对树突分支数量和总长度的影响,但对野生型大鼠无显著作用。

图4 早期游泳干预后大鼠纹状体树突形态Figure 4. Dendritic Morphology of Rat Striatum after Early Swimming Intervention
通过比较各组大鼠纹状体树突棘密度(树突棘数量/10 μm)发现,KC 组大鼠树突棘密度显著低于WC 组(P<0.01),早期游泳干预后,KS 组大鼠树突棘密度显著高于KC 组(P<0.05),与WC 组无显著差异(P>0.05)。游泳干预后,WS 组大鼠纹状体树突棘密度也得到提高,显著高于WC 组(P<0.05),且显著高于KC 组(P<0.001)和KS 组(P<0.01)(图4F)。这些结果表明,Shank3基因敲除导致大鼠纹状体树突棘密度降低,早期游泳干预不仅能改善基因敲除对树突棘密度的影响,还可以提高野生型大鼠的树突棘密度。
2.4 纹状体兴奋性突触后支架蛋白的表达情况
为了探讨早期游泳对ASD 样大鼠纹状体兴奋性突触后支架蛋白的影响,本研究对纹状体PSD 中兴奋性突触后支架蛋白的表达情况进行了检测(图5A)。结果显示,在纹状体PSD 组分中,各组间SHANK2 蛋白的表达水平无显著差异(图5B),KC 组大鼠纹状体PSD95、Homer1 蛋白表达显著低于WC 组(P<0.05)和WS 组(P<0.05)。早期游泳干预后,KS 组大鼠纹状体PSD95 蛋白表达显著高于KC 组(P<0.05)。结果表明,Shank3基因敲除导致大鼠纹状体PSD 中兴奋性突触后支架蛋白表达降低,早期游泳干预增加了纹状体PSD 中PSD95 的表达。

图5 早期游泳干预后大鼠纹状体突触后致密部支架蛋白表达Figure 5. Expression of Scaffold Protein in Rat Striatal Postsynaptic Density after Early Swimming Intervention
2.5 纹状体兴奋性突触后受体蛋白的表达情况
为了探讨早期游泳对ASD 样大鼠纹状体受体蛋白表达的影响,本研究进一步对纹状体PSD 中Glu 能受体和GABA 能受体蛋白的表达进行了检测(图6A)。结果显示,在纹状体PSD 组分中,KC 组大鼠AMPA 受体亚基GluA1、GluA2 表达显著低于WC 组(P<0.001,P<0.01)和WS 组(P<0.001)。早期游泳干预后,WS 组大鼠与WC组无差异,但KS 组大鼠GluA1、GluA2 表达均显著高于KC 组(P<0.05;图6B、6C)。对NMDA 受体的3 个亚基NR1、NR2A 和NR2B 的表达水平进行检测,结果显示,KC组大鼠纹状体PSD 组分中NR1、NR2A、NR2B 表达均显著低 于WC 组(P<0.05,P<0.01,P<0.01)和WS 组(P<0.05,P<0.01,P<0.05)。早期游泳干预后WS 组NMDA受体亚基表达与WC 组仍无差异,KS 组大鼠纹状体PSD组分中NR1 表达略有升高,与WC 和WS 组相比无显著差异(P>0.05),KS 组NR2A、NR2B 表达显著高于KC 组(P<0.05)(图6D、6E、6F)。4个组别的mGluR5蛋白表达(图6G)与GABA 受体蛋白表达(图6H)均无显著差异(P>0.05)。
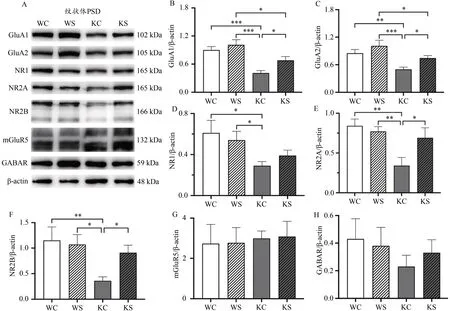
图6 早期游泳干预后大鼠纹状体突触后致密部受体蛋白表达Figure 6. Expression of Striatal Postsynaptic Dense Part Receptor Protein after Early Swimming Intervention
3 讨论
ASD 相关的致病因素众多,包括参与转录调节的基因(MECP2、MEF2)、参与翻译调节的基因(Staufen、FMRP)、细胞黏附分子(NLGN1、α-neurexin)和支架蛋白(Shank 家族、Homer1、PSD95)等(Gatto et al., 2010)。相较于参与细胞分子调节过程的基因,支架蛋白的破坏性更加简单直接。Shank3是ASD 的一个重要致病基因(Genovese et al., 2020)。关于Shank3基因不同外显子缺失的动物模型研究表明,Shank3基因缺失可以引起ASD样症状(刘海鹰 等, 2018;刘加强 等, 2016)。本研究对Shank3基因11~21 号外显子敲除大鼠进行了行为学测试,结果发现,Shank3基因敲除大鼠不仅存在严重的重复刻板行为和焦虑情绪,并且在运动能力方面也存在缺陷,包括自主活动度较低,肌肉力量和运动协调能力较差。结果证明,Shank3基因11~21 号外显子敲除大鼠是典型的伴随运动功能障碍的ASD 动物模型。
3.1 Shank3基因对纹状体突触形态和功能的影响
ASD 的症状,特别是刻板行为和运动障碍与纹状体脑 区 的 功 能 密 切 相 关(Peca et al., 2011; Wang et al.,2017)。SHANK3 蛋白在纹状体脑区的表达最为丰富(Monteiro et al., 2017),定位于树突和胞体中,可通过肌动蛋白依赖的机制促进神经元的生长和发育(Halbedl et al.,2016),促进树突棘的形成并调节其数量(Grabrucker et al.,2011)。研究表明,Shank3基因突变与树突分支异常有很强的相关性,神经元胞体面积、轴突数目和长度都受到Shank3基因突变的显著影响(Kathuria et al., 2018;Peca et al.,2011;Wang et al., 2016)。研究团队前期的研究发现,Shank311~21 号外显子缺失的大鼠模型海马脑区树突棘密度降低(Song et al., 2019)。本研究对纹状体MSNs 的树突分支数量、树突总长度和树突棘密度进行了检测,发现Shank311~21 号外显子缺失大鼠纹状体MSN 树突分支数量、总长度和树突棘密度均显著降低。突触后的分子组分是突触形态的基础,因此,本研究进一步对参与组成突触后组分的支架蛋白表达进行了检测。检测SHANK2 蛋白表达,探讨Shank3基因敲除是否引起了SHANK2 蛋白的代偿作用,结果显示,SHANK2 蛋白表达并未发生变化。检测兴奋性突触后的其他重要支架蛋白PSD95 和Homer1 蛋白表达,结果显 示,PSD95 和Homer1表达都有所降低,证实了Shank3基因敲除对MSNs 树突发育的破坏。
在突触受体表达方面,AMPA 受体在兴奋性信息传递中起先导作用,在树突棘结构中含量丰富,其功能与树突棘形态发育密切相关。NMDA 受体广泛表达于锥体神经元和中间神经元中,参与调节一些与动作学习相关的复杂认知和行为过程。有研究证明,Shank3基因不同位点的缺失会导致纹状体Glu 能受体蛋白的改变(Peca et al., 2011;Wang et al.,2016)。本研究对AMPA 受体亚基GluA1、GluA2,NMDA 受体亚基NR1、NR2A、NR2B,mGluR 亚基mGluR5 表达进行了检测。与前人研究结果类似,Shank3基因敲除大鼠纹状体GluA1、GluA2、NR1、NR2A、NR2B 的表达均降低。
3.2 早期游泳干预对Shank3敲除大鼠纹状体突触结构可塑性的调控作用
运动作为神经可塑性过程的有利刺激,在促进神经发育、改善社会交往(Gopinath et al., 2018)、提高执行功能(陈爱国 等, 2021)和记忆能力(Erickson et al., 2019)等方面的作用日益凸显。游泳是生命早期可行的有效运动方案之一,在以往的动物游泳干预研究中,干预时间通常设定在PND21 之后(Kim et al., 2020;Ma, 2020)。然而,本研究对幼年期的ASD 模型动物进行游泳干预,选择了PND8 到PND60 作为游泳干预时间,因为大鼠的PND8 大约相当于人类的1~2 岁,大鼠的PND60 大约相当于人类的成年期。本研究选择这个干预时期与临床ASD 的最早诊断时间相对应,即ASD 症状最早出现是在出生后1~2 岁(Sturner et al., 2017)。更重要的是,根据美国疾病控制和预防中心(Centers for Disease Control and Prevention,CDC)的建议,早期干预可以显著改善ASD 儿童的相关症状,对ASD 儿童的治疗应在ASD 症状出现后立即开始。
对游泳干预ASD 患者的研究表明,游泳可以改善ASD儿童的体能和耐力(Pan, 2011; Yanardag et al.,2013),并对其认知功能如社会交往、情感和学习产生积极影响(Chu et al., 2012; Ennis, 2011)。此外,游泳可以减 少ASD 儿童刻板行为的发生(Yilmaz et al., 2004)。ASD 动物模型的运动干预研究也证明了运动可以改善ASD 动物模型的症状,但这些研究的ASD 模型多为采用孕期药物诱导的动物模型(Ghahremani et al., 2022; Tu et al.,2023;Wang et al., 2020)。然而ASD 的致病因素主要以遗传因素为主,约占37%~90%(杨志亮 等, 2016)。流行病学研究发现,突触支架组分相关的Shank3基因缺陷的临床ASD 患者占有较高比例,近10%(Uchino et al., 2013),因此对Shank3基因敲除ASD 模型的干预研究具有重要意义。与药物诱导的ASD 模型不同,Shank3敲除模型动物的基因组中消除了Shank3基因的重要区段,因此难以通过非基因手段来恢复SHANK3 蛋白的正常表达,在此前提下的运动干预治疗是否仍能逆转基因缺陷导致的行为异常是本研究的重点。本研究对Shank3基因敲除动物模型进行了早期游泳干预,发现早期游泳改善了ASD 模型大鼠的运动能力,主要表现在自主活动能力、力量和运动协调能力的提高,同时也改善了ASD 核心症状中的重复刻板行为,但并未改善焦虑情绪。
这些结果证明,早期游泳干预可以改善Shank3基因缺陷导致的行为异常。因此,本研究对与这些行为相关的纹状体突触形态、支架蛋白和受体蛋白进行了检测。形态学结果显示,早期游泳干预显著改善了Shank3基因敲除大鼠的纹状体MSNs 树突形态,表现在MSNs 树突分支数和总长度显著增加,树突棘密度显著提高。表明早期游泳的多元感官刺激和运动练习显著促进了纹状体MSNs 发育,改善突触形态。这也为早期游泳改善与纹状体相关的行为提供了形态学支持。进一步探索新生成的树突结构主要是由哪些支架蛋白和受体蛋白的增加引起的,结果显示,早期游泳干预显著增加了Shank3基因敲除大鼠纹状体兴奋性突触后支架蛋白中PSD95 的表达,并显著提高了AMPA 受体亚基GluA1、GluA2 和NMDA 受体亚基NR2A 和NR2B 的表达。这些结果表明,运动在不改变SHANK3 和SHANK2 蛋白表达的情况下,仍能改善突触形态及质量,这可能与以下因素有关:1)Shank3基因有22 个外显子,本研究的动物模型只敲除了11~21 号外显子,并未完全敲除,然而为排除其他Shank 家族蛋白的影响特异性检测SHANK3 蛋白,我们使用的抗体为anti-SHANK3 (781-1009 和1260-1392氨基酸)(Song et al.,2019),并不能检测残缺的SHANK3 蛋白的情况,然而残缺的SHANK3 蛋白仍可能发挥作用。2)兴奋性突触的形成并不绝对依赖于SHANK3 蛋白。兴奋性突触后的组成非常复杂,包括多个蛋白质,如PSD95、Homer1、DLGAP1和SAPAPs 等(孟昀晨 等, 2021),它们均参与突触的形成和维持,本研究中也发现了PSD95 蛋白的增加。
综上所述,早期游泳引起的Shank3基因敲除大鼠纹状体突触结构可塑性的变化,即树突结构、兴奋性突触后的支架蛋白与受体蛋白的改变,是早期游泳干预后Shank3基因敲除大鼠ASD 样行为得到改善的重要机制,并提示早期游泳引起的纹状体MSNs 突触形态和功能的变化并不依赖于Shank3基因。
4 结论
Shank3基因敲除大鼠纹状体树突发育受损,兴奋性突触后PSD95、Homer1、GluA1、GluA2、NR1、NR2A 和NR2B受体表达降低,并出现ASD 样症状,刻板行为与运动功能障碍。早期游泳干预对Shank3基因敲除大鼠的ASD 样行为具有改善效果,主要通过上调纹状体树突分支数、树突总长度与树突棘密度,及部分兴奋性突触后受体表达。此外,早期游泳引起的纹状体形态和功能的变化并不依赖于Shank3基因。
