钠-葡萄糖协同转运蛋白2抑制剂对乳腺癌化疗患者的心血管保护作用研究*
2024-01-08刘运波
陈 杰,刘运波,毛 敏,常 静
(重庆医科大学附属第一医院心血管内科,重庆 400010)
蒽环类药物和曲妥珠单抗显著改善了乳腺癌患者的预期寿命,但同时也带来了新的临床问题-肿瘤心脏毒性。这种心脏毒性导致了患者的不良预后,并严重限制了他们的肿瘤治疗机会。有研究表明,自2014年以来,心血管疾病是导致乳腺癌幸存者最常见的死亡原因[1]。
钠-葡萄糖协同转运蛋白2抑制剂(SGLT-2i)作为一种新型降糖药物,已被证明在降糖的同时还具有额外的心血管效益。2022年美国心脏协会/美国心脏病学会(AHA/ACC)《心力衰竭(HF)管理指南》[2]推荐SGLT-2i用于治疗症状性HF患者及合并糖尿病A、B期HF患者,是唯一覆盖HF全程管理的药物。近年来,多项动物实验表明,SGLT-2i可以减少蒽环类药物和曲妥珠单抗的心脏毒性,但目前相关的临床研究很少[3-5]。本研究旨在探寻SGLT-2i是否能减少乳腺癌合并2型糖尿病患者化疗中的心脏毒性,同时不降低化疗的药效,以期此类患者能更平缓地度过化疗期,并减少心血管不良反应,增加患者无病生存期,减轻患者及社会经济负担。
1 资料与方法
1.1一般资料 回顾性收集2019年1月至2022年6月因乳腺癌就诊于重庆医科大学附属第一医院乳腺外科住院化疗的2型糖尿病患者62例。纳入标准:病理明确诊断为乳腺癌,需要进行以蒽环类药物或曲妥珠单抗为基础的化疗且既往或此次明确诊断为2型糖尿病的女性患者。排除标准:(1)年龄<18岁或>85岁;(2)孕妇及哺乳期妇女;(3)确诊时经影像学或病理学证实已出现全身转移 ;(4)化疗开始前已出现心力衰竭、冠状动脉粥样硬化等严重心血管疾病;(5)特殊类型糖尿病;(6)严重肾功能不全[肾小球滤过率(eGFR)<45 mL/(min·1.73 m2)];(7)严重肝功能不全等其他严重危及生命的情况。
1.2方法 根据降糖方案的不同,将患者分为SGLT-2i组(17例)和其他降糖药物组(45例)。为探讨SGLT-2i对蒽环类药物或曲妥珠单抗化疗后患者的心脏结构和功能及电生理的影响,次要目标是评估SGLT-2i对肿瘤疗效、化疗后血糖和eGFR的影响。通过医院信息系统收集以下资料:(1)研究对象均化疗前实现全面的体格检查、心脏及乳腺外科专科检查,记录包括年龄、身高、体重、血压、血糖、血脂、血常规、肝肾功能、心电图、超声心动图、乳腺超声/CT/磁共振成像(MRI)、淋巴结转移情况等基本资料。(2)记录化疗前后PR间期、QTc间期的变化来评估心电功能;(3)记录化疗前后超声心动图参数的变化来评估心脏功能,包括左室射血分数(LVEF)、左房前后径(LAD)、左室舒张末内径(LVEDD)、室间隔舒张末厚度(IVSd)和左室后壁舒张末厚度(LVPWd);(4)记录化疗前后乳腺超声/CT/MRI的变化,按WHO标准[6]对化疗效果进行临床评估:①完全缓解(CR):肿瘤完全消失;②部分缓解(PR):肿瘤缩小>50%;③稳定疾病(SD):肿瘤缩小<50%,或增大<25%;④进展性疾病(PD):肿瘤增大>25%或出现新病灶。疗效良好被定义为CR或PR,疗效欠佳被定义为SD或PD;(5)记录化疗前后的空腹血糖评估药物的降糖效果;(6)记录患者的年龄、种族和化疗前后血肌酐水平变化,通过慢性肾脏病流行研究方程(CKD-EPI)公式计算eGFR评估患者的肾脏功能;(7)记录入选患者的身高与体重,计算体重指数(BMI):BMI=体重(kg)/身高(m2)。

2 结 果
2.1两组基线临床资料比较 62名女性乳腺癌合并T2DM患者最终被纳入本研究,其中SGLT-2i组17例(27.4%),其他降糖药物组45例(72.6%)。两组患者的基线临床资料见表1。

表1 两组基线资料比较
2.2SGLT-2i对化疗后心脏结构、功能及电生理的影响 采用协方差分析或广义估计方程对结局指标进行统计学分析,以年龄、BMI或基线参数水平作为协变量,以降糖方案作为自变量(赋值:SGLT-2i=1,其他降糖药物=2),SGLT-2i组化疗后PR间期较其他降糖药物组更短[MD=-10.58,95%CI(-21.03,-0.14),P=0.047],两组LVEF、LVEDD、LAD、IVSd、LVPWd比较,差异均无统计学意义(P>0.05)。见表2。
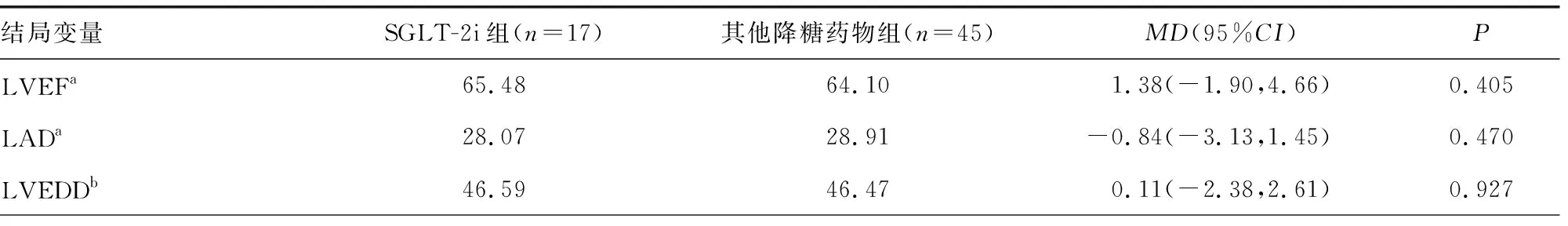
表2 SGLT2-i对化疗后心脏结构、功能及电生理的影响
2.3SLGT-2i对化疗疗效、血糖及eGFR的影响 SGLT-2i对蒽环类药物或曲妥珠单抗的疗效无显著影响;在降糖效果方面,SGLT-2i与其他降糖药物相当。在不良反应方面,SGLT-2i未导致额外的肾功能损伤。见表3。

表3 SLGT-2i对化疗效果、血糖及eGFR的影响
3 讨 论
目前,国内外针对SGLT-2i治疗肿瘤心脏毒性的临床研究很少。本研究是一项单中心、回顾性队列研究,评估了SGLT-2i对乳腺癌合并糖尿病患者化疗后心脏毒性的影响。本研究主要发现包括:(1)SGLT-2i对LVEDD、LVSd、LVPWd、LAD均无显著影响;(2)SGLT-2i对乳腺癌患者化疗后LVEF无改善作用;(3)SGLT-2i使乳腺癌患者化疗后PR延长减少,但对QTc间期无显著影响;(4)SGLT-2i对化疗效果、肾功能无显著影响,降糖效果和其他降糖药物相当。
SGLT-2i作为新一代口服降糖药物的代表,在降低血糖的同时还具有额外的心血管效益。研究表明,SGLT-2i对处于不同临床阶段HF患者的心脏结构和功能都有不同程度的改善作用[7]。最近,一篇关于SGLT-2i对心脏结构和功能影响的meta分析表明,SGLT-2i改善了射血分数减少的心力衰竭(HFrEF)患者的LVEF(3.16%,95%CI0.11%~6.22%,P=0.04,I2=0%),对射血分数保留的心力衰竭(HFpEF)患者和A、B期HF患者的LVEF无改善作用[8]。但在各HF亚组中,均可观察到舒张功能的改善。在对心脏结构的影响方面,得出了与PATOULIAS等[9]相同的结论,SGLT-2i治疗使左心室质量显著降低了3.04 g(MD=-3.04,95%CI-5.14~-0.14,I2=0%),但并未发现SGLT-2i对左心室容积有显著的改善作用。上述结论表明,SGLT-2i主要通过改善心室肥厚和舒张功能,而对心腔重塑影响不大。
本研究发现,对于化疗后乳腺癌患者,SGLT-2i治疗无改善LVEF、心腔大小(LVEDD、LVD),这与之前研究一致。然而,与之前的研究不同的是,作者并未发现SGLT-2i对心室壁(LVSd、LVPWd)结构的改善作用。这可能归因于以下两点:(1)本研究主要纳入的人群为蒽环类或曲妥珠单抗化疗后的女性乳腺癌患者,大部分患者以药物心脏毒性为唯一的心血管危险因素,只有约34%的患者合并高血压病史,而化疗药物主要导致心脏收缩功能减退和心室腔扩大[10]。在之前的2项研究中,研究人群为HF患者或冠心病患者,大部分合并有高血压病史。其中EMPA-HEART CardioLink-6试验[11]约为90%、DAPA-LVH试验[12]约为77.3%,心脏结构的改变以心室壁的肥厚为主。(2)在肿瘤心脏毒性早期,主要表现为心肌损伤,心脏收缩功能的下降,心脏结构的改变通常在中晚期出现[13]。
除了对心脏结构和功能的直接影响外,肿瘤治疗也可以导致心脏电生理紊乱和随后的心律失常[14]。但到目前为止,很少有研究探索肿瘤心电毒性的早期识别、预防和治疗。近年来,多项临床研究发现SGLT-2i能降低T2DM和HF患者心律失常(主要是心房颤动)和心源性猝死的发生率[15-16]。既往研究表明,PR间期延长与心房颤动、HFrEF和死亡风险的增加有关[17-18]。作者评估了SGLT-2i对肿瘤心电毒性的影响,发现了SGLT-2i能减少化疗后PR间期的延长(MD为-10.58 ms)。但其对化疗后PR间期延长的这种小量的抑制作用能否转化为临床效益仍需进一步探索。此外,作者并未发现SGLT-2i对化疗后QTc间期有显著影响。
本研究存在一定的局限性:首先,本研究数据样本量偏小;其次,本研究只评估了SGLT-2i对化疗结束后单个时间点心脏毒性的影响,无法明确SGLT-2i对使用蒽环类或曲妥珠单抗化疗的患者长期预后的影响;最后,本研究并未对化疗方案和是否合并高血压进行分层,因此无法分析不同化疗方案和心血管风险对SGLT-2i疗效的影响。由此,仍需要进一步的研究来明确SGLT-2i在肿瘤心脏毒性一级预防中的作用。
综上所述,SGLT-2i不影响蒽环类药物或曲妥珠单抗对乳腺癌患者的疗效,可以减少化疗后PR间期的延长,但对化疗后心脏功能和结构的影响仍需进一步探索。
