川芎-丹参配伍治疗脊髓损伤的网络药理学研究与验证
2024-01-08裴珍珍邓博文蒋昇源白惠中左心玮穆晓红
刘 港 裴珍珍 邓博文 蒋昇源 马 超 白惠中 左心玮 徐 林 穆晓红
(1 北京中医药大学,北京,100029; 2 北京中医药大学东直门医院,北京,100010)
脊髓损伤(Spinal Cord Injury,SCI)是指直接或者间接暴力造成脊髓组织损害,主要表现为损伤节段以下肢体严重功能障碍[1]。全球每年SCI人数25万~50万[2]。目前,我国SCI患者人数超过200万,其发病率也伴随交通意外、建筑事故频发而快速上升[3]。SCI有效治疗手段较少,是21世纪医学领域面临的重大难题。
原发性损伤和继发性损伤是SCI的2个阶段[4]。原发性损伤包括神经实质及轴突网络的破坏以各类细胞的机械性损伤。原发性损伤后继发的组织级联反应称为继发性损伤,炎症反应、氧化应激反应、微循环障碍、离子失衡、细胞凋亡和胶质瘢痕形成及过度增生等是该阶段主要病理[5]。SCI作用机制复杂,长期以来,人们针对SCI不同机制分别进行了探索,但进展缓慢。目前,现代医学对于SCI治疗手段主要包括手术减压及激素冲击疗法,虽能取得一定效果,但效果并不理想[2]。中医药在SCI后神经微环境调控方面具有独特优势[6],但仍需要更多研究进一步阐明其作用机制。
中医认为督脉受损,气滞血瘀为SCI病机,活血祛瘀、通达气血、温通督脉为治则,处方以通络活血、行气化瘀药物为主。回顾文献[7-9]发现,川芎、丹参为活血化瘀药物代表药,在治疗SCI时常被配伍使用。川芎为“血中之气药”,上可至巅顶,下可达血海;丹参具有较强的活血作用,在血瘀类疾病中,常配伍使用。在补阳还五汤、脊髓康、川芎丹参汤等方中,二者均相须为用,共奏行气活血之功。本研究采用网络药理学方法,挖掘川芎-丹参治疗SCI的有效成分,预测核心靶点及通路,并对部分网络药理学结果进行实验验证,以期为后续基础研究及临床应用提供证据支持。
1 材料与方法
1.1 材料
1.1.1 动物 健康无特定病原体(Specific Pathogen Free,SPF)级8周龄雌性斯泼累格·多雷(Sprague Dawley,SD)大鼠30只,体质量220~240 g,购于北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK(京)2021-0011。于北京中医药大学的SPF级动物饲养中心饲养,温度22 ℃,湿度40%~50%,12 h光暗交替循环,标准饲料饮食,活动无限制。实验方案经由北京中医药大学动物实验伦理委员会批准(伦理审批号:BUCM-2022042104-2098)。
1.1.2 药物 川芎、丹参均购自北京中医药大学东直门医院,根据临床剂量和药物动物剂量换算[10],并参考文献[11],给药剂量分为3个梯度,分别为川芎-丹参高剂量(8.100 g/kg),川芎-丹参中剂量(4.050 g/kg),川芎-丹参低剂量(2.025 g/kg)。
1.1.3 试剂与仪器 酶联免疫吸附试验(Enzyme-Linked Immunosorbent Assay,ELISA)试剂盒(北京索莱宝科技有限公司,货号:SEKR-0017);小鼠抗鼠单克隆磷脂酰肌醇3激酶(Phosohoinositide 3 Kinase,PI3K)抗体(武汉三鹰生物技术有限公司,货号:60225-1-Ig);兔抗鼠多克隆p-PI3K抗体(英国Abcam公司,货号:ab182651);小鼠抗鼠单克隆p-蛋白激酶B(Protein Kinase B,AKT)抗体(武汉三鹰生物技术有限公司,货号:66444-1-Ig);兔抗鼠多克隆AKT抗体(武汉三鹰生物技术有限公司,货号:10176-2-AP);GAPDH(北京索莱宝科技有限公司,货号:P02436);ECL发光液(Perkin Elmer公司,美国,货号:NEL111001);聚偏二氟乙烯(Polyvinylidenefluoride,PVDF)膜(北京索莱宝科技有限公司,货号:YA1701);酶标仪(无锡华卫德朗仪器有限公司,型号:DR-200BS);稳压稳流电泳仪(Bio-rad公司,美国,型号:Powerpac HQ);计算机图像分析仪(Media Cybernetics公司,美国,型号:Image-Pro Plus Analysis Soft ware)。
1.2 方法
1.2.1 网络药理学预测
1.2.1.1 检索及筛选川芎-丹参药物主要活性成分 使用中药系统药理学数据库与分析平台(https://tcmsp-e.com/)、中国科学院有机化学研究所化学专业数据库(http://www.organchem.csdb.cn.[1978-2019])、化源网(https://www.chemsrc.com/),检索川芎、丹参两味药物的活性成分,并利用Pub-Chem数据库(https://pubchem.ncbi.nlm.nih.gov/)查找收集得到的药物活性成分的化学结构式(2D结构或smiles号),在Swissh(http://www.swissadme.ch/)平台上传化学结构式,利用ADME(Absorption、Distribution、Metabolism and Excretion)进行筛选,GI absorption为High;Druglikeness中Lipinski、Ghose、Veber、Egan、Muegge满足≥3个yes的活性成分纳入。其他重要活性成分通过文献检索方式补充。
1.2.1.2 预测川芎-丹参药物活性成分作用靶点 利用Swiss Target Prediction平台(http://www.swisstargetprediction.ch),预测ADME筛选后所得活性成分的作用靶点,设置物种为“Homo sapiens”,选取Probability>0的靶基因。
1.2.1.3 获取SCI疾病基因 以“Spinal cord injury”和“Spinal Cord Traumas”为关键词,在GeneCards(http://www.genecards.org/)和OMIM(http://omim.org/)数据库中查找SCI疾病基因。GeneCards数据库中,Relevance score大于中位数的靶点被选为疾病对应的基因。
1.2.1.4 构建川芎-丹参活性成分-SCI相关靶点网络 利用在线绘图工具imageGP(http://www.ehbio.com/Cloud_Platform/front/)绘制川芎-丹参药物成分和SCI对应靶点的韦恩图。后借助Cytoscape(3.8.2)软件构建“川芎-丹参活性成分-交集靶点”网络图,中药活性成分的重要性通过节点度值大小评估。
1.2.1.5 蛋白质-蛋白质相互作用(Protein-protein Interaction,PPI)网络的构建 在String(https://www.string-db.org/)平台中导入获得的交集靶点,定义最高置信度0.900,分析蛋白间作用,后使用Cytoscape软件,导入分析结果,优化图像。借助CytoNCA插件对PPI网络数据进行拓扑属性分析,筛选出核心靶点网络。
1.2.1.6 生物富集分析 为了进一步了解所筛选出的靶标蛋白的功能及其在相关通路中的作用,将川芎-丹参和SCI的交集基因导入Metascape数据库(https://metascape.org/)中,物种限定为人类,阈值设定为P<0.01,在数据库自我检索和转化操作后,进行基因本体(Gene Ontology,GO)富集分析和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析,P值≤0.01的数据和KEGG通路被认为是与本病的相关性最强,使用imageGP做出可视化结果。
1.2.2 实验验证
1.2.2.1 分组与模型制备 30只大鼠随机分为假手术组、模型组、川芎-丹参高剂量组、川芎-丹参中剂量组、川芎-丹参低剂量组,每组6只。造模前,各组大鼠禁食水12 h,腹腔注射戊巴比妥钠麻醉(3%,1.5 mL/kg)。除假手术组外,其余各组采用改良Allen重物打击法制备SCI模型[12]。大鼠取俯卧位,于背部以胸10椎体为中心,纵向切开皮肤,逐层分离筋膜、肌肉等组织,充分胸10段脊髓。随后使用脊髓打击器完成打击,高25 cm,重量10 g。逐层缝合切口。完成打击后,局部脊髓表面迅速出现瘀紫色,并伴有强烈尾部摆动,术后双下肢完全瘫痪,认定为造模成功。假手术组暴露脊髓后即逐层缝合切口,不进行打击。模型构建完成后,每日2次人工排尿,直至大鼠恢复自主排尿。
1.2.2.2 给药方法 川芎-丹参各组按照1.1.2剂量灌胃给药,假手术组给予等量生理盐水,持续28 d。
1.2.2.3 检测指标与方法 1)ELISA检测大鼠脊髓组织活性氧(Reactive Oxygen Species,ROS)、丙二醛(Malondialdehyde,MDA)水平,干预28 d后,取各组大鼠脊髓50 mg。采用ELISA试剂盒检测ROS、MDA含量,检测均按照试剂盒说明严格操作。2)蛋白质印迹法检测大鼠脊髓组PI3K、p-PI3K、AKT、p-AKT蛋白表达水平,干预28 d后,取各组大鼠脊髓50 mg,冰上研磨呈粉末状,加入裂解液后离心。蛋白样品转移至PVDF膜,加入5%脱脂奶粉,封闭样品2 h。分别加入一抗PI3K(1∶2 000)、p-PI3K(1∶1 000)、AKT(1∶3 000)、p-AKT(1∶1 000)、GAPDH(1∶5 000),4 ℃孵育过夜,加入二抗室温孵育1 h,使用ECL液显色。ImageJ软件观察条带灰度值并计算。

2 结果
2.1 川芎-丹参活性成分及靶点 共收集到川芎-丹参的154个活性成分,其中,川芎84个,丹参74个。4个成分为川芎、丹参中药所共有。预测154个成分靶点,将重复靶点删除,最终得到903个靶点,其中川芎645个,丹参788个,530个靶点为二者共有。
2.2 SCI基因 共得到3 446个与SCI相关的基因。
2.3 川芎-丹参活性成分-SCI相关靶点网络构建 共得到484个川芎-丹参活性成分与SCI的共同靶点。见图1。“药物主要活性成分-交集靶点”关系网络见图2。反映川芎-丹参154种成分与484个交集靶点之间的潜在作用。

图1 川芎-丹参与SCI的韦恩图
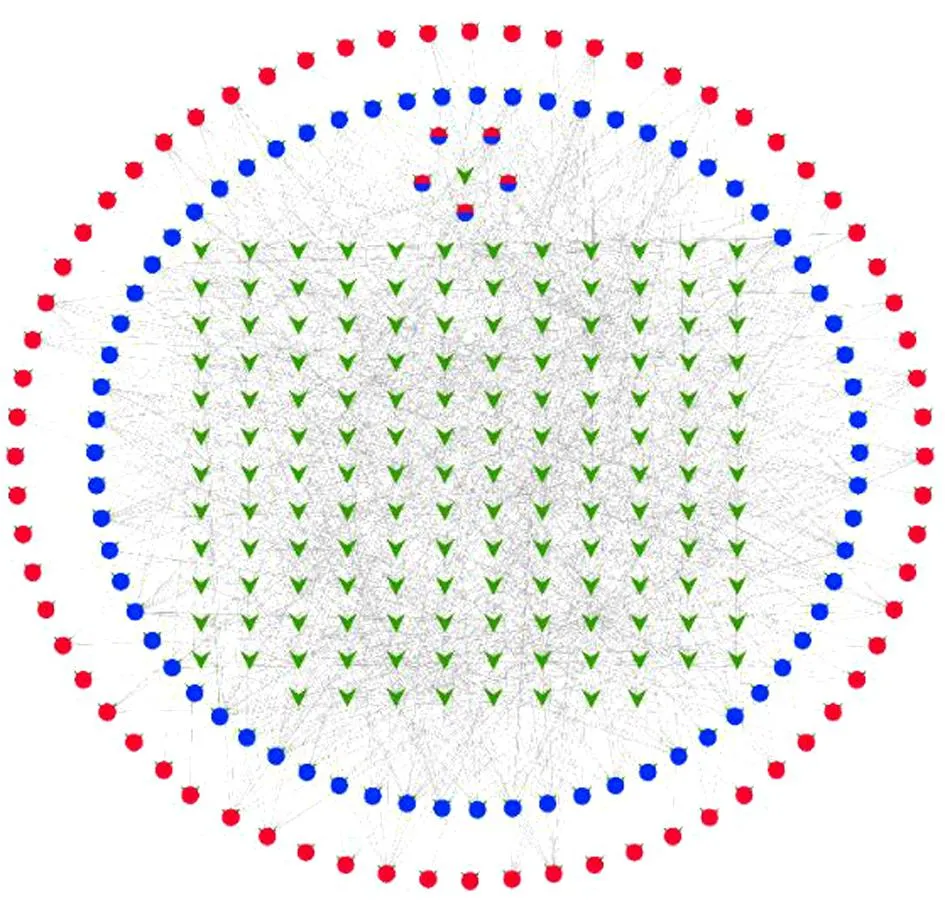
图2 药物主要活性成分-交集靶点网络
2.4 PPI网络 共发现关键靶点34个。根据Degree值排列,表1列出前8个关键节点,包括淀粉样前体蛋白、磷脂酰肌醇3激酶、促分裂原活化的蛋白

表1 川芎-丹参治疗SCI的核心靶点
激酶1、丝/苏氨酸蛋白激酶1、促分裂原活化的蛋白激酶3、信号转导及转录激活子3、缓激肽受体B2、细胞外钙敏感受体。关键靶点相互作用关系见图3。

图3 川芎-丹参治疗SCI关键靶点网络
2.5 GO功能富集分析结果 共得到447个GO功能富集分析条目(P<0.01),其中生物过程(Biologi-cal Process,BP)条目247个,细胞组分(Cellular Component,CC)条目94个,分子功能(Molecular Function,MF)条目106个。BP包括对有机氮化合物的细胞反应、激酶活性的正向调节、炎症反应等。CC包括神经元胞体、轴突等。MF包括神经递质受体活性、蛋白激酶活性等。各组前12个条目见图4。

图4 川芎-丹参治疗SCI的关键靶点的GO功能富集分析
2.6 KEGG通路分析结果 KEGG通路富集筛选得到126条信号通路(P<0.01),涉及PI3K/AKT、cAMP、Apoptosis、MAPK等信号通路等,这意味着川芎-丹参可通过调控上述信号通路达到促SCI后神经修复的效果。前20条通路构建可视化见图5。药物-疾病-核心交集靶点-通路网络图见图6。

图5 川芎-丹参治疗SCI关键靶点的KEGG通路富集分析
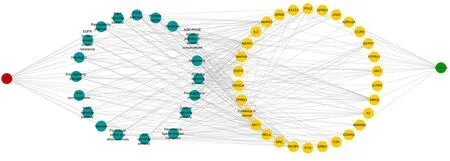
图6 药物-疾病-核心交集靶点-通路网络
2.7 川芎-丹参对SCI大鼠脊髓组织ROS、MDA水平的影响 与假手术组比较,模型组大鼠脊髓ROS及MDA表达升高(P<0.01);与模型组比较,川芎-丹参各剂量组ROS均降低(P<0.01);川芎-丹参高、中剂量组MDA均降低(P<0.01);其中川芎-丹参高剂量组差异最为显著。见表2。

表2 川芎-丹参对SCI大鼠脊髓组织ROS、 MDA表达的影响
2.8 川芎-丹参对SCI大鼠脊髓组织PI3K、p-PI3K、AKT、p-AKT蛋白表达的影响 PI3K及AKT蛋白表达组间差异均无统计学意义(均P>0.05);与假手术组比较,模型组大鼠脊髓p-PI3K、p-AKT显著降低(P<0.01);与模型组比较,川芎-丹参各剂量组p-PI3K、p-AKT均升高(P<0.01);其中川芎-丹参高剂量组差异最为显著。见表3,图7。

表3 川芎-丹参对SCI大鼠脊髓组织PI3K、p-PI3K、AKT、p-AKT蛋白表达的影响

图7 各组大鼠脊髓组织PI3K、p-PI3K、AKT、p-AKT蛋白表达电泳条带
3 讨论
《灵枢经·寒热病》曰:“身有所伤,血出多,及中风寒,若有所堕坠,四支懈惰不收,名曰体惰。”中医理论认为SCI当属于“体惰”和“痿证”范畴。SCI血络受损,血不循经而溢出脉外,离经之血成为瘀血。在此病理状态下,阳气不能交会于四肢,而且气血不能输布四肢以濡养筋脉,从而导致四肢麻木,痿软无力甚至截瘫。“气滞血瘀”是SCI的主要病机,“行气活血”是其主要治则。川芎被称为血中之气药,走行力强。其有效成分川芎嗪可改善SCI继发的微循环障碍,抑制炎症反应以及神经细胞凋亡等[13-15]。丹参具有活血祛瘀,凉血消痈的功效,也是活血化瘀的重点药物,PI3K/AKT、缺氧诱导因子1-α(Hypoxia Inducible Factor-1,HIF-α)/血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)、细胞因子信号传送阻抑物3(Suppressor of Cytokine Signaling 3,SOCS3)/STAT3等多条通路可被丹参有效活性成分丹参酮ⅡA激活[16-18],进而抑制炎症反应、细胞凋亡等,改善微循环障碍。川芎、丹参临床治疗SCI时常相须为用,共同发挥活血化瘀之功,探究二者配伍后作用靶点、调控机制,将为SCI治疗提供新的治疗思路及实验数据支持。本研究通过网络药理学数据分析,川芎-丹参治疗SCI具有相关作用靶点484个。通过PPI网络图发现,各靶点间存在大量交互关系,APP、PI3K、MAPK1/3、AKT1是最重要靶点蛋白。淀粉样前体蛋白(Amyloid Precursor Protein,APP)是一种膜内在蛋白,广泛存在神经元的突触中,其可被β淀粉样前体蛋白切割酶1(Beta-site Amyloid Precursor Protein Cleaving Enzyme 1,BACEL)和γ分泌酶分解产生β淀粉样蛋白(Amyloid β,Aβ)[19]。研究表明SCI小鼠损伤早期APP、BACE1和γ-分泌酶和Aβ的水平明显增加[20],进一步对SCI小鼠应用DAPT(γ-分泌酶抑制剂)发现,Aβ形成显著减少,进而影响SCI小鼠运动功能恢复。MAPK1、MAPK3在MAPK信号转导中扮演了重要角色,可使丝氨酸、苏氨酸和络氨酸去磷酸化,抑制AMPK激活[21]。抑制SCI小鼠MAPK1/MAPK3表达后,可抑制炎症通路激活、减轻炎症反应以及神经细胞凋亡[22]。AKT1是PI3K下游主要的效应物,参与调控PI3K/AKT[23]。研究发现,促进AKT激活,可提高抗凋亡蛋白表达,抑制促凋亡蛋白表达,减少SCI后神经细胞凋亡[24-25]。
对关键靶点进行GO富集分析,发现川芎-丹参治疗SCI主要涉及细胞对氮化合物的反应、激酶活性调节、离子平衡、对创伤的反应、炎症反应、跨突触信号等生物学过程。涉及蛋白激酶活性、磷酸转移酶活性、激酶结合等分子功能;涉及膜阀、受体复合物、树突、轴突等细胞组分。通过KEGG富集分析,筛选得到了126条通路,在查阅相关资料和阅读文献后,发现PI3K/AKT、cAMP、MAPK等通路在川芎-丹参治疗SCI中发挥着关键作用。PI3K/AKT信号通路参与细胞凋亡、自噬及增殖等多个表型。该通路激活后,磷酸肌醇三磷酸可被p-PI3K催化,进而作用于AKT并使其活化[23]。环磷酸腺苷(Cyclic Adenosine Monophosphate,cAMP)广泛存在于中枢神经系统中,cAMP表达抑制可减少脊髓断端轴突增长[26]。使用cAMP衍生物可以促使SCI大鼠神经干细胞分化和神经细胞增殖,这些对神经恢复尤为关键[27-28]。MAPK信号通路是指以MAPK为代表的信号转导通路,MAPK通过逐级磷酸化,进入细胞核,调控细胞炎症、增殖、凋亡等过程[29]。该通路包括细胞外调节蛋白激酶(Extracellular Regulated Protein Kinases,ERK1/2)、c-Jun氨基末端激酶(c-Jun N-terminal Kinase,JNK)和p38MAPK3条信号通路。研究发现,抑制SCI小鼠组JNK通路,可促进小鼠行为学改善,这可能与JNK通路抑制剂下调凋亡相关基因表达、阻止受损神经元异常活跃相关[30-31]。QIAN等[32]发现抑制p38MAPK信号通路,能够抑制氧化应激反应、炎症反应及减少细胞凋亡,减少继发性损伤阶段胶质瘢痕增生及增加神经营养因子表达。
本研究进一步探究PI3K/AKT信号通路发现,SCI发生后,PI3K/AKT信号通路被抑制,而川芎-丹参能激活该通路。PI3K/AKT信号通路是与SCI病理过程密切相关的重要通路,激活该通路可以通过减少细胞凋亡、减轻炎症反应和防止胶质瘢痕形成来促进脊髓损伤后神经功能的恢复[32]。该通路与氧化应激反应也具有密切的关系。氧化应激是指机体氧化系统与抗氧化系统失衡,ROS过度累积的一种代谢状态。过量产生的ROS激发链式脂质过氧化反应,加重炎症反应,加快细胞凋亡[33]。PI3K/AKT信号通路能通过调节过氧化物酶体增殖物激活受体α等调控脂质过氧化反应[34]。实验结果发现,SCI发生后,ROS及MDA表达水平显著增加,而川芎-丹参能减低ROS及MDA表达水平,表明其在一定程度上能改善氧化应激反应,减轻脊髓继发性损伤,这可能与其调控PI3K/AKT信号通路相关。
综上所述,川芎-丹参配伍治疗SCI具有多靶点、多途径的优势,可能是通过激活PI3K/AKT信号通路,进而抑制氧化应激反应,减轻脊髓继发性损伤。本研究为进一步探究川芎-丹参配伍治疗SCI提供了一定的药理学基础。但本研究只对部分网络药理学结果进行验证,其作用机制仍有待进一步探究。
利益冲突声明:无。
