宫颈病变中转录因子NF-κB 家族P50、IκB-α 表达与HPV16 阳性宫颈癌的关系分析
2024-01-08李铃铃尹翼何爱琴
李铃铃,尹翼,何爱琴
宫颈癌为女性生殖系统中常见的恶性肿瘤,在女性恶性肿瘤发病率中占第2 位[1-2]。高危型人乳头瘤病毒(human papilloma virus, HPV)作为最主要的致癌因子,可直接参与宫颈癌的发生发展,其中约70%的宫颈癌与高危型HPV16 感染有关[3]。目前高危型HPV16 如何诱导正常宫颈上皮细胞发生恶性转化,病毒癌蛋白在HPV 感染早、晚期通过调控何种细胞信号通路发挥致癌作用等问题尚不清楚,亟需进行研究。核因子-κB(nuclear factor κB,NF-κB)P50、NF-κB 抑制蛋白-α(inhibitory nuclear factor-κB-α, IκB-α)参与肺癌等多种恶性肿瘤的发生发展[4-7],但NF-κB P50、IκB-α 表达与HPV16 阳性宫颈癌的关系目前尚不清楚。鉴于此,本研究分析NF-κB P50、IκB-α 表达及两者与HPV16 阳性宫颈癌预后的关系,旨在为临床治疗及改善宫颈癌患者的预后提供参考。
1 对象与方法
1.1 研究对象 收集南通大学附属肿瘤医院2017 年3 月至2019 年2 月收治的106 例HPV16阳性宫颈癌、52 例高级别鳞状上皮内瘤变(highgrade squamous intraepithelial lesion, HSIL)、43 例低级别鳞状上皮内瘤变(low-grade squamous intraepithelial lesion, LSIL)患者的宫颈组织标本及同期行全子宫切除术(因子宫腺肌症)的80 例患者正常宫颈 组 织 标 本。患 者 年 龄21~62 岁[(46.85 ±10.42)岁]。本研究患者及其家属均知情同意,并经本院医学伦理委员会审批。
纳入标准:病理类型经病理科证实者;年龄>18 岁;术前未接受任何形式的治疗;临床资料完整。排除标准:伴有其他部位恶性肿瘤或阴道炎;注射过HPV 疫苗;重要脏器严重功能障碍;伴有免疫缺陷性疾病;伴有传染性疾病或性病者;哺乳期或妊娠期女性。
1.2 NF-κB P50、IκB-α 表达检测方法 采取免疫组化法检测宫颈癌组织、LSIL 组织、HSIL 组织、正常宫颈组织中NF-κB P50、IκB-α 表达情况。标本采用石蜡包埋、切片,灭活、微波抗原修复、洗涤,添加鼠抗人NF-κB P50 单克隆抗体、IκB-α 抗体(北京博奥森公司),于4 ℃孵育过夜;随后,采用磷酸盐缓冲溶液冲洗,滴二氨基联苯胺显色液显色,采用苏木精复染,脱水,封片。NF-κB P50、IκB-α 以细胞核、细胞质染为黄色或棕黄色记为阳性表达,否则记为阴性表达。
1.3 预后随访 通过门诊、电话等多种方式进行随访,随访截止时间为2022 年3 月,每3 个月随访1 次,以研究对象失访、死亡或随访时间截止为终点事件。
1.4 临床资料收集 收集影响HPV16 阳性宫颈癌患者预后的有关资料,主要包括年龄、体重指数(body mass index, BMI)、肿瘤最大径、是否合并基础疾病(糖尿病、高血压、高脂血症)、临床分期、淋巴结转移、分化程度、宫旁浸润、脉管侵犯、术后治疗(放疗、化疗)、宫颈癌组织中NF-κB P50 及IκB-α表达情况。
1.5 统计学处理 采用SPSS 18.0 统计软件处理所得数据。计量资料以xˉ± s 表示,采用t检验;计数资料以例数和百分比(%)表示,采用χ2检验,多组间计数资料两两比较需调整检验标准,即α'=α/k×(k-1)/2,其中α=0.05,k是组数;绘制受试者工作特征(receiver operating characteristics, ROC)曲线;采用Cox 回归模型分析影响因素。P<0.05 表示差异有统计学意义。
2 结果
2.1 NF-κB P50、IκB-α 在不同宫颈组织中的表达情况比较 正常宫颈组织、LSIL 组织、HSIL 组织、宫颈癌组织中NF-κB P50 阳性表达率、IκB-α 阴性表达率比较,差异有统计学意义(P<0.01);NF-κB P50 阳性表达率、κBα 阴性表达率表现为宫颈癌组织>HSIL 组织>LSIL 组织>正常宫颈组织(P<0.01)。见表1。
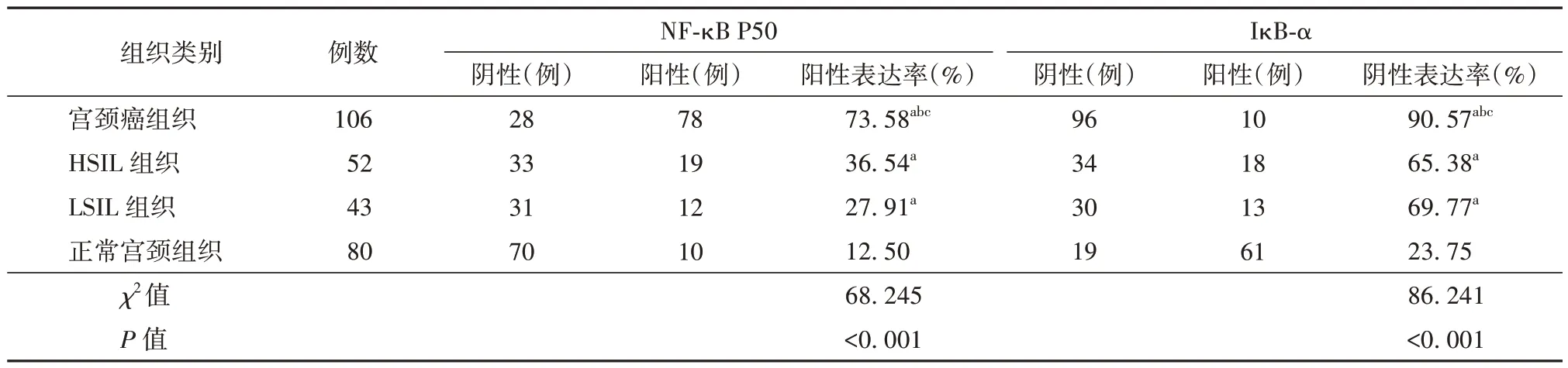
表1 NF-κB P50、IκB-α 在不同宫颈组织中的表达情况
2.2 NF-κB P50、IκB-α 表达与宫颈癌患者病理特征的关系 不同年龄、BMI、病理类型、宫旁浸润的HPV16 阳性宫颈癌患者癌组织中NF-κB P50 阳性表达率、IκB-α 阴性表达率比较,差异无统计学意义(P>0.05);肿瘤最大径≥4 cm、临床分期Ⅲ/Ⅳ期、有淋巴结转移、低分化、脉管侵犯的HPV16 阳性宫颈癌患者癌组织中NF-κB P50 阳性表达率、IκB-α 阴性表达率高于肿瘤最大径<4 cm、临床分期Ⅰ/Ⅱ期、无淋巴结转移、中/高分化、无脉管侵犯的HPV 阳性宫颈癌患者,差异有统计学意义(P<0.05)。见表2。

表2 NF-κB P50、IκB-α 表达与宫颈癌患者病理特征的关系[例(%)]
2.3 影响HPV16 阳性宫颈癌患者预后的多因素分析 106 例HPV16 阳性宫颈癌患者术后随访3 年,共失访3 例,剩余103 例患者中22 例死亡,存活率为78.64%(81/103);Cox 回归分析显示,临床分期(OR=2.546,95%CI:1.054~3.672)、淋巴结转移(OR=2.734,95%CI:1.469~4.183)、分化程度(OR=3.257,95%CI:2.015~6.432)、NF-κB P50 阳性表达(OR=4.025,95%CI:2.765~8.436)、IκB-α 阴性表 达(OR=4.368,95%CI:3.104~10.254)均 是HPV16 阳性宫颈癌患者预后的独立影响因素(P<0.05)。见表3。

表3 影响HPV16 阳性宫颈癌患者预后的单因素、多因素分析
2.4 NF-κB P50、IκB-α 表达与HPV16 阳性宫颈癌患者预后的关系 截至随访结束,NF-κB P50 阳性患者失访2 例,剩余76 例,其中死亡20 例,总存活率为73.68%(56/76);NF-κB P50 阴性患者失访1 例,剩余27 例,其中死亡2 例,总存活率为92.59%(25/27)。NF-κB P50 阳性表达患者与NFκB P50 阴性表达患者生存曲线比较,差异有统计学意义(χ2=4.098,P=0.043)。见图1。

图1 HPV16 阳性宫颈癌组织NF-κB P50 阳性表达、NF-κB P50 阴性表达患者生存曲线
截至随访结束,宫颈癌患者中IκB-α 阳性患者无失访,无死亡,总存活率为100.00%(10/10);IκBα 阴性患者失访3 例,剩余93 例,其中死亡22 例,总存活率为76.34%(71/93)。IκB-α 阳性表达患者与IκB-α 阴性表达患者生存曲线比较,差异有统计学意义(χ2=3.783,P=0.048)。见图2。

图2 HPV16 阳性宫颈癌组织IκB-α 阳性表达、IκB-α 阴性表达患者生存曲线
3 讨论
宫颈癌的发病机制目前尚不清楚,可能与遗传、过早性生活等因素有关[8-10]。HPV 是一种具有高度特异性的嗜上皮性病毒,其中高危型HPV16 持续感染的宫颈病变进展为宫颈癌的概率大幅增加[11]。在宫颈癌变发展期间及时筛查、准确诊断并给予对症治疗对降低宫颈癌发生率、死亡率意义重大。对NF-κB P50、IκB-α 与HPV16 阳性宫颈癌的关系进行探讨,具有十分重要的临床意义。
本研究结果显示,NF-κB P50 阳性表达率、IκB-α阴性表达率表现为宫颈癌组织>HSIL 组织>LSIL 组织>正常宫颈组织。提示NF-κB P50 在宫颈病变组织中异常高表达,且随着宫颈病变的严重程度增加,NF-κB P50 表达水平呈升高趋势;IκB-α 在宫颈病变组织中异常低表达,且随着宫颈病变的严重程度增加,IκB-α 表达水平呈下降趋势。目前已有多项研究证实,慢性炎症与肿瘤的发生发展密切相关[12-14];NF-κB 家族为炎症通路中的关键成员之一,其在介导免疫应答、调节天然免疫系统功能方面发挥着重要作用。其中NF-κB P50 为其家族的主要成员之一,可与其他家族成员互相聚合为同源、异源二聚体,在上游激活信号的作用下由细胞质转移至细胞核,进而发挥促细胞增殖、迁移及血管生成等作用[15]。IκB-α 为NF-κB 的抑制蛋白,在细胞质内,IκB-α 与NF-κB 相结合,并通过IκB-α 锚蛋白与位于NF-κB 上的核定位信号结合,遮蔽核定位信号使NF-κB 滞留于细胞质内呈失活状态,进而参与肿瘤的发生[16]。本研究结果表明,肿瘤最大径≥4 cm、临床分期Ⅲ/Ⅳ期、有淋巴结转移、低分化、脉管侵犯的HPV16 阳性宫颈癌患者癌组织中NF-κB P50 阳性表达率、IκB-α 阴性表达率高于肿瘤最大径<4 cm、临床分期Ⅰ/Ⅱ期、无淋巴结转移、中/高分化、无脉管侵犯的HPV16 阳性宫颈癌患者。提示NF-κB P50、IκB-α 表达与HPV16 阳性宫颈癌临床病理特征存在一定的相关性。本研究中,Cox 回归分析显示,临床分期、淋巴结转移、分化程度、NF-κB P50阳性表达、IκB-α 阴性表达均是HPV16 阳性宫颈癌患者预后的独立影响因素。NF-κB P50 在正常宫颈组织中的表达水平较低,当HPV16 感染宿主细胞,病毒蛋白可能通过破坏NF-κB 与抑癌基因信号通路的平衡,致使炎症通路NF-κB 被异常激活,进而导致宫颈癌的发生[17];NF-κB 被激活后,NF-κB P50 与IκB-α 合成增加,并通过促进NF-κB P50 表达,增加IκB-α 蛋白降解,使IκB-α 表达降低,进而抑制NF-κB 活性,并调控肿瘤细胞增殖,促进肿瘤细胞凋亡[18]。截至随访结束,NF-κB P50 阳性、NF-κB P50 阴性的HPV16 阳性宫颈癌患者总存活率分别为73.68%、92.59%,NF-κB P50 阳性表达患者与NF-κB P50 阴性表达患者生存曲线比较,差异有统计学意义;IκB-α 阳性、IκB-α 阴性的HPV16阳性宫颈癌患者总存活率分别为100.00%、76.34%,IκB-α 阳性表达患者与IκB-α 阴性表达患者生存曲线比较,差异有统计学意义。提示NF-κBP50、IκB-α 表达与HPV16 阳性宫颈癌患者预后具有一定的相关性,检测其表达情况对HPV16 阳性宫颈癌患者预后评估具有重要参考价值。NF-κB 作为一种多向调节功能的转录因子,可以同源或异源二聚体与IκB 抑制蛋白结合,在炎症、免疫反应等方面均发挥着重要作用,同时还可调节细胞增殖基因、抗凋亡基因的表达,而且被证实与肿瘤的发生有关;NF-κB P50 作为NF-κB 家族的主要成员之一,可通过启动靶基因的转录,影响细胞增殖、凋亡,进而参与肿瘤的发生发展[19]。IκB-α 与NF-κB家族结合为复制物,抑制NF-κB 活性,并可实现NF-κB 活化、失活的循环,进而调控基因转录。Tan等[20]研究报道,NF-κB 呈非活化状态时,在外来信号的刺激下,可经特异性激酶使IκB-α 磷酸化,致使IκB-α 降解,游离二聚体移位至细胞核,并通过与靶基因启动子κB 位点结合,对靶基因的表达进行调节。
综上所述,HPV16 阳性宫颈癌患者癌组织中NF-κB P50 阳性、IκB-α 阴性表达率较高,NF-κB P50、IκB-α 表达与HPV16 阳性宫颈癌临床病理特征及预后均具有一定的相关性,对其表达情况进行检测对HPV16 阳性宫颈癌患者预后评估具有重要参考价值。
