肠道菌群失调作为始发因素参与腹泻型肠易激综合征的发生与发展分析
2024-01-08董昌昊李超王少鑫王广祥冼锐刘晓娜崔立红
董昌昊,李超,王少鑫,王广祥,冼锐,刘晓娜,崔立红
肠易激综合征(irritable bowel syndrome, IBS)是一种以腹痛、腹胀等为主要症状,且伴随排便习惯或粪便性状改变的常见的胃肠道疾病[1]。临床上按照粪便性状将IBS 分为腹泻型(IBS-D)、便秘型(IBS-C)、混合型(IBS-M)和不定型。据报道,在中国人群中IBS-D 约占IBS 总患者的66.3%,是最常见的亚型[2]。IBS-D 的病因和发病机制尚不明确,目前被认为可能与脑肠调控异常、肠道微生态失衡、肠黏膜低度炎症和精神心理等多种因素共同作用有关[3]。多个研究报道了IBS-D 患者中出现肠道菌群的变化[4-6]。然而,肠道菌群失调是IBS-D 的伴随现象还是作为IBS-D 的诱发因素尚不十分清楚。本研究拟通过粪菌移植实验,探讨肠道菌群在IBS-D 发生发展中的具体作用。
1 材料与方法
1.1 实验动物及分组 小鼠购自北京天融慧通科技有限责任公司[实验动物生产许可证号:SCXK(京)2019-0010],饲养环境温度25 ℃,湿度40%~45%。取10 只SPF 级C57BL/6J 小鼠,并随机取其中5 只采用避水应激法构建IBS-D 小鼠模型,通过检测其粪便含水量、肠道传输时间、肠道敏感性等方法验证造模是否成功,其余5 只置于相同环境中正常饲养作为健康对照小鼠。造模成功后另取10 只小鼠(SPF 级, C57BL/6J)进行粪菌移植实验。首先,按照氨苄西林1 g/L、新霉素1 g/L、甲硝唑1 g/L、万古霉素500 mg/L 的浓度配制成四联抗生素水溶液,给小鼠喂食含有上述4 种抗生素及甜味剂的水,共10 d,模拟肠内无菌条件,饮用水2 d 更换1 次。然后,将经过抗生素清扫的小鼠随机分为实验组和对照组,每组5 只。将IBS-D 小鼠和健康小鼠的粪便标本分别配制成菌群PBS 混悬液(50 mg/ml)。在抗生素清扫的第11 天,通过灌胃法分别给予实验组和对照组小鼠来源于IBS-D 和健康小鼠的菌群PBS 混悬液,200 µl/d,连续5 d。粪菌移植结束1 周后记录小鼠的肠道传输时间、肠道敏感性及粪便含水量。
1.2 实验试剂 β-actin(货号:BM0627)和HRP 标记羊抗兔二抗(货号:BA1054)购自武汉博士德生物工程有限公司。兔多抗核因子κB(nuclear factor kappa-B, NF-κB)、Toll 样受体4(toll like receptor 4,TLR4)、髓样分化因子88(myeloid differentiation factor 88, MyD88)、白细胞介素-1β(interleukin-1β, IL-1β)、白细胞介素-6(interleukin-6, IL-6)、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)购自Affinity公司。反转录试剂及实时荧光定量PCR(qRTPCR)试剂购自VAZYME 公司。
1.3 粪便含水量 采用Bristol 粪便分级量表对小鼠粪便进行分级。随后检测小鼠粪便含水量,在鼠筐底部铺上一张滤纸收集小鼠4 h 内的粪便,此过程中应时刻注意保持滤纸完整。收集的粪便首先称量湿重,记为W1,然后将粪便放入烘箱中,干燥后称量干重,记为W2。粪便含水量(%)=(W1-W2)/W1×100%。
1.4 肠道传输时间 通过灌胃法给予未禁食的小鼠6%的胭脂红溶液(溶于0.5%的甲基纤维素中)并观察传输时间。从灌胃开始到粪便中胭脂红首次出现的时间记作该小鼠的肠道运输时间。
1.5 肠道敏感性 采用结直肠扩张实验测试小鼠肠道敏感性。小鼠禁食24 h 但不禁水,测试当天用乙醚镇静小鼠,将液体石蜡油润滑后的导尿管(6 Fr)置于直肠中,使气囊末端距离肛门约2 cm 并固定。然后将小鼠放置在固定器内,待其苏醒适应30 min后分别注入0.2、0.3、0.4 和0.5 ml 空气(每个体积持续20 s,中间间隔4 min)。记录观察小鼠腹部回撤反射(abdominal withdrawal reflex, AWR)情况并进行评分。
1.6 qRT-PCR 检测 检测小鼠结肠组织中NF-κB(P65)、TLR4、MyD88、IL-Iβ、IL-6、TNF-α 的mRNA表达水平。利用Trizol 法提取总RNA,然后进行cDNA 的合成和qRT-PCR 检测。PCR 检测条件为95 ℃ 15 s、60 ℃ 60 s、95 ℃ 15 s,共40 个循环。通过2-ΔΔCt法计算mRNA 相对表达量。PCR 引物序列见表1。

表1 PCR 引物序列
1.7 蛋白质印迹法检测 检测结肠组织中NF-κB(P65)、NF-κB(P-P65)、TLR4、MyD88、IL-Iβ、IL-6、TNF-α 的表达水平。取小鼠结肠组织置于裂解液中,匀浆后取上清液。利用BCA 试剂盒测定蛋白浓度。制备SDS-PAGE 凝胶,将制备好的凝胶固定到电泳槽上,上样进行电泳。电泳完成后将凝胶转移到PVDF 膜上。用含5% 脱脂奶粉的TBST 浸泡PVDF 膜,室温摇床封闭2 h。孵化抗体,洗涤并去除多余的抗体,最后显影曝光。
1.8 统计学处理 采用SPSS 26.0 统计软件进行数据分析。计量资料以±s表示,组间比较分析采用t检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 避水应激小鼠模型构建 与健康小鼠相比较,避水应激小鼠肠道传输时间短于健康小鼠(P<0.05),粪便含水量高于健康小鼠(P<0.01)。见表2。避水应激小鼠肠道敏感性高于健康小鼠,见图1。提示造模成功。

图1 避水应激小鼠与健康小鼠不同压力下AWR 评分
表2 避水应激小鼠与健康小鼠粪便含水量、肠道传输时间比较(± s)

表2 避水应激小鼠与健康小鼠粪便含水量、肠道传输时间比较(± s)
类别健康小鼠避水应激小鼠P 值例数5 5粪便含水量(%)58.93 ± 4.39 67.28 ± 2.61<0.01肠道传输时间(min)204.20 ± 25.15 170.80 ± 16.51 0.04
2.2 实验组与对照组小鼠粪便含水量、肠道传输时间、AWR 评分比较 与移植健康粪便的小鼠相比,移植IBS-D 粪便的小鼠出现IBS-D 相关表现包括粪便含水量和AWR 评分均增加(P<0.05);肠道传输时间缩短(P<0.05)。见表3、图2。

图2 实验组与对照组小鼠不同压力下AWR 评分
表3 实验组与对照组小鼠粪便含水量、肠道传输时间比较(± s)

表3 实验组与对照组小鼠粪便含水量、肠道传输时间比较(± s)
组别对照组实验组P 值例数55粪便含水量(%)53.82 ± 3.84 63.58 ± 4.53<0.01肠道传输时间(min)181.80 ± 13.77 111.20 ± 38.90<0.01
2.3 实验组与对照组小鼠qRT-PCR 检测结果 实验组与对照组小鼠结肠组织中IL-6、IL-1β、MyD88、TNF-α、NF-κB(P65)、TLR4 6 种mRNA 表达水平见图3。实验组小鼠结肠组织中上述指标的mRNA表达水平均高于对照组小鼠,差异有统计学意义(P<0.05)。
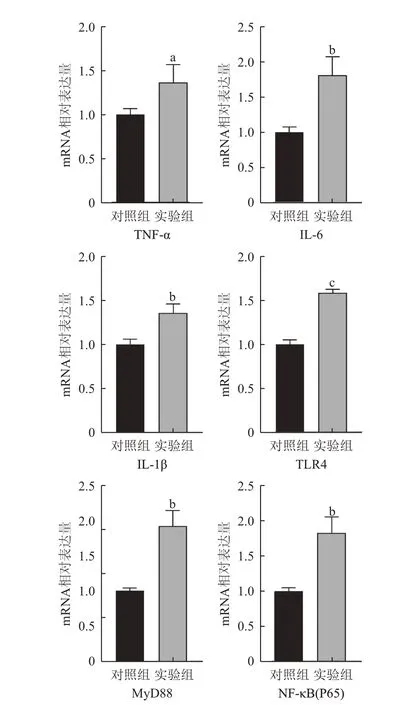
图3 实验组与对照组小鼠TNF-α、IL-6、IL-1β、TLR4、MyD88、NF-κB(P65)的mRNA 表达水平比较
2.4 实验组与对照组小鼠蛋白质印迹法检测结果 通过对比β-actin 计算得出的相对表达量见图4、5。实验组小鼠结肠组织中IL-6、IL-1β、MyD88、TNF-α、NF-κB(P65)、TLR4 蛋白表达量高于对照组,差异有统计学意义(P<0.05)。
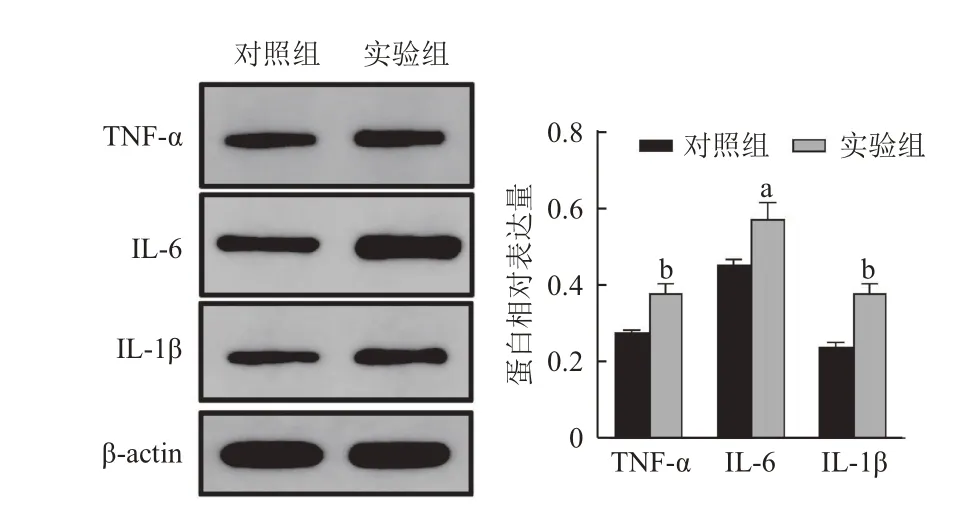
图4 实验组与对照组小鼠TNF-α、IL-6、IL-1β 蛋白的表达水平比较
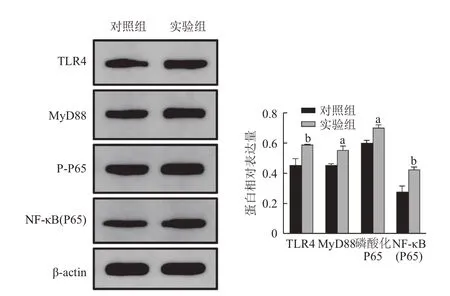
图5 实验组与对照组小鼠NF-κB(P65)、磷酸化P65、MyD88、TLR4 蛋白的表达水平
3 讨论
IBS-D 是最常见的功能性胃肠病之一。这种疾病虽然不会危及生命,但对患者的生活质量有着严重影响,同时给医疗保健系统带来巨大负担[7]。全球估计IBS 患病率为10%~20%[8]。据报道,与西方国家相比,亚洲国家的IBS 患病率较低[9]。然而随着生活方式和社会经济因素的变化,IBS-D 在亚洲地区的发病率可能不断上升[10]。
IBS-D 的发病机制很复杂,至今尚未完全明确。研究表明,肠道菌群失调、结肠黏膜的慢性炎症反应以及肠道内脏敏感性的增加在IBS-D 患者中很常见[11]。肠道菌群是人体内最庞大最复杂的微生态系统之一,其与人类共生共存,在参与宿主营养代谢、维持肠道屏障完整性、调节免疫等方面发挥着重要作用[12]。随着研究的不断深入,越来越多的研究发现相对于健康人群而言,IBS-D 患者肠道菌群的数量和组成发生了显著变化。相关研究表明,IBS-D患者肠道菌群的丰富度显著降低,其表现为2 个主要门的明显变异,即拟杆菌门增加和厚壁菌门减少[13]。在属水平上,表现为拟杆菌属和普雷沃氏菌属增加,双歧杆菌属减少[14]。但这些变化与IBS-D发生的具体因果关系尚不明确,肠道菌群改变是IBS-D 的伴随现象还是作为始发因素诱导IBS-D 的发生值得进一步探索。
本研究通过抗生素清扫,模拟肠内无菌环境,通过粪菌移植探究肠道菌群在IBS-D 发生中的作用。与移植健康粪便的小鼠相比,移植IBS-D 粪便的小鼠表现出了明显的肠易激症状,包括粪便含水量增加、肠道传输时间缩短以及肠道敏感性增加。同时本研究也检测了2 组小鼠肠黏膜的炎症因子表达情况,结果显示接受IBS-D 粪便移植的小鼠肠黏膜炎症因子水平高于接受健康粪便移植的小鼠。
肠道的低度炎症和免疫激活被认为是IBS-D 发病的重要因素之一。研究表明炎症因子水平在IBS-D小鼠中升高,抗炎治疗在IBS-D 小鼠中展示了良好的临床前景[15]。NF-κB 是一种转录因子,其在免疫反应、炎症、凋亡等生物学过程中扮演着重要角色。结肠组织中NF-κB 及其通路相关分子TLR4、MyD88 的表达水平升高已被证明与IBS-D 发病相关,NF-κB 驱动的炎症细胞因子,如IL-1β、IL-8 和TNF-α 等,可影响肠道分泌和运动并刺激内脏感觉神经末梢,导致内脏高敏感性[16]。
在健康个体中,稳定的肠道菌群在维持肠道屏障完整性和炎症平衡方面起着关键作用。但这种“稳态”在某些情况下可能会被打破[17]。肠道菌群的失衡可能会导致肠道黏膜屏障被破坏及通透性增加,使得促炎微生物产物如脂多糖(lipopolysaccharides, LPS)进入肠黏膜,LPS 可以与肠道上皮细胞表面的TLR4 结合,从而激活肠道上皮细胞和免疫细胞的炎症反应[18]。这些免疫细胞和上皮细胞通过激活NF-κB 通路产生炎症因子,如IL-6、TNF-α和IL-1β 等,引起肠道黏膜的炎症和一系列肠道症状,促进IBS-D 的发生。
综上所述,本研究通过粪菌移植的方式成功构建出IBS-D 小鼠模型。提示肠道菌群失调在IBS-D的发生中可能起到“启动”作用。尽管其中的具体机制有待进一步研究,但菌群紊乱导致肠黏膜低度炎症及NF-κB 相关通路的异常激活可能在此过程中发挥关键作用。
