菲胁迫对泥鳅肝脏氧化毒性及可逆性研究
2024-01-08杨超超冯宇宇
王 琪,杨超超,明 艳,冯宇宇,唐 绪,雷 忻
(延安大学 生命科学学院;延安市生态恢复重点实验室,陕西 延安 716000)
菲(Phenanthrene,Phe)是广泛分布于水体中的一类多环芳烃类污染物(Polycyclic Aromatic Hydrocarbons,PAHs),由3 个苯环组成[1]。由于大气沉积以及石油泄漏等原因,水生环境中的Phe 浓度大幅增加。Phe 在水体中脂溶性高,易富集到有机体内[2]。已有研究发现,Phe 对鱼类具有一定的氧化毒性。阎波等[3]在Phe 对毛蚶氧化胁迫的研究中发现,50 mg/L 胁迫下毛蚶体内活性氧含量均高于对照组,整体呈现出不断增加的趋势,且随着Phe浓度的增加存在剂量-效应关系;在Phe对中华倒刺鲃的研究中发现,随着饲料Phe浓度的升高,实验鱼肝胰脏和肠组织中总的抗氧化能力显著降低,表明Phe 食物暴露会导致鱼体组织器官的氧化损伤并抑制鱼体相应解毒酶系统的活性,可引起鱼类肝脏和肠道出现组织增大等形态结构特征的改变[4]。
污染物通过不同途径进入鱼体会诱发产生大量的活性氧(reactive oxygen species,ROS)[5],这种活性氧自由基会导致生物体内出现氧化损伤,进而诱导机体抗氧化防御系统的效用,包括抗氧化酶活性的改变,例如:超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)等[6]。在反应过程中SOD 会通过歧化反应将活性超氧阴离子转化为H2O2,SOD 基因有几种亚型:Cu/Zn-SOD、Fe-SOD等,在动物细胞乃至鱼类细胞中较为常见的是Cu/Zn-SOD基因[7]。CAT 可将H2O2转化为H2O 和O2[8],其中CAT1和CAT3是对氧化剂反应最高的基因。同时,机体的氧化损伤也会导致氧化应激指数丙二醛(malondialdehyde,MDA)、发生DNA损伤的标志性指数8-羟基脱氧鸟苷(8-hydroxy-2 deoxyguanosine,8-OHdG)的值发生改变。这种氧化应激反应是由细胞过氧化和抗氧化剂的不平衡以及氧化的偏向引起的,最终会导致细胞损伤[9-10]。XIE 等[11]在对黄鲶鱼肠道抗氧化能力的研究中发现,镉暴露会诱导氧化应激抑制抗氧化活性,其特征在于MDA 水平的升高以及抗氧化酶的活性和转录水平的降低。综合生物标志物指数(integrated biomarker response,IBR)可以准确详细地预测各种标志物综合联系的指数,它是衡量评估污染物严重性的有力工具[12]。
泥鳅(Misgurnusanguillicaudatus)隶属于鲤形目(Cypriniformes)、鳅科(Cobitidae)、泥鳅属(Misgunus),常栖息在河流淤泥底部,具备较强适应能力,易在实验室条件驯养,在检测污染物毒性过程中具有一定指示性。本研究以泥鳅为材料,检测在Phe 胁迫下其肝脏SOD、CAT 活性和MDA、8-OHdG 含量的变化,测定Cu/Zn-SOD、CAT3基因mRNA 相对表达量的变化,探究Phe 对泥鳅抗氧化和代谢解毒过程的影响,并运用IBR 模型,综合分析Phe 对泥鳅的氧化毒性效应及其可逆性,以期为其污染治理和生态风险评估提供理论依据。
1 材料与方法
1.1 实验材料
菲(纯度>95%)购自源叶生物);MDA、8-OHdG ELISA 试剂盒购自上海酶联生物科技有限公司;泥鳅购买于江苏生态泥鳅养殖基地,实验前泥鳅在实验室环境中用自然脱氯的水驯养15 d,每天定时投喂泥鳅食少量,泥鳅养殖水温保持在(25 ± 2)℃,pH为(7.5 ± 0.2)。
1.2 方法
1.2.1 染毒实验与恢复实验
本实验室前期对泥鳅进行急性毒性实验,寻找Phe 胁迫下泥鳅的安全浓度,在安全浓度范围内等对数设置5个Phe浓度处理组:0.15、1.33、1.77、2.36、3.13 mg/L,同时设置空白对照组和溶剂对照组(丙酮溶液),采用半静态亚急性毒性法,设置3组重复,每组均放入泥鳅25 条,每24 h 更换Phe 试剂,同时观察并记录泥鳅行为变化情况,胁迫45 d 后将其转入自然水体中驯养30 d,并设置对照组。短期胁迫15、30、45 d以及恢复期驯养30 d后,取不同浓度泥鳅约3~5条,剖取肝脏等组织,置于-80 ℃冷冻保存待测。
1.2.2 SOD、CAT活性及MDA、8-OHdG含量测定
将剖取的肝脏组织称重记录,加入PBS 缓冲液(按重量:体积=1∶9),混至匀浆,以转速3 000 r/min离心处理后取上清,利用ELISA 试剂盒检测MDA、8-OHdG 含量以及SOD、CAT 酶活性。8-OHdG 和MDA 含量测定采用双抗体夹心法,SOD 活性使用氮蓝四唑光化还原法测定[13],CAT 活性使用钼酸铵比色法测定[14]。
1.2.3Cu/Zn-SOD、CAT3基因的表达测定
采用qRT-PCR 方法检测Cu/Zn-SOD、CAT3两种基因mRNA 表达量,选择β-actin基因作为相对定量内参。引物由上海生工生物工程股份有限公司(西安分部)合成,引物序列下表1所示。

表1 特异性引物
利用Trizol 试剂盒从泥鳅中提取肝脏组织总RNA,取少量DEPC(diethylprocarbonate)水迅速溶解,检测其RNA 浓度和质量,后通过试剂盒取少量进行去除gDNA 和反转录实验。采用SYBR Green Pro Tap HS 预混型qPCR 试剂盒进行后续荧光定量qPCR 实验,需注意保持干燥,防止污染。以β-actin作为相对定量内参,采用2-△△Ct法[15]计算Cu/Zn-SOD、CAT3的mRNA相对表达量。
1.2.4 泥鳅肝脏组织切片制作与观察
将胁迫30 d 不同浓度处理组泥鳅各取3 尾,解剖肝脏部位并置于Bouin’s 固定液中1 d,清洗组织数次,采用石蜡包埋,使用轮式切片机制作切片,hematoxylin-eosin(H.E)染色法对切片染色、镜检、观察并拍照。
1.2.5 IBR综合指数
IBR 综合指数采用第二代综合生物标志物响应指数法[16],计算各浓度组中多种生物标志物数值,采用公式Y=log(X/X0)、Zi=(Y-M)/SD、A=Zi-Z0分别计算出标志物的标准化值、均一化值和偏离指数,最后计算IBR总值。
其中,X及X0代表生物标志物在不同染毒组和对照组的平均值,Y代表各标准化值,Z代表所得的均一化值,A为生物标志物偏离指数。
1.3 数据处理
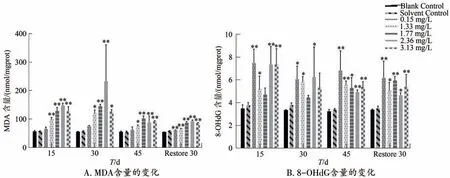
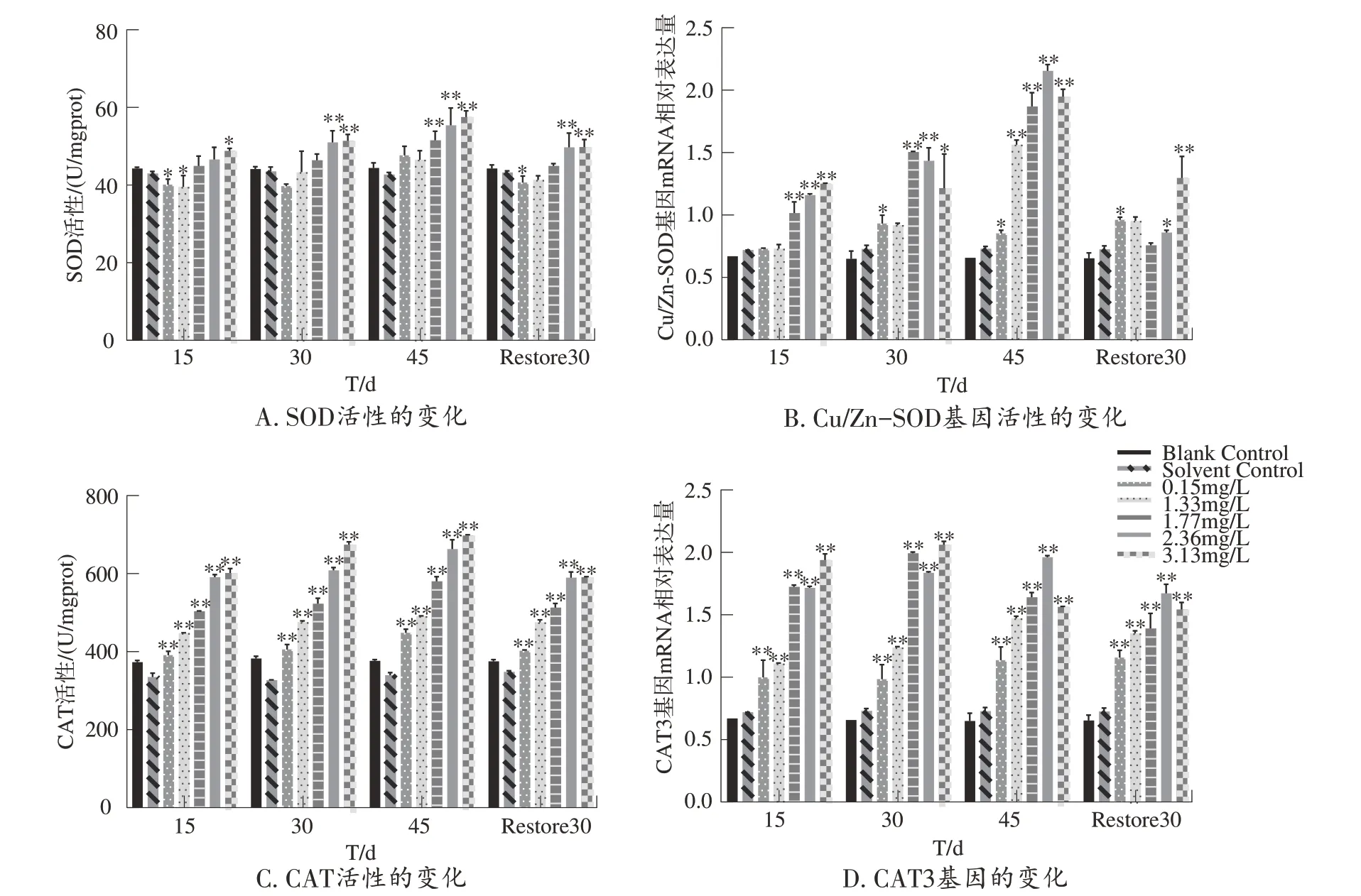
实验结果以平均值 ± 标准差(Mean ± SD)表示,所有数据采用SPSS Statistics 25统计软件进行单因素方差分析(One-way ANOVA),采用Duncan 法比较组间差异,使用graphpad 9.0 和 Origin 2022 作图。当0.01 Phe 对泥鳅肝脏MDA 和8-OHdG 含量的影响如图1 所示。由图1A 可知,各Phe 浓度处理组暴露下MDA 含量均高于对照组;Phe 胁迫30 d 时,2.36 mg/L 浓度组MDA 含量最高。在不同胁迫时间下,随着胁迫浓度的增加,中低浓度组(0.15、1.33、1.77 mg/L)MDA 含量显著上升(P<0.05);恢复驯养30 d 时,Phe 各浓度处理组MDA 含量略有降低,但与对照组相比呈显著上升趋势(P<0.01)。由图1B 可知,各Phe 浓度处理组胁迫下8-OHdG含量均高于对照组;在胁迫10 d 时,0.15 mg/L 浓度组8-OHdG 含量最高;在胁迫15、30、45 d 过程中,随着Phe 浓度的不断增大,8-OHdG 含量先呈下降趋势后呈上升趋势;恢复驯养30 d 时,各浓度组含量仍高于对照组。 图1 Phe胁迫下泥鳅肝脏MDA和8-OHdG含量的变化 Phe 胁迫对肝脏抗氧化酶活性及其基因表达的影响如图2所示。由图2A可知,与对照组相比,毒性胁迫15、30 d 时,低浓度组(0.15、1.33 mg/L)肝脏SOD 活性低于对照组,随着胁迫浓度增大,SOD 活性逐渐增加;在胁迫45 d以及恢复驯养30 d时,中高浓度组(1.77、2.36、3.13 mg/L)SOD 活性显著上升(P<0.01);在胁迫45 d时,3.13 mg∙L-1浓度组SOD活性最大;恢复驯养30 d时,各浓度组SOD活性与胁迫15 d 时各浓度组活性相似但略高于胁迫初期。由图2B 可知,与对照组相比,各浓度组Cu/Zn-SOD基因mRNA相对表达量均高于对照组;在胁迫15 d时,随着胁迫浓度的不断增加,中高浓度组(1.77、2.36、3.13 mg/L)Cu/Zn-sod相对表达量显著上升(P<0.01),且胁迫45 d 时,中高浓度组Cu/Zn-SOD相对表达量均高于其他浓度组;恢复驯养30 d 时各浓度组Cu/Zn-SOD相对表达量呈先下降后上升的趋势。 图2 Phe胁迫下泥鳅肝脏抗氧化酶活性及其基因表达的变化 由图2C 可知,当泥鳅分别胁迫15、30、45 d 时,随着胁迫浓度的增加,各浓度组CAT 活性显著上升(P<0.01),表现出一定的时间-剂量效应;胁迫45 d时,3.13 mg/L 浓度组CAT 活性最大;恢复驯养30 d时,泥鳅肝脏CAT 活性仍随胁迫浓度增大显著上升(P<0.01),恢复驯养后CAT活性略低于毒性胁迫30、45 d,但仍高于对照组。由图2D 可知,相较于对照组,各浓度组CAT3基因mRNA相对表达量均高于对照组,在低浓度胁迫下,泥鳅肝脏CAT3表达量呈先上升后下降的趋势,中浓度组(3.13 mg/L)CAT3表达量呈显著上升趋势,恢复驯养30 d 后,中低胁迫浓度组CAT3表达量呈显著上升趋势(P<0.01);但低于45 d 各胁迫组。 Phe 暴露30 d 对泥鳅肝脏组织的影响如图3 所示。由图可知,毒性胁迫下泥鳅肝细胞出现了不同程度的变化,对照组泥鳅细胞分布均匀,细胞核较为清晰且位于各细胞中央呈圆球状,肝细胞、红细胞、肝板等其余细胞结构清晰可见(图3A、B)。与对照组相比,当Phe 最低浓度胁迫时,部分肝细胞出现肿胀,细胞核溶解清晰可见(图3C、D);随着胁迫浓度增大,细胞组织间隙增大,细胞核空泡化严重,细胞出现不同程度坏死;(图3E、F)Phe 处理最高浓度组较低浓度组损伤较为明显,细胞核溶解和核偏移较为明显,细胞间隙较对照组大(图3G)。 Phe 不同浓度组胁迫不同时间下,SOD、CAT、MDA、8-OHdG 4 个指标的变化IBR 雷达图如图4所示。雷达图面积代表着IBR 指数,与对照组相比,长时间胁迫下的雷达图面积高于对照组,但不同处理组的图形面积也存在较大差异;在毒性暴露15 d 时,高浓度组(2.36、3.13 mg/L)IBR 指数呈上升趋势;毒性暴露15、45 d 时,0.15 mg/L 浓度组IBR 指数最大,在Phe 胁迫下,泥鳅肝脏IBR 指数总体表现为45 d>15 d>30 d;恢复驯养30 d 时,与对照组相比,各浓度处理组IBR 指数仍高于对照组,3.13 mg/L 浓度组IBR 指数最大。雷达图中辐射线长度代表着各生物标志物存在的组间差异,在Phe各浓度组中,5 个生物标志物指标组间差异较大,且Phe 胁迫下肝脏SOD、8-OHdG 活性所受的影响最大。 图4 Phe胁迫下泥鳅肝脏IBR分析 污染物可以在鱼体诱导发生氧化应激。这些氧化应激反应都是由于毒性作用使鱼体的ROS 大量积累,这是一种特异性损伤也是鱼类病害的普遍原因[5,10,17]。MDA 是衡量氧化胁迫程度的常用指标之一。王汩等[4]在Phe 对长江上游鱼类的毒性作用研究中发现,Phe 胁迫下,中华倒刺鲃肝脏中MDA含量随Phe 浓度的增高而增高。在本研究中,不同浓度Phe 胁迫对泥鳅肝脏MDA 含量均高于对照组。出现先上升后下降的趋势。这可能是由于Phe胁迫初期泥鳅表现出应激性,泥鳅体内ROS 积累,机体抗氧化系统受到严重损害,自身清除能力受损并导致大量MDA 增加。在恢复驯养30 d 后,泥鳅肝脏MDA含量略低于浓度处理组但仍高于对照组,说明恢复驯养可以减少泥鳅对污染物的吸收,但不能完全恢复机体的抗氧化能力。8-OHdG水平作为DNA损伤的生物标志物已被应用于评估DNA 损伤[18]。本实验室以往研究发现,高浓度多菌灵胁迫泥鳅后,8-OHdG 含量呈上升趋势,恢复驯养下也呈上升趋势[19]。在本研究中,Phe 胁迫泥鳅8-OHdG 活性短时间内显著升高,随浓度的上升呈先下降后升高的趋势,说明毒性胁迫引发了泥鳅DNA 损伤,恢复驯养30 d 后8-OHdG 活性略有下降但远高于对照组,说明恢复驯养不能完全修复Phe 对DNA 造成的氧化损伤。 SOD 在解毒和维持体内平衡的过程中起着不可或缺的作用,通过歧化反应产生的自由基是生物体内正常的代谢物。但是毒性作用下,自由基不断积累使细胞膜因过氧化作用而裂变,导致细胞损伤甚至死亡。SOD 活性及Cu/Zn-SOD的相对表达量的变化可在一定程度上反映机体清除ROS 的能力[20-21]。在本研究中SOD 酶活性在低浓度胁迫初期低于对照组。这可能是由于低浓度组诱导的氧化应激反应较弱,随着染毒时间的延长以及毒性浓度的增加,Cu/Zn-SOD基因表达量显著升高、SOD活性升高,从而防止ROS 对肝脏组织结构和功能的损害,这与徐文菊[22]的研究结果相似。恢复驯养30 d时,低浓度组SOD活性仍低于对照组,但中高浓度组毒性作用较浓度组略有下降但仍高于对照组,说明恢复驯养不能完全减少机体的氧化损伤。CAT通过催化H2O2降解为水(H2O)和O2,提供对ROS 衍生的氧化应激的保护[23]。在本研究中,随Phe 毒性胁迫时间和胁迫浓度的增加,泥鳅肝脏CAT 活性显著上升。说明胁迫时间和胁迫浓度的增加会使泥鳅肝脏出现一定程度的氧化应激,Phe 会促进泥鳅肝脏CAT 酶的分泌,提高机体清除过氧化氢的能力,使机体免受H2O2的毒害。这一结果与先前研究类似,郭红会[24]研究发现,亚慢性氨氮暴露可导致肝脏CAT 活性及基因CAT3的转录水平呈现显著的浓度依赖性升高,从而降低氨诱导的活性氧代谢产物。在本研究中,经过30 d 的恢复驯养后,机体的抗氧化水平有一定程度的恢复趋势,但未能恢复到正常状态,说明在恢复驯养后泥鳅肝脏体内的毒性有部分减弱,但仍有残留,机体仍发挥较强的抗氧化保护作用。两种抗氧化酶活性及其基因的表达结果显示,Phe 胁迫下两种酶活性和基因表达呈正相关,表现出时间-剂量效应,因此可就不同时间、剂量Phe胁迫对鱼类的抗氧化酶活性及基因表达调控进行深入研究。 肝脏是鱼类自体代谢解毒的重要器官,肝组织结构的变化可以反映污染物对鱼类的氧化毒性作用。杨超超等[25]在Phe 对泥鳅肝脏毒性研究中发现,Phe 在肝脏中的累积量随着毒性胁迫时间和浓度的增大而增强,低浓度组出现肝细胞肿胀现象,随毒性增强,肝细胞核溶解、细胞空泡化等现象明显;宋楚心[26]在全氟己磺酸对斑马鱼的肝脏毒性研究中发现,与对照组相比,染毒组细胞排列紧密,肝细胞膜不清晰,有消失的趋势,肝细胞核溶解等现象较为明显。本研究观察到,30 d 时泥鳅肝细胞出现不同程度的细胞肿胀,细胞核偏移、细胞核溶解现象,随着胁迫时间增加,高浓度组也出现了部分细胞坏死,说明一定剂量的Phe 胁迫会导致泥鳅肝细胞结构异常。这可能是由于Phe 暴露时间过长,肝脏产生氧化毒性和DNA 损伤逐渐演变为细胞损伤。这与BRANDTS等[27]的研究结果相似。 SOD、CAT、MDA 和8-OHdG 作为机体环境胁迫下的重要生物标志物,可以通过IBR 指数对毒性暴露下生物的毒性效应进行简明全面的评估[28]。在评估砷酸盐和全氟辛烷磺酸对蚯蚓联合毒性效应的研究中发现,单独或联合暴露的高剂量组表现出的IBR 值更高,表明综合毒性应激随着暴露水平的增加而增加[29]。本研究中,Phe 胁迫下泥鳅肝脏IBR 指数在最长时间45 d 下高于对照组,说明综合应激水平随着Phe 的暴露时间不断增加;在胁迫后期高浓度组的IBR 值最大,说明高浓度组在毒性暴露过程中的生物累积性较高;恢复驯养30 d 后,Phe各浓度组IBR指数有降低,但仍高于对照组,说明一定剂量的Phe长期胁迫对泥鳅的氧化损伤有一定程度逆转,但并不能完全恢复正常。 考察了菲胁迫对泥鳅肝脏氧化毒性及可逆性的影响。实验结果表明,一定剂量Phe 对泥鳅肝脏MDA、8-OHdG 含量、SOD、CAT 活性、Cu/Zn-SOD、CAT3基因mRNA 表达量有明显诱导作用。恢复驯养30 d 后,其含量和氧化毒性不能完全恢复正常状态。Phe 对30 d 泥鳅肝脏组织结构产生明显的损伤效应,其中胁迫浓度越大,肝脏损伤越严重。2 实验结果
2.1 Phe胁迫下泥鳅肝脏MDA和8-OHdG含量变化
2.2 Phe 胁迫下泥鳅肝脏SOD、CAT 活性及其基因表达的变化
2.3 Phe暴露对泥鳅肝脏组织结构的影响
2.4 Phe胁迫下泥鳅肝脏IBR指数

3 讨论
4 结论
