AMPAR在抗AMPAR脑炎合并小细胞肺癌患者中的表达
2024-01-07姚海燕杨洁杨新光
姚海燕,杨洁,杨新光,2
(1.广州医科大学附属第二医院神经内科,广东广州 510260;2.中山大学孙逸仙纪念医院神经内科,广东广州 510120)
自身免疫性脑炎(autoimmune encephalitis,AE)是一种严重且经常致命的疾病,与针对可影响神经元功能的抗原的神经元特异性自身抗体有关。抗神经元抗体包括针对神经元和胶质细胞的细胞表面或突触抗原的抗体,以及针对细胞内抗原的抗体。抗细胞表面抗原的抗体通常是致病性IgG,如抗N⁃甲基⁃D⁃天冬氨酸受体(N⁃methyl⁃D⁃aspartic acid receptor,NMDAR)抗体、抗富亮氨酸胶质瘤失活蛋白1(leucine rich glioma inactivated 1,LGI1)抗体、抗接触蛋白关联蛋白样蛋白2(contactin⁃associated protein⁃like 2,CASPR2)抗体、抗γ 氨基丁酸受体(γ⁃aminobutyric acid,GABA)抗体、抗α⁃氨基⁃3⁃羟基⁃5⁃甲基⁃4⁃异唑丙酸受体(α⁃amino⁃3⁃hydroxy⁃5⁃methyl⁃4⁃isoxazolepropionic acid receptor,AMPAR)抗体,致病机制包括受体激动剂或拮抗剂作用、补体级联的激活、抗体依赖的细胞介导的细胞毒性以及抗原内化,从而改变细胞表面的抗原密度[1⁃2]。
AE通常有副肿瘤性的起源,由质膜中表达的肿瘤神经蛋白启动肿瘤靶向免疫反应,这些抗原呈递给适应性免疫系统并激活免疫细胞[1⁃2]。抗AMPAR脑炎是几种新近描述的自身免疫性疾病之一,以突触表面蛋白为靶点,引起精神和神经症状,目前抗AMPAR 脑炎已报道超过35 例[3⁃11]。在近一半的抗AMPAR 脑炎患者中发现了肿瘤,提示肿瘤是抗AMPAR脑炎的主要病因之一[11]。
虽然一些抗AMPAR 脑炎患者合并肿瘤的病理表现为小细胞肺癌(small cell lung cancer,SCLC)[9],但SCLC 与抗AMPAR 脑炎之间的病理学联系尚不清楚。本研究收集2 例伴抗AMPAR 脑炎和80 例不伴抗AMPAR 脑炎的SCLC 患者,免疫组化检测肺部肿瘤组织AMPAR的表达并描述其表达特征。
1 资料与方法
1.1 临床资料
2013 年6 月至2019 年11 月,连续从942 例疑似AE患者中收集脑脊液和(或)血清样本,所有样本均检测AE⁃IgG,包括抗NMDAR、AMPAR1、AMPAR2、CASPR2、LGI1、GABA 抗体。这些样本来自不同的医院,但均在广州医科大学第二附属医院神经科学研究所进行自身抗体筛查。本研究经广州医科大学第二附属医院伦理委员会批准(2019⁃hs⁃11,2020⁃hs⁃54),所有患者均知情同意。
1.2 AE抗体检测和AMAPR⁃IgG鉴定
参照文献[12]使用商业化标准的大鼠海马和小脑组织切片,采用间接免疫荧光法检测脑脊液和(或)血清AE 抗体。将未稀释的脑脊液或1∶10稀释的血清与商业化切片在室温下孵育3 h,洗涤后与带有荧光标记的山羊抗人IgG 血清室温下孵育2 h,洗涤后在显微镜下观察荧光模式和荧光强度。使用基于细胞法(cell⁃based assay,CBA)试剂盒(德国Euroimmun)检测AE 抗体阳性的样本AMPAR1 和AMPAR2抗体表达。
1.3 肿瘤组织的抗神经元抗体免疫组化检测
收集来自广州医科大学附属第二医院的两名抗AMPAR 抗体阳性并且合并SCLC 患者的肺部肿瘤组织切片和80 份商业的无AE 表现的人SCLC 组织芯片(西安Ailina Biotech)。参照文献[13],采用亲和素⁃生物素化酶复合物免疫染色方法进行免疫组化检测。将组织芯片及切片在二甲苯中浸泡3次,每次浸泡5 min,然后在100%乙醇、95%乙醇和90%乙醇中分别浸泡5 min。蒸馏水冲洗,然后PBS洗3 次。室温下用10%山羊血清孵育芯片及切片30 min 阻断非特异性蛋白质结合,然后4 ℃下切片分别与CRMP5、NMDAR、AMPAR1、2 等一抗(1∶300稀释,北京Bioss)以及患者脑脊液(1∶1)孵育过夜。用PBS 洗涤芯片及切片,用含30%甲醇和30%过氧化氢的PBS孵育20 min,PBS洗3次。组织芯片及切片与二抗室温下孵育2 h,盐酸二氨基联苯胺(棕色)染色,最后用苏木精反染(蓝色),显微镜下观察,细胞染色呈棕色为抗体阳性表达。
2 结果
2.1 AMPAR⁃IgG检测
4 例(0.4%,4/942)患者的脑脊液和血清抗AMPAR 抗体阳性,其中3 例患者经病理证实为SCLC,2例患者肺部肿瘤组织可用于免疫组化检测。所有3 例患者的临床资料见表1。3 例患者皆为男性,都出现记忆迅速下降和精神行为异常,磁共振成像(MRI)均显示非特异性脑损伤。

表1 抗AMPAR2抗体阳性患者3例临床资料
2.2 抗神经元抗体免疫组化检测
2 例AMPAR⁃IgG 阳性患者肿瘤组织免疫组化检测显示AMPAR1、AMPAR2、CRMP5 均为强阳性,但NMDAR 为阴性。1 例AMPAR2 抗体阳性患者肺部肿瘤组织AMPAR2 高表达,并与患者的脑脊液抗体发生反应。见图1,图2。80例无AE的SCLC患者肺部肿瘤组织AMPAR2均为阳性。
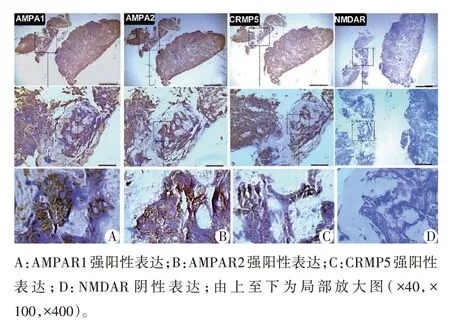
图2 小细胞肺癌患者肺部肿瘤组织中的免疫组化检测
3 讨论
抗AMPAR 脑炎既往少见报道,Höftberge等[9]在10 573 例疑似AE 或副肿瘤神经综合征的患者中检测出22 例携带AMPAR 抗体(0.2%,22/10 573)。本研究仅0.4%的患者(4/942)AMPAR⁃IgG 阳性,显示抗AMPAR脑炎在中国患者中也很罕见。
SCLC一直被认为是不同类型AE的重要病因之一。Höftberge 等[9]报道,SCLC 患者抗GABA 脑炎发生率较高(50%~60%),但仅在22 例抗AMPAR 脑炎患者中发现4 例SCLC(18%),显示SCLC 在抗AMPAR 脑炎中的比例要低于抗GABA 脑炎。但本研究在4例抗AMPAR脑炎患者中发现了3例(75%)SCLC,高发生率可能与样本量较小有关,因此需要进一步增加样本量进行检测。
副肿瘤性AE 的发生机制尚不清楚。一般来说,肿瘤靶向免疫反应是由肿瘤神经蛋白启动的,这些蛋白呈现给适应性免疫系统并激活免疫细胞[1]。这些抗原也在神经细胞中表达,因此受到多种途径的攻击,包括受体激动剂或拮抗剂作用、补体级联的激活、抗体依赖的细胞介导的细胞毒性和抗原内化[1]。
AMPAR 是一类离子型谷氨酸受体,在哺乳动物中高度保守,并介导了大脑中的大部分快速兴奋性神经传递。针对AMPAR 胞外结构域的抗体已在一组AE 肿瘤患者中被报道,包括胸腺瘤、乳腺癌、小细胞肺癌或非小细胞肺癌[3]。Bataller 等[4]发现,乳腺导管浸润性腺癌强表达AMPAR,并与AE 患者的IgG 发生反应,从而表明AMPAR⁃IgG 具有特异性的体液免疫作用。虽然在抗AMPAR 脑炎患者中可以发现SCLC,但目前还没有病理证据表明神经AMPAR 抗原也在癌细胞中表达,因此我们收集了2例合并抗AMPAR 脑炎的SCLC 患者的肺部肿瘤组织,检测显示2 例患者肺部肿瘤组织不仅表达AMPAR 抗原,并且可与患者脑脊液IgG 发生反应。此外,本研究显示80 例(100%)无AE 的SCLC 患者的肿瘤组织中均有AMPAR 抗原的强表达。目前认为肿瘤表达的AMPAR 可能有助于AMPAR 抗体的产生,从而激活脑炎患者的体液免疫和细胞免疫,这与之前其他肿瘤类型的研究结果一致[4]。虽然目前普遍认为SCLC 的存在是AE 的诱发因素,但抗AMPAR 脑炎或其他类型的AE 只能在少数SCLC 患者中发现[14]。这与我们目前的研究一样,大部分表达神经元抗原的SCLC 并没有诱导抗AMPAR 脑炎或其他类型的AE。因此,AE患者中,肿瘤组织蛋白激活适应性免疫系统的主要机制尚不清楚,还必须需要进一步的研究。
总之,本研究显示SCLC 本身可以表达AMPAR抗原,但其表达的意义尚不清楚,抗AMPAR 抗体在SCLC患者中的致病机制仍不完全了解,还需要进一步进行研究。
