玛曲高寒退化草地土壤-微生物特征及相互作用
2024-01-06刘旻霞王千月苗乐乐杨春亮肖音迪
王 敏,刘旻霞,王千月,苗乐乐,杨春亮,肖音迪
玛曲高寒退化草地土壤-微生物特征及相互作用
王 敏,刘旻霞*,王千月,苗乐乐,杨春亮,肖音迪
(西北师范大学地理与环境科学学院,甘肃 兰州 730070)
以甘肃省甘南藏族自治州玛曲县4种不同退化程度的高寒草地为研究对象,测定和分析了土壤理化因子以及土壤微生物群落变化特征.结果表明:土壤含水量、土壤有机碳、全氮、全磷的含量随草地退化加剧显著下降(<0.05),土壤pH值和土壤电导率的变化趋势则与之相反.通过高通量测序,分析得到在无、轻度、中度、重度退化草地的细菌、真菌OTU数量分别为1927、2011、2040、1798以及1492、1511、1383、1466个;无、轻度、中度、重度退化草地特有的细菌、真菌OTU数量分别为588、513、691、409和116、112、73、79个.土壤微生物群落细菌数量占明显优势,多样性随草地退化整体下降.土壤细菌的优势菌群变形菌门在中度退化草地上的相对丰度达到最大为45%;土壤真菌优势菌群子囊菌门在无退化草地上的相对丰度最大为89%.RDA分析中,土壤电导率、有机碳、含水量、全氮、全磷和pH值是影响土壤细菌的主要因子,土壤全磷、全氮和有机碳是影响土壤真菌的主要因子.
玛曲县;退化草地;土壤微生物;高通量测序技术;冗余分析
草地是陆域生态系统的重要成分,是牧区经济社会发展的重要基石[1].草地在保护土壤、涵养水源、调控天气、保护生物多样性等方面,有着巨大的生态功效[2].然而,由于气候变化、管理不当、超载过牧等,我国90%左右的草地生态系统处于不同程度的退化状态[3].
近年来,针对退化草原问题的研究主要集中在植被结构、土壤特性和土壤微生物三个方面.研究者对中国三江源地区的高寒草甸草地进行了深入研究,发现随着退化程度的加剧,植物种群构成发生明显变化,生物多样性、均匀性、生物量和土壤营养特征出现下降趋势[4].另一部分学者关注土壤特性,发现土壤营养特征、酶活性和重金属含量呈波浪形变化,与草地退化程度相关[5-6].同时,研究者还探讨了土壤微生物的季节动态和对草地退化的响应,以及土壤环境因子与细菌群落的关系[7-8].这些研究为采取措施恢复退化草地提供了重要信息,尽管土壤微生物的复杂性使其在恢复过程中的确切作用仍不明确.
玛曲县地处青藏高原东部边缘,境内天然草原、沼泽湿地分布广,是黄河上游重要的水源涵养区、补给区.长期以来,由于人为和自然因素影响,玛曲县高寒草甸出现不同程度的退化现象,导致青藏高原生态安全屏障遭到破坏,这严重影响黄河上游的水源补给功能,还导致了黄河中下游沙尘暴和荒漠化,玛曲县的生态环境稳定还关系到多民族交汇地区的经济社会稳定.目前研究有关甘南玛曲的退化草地,大多聚焦在植物多样性、产量以及土壤的物理化学特性等方面[9],对土壤微生物方面的研究较少,十分缺乏对玛曲退化草地土壤微生物方面的了解与信息储备,对玛曲退化草地的研究并不全面.而微生物主宰着土壤生命,并通过调节养分循环、分解有机质、抑制土壤传播植物病害、形成土壤结构和支持植物生产力来执行一系列重要的土壤功能[10].因此,土壤微生物是土壤生态系统变化的促进者.另一方面,微生物群落结构和多样性也可以作为土壤健康的指标[11].除此之外,还有人提出,微生物群落不仅是变化的指标,而且在管理得当以促进恢复过程和系统健康的情况下,也是退化生态系统恢复的基础[12].因此,本文通过研究甘南玛曲不同退化草地土壤微生物菌群OTU数量、土壤微生物多样性、土壤微生物群落组成变化情况以及土壤理化因子与土壤微生物之间的关系,分析甘南玛曲退化草地对土壤以及土壤微生物群落的影响,从土壤-微生物角度分析草地退化的内在因素,为退化草地的恢复重建提供理论依据.
1 材料与方法
1.1 研究区概况
研究区位于甘肃省甘南藏族自治州西南部玛曲县(图1).地理位置处于100°45′45″~102°29′00″E, 33°06′30″~34°30′15″之间[13].全县总面积1.02× 106hm2,海拔3300~4806m,气候寒冷阴湿,无绝对无霜期[14].冷季十分漫长,长达314d;暖季短暂,时长51d.年平均气温1.8℃,冬季最低气温-21℃,夏季最高温20.6℃.春季为3~5月,夏季为6~8月,秋季为9~11月,冬季为12月~次年2月.雨水集中,日照充足,辐射强烈,年均降水量为593.3mm,年平均日照2594.8h,日照率为61%,辐射量大,年总辐射为109.8kcal/cm2.牧草生长期只有190d,相对较短[15].

图1 研究区概况
1.2 试验设计与样品采集
对研究区样地进行调查统计,记录样地草地植被与土壤的各类指标,按照《天然草地退化、沙化、盐渍化的分级标准》(GB19377-2003)[16],将研究区内草地分为无退化草地、轻度退化草地、中度退化草地和重度退化草地4种类型(表1),于每个退化草地采用五点采样法选取5个0.5m×0.5m的样方.对样方信息进行调查,记录样方内植物物种数、株数以及高度,并估测样地盖度.在每个样方内用直径为3.5cm的土钻,采集表层土壤,去除植物根系和砂砾,装入自封袋中并冷藏保存.将鲜土带回实验室后,放入冰箱保存,进行后续土壤微生物的测定.其余土壤样品自然风干后研磨,过2mm筛后,用于分析土壤理化因子.

表1 不同退化程度草地植被特征
注:不同小写字母a~d表示不同退化程度间在0.05水平存在显著性差异(<0.05).
1.3 土壤微生物的测定
采用16S扩增子测序技术对土壤细菌进行测序,微生物16S扩增子测序是通过向样品DNA中添加已知拷贝数spike-in人工合成序列,然后将样本进行16S扩增子文库构建、测序,再根据spike-in的16S扩增子序列(reads)数及其拷贝数绘制标准曲线,根据OTU序列(reads)数,计算出样品中OTU代表序列对应物种16S rRNA基因拷贝数.添加16S spike-in到样品模板中进行16S rRNA基因扩增子高通量测序,得到样本中的物种组成信息.其实验流程主要包括:样本质量检测,目的区域预扩增,添加-,文库构建与质检,样本上机测序[17].
真菌采用ITS测序,用DNA抽提试剂盒(Soil DNA isolation Kit)提取土壤DNA,用ITS1和ITS2区引物对其进行扩增,经琼脂糖凝胶电泳检测后进行测序.其实验流程主要包括:基因组DNA提取,ITS区PCR扩增,扩增产物回收纯化,上机测序[18].
1.4 土壤理化性质分析方法
土壤有机碳采用硫酸消煮-重铬酸钾外加热法[19-20],土壤全氮测定采用半微量凯氏定氮法[19-20],土壤全磷采用硫酸-高氯酸消煮法[19-20],土壤pH值采用水浸提电位法[19-20],土壤含水量采用烘干法测定[21],土壤电导率采用5:1浸提法和电导法测定[22].
1.5 数据分析与处理
使用R软件计算样品的香农维纳指数(Shannon-wiener index)、丰富度估计指数(Chao1),对土壤微生物群落与土壤环境因子间的相互关系进行冗余分析(RDA).所用数据采用Excel 2016进行统计、计算,运用SPSS18.0对土壤微生物与环境因子进行相关分析、单因素方差分析(One-way ANOVAs),绘图采用Origin2021软件和R软件.
2 结果与分析
2.1 不同退化草地土壤理化性质
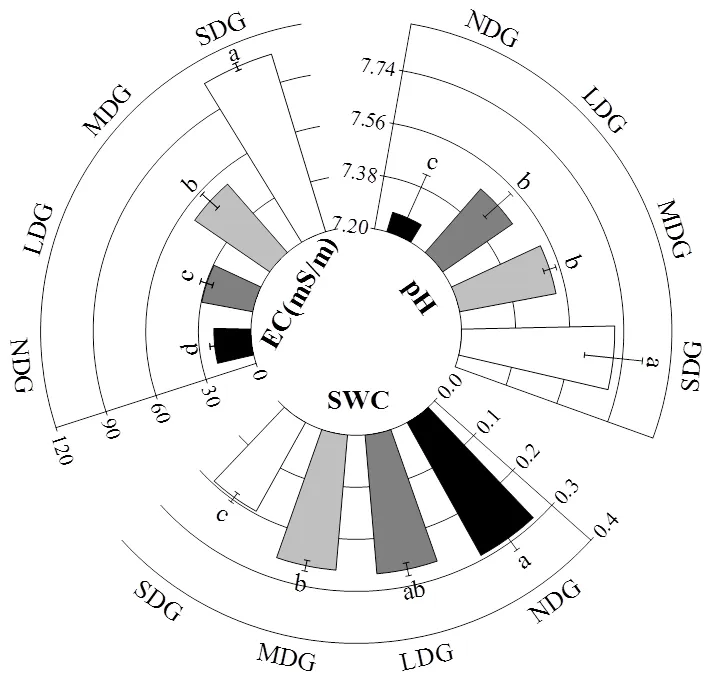
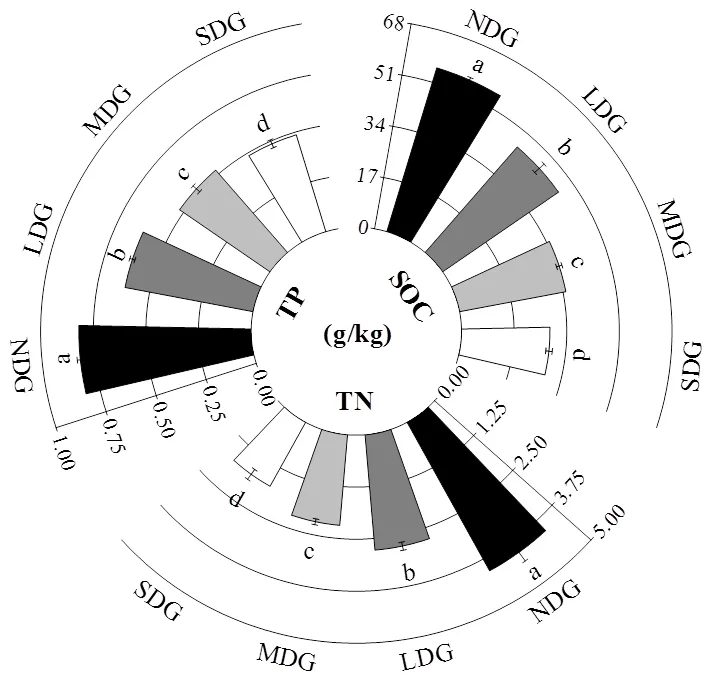
图2 不同退化草地土壤理化性质
由图2可知,土壤含水量SWC、土壤有机碳SOC、全氮TN、全磷TP的含量随着草地退化程度的不断加深呈下降趋势,土壤pH值和土壤电导率EC均随着草地退化程度的加深而增大.土壤pH值在无退化与轻度退化之间差异较为显著,但轻度退化与中度退化之间差异并不显著,而中度退化与重度退化之间较为显著(<0.05);与土壤pH值不同,土壤电导率在不同退化程度之间均具有显著差异(<0.05);土壤含水量SWC随草地退化程度的不断加深呈下降趋势,土壤含水量在无退化与轻度退化以及轻度退化与中度退化之间均无显著差异,而在中度退化与重度退化之间有显著差异(<0.05).
2.2 不同退化草地土壤微生物菌群OTU数量分析
根据4种不同退化草地土壤的细菌和真菌OTU数量绘制了Venn图(图3),由图可以清晰的发现NDG、LDG、MDG、SDG得到的细菌、真菌OTU数量分别为1927、2011、2040、1798以及1492、1511、1383、1466个.NDG、LDG、MDG、SDG特有的细菌、真菌OTU数量分别为588、513、691、409和116、112、73、79个.
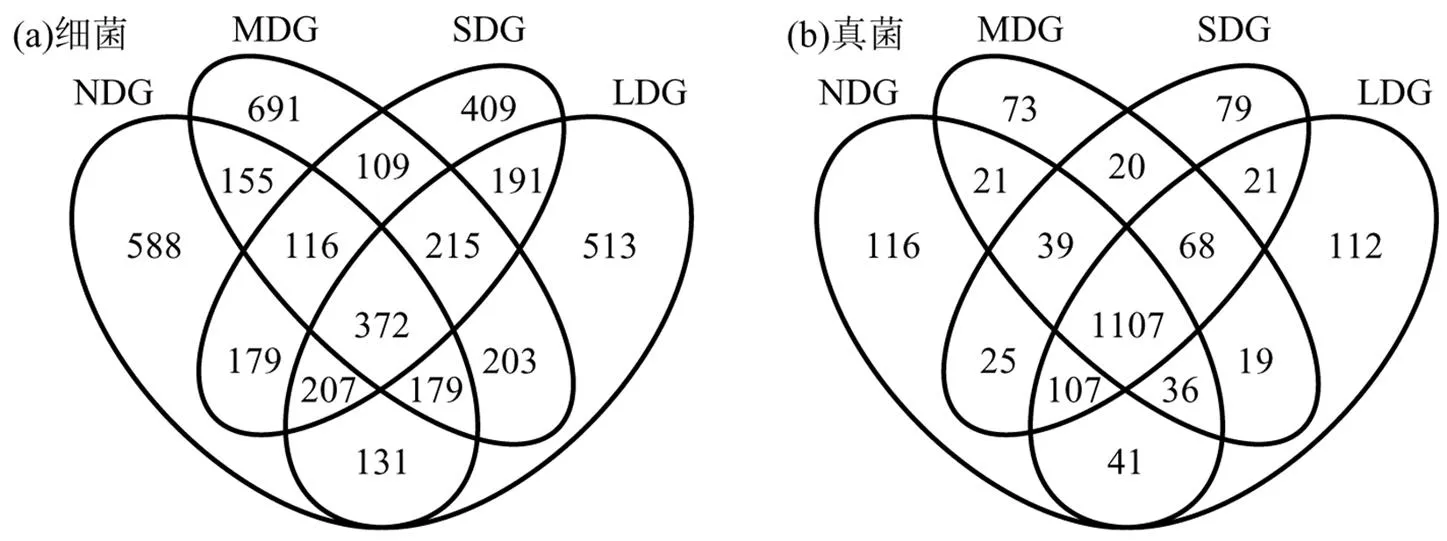
图3 不同退化草地土壤细菌和真菌OTU Venn图
2.3 不同退化草地土壤微生物群落多样性指数
图4是不同退化草地土壤细菌和真菌群落的多样性指数.在图4c中土壤细菌和真菌的测序覆盖度均在97%以上,数据较为准确.由图4a可知,不同退化草地土壤细菌Shannon-wiener指数为NDG> LDG>SDG>MDG,NDG与MDG、SDG,LDG与MDG间差异较为显著(<0.05),土壤真菌Shannon-wiener指数为SDG>NDG>LDG>MDG, SDG与NDG、LDG、MDG均差异显著(<0.05);图4b中,不同退化草地土壤细菌Chao1指数为NDG> LDG>SDG> MDG,NDG与LDG、MDG、SDG均有显著差异(<0.05),土壤真菌Chao1指数为NDG>LDG> SDG>MDG,NDG、LDG均与MDG、SDG有显著差异(<0.05).

图4 不同退化草地土壤微生物群落多样性指数
2.4 不同退化草地土壤微生物群落组成
各样地土壤细菌群落组成,除去相对丰度<1%的,共得到了9个细菌类群.主要优势类群为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)和酸杆菌门(Acidobacteria),其次还有绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)、疣微菌门(Verrucomicrobia)、拟杆菌门(Bacteroidetes)和硝化螺旋菌门(Nitrospirae).优势类群中放线菌门、厚壁菌门和酸杆菌门的相对丰度随退化程度的加深先降低后增大,而变形菌门先增大后减少(图5a).
在各样地土壤中,去掉相对丰度<1%的真菌类群,共得到了6个真菌类群.分别为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota)、壶菌门(Chytridiomycota)、球囊菌门(Glomeromycota)和毛霉菌门(Rozwllomycota).子囊菌门的相对丰度随退化程度的加剧呈先降低后增大的趋势,而担子菌门、接合菌门、壶菌门、球囊菌门、毛霉菌门则与之相反(图5b).
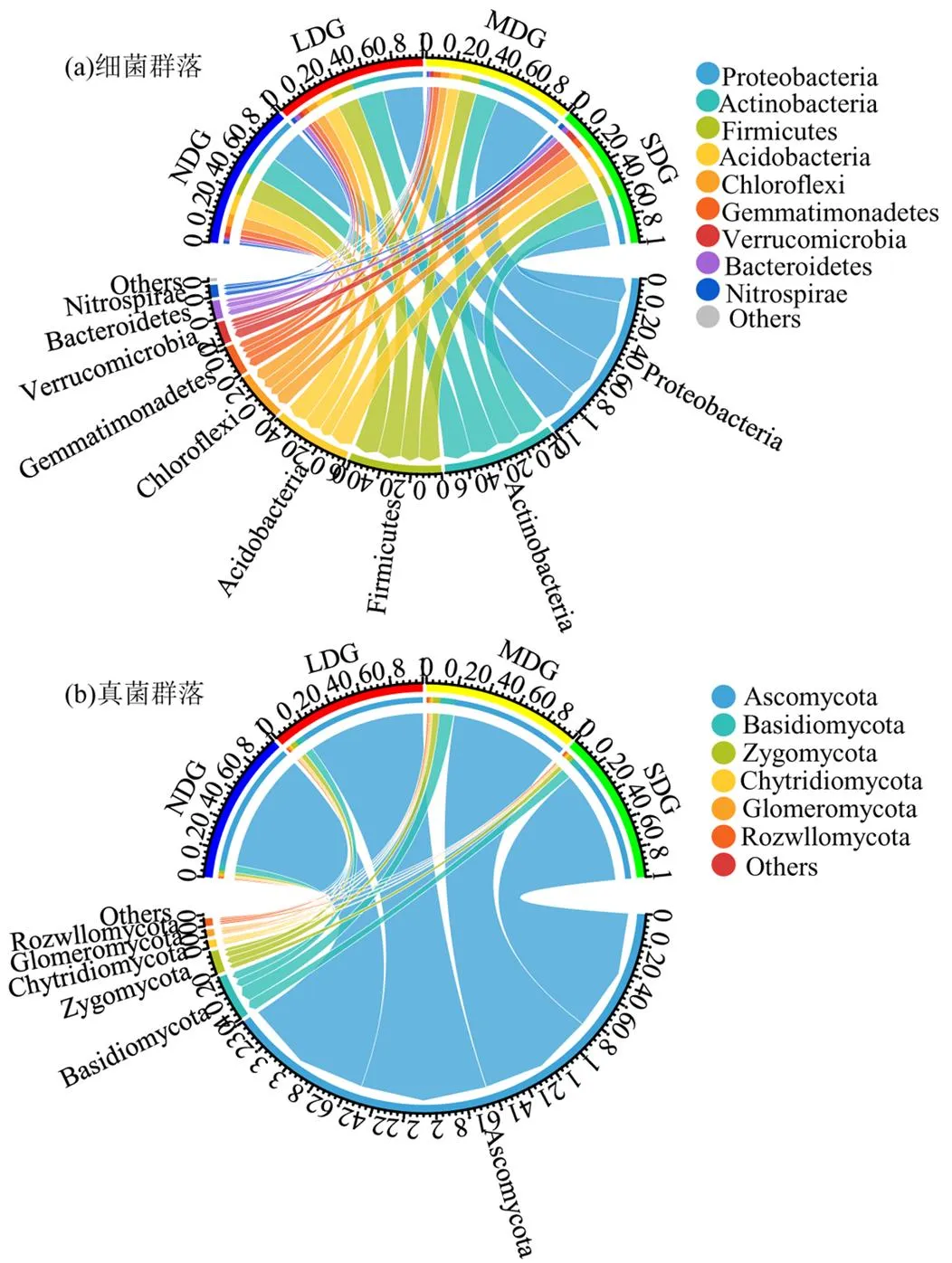
图5 不同退化草地土壤细菌和真菌群落组成
2.5 不同退化草地土壤微生物群落与土壤理化因子RDA分析
使用R中的decorana函数检测数据是否符合做RDA的要求,计算土壤细菌、真菌群落DCA第一排序轴值为0.602、0.133,均小于3.0,表明土壤细菌、真菌群落与土壤理化因子之间适用于RDA分析.采用冗余分析(RDA)研究细菌群落、真菌群落与土壤理化因子之间的相互关系.
由土壤细菌群落与土壤理化因子RDA分析(图6a)表明:第1、2排序轴解释率分别为67.79%、5.38%,两轴累计解释率为73.17%.从土壤理化因子和排序轴的夹角来看,土壤有机碳、全氮、全磷、含水量、电导率和pH值主要构成了第二排序轴,而且土壤有机碳、全氮、全磷、含水量与排序轴负相关,土壤电导率和土壤pH值与排序轴正相关.放线菌门、厚壁菌门细菌与土壤有机碳、全氮、全磷、含水量之间的夹角<90°呈正相关性,芽单胞菌门、疣微菌门细菌与土壤电导率和土壤pH值之间呈正相关性.对土壤细菌群落具有重要影响的土壤理化因子有:土壤电导率(2=0.9577,<0.01),土壤有机碳(2= 0.8003,<0.01),土壤含水量(2=0.7841,<0.01),土壤全氮(2=0.6196,<0.01),土壤全磷(2=0.6139,<0.01),土壤pH值(2=0.6023,<0.01).

图6 不同退化草地土壤细菌、真菌群落与土壤理化因子的RDA分析
图6b是土壤真菌群落与土壤理化因子的RDA分析,由图可知,其第1、2排序轴解释率分别为78.07%和7.17%,两轴累计解释率为85.24%,具有较强的生物学统计意义.土壤pH值、电导率、全氮、全磷、有机碳主要构成了第一排序轴,土壤pH值和土壤电导率与排序轴正相关,土壤全氮、全磷和土壤有机碳与排序轴负相关.子囊菌门真菌与土壤全氮、全磷、有机碳呈正相关,担子菌门和毛霉菌门真菌与土壤pH值和土壤电导率呈正相关,接合菌门真菌与土壤pH值呈正相关,壶菌门和球囊菌门真菌与土壤pH值和土壤含水量正相关.对土壤真菌群落具有显著影响的土壤理化因子有:土壤全磷(2=0.6256,<0.01),土壤全氮(2=0.6062,<0.01),土壤有机碳(2=0.5028,<0.05).
3 讨论
3.1 高寒退化草地对土壤理化因子的影响
土壤有机碳、土壤全氮、土壤全磷等都是土壤中的重要因子,是土壤中的重要养分.土壤有机碳、土壤全氮和土壤全磷均随草地退化程度的加剧而显著减少(<0.05),土壤含水量SWC也呈下降趋势,这与杨馥铖[23]、姚宝辉[24]等的研究结果相一致.与之相反,土壤电导率EC随退化程度的加剧而增大,土壤pH值随草地退化程度的加重也呈增大趋势.这与Li等[25]的研究结果一致.随着高寒草甸退化的加剧,SWC、SOC、TN和TP含量均显著降低,土壤pH值随着退化程度的增加而显著增加.造成这种结果的原因可能是无节制地放牧,于是,当草地自身不足以承载高强度的放牧时,草地土壤、植被发生退化,导致土壤有机质输入量下降,土壤养分含量降低.
3.2 高寒退化草地对土壤微生物群落的影响
土壤微生物能够对作物的生长发育产生有益影响,并且对土壤结构的形成发育、土壤有机质的分解和养分的转化、物质循环等均有十分重要的影响[26].有研究发现,未退化草地土壤细菌的多样性指数(Shannon-wiener index)、chao1指数都显著高于退化草地[27].本研究结果发现,随草地退化程度的加深,土壤细菌多样性指数(Shannon-wiener index)和Chao1指数均先降低后增大,整体变化趋势是下降趋势.这可能是因为草地土壤退化导致土壤养分降低,进而影响土壤细菌的生长繁殖,从而降低了土壤细菌群落多样性.土壤真菌Chao1指数变化趋势与细菌相同,而土壤真菌多样性指数(Shannon-wiener index)是先下降后增加,但真菌群落多样性在重度退化时最大,这与李海云等[28]的研究结果相似.造成这种情况可能的原因是随着草地退化程度的加深,土壤环境更加恶劣,但有些真菌对恶劣环境的适应性更强,具有更强的生存竞争力,因此土壤真菌的群落多样性增大[29].
不同退化草地土壤检出的细菌OTU数量多于真菌,细菌数量占优势,这与姚宝辉等[24]在甘南碌曲县尕海乡的研究结果一致.不同退化草地土壤细菌、真菌的相对丰度均有变化,但不同退化草地具有相似的优势菌群.细菌优势菌群为:变形菌门、放线菌门、厚壁菌门、酸杆菌门和绿弯菌门;真菌优势菌群为:子囊菌门、担子菌门、接合菌门和壶菌门.金志薇等[30]研究发现,滇西北高寒草地土壤细菌主要类群为放线菌门、变形菌门、绿弯菌门、酸杆菌门和蓝藻门.阚海明等[31]的研究结果发现,北京西北浅山区退化草地土壤的主要真菌菌群为:子囊菌门、接合菌门、担子菌门、球囊菌门和壶菌门.由此发现不同地区退化草地土壤微生物群落组成可能会有所不同,但整体优势菌群比较相似,差距较小.
3.3 高寒退化草地土壤微生物与土壤理化因子的关系
土壤微生物对于草地生态系统中的能量流动和物质转化具有重要作用[32].土壤含水量、pH值、有机碳含量等均会对土壤微生物的活性产生影响[33],而不同的微生物对土壤性质的变化也有不同的响应程度[34].草地退化直观表现为植被群落的变化,进而引起了土壤性质的变化.本研究通过RDA研究发现,土壤细菌群落受土壤电导率(<0.01)、土壤有机碳(<0.01)、土壤含水量(<0.01)、土壤全氮(<0.01)、土壤全磷(<0.01)和土壤pH值(<0.01)影响较大,土壤真菌群落受土壤全磷(<0.01)、土壤全氮(<0.01)和土壤有机碳(<0.05)影响较大.研究发现在退化草地中土壤细菌受土壤环境因子影响较大,这与朱怡等[35]的研究结果一致.可能的原因是细菌对土壤养分的依赖性更强,因此对于退化过程中土壤养分变化的响应也就更大.总体来看,退化草地中,土壤有机碳、土壤含水量、土壤电导率、土壤全氮、全磷、土壤pH值是土壤微生物群落分布的主要驱动因子.这与李海云等[8,28]的研究结果相类似.碳源、氮源、能源、无机盐、生长因子和水等是土壤微生物生长所需的主要营养要素,土壤微生物生长所需的碳源和能源依赖于有机碳,对土壤微生物的生长繁殖具有十分重要的影响[36],土壤全氮的影响次之.随着草地退化加剧,植被覆盖率降低,地上生物量减少,造成土壤有机质减少,土壤养分减少,肥力降低,使得土壤微生物生存环境恶劣,大大降低其活性及数量[37-38].土壤细菌和真菌的生长繁殖需要土壤有机质、全氮等养分的参与,而退化草地土壤养分含量较低,导致土壤有机质、全磷、全氮等养分下降.因此,土壤细菌和真菌数量也有所下降[39].
4 结论
4.1 玛曲县高寒草地土壤含水量、土壤有机碳、全氮、全磷的含量随退化加剧显著下降(<0.05),土壤含水量变化范围为19.50%~29.18%,土壤有机碳从无退化的55.93g/kg下降到重度退化的28.60g/kg,土壤全氮变化范围为1.75~4.07g/kg,土壤全磷由0.82g/kg下降到0.49g/kg;而土壤pH值和土壤电导率的变化趋势则与之相反,土壤pH值变化范围为7.27~7.71,土壤电导率变化范围为21.18~ 107.10mS/m.
4.2 通过高通量测序,分析得到NDG、LDG、MDG、SDG的细菌、真菌OTU数量分别为1927、2011、2040、1798以及1492、1511、1383、1466个;NDG、LDG、MDG、SDG特有的细菌、真菌OTU数量分别为588、513、691、409和116、112、73、79个.
4.3 玛曲县退化草地土壤微生物群落细菌数量占明显优势,多样性随草地退化整体下降.土壤细菌的优势菌群为:变形菌门、放线菌门、厚壁菌门、酸杆菌门和绿弯菌门,其中变形菌门在MDG的相对丰度达到最大为45%;土壤真菌优势菌群为:子囊菌门、担子菌门、接合菌门和壶菌门,子囊菌门在NDG的相对丰度最大为89%.
4.4 RDA分析中,土壤电导率、土壤有机碳、土壤含水量、土壤全氮、土壤全磷和土壤pH值是影响土壤细菌的主要土壤理化因子,土壤全磷、土壤全氮和土壤有机碳是影响土壤真菌的主要土壤理化因子.
[1] 许志信,郭丽珍.加强草原建设促进畜牧业发展 [J]. 内蒙古草业, 2000,(3):1-6.
Xu Z X, Guo L Z. Strenthenning grassland construction and promoting the development of animalhusbandry [J]. Inner Mongolia Pratacclture, 2000,(3):1-6.
[2] 员旭疆.重新认识草原的地位和作用 [J]. 中国畜牧业, 2001,(2):4.
Yuan X J. Re-understanding the position and function of grassland [J]. China Animal Industry, 2001,(2):4.
[3] 王庆国,建 原,晔薷罕,等.加强草原生态保护和建设实现全区草原资源的可持续发展 [J]. 内蒙古草业, 2009,21(4):1-4.
Wang Q G, Jian Y, Ye R H, et al. Strengthening grassland ecological protection and construction to realize the sustainable development of grassland resources in the whole region [J]. Inner Mongolia Pratacclture, 2009,21(4):1-4.
[4] 孙小弟,王彦龙.不同退化程度高寒草甸草地生物量及土壤养分差异 [J]. 青海畜牧兽医杂志, 2008,38(3):6-8.
Sun X D, Wang Y L. Difference of biomass and soil nutrition in alpine-cold meadow of different degraded degree [J]. Chinese Qinghai Journal of Animal and Veterinary Sciences, 2008,38(3):6-8.
[5] 周会程,周 恒,肖海龙,等.三江源区不同退化梯度高寒草原土壤重金属含量及其与养分和酶活性的变化特征 [J]. 草地学报, 2020,28(3):9.
Zhou H C, Zhou H, Xiao H L, et al. The variation characteristics of heavy metal content, nutrient and enzyme activity in soil of alpine steppe with different degradation gradient in the Three River- Headwaters Region [J]. Acta Agrestia Sinica, 2020,28(3):9.
[6] 阿依敏・波拉提,安沙舟,董乙强,等.巴音布鲁克高寒草原不同退化阶段土壤养分的变化 [J]. 新疆农业科学, 2017,54(5):953-960.
Ayimin Bolati, An S Z, Dong Y Q, et al. Changes of soil nutrients in different degradation stages of alpine steppe in bayanbulak [J]. Xinjiang Agricultural Sciences, 2017,54(5):953-960.
[7] 曾智科.三江源区高寒草甸土壤微生物季节动态及对草地退化的响应 [D]. 西宁:青海师范大学, 2009.
Zeng Z K. The seasonal dynamics of alpine meadow soil microorganisms and the response from grassland degradation in the area of Three River Source [D]. Xining: Qinghai Normal University, 2009.
[8] 李海云,姚 拓,张建贵,等.东祁连山退化高寒草地土壤细菌群落与土壤环境因子间的相互关系 [J]. 应用生态学报, 2018,29(11): 3793-3801.
Li H Y, Yao T, Zhang J G, et al. Relationship between soil bacterial community and environmental factors in the degraded alpine grassland of eastern Oilian Mountains, China [J]. Chinese Journal of Applied Ecology, 2018,29(11):3793-3810.
[9] 魏 强,王 芳,陈文业,等.黄河上游玛曲不同退化程度高寒草地土壤物理特性研究 [J]. 水土保持通报, 2010,30(5):16-21.
Wei Q, Wang F, Chen W Y, et al. Soil physical characteristics on different degraded alpine grasslands in Maqu County in Upper Yellow River [J]. Bulletin of Soil and Water Conservation, 2010,30(5):16-21.
[10] Coban O, De Deyn G B, van der Ploeg M. Soil microbiota as game-changers in restoration of degraded lands [J]. Science, 2022, 375(6584):abe0725.
[11] Fierer N, Wood S A, de Mesquita C P B. How microbes can, and cannot, be used to assess soil health [J]. Soil Biology and Biochemistry, 2021,153:108111.
[12] Harris J. Soil microbial communities and restoration ecology: Facilitators or followers [J]? Science, 2009,325(5940):573–574.
[13] 褚 琳.黄河源玛曲高寒湿地生态退化与修复适宜性评价研究 [D]. 武汉:华中农业大学, 2012.
Chu L. The research on degradation and restoration suitability assessment of Yellow River Source Alpine Wetlands in Maqu [D]. Wuhan: Huazhong Agricultural University, 2012.
[14] 韩海涛,祝小妮.气候变化与人类活动对玛曲地区生态环境的影响 [J]. 中国沙漠, 2007,27(4):608-613.
Han H T, Zhu X N. Climate change and human activities of Maqu area and lts lmpact on eco-environment [J]. Journal of Desert Research, 2007,27(4):608-613.
[15] 黄国勇,韩茂莉,陈兴鹏.玛曲国家级生态功能保护区分区研究 [J]. 地理与地理信息科学, 2003,19(2):5.
Huang Y L, Han M L, Chen X P. A study on the regionalization of Maqu national ecological function reserve [J]. Geography and Geo-Information Science, 2003,19(2):5.
[16] GB 19377-2003 天然草地退化、沙化、盐渍化的分级指标 [S].
GB 19377-2003 Parameters for degradation, sandification and salification of rangelands [S].
[17] 浦 滇,石 明,周雪孟,等.基于高通量绝对定量对不同树龄茶树土壤细菌群落多样性的研究 [J]. 西南农业学报, 2022,35(1):186-193.
Pu D, Shi M, Zhou X M, et al. Soil bacterial community diversity of tea plants with different ages based on high-throughput absolute quantification [J]. Southwest China Journal of Agricultural Sciences, 2022,35(1):186-193.
[18] 蔡丽琼,陈 瑞,杨德强,等.基于高通量测序的天麻连作根际土壤真菌群落多样性分析 [J]. 中国麻业科学, 2022,44(6):321-330.
Cai L Q, Chen R, Yang D Q, et al. Analysis of fungal community diversity in rhizosphere soil of the continuous cropping gastrodia elata based on the high-throughput sequencing [J]. Plant Fiber Sciences in China, 2022,44(6):321-330.
[19] 鲁如坤.土壤农业化学分析方法 [M]. 北京:中国农业科技出版社, 2000:106-168.
Lu R K. Methods for agrochemical analysis of soils [M]. Beijing: China Agricultural Science and Technology Press, 2000:106-168.
[20] 鲍士旦.土壤农化分析第3版 [M]. 北京:中国农业出版社, 2000:22- 76.
Bao S D. Soil agrochemical analysis (3rd Edition) [M]. Beijing: China Agriculture Press, 2000:22-76.
[21] 吴 昊,王理德,宋达成,等.民勤退耕区不同年限退耕地土壤理化性质及酶活性 [J]. 干旱地区农业研究, 2021,39(1):191-199.
Wu H, Wang L D, Song D C, et al. Soil properties and enzyme activities of abandonedfarmland in different years in Minqin [J]. Agricultural Research in the Arid Areas, 2021,39(1):191-199.
[22] 张瑜斌,邓爱英,庄铁诚,等.潮间带土壤盐度与电导率的关系 [J]. 生态环境, 2003,(2):164-165.
Zhang Y B, Deng A Y, Zhuang T C. Relation between soil salinity in intertidal zone and electric conductivity [J]. Ecology and Environmental Sciences, 2003,12(2):164-165.
[23] 杨馥铖,刘昌义,胡夏嵩,等.黄河源区不同退化程度高寒草地理化性质及复合体抗剪强度研究 [J]. 干旱区研究, 2022,39(2):12.
Yang F C, Liu C Y, Hu X S, et al. Study on physical and chemical properties and shear strength characteristics of root-soil composite system with different degradation degrees of alpine grassland in the source region of the Yellow River [J]. Arid Zone Research, 2022,39(2):12.
[24] 姚宝辉,王 缠,张 倩,等.甘南高寒草甸退化过程中土壤理化性质和微生物数量动态变化 [J]. 水土保持学报, 2019,33(3):8.
Yao B H, Wang C, Zhang Q, et al. Dynamic characteristics of soil physicochemical properties and microbial quantity during the degradation of Gannan Alpine Meadow [J]. Journal of Soil and Water Conservation, 2019,33(3):8.
[25] Li H, Qiu Y, Yao T, et al. Nutrients available in the soil regulate the changes of soil microbial community alongside degradation of alpine meadows in the northeast of the Qinghai-Tibet Plateau [J]. Science of The Total Environment, 2021,792:148363.
[26] 李延茂,胡江春,汪思龙,等.森林生态系统中土壤微生物的作用与应用 [J]. 应用生态学报, 2004,15(10):4.
Li Y M, Hu J C, Wang S L, et al. Function and application of soil microorganisms in forest ecosystem [J]. Chinese Journal of Applied Ecology, 2004,15(10):4.
[27] 王英成,姚世庭,金 鑫,等.三江源区高寒退化草甸土壤细菌多样性的对比研究 [J]. 生态环境学报, 2022,31(4):695-703.
Wang Y C, Yao S T, Jin X, et al. Comparative study on soil bacterial diversity of degraded alpine meadow in the Sanjiangyuan Region [J]. Ecology and Environmental Sciences, 2022,31(4):695-703.
[28] 李海云,姚 拓,高亚敏,等.退化高寒草地土壤真菌群落与土壤环境因子间相互关系 [J]. 微生物学报, 2019,59(4):11.
Li H Y, Yao T, Gao Y M, et al. Relationship between soil fungal community and soil environmental factors indegraded alpine grassland [J]. Acta Microbiologica Sinica, 2019,59(4):11.
[29] 陆 梅.纳帕海湿地退化对土壤微生物群落结构及多样性的影响 [D]. 北京:北京林业大学, 2018.
Lu M. Effects of wetlands degradation on structure and biodiversity of soil microbial community in Napahai plateau wetlands [D]. Beijing: Beijing Forestry University, 2018.
[30] 金志薇,钟文辉,吴少松,等.植被退化对滇西北高寒草地土壤微生物群落的影响 [J]. 微生物学报, 2018,58(12):2174-2185.
Jin Z W, Zhong W H, Wu S S, et al. Effect of vegetation degradation on microbial communities in alpine grassland soils in Northwest Yunnan [J]. Acta Microbiologica Sinica, 2018,58(12):2174-2185.
[31] 阚海明,庞 卓,陈 超,等.北京西北浅山区退化草地植被恢复对土壤微生物群落多样性的影响 [J]. 草地学报, 2022,30(6):1350-1358.
Kan H M, Pang Z, Chen C, et al. Changes in soil microbial communities following the vegetation restoration of degraded sandy grassland in Beijing [J]. Acta Agrestia Sinica, 2022,30(6):1350-1358.
[32] Steenwerth K L, Jackson L E, Calderón F J, et al. Soil microbial community composition and land use history in cultivated and grassland ecosystems of coastal California [J]. Soil Biology and Biochemistry, 2003,34(11):1599-1611.
[33] Nie X, Li Z, Huang J, et al. Thermal stability of organic carbon in soil aggregates as affected by soil erosion and deposition [J]. Soil and Tillage Research, 2018,175:82-90.
[34] Huang J, Li Z, Zeng G, et al. Microbial responses to simulated water erosion in relation to organic carbon dynamics on a hilly cropland in subtropical China [J]. Ecological Engineering, 2013,60:67-75.
[35] 朱 怡,吴永波,安玉亭.基于高通量测序的禁牧对土壤微生物群落结构的影响 [J]. 生态学报, 2022,42(17):7137-7146.
Zhu Y, Wu Y B, An Y T. Effects of grazing prohibition on soil microbial community structure based on high-throughput sequencing [J]. Acta Ecologica Sinica, 2022,42(17):7137-7146.
[36] 谢龙莲,陈秋波,王真辉,等.环境变化对土壤微生物的影响 [J]. 热带农业科学, 2004,24(3):39-47.
Xie L L, Chen Q B, Wang Z H, et al. Effects of environmental changes on soil microorganisms [J]. Chinese Journal of Tropical Agriculture, 2004,24(3):39-47.
[37] Bokulich N A, Subramanian S, Faith J J, et al. Quality-filtering vastly improves diversity estimates from Illumina amplicon sequencing [J]. Nature Methods, 2013,10(1):57-59.
[38] Caporaso J G, Kuczynski J, Stombaugh J, et al. QIIME allows analysis of high-throughput community sequencing data [J]. Nature methods, 2010,7(5):335-336.
[39] 姚宝辉,王 缠,郭怀亮,等.人工草地建设对甘南草原土壤理化特性和微生物数量特征的影响 [J]. 水土保持学报, 2019,33(1):192-199.
Yao B H, Wang C, Guo H L, et al. Effects of artificial supplementary sowing on soil physical and chemical characteristics and microorganism quantity in Gannan Grassland [J]. Journal of Soil and Water Conservation, 2019,33(1):192-199.
Soil-microbe characterization and interaction in alpine degraded grassland in Maqu county.
WANG Min, LIU Min-xia*, WANG Qian-yue, MIAO Le-le, YANG Chun-liang, XIAOYin-di
(School of Geography and Environmental Science, Northwest Normal University, Lanzhou 730070, China)., 2023,43(12):6482~6489
In this paper, four kinds of alpine grassland with different degradation levels in Maqu county, Gannan Tibetan Autonomous Prefecture, Gansu Province, were used as the research objects, and soil physicochemical factors and soil microbial community characteristics were measured and analyzed. The results showed that the soil water content, soil organic carbon, total nitrogen, and total phosphorus decreased significantly (<0.05) with increased grassland degradation. In contrast, the trends of soil pH and soil electrical conductivity were opposite. Through high-throughput sequencing, we analyzed and obtained the numbers of bacterial and fungal OTUs in no, light, moderate, and severely degraded grassland were 1927, 2011, 2040, 1798 and 1492, 1511, 1383, 1466; the numbers of bacterial and fungal OTUs specific to no, light, moderate and severely degraded grassland were 588, 513, 691, 409 and 116, 112, 73, 79. The number of soil microbial community bacteria dominated significantly, and the diversity decreased with the degradation of grassland as a whole. The relative abundance of the dominant group of soil bacteria, Proteobacteria, reached a maximum of 45% in the moderately degraded grassland; the relative abundance of the dominant group of soil fungi, Ascomycota, reached a maximum of 89% in the non-degraded grassland. Through RDA analysis, it was obtained that soil electrical conductivity, organic carbon, water content, total nitrogen, total phosphorus and pH were the main influence factors of soil bacteria, and soil total phosphorus, total nitrogen, and organic carbon were the main influence factors of soil fungi.
Maqu county;degraded grassland;soil microorganisms;high-throughput sequencing technology;redundancy analysis
X53
A
1000-6923(2023)12-6482-08
王 敏,刘旻霞,王千月,等.玛曲高寒退化草地土壤-微生物特征及相互作用 [J]. 中国环境科学, 2023,43(12):6482-6489.
Wang M, Liu M X, Wang Q Y, et al. Soil-microbe characterization and interaction in alpine degraded grassland in Maqu county [J]. China Environmental Science, 2023,43(12):6482-6489.
2023-04-28
甘肃省高校产业支撑计划项目(2023CYZC-21)
* 责任作者,教授,xiaminl@163.com
王 敏(1998-),女,山西朔州人,西北师范大学硕士研究生,研究方向为土壤微生物和恢复生态学.17852325851@139.com.
