高危前列腺癌围手术期综合治疗专家共识(2023年版)
2024-01-05中国抗癌协会男性生殖系统肿瘤专业委员会
中国抗癌协会男性生殖系统肿瘤专业委员会
前列腺癌是国内外常见的恶性肿瘤。相关诊疗指南[1]建议将前列腺癌按照多种风险因素进行分层,作为指导不同危险分层治疗决策的基础以及预测确切性治疗后复发风险的依据。在新诊断的临床局限性前列腺癌中,15% ~ 20%的患者属于高危阶段[2]。这类患者以根治性手术或根治性放疗为主,并同时辅助进行18 ~ 36个月的雄激素剥夺治疗(androgen deprivation therapy,ADT),能有效地改善患者预后,但依然有超过50%的高危前列腺癌患者会在10年内不可避免地出现生化复发。研究[2-4]提示10年内死于前列腺癌的患者中有66%来自高危前列腺癌。
尽管为了避免或降低局部治疗后较高的复发风险,新辅助治疗是当前高危前列腺癌患者值得积极尝试的治疗策略,但对于手术前是否进行新辅助治疗仍然存在争议。近年来随着新药的不断研发,新辅助治疗在高危前列腺癌领域中的应用取得一定成果。本课题组召集相关专家,通过查阅文献,针对高危前列腺癌围手术期的新辅助治疗和术后辅助治疗进行探索、讨论,旨在为临床医师开展高危前列腺癌患者围手术期的治疗提供指导意见。
本共识已在国际实践指南注册平台(International Practice Guideline Registry Platform,IPGRP)上注册,注册号为PREPARE-2023CN452。
1 共识的制定方法
1.1 共识专家构成
共有78名来自上海、山东、四川、黑龙江、辽宁、吉林、北京、天津、陕西、江苏、浙江、福建、江西、广东、广西、内蒙古、新疆等23个省市自治区,33个不同城市的专家参与问卷咨询与调研,所有的专家均具有泌尿外科一线临床实践经验,98.7%(77/78)的专家来自三级甲等医院。
1.2 文献检索方法
检索的英文数据库包括PubMed、Embase和Cochrane Library,中文数据库包括中国知网、万方数据库、维普数据库及中国生物医学文献数据库,检索时限均为建库至2023年7月10日,英文文献检索词主要包括prostate cancer、high-risk、perioperative、comprehensive treatment、expert consensus management、therapeutic strategies、preoperative、postoperative、multimodal therapy、adjuvant therapy、neoadjuvant therapy、radiotherapy、hormone therapy;中文文献检索词主要包括高危前列腺癌、前列腺癌、围手术期、综合治疗、专家共识、治疗策略、术前新辅助治疗、术后辅助治疗、多模式治疗。对于前列腺癌的新辅助治疗和术后辅助治疗的有效性、安全性、评估指标,我们纳入了系统评价、meta分析、随机对照试验、队列调查、病例对照调查和病例报告等类型的文献,同时也包括与高危前列腺癌相关的指南、共识和综述。我们排除了非中英文、学位论文、索引、无法获得完整版本及重复发表的文献。经过文献的搜寻、筛选和证据汇总后,开始编写初步的草稿。
1.3 德尔菲问卷调查法
采用德尔菲问卷调查法就高危前列腺癌围手术期综合治疗进行专家函询。投票设置“非常同意”、“基本同意”、“不确定或不同意”3个选项,专家可对每个章节提出修改意见。每次调查结束后,根据专家的反馈意见对“稿件”进行修改或增补。参考相关共识形成方法,若同意率(即选择“非常同意”或“基本同意”的专家人数比例)≥75%则认为该章节达成共识。
1.4 证据分级方法
专家小组对证据和共识的分类采用推荐意见分级的评估、制定及评价(Grading of Recommendations, Assessment, Development and Evaluation,GRADE)系统[5](表1)。

表1 GRADE系统的证据质量与推荐强度分级
2 结果
2.1 问卷收集情况
共开展了2次问卷调查,78名专家参与问卷填写,收集了89条专家建议。汇总分析2次问卷数据,基于审核专家的一致意见,删除了部分内容,调整或增加专家意见,最终纳入本共识的内容均达成共识,最后经审核并部分修改后定稿。
2.2 共识达成情况
2.2.1 高危前列腺癌的定义
根据欧洲泌尿外科协会及美国国立综合癌症网络等前列腺癌指南描述,前列腺癌的危险分层模型主要依据患者的血清前列腺特异性抗原(prostate-specific antigen,PSA)水平、穿刺活检的Gleason评分及临床TNM分期进行划分[6]。本共识中,高危前列腺癌包括器官局限性高危/极高危前列腺癌和局部进展性前列腺癌。高危/极高危具体定义为PSA>20 ng/mL、活检Gleason评分≥8分、临床T分期为cT2c期或以上,3项指标至少具备其中之一,且没有远处转移。局部进展通常指仅盆腔淋巴结转移[1,7-8]。
2.2.2 围手术期新辅助药物治疗的理论依据
常见恶性肿瘤(如乳腺癌、卵巢癌等)中已有大量研究证实针对高危患者,新辅助治疗能改善患者预后,延长患者疾病无进展生存期(progression-free survival,PFS)乃至总生存期(overall survival,OS)[9-10]。高危前列腺癌同样存在恶性程度高、分期偏晚等特征,且可能存在影像学检查尚无法发现的微转移[11]。因此,术前新辅助药物治疗的对象,通常指具备有效的局部手术治疗方案的恶性肿瘤患者,在确切的局部治疗前采用诱导治疗,能减轻术前的肿瘤负荷、降低手术难度、减少切缘阳性发生率,同时治疗潜在的微转移,避免或延缓局部治疗后较高的复发风险。高危前列腺癌术前新辅助药物治疗的时长尚无定论,以3 ~ 6个月为主,需要通过术前再次影像学评估[磁共振成像、全身骨扫描、正电子发射计算机体层显像(positron emission tomography and computed tomography,PET/CT)等]、直肠指诊及血清PSA变化综合判断新辅助治疗效果。以病理学完全缓解(pathological complete response,pCR)为目标的新辅助治疗疗程通常以6个月为妥。
2.2.3 一代抗雄激素药物为主的新辅助治疗
20世纪90年代开始,比卡鲁胺、氟他胺等一代抗雄激素药物,与常见ADT药物一起广泛用于晚期前列腺癌治疗。一代抗雄激素药物为主的新辅助治疗高危前列腺癌主要循证医学证据见表2。在新辅助治疗阶段,也有进行不同药物间组合治疗的研究报道。Meta分析[12]结果显示,ADT联合一代抗雄激素药物治疗能够使前列腺体积缩小和PSA水平下降,肿瘤组织内雄激素水平下降,切缘阳性率及临床分期降低,精囊侵犯减少,以及淋巴结转移侵袭减少。
中长期随访预后情况方面,Gravina等[13]的研究报告首次提示新辅助治疗对比即刻手术组,PSA复发升高率差异无统计学意义,也无法延长无生化复发时间或改善OS[12,14]。随后,一项针对1 170例高危前列腺癌行根治性手术患者的回顾性研究[15]提示新辅助内分泌治疗联合术后辅助放疗能降低前列腺癌的死亡风险,5年特异死亡率降低到2.3%(对照组为7.5%)。因此,单一新辅助一代抗雄激素药物治疗对中长期预后的改善尚未达成广泛共识。
2.2.4 新型雄激素受体信号抑制剂(androgen receptor signalling inhibitors,ARSI)为主的新辅助治疗
新型ARSI包括CYP17酶抑制剂(阿比特龙)、二代抗雄激素药物(恩扎卢胺、阿帕他胺、瑞维鲁胺、达罗他胺),是近年来推出的对于前列腺癌不同疾病阶段有治疗效果的新型内分泌治疗药物。在转移性激素敏感、转移性去势抵抗及非转移性去势抵抗阶段,研究证实ADT联合新型ARSI药物治疗显示出实质性的生存获益,能延缓前列腺癌患者影像学进展,减轻疼痛和延缓PSA复发,并延长患者生存期[16]。
在新辅助药物治疗领域,伴随药物研发和临床运用,越来越多的证据显示ADT联合新型ARSI治疗,不仅有助于缩瘤降期、降低手术难度、减少切缘阳性[17],也能改善患者的PFS[18]。
2.2.4.1 ADT联合一种新型ARSI药物
目前常用新辅助内分泌治疗方案以ADT联合单一新型ARSI药物为主。几乎所有已知的新型ARSI药物都在新辅助治疗方案中进行了探索。
⑴ ADT联合阿比特龙
早在2014年就首次有研究[19]探索了ADT联合阿比特龙+泼尼松的术前新辅助内分泌治疗方案,与单独ADT治疗相比,联合用药能够显著降低患者前列腺组织内的雄激素水平。ADT联合阿比特龙治疗高危前列腺癌主要循证医学证据见表3。使用3个月,pCR率及最小肿瘤残留(minimum tumor residual,MRD)率等前列腺肿瘤负荷指标降低48%,切缘阳性率降低到19%;使用6个月肿瘤负荷降低率达62%,切缘阳性率降低到10%。2019年报道65例高危前列腺癌ADT联合阿比特龙+泼尼松对比ADT单药的研究[20],3个月新辅助内分泌治疗显著缩小肿瘤体积,降低肿瘤细胞密度。长期随访结果显示,联合治疗后肿瘤体积越小的患者,生化复发(biochemical recurrence,BCR)率越低,有力证实ADT联合阿比特龙+泼尼松联合治疗能改善无生化复发生存时间。值得注意的是,与单独ADT治疗相比,患者对联合治疗的耐受性良好,没有增加根治手术的并发症。
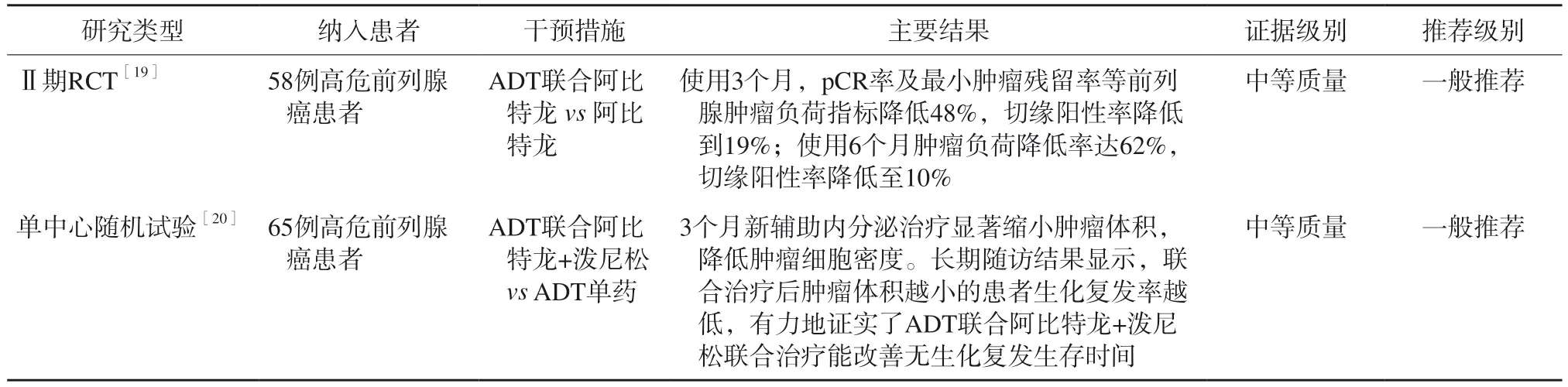
表3 ADT联合阿比特龙治疗高危前列腺癌患者的主要循证医学证据
⑵ ADT联合恩扎卢胺
ADT联合恩扎卢胺治疗高危前列腺癌主要循证医学证据见表4。2017年一项纳入48例中高危前列腺癌患者的研究[21]比较了恩扎卢胺单药与恩扎卢胺联合ADT及度他雄胺的新辅助治疗的效果。患者在接受6个月的治疗后行根治手术,结果显示,恩扎卢胺单药组,患者均未实现pCR,9例(36%)实现MRD;联合治疗组,23例患者中1例(4.3%)实现pCR,17例(73.9%)实现MRD,明显优于单药治疗组。
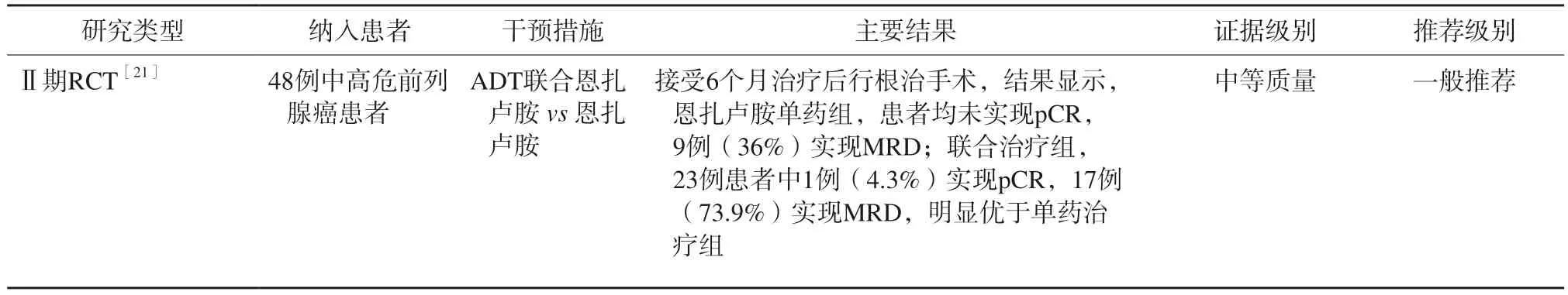
表4 ADT联合恩扎卢胺治疗高危前列腺癌患者的主要循证医学证据
⑶ ADT联合阿帕他胺
ADT联合阿帕他胺治疗高危前列腺癌主要循证医学证据见表5。2022年小型单中心NEAR试验[22-23]研究30例中高危前列腺癌患者在根治术前接受3个月ADT联合阿帕他胺新辅助治疗的效果,提示术前新辅助阿帕他胺治疗,对患者的整体健康和生活质量评分没有负面影响,但12周的治疗尚未达到pCR的主要终点,同时考虑该研究的病例数较少,用药时长较短,因此证据等级不高。目前关于阿帕他胺大型的随机、对照、Ⅲ期试验(PROTEUS)正在进行中,计划招募2 500例高危前列腺癌受试者,主要终点为pCR率和无转移生存期(metastasis-free survival,MFS),预计2024年完成最后数据录入,2027年发布初步随访结果[24]。

表5 ADT联合阿帕他胺治疗高危前列腺癌患者的主要循证医学证据
⑷ ADT联合瑞维鲁胺
瑞维鲁胺作为国内原研的新型ARSI药物,能有效抑制雄激素受体核转位及转录活性、前列腺癌细胞的增殖和PSA分泌,且血脑屏障渗透率较低。ADT联合瑞维鲁胺治疗高危前列腺癌主要循证医学证据见表6。根据CHART研究[25],ADT联合瑞维鲁胺在转移性激素敏感前列腺癌患者中运用,瑞维鲁胺组的2年影像PFS(radiographic PFS,rPFS)率为72.3%,比卡鲁胺组为50.0%;2年OS率为81.6%,比卡鲁胺组为70.3%。提示瑞维鲁胺能显著提高中位rPFS,明显延长了患者的OS。
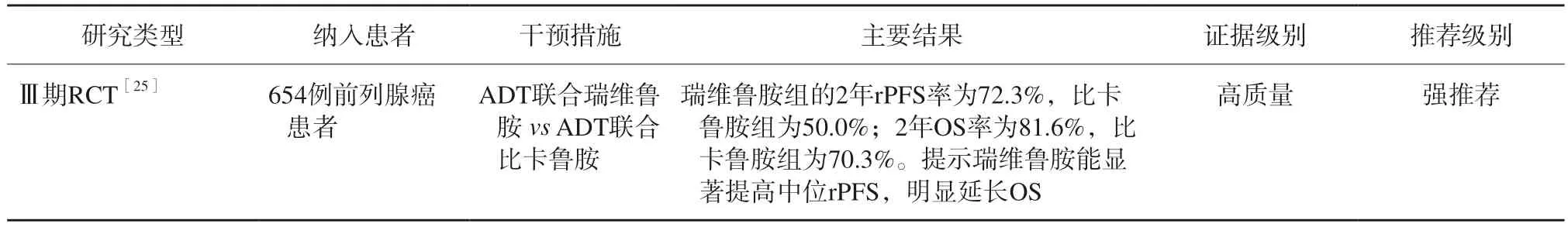
表6 ADT联合瑞维鲁胺治疗高危前列腺癌患者的主要循证医学证据
随后,2021年启动了ADT联合瑞维鲁胺在局限高危或局部晚期前列腺癌患者围手术期的多中心、随机、对照、双盲的Ⅲ期临床研究(NCT05009290),主要研究目的是通过pCR率和MFS来评价ADT联合瑞维鲁胺治疗局限高危或局部晚期前列腺癌患者的有效性,并探索PSA应答率、切缘阳性率、至BCR时间等关键指标。计划入组1 256例患者,是目前针对中国人群研究人数最多的新辅助治疗新药试验,其结果对中国前列腺癌患者的治疗最有指导意义。目前仍在患者招募中,预估2023年底初步得出相关结论。考虑到瑞维鲁胺在转移性激素敏感阶段良好的治疗效果[25],它在新辅助治疗阶段中的疗效值得期 待。
2.2.4.2 ADT联合两种新型ARSI药物
⑴ ADT联合阿比特龙+阿帕他胺
ADT联合阿比特龙+阿帕他胺治疗高危前列腺癌主要循证医学证据见表7。Graham等[26]探索了20例患者新辅助治疗接受12周的ADT联合阿帕他胺+阿比特龙的单臂研究,结果显示,1例患者实现pCR,6例患者实现MRD,治疗耐受性良 好。
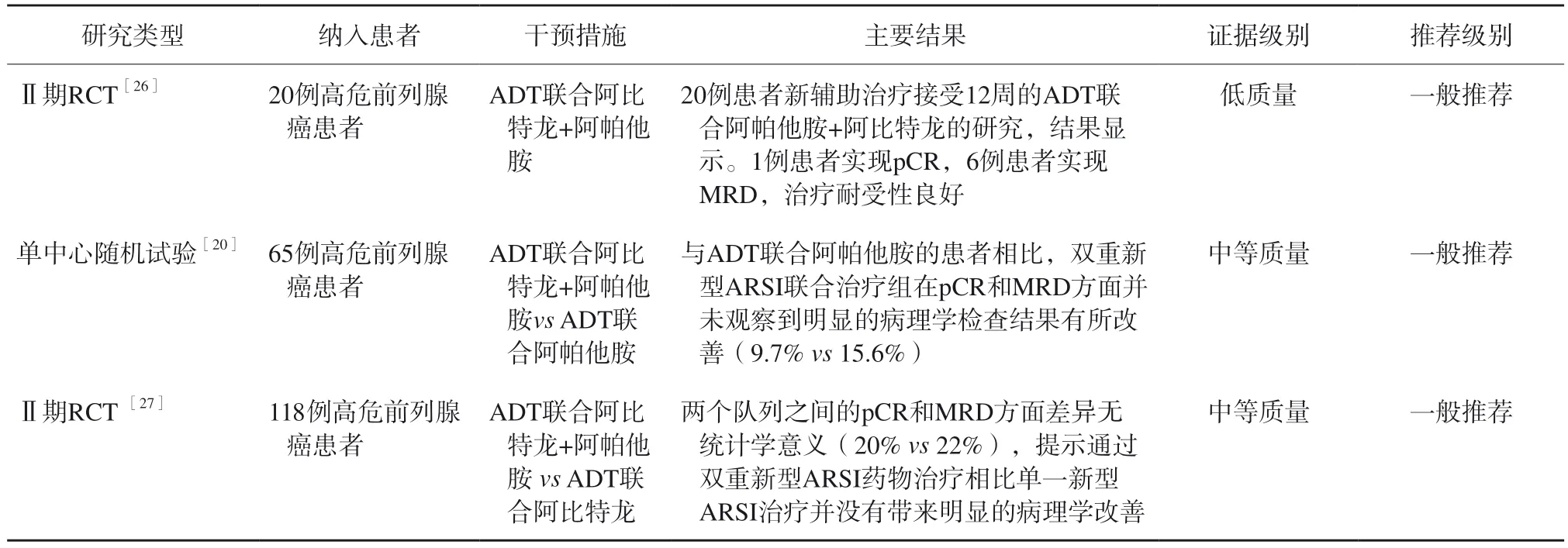
表7 ADT联合阿比特龙+阿帕他胺治疗高危前列腺癌患者的主要循证医学证据
但采用RCT后结论不一。65例高危前列腺癌患者被随机分配接受6个月的ADT联合阿帕他胺或ADT联合阿比特龙+阿帕他胺治疗。阿帕他胺和阿比特龙都是新型内分泌治疗药物,但与ADT联合阿帕他胺的患者相比,双重新型ARSI联合治疗组在pCR和MRD方面并未观察到明显的病理学检查结果有所改善(9.7%vs15.6%)[20]。进一步调整治疗方案,118例高危前列腺癌患者随机分配接受ADT联合阿比特龙或ADT联合阿比特龙+阿帕他胺。同样在两个队列之间的pCR和MRD方面差异无统计学意义(20%vs22%),提示通过双重新型ARSI药物治疗相比单一新型ARSI治疗并没有带来明显的病理学改善[27]。
⑵ ADT联合阿比特龙+恩扎卢胺
ADT联合阿比特龙+恩扎卢胺治疗高危前列腺癌主要循证医学证据见表8。McKay等[28]探索了中高危前列腺癌患者接受ADT联合阿比特龙+恩扎卢胺对比ADT联合恩扎卢胺的疗效。结果显示,虽然2种新型ARSI联合治疗组患者的pCR/MRD率更高(30%vs16%),但差异无统计学意义,PSA反应率方面两组结果相似,术中和术后并发症差异无统计学意义。

表8 ADT联合阿比特龙+恩扎卢胺治疗高危前列腺癌患者主要的循证医学证据
共识专家组讨论认为,2种新型ARSI药物联合治疗较单一新型ARSI治疗并不具备病理学反应及预后方面的优势,当前阶段不推荐在新辅助阶段使用2种新型ARSI药物联合进行治疗。
2.2.5 ADT联合化疗、其他药物的新辅助治疗
有证据[29-30]表明,多西他赛静脉化疗和内分泌治疗的组合对高危前列腺癌具有协同增效的作用。ADT联合化疗、其他药物的新辅助治疗高危前列腺癌主要循证医学证据见表9。一项针对177例高危前列腺癌的研究[31]结果显示,新辅助化疗联合内分泌治疗组有6例(6/42,14%)患者出现BCR,中位时间19个月;优于新辅助内分泌治疗组(BCR率为47%,中位时间13个月)和即刻手术组(BCR率为81%,中位时间9个月)。
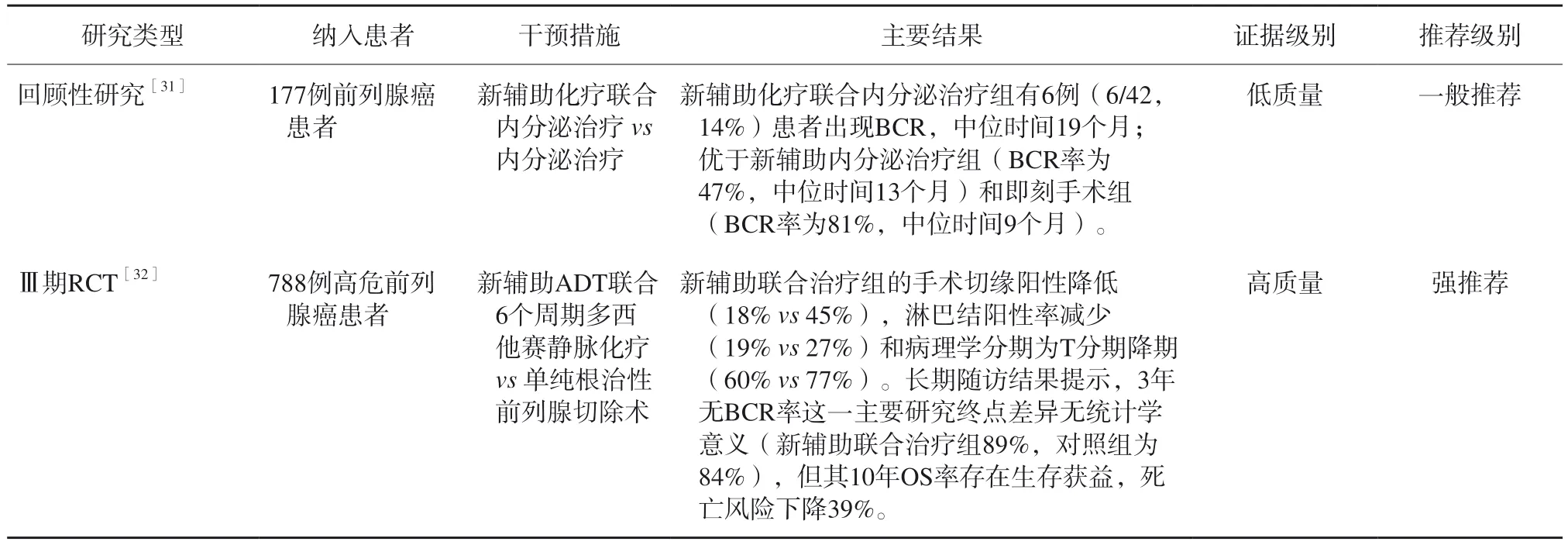
表9 ADT联合化疗、其他药物的新辅助治疗高危前列腺癌患者的主要循证医学证据
大型Ⅲ期PUNCH试验[32]纳入788例高危前列腺癌患者,比较单纯根治性前列腺切除术与手术前新辅助ADT联合6个周期多西他赛静脉化疗的数据。结果显示,新辅助联合治疗组的手术切缘阳性降低(18%vs45%),淋巴结阳性率减少(19%vs27%),病理学分期为T分期降期(60%vs77%) 。长期随访结果提示,3年无BCR率这一主要研究终点差异无统计学意义(新辅助联合治疗组为89%,对照组为84%),但其10年OS率存在生存获益,死亡风险下降39%。
共识专家组讨论认为,术前新辅助化疗对降期缩瘤、降低手术难度等方面有积极影响,尤其对术前明确有内脏及淋巴结转移的患者有明显获益。但目前尚没有足够证据支持术前新辅助化疗对患者预后的改善作用,还需要更长的研究时间以及在更大的研究人群中进行探索。
其他一些如多腺苷二磷酸核糖聚合酶(polyadenosine diphosphate ribose polymerase,PARP)抑制剂、前列腺特异性膜抗原标记的核素镥177(Lutetium177-prostate specific membrane antigen,177Lu-PSMA)等既往用于转移性去势抵抗型前列腺癌治疗的药物,也在围手术期新辅助治疗阶段运用过程中进行了疗效和安全性的探索。目前多数处于患者招募和治疗过程的注册研究中,有研究报道将氟唑帕利联合阿比特龙用于术前新辅助治疗24周,相关药物不良反应包括贫血、低钾血症和肝功能障碍,患者总体围手术期耐受性良好,但由于随访时间较短,尚未明确对生存预后的影响[33]。
2.2.6 术前新辅助治疗的效果评价
OS是评价治疗效果的最佳指标,但前列腺癌患者需要较长时间随访,且存在多线治疗的影响。MFS是这类患者OS的良好替代指标,但也需要注意高危患者根治术后辅助治疗的影响[16]。高危前列腺癌患者术前新辅助治疗的疗效评价的主要循证医学证据见表10。

表10 高危前列腺癌患者术前新辅助治疗的疗效评价的主要循证医学证据
多数新辅助治疗的疗效评价主要依据术后组织标本的病理学变化。最主要的病理学评估指标为pCR率。pCR的定义是新辅助治疗后行根治手术的病理学标本中未见到任何肿瘤残留,相比于其他瘤种的新辅助治疗后pCR率可达10% ~ 20%,前列腺癌的pCR率较低,往往小于5%[34]。因此,通常需要pCR联合采用其他指标共同完成前列腺癌新辅助治疗效果的评价。目前最常用的指标为MRD,其定义为新辅助治疗后仍残存于体内的微小癌病灶直径≤5 mm。MRD的优点在于可以从一定程度上通过根治性前列腺切除术(radical prostatectomy,RP)术后前列腺病理学层面反映新辅助治疗效果,但也存在不足,主要在于患者术前肿瘤负荷存在差异,因此术后观测MRD值无法真实评估新辅助内分泌治疗的效果。同时肿瘤如呈多灶性分布,则评价MRD值存在一定困难,无法使用≤5 mm的方法去评估多病灶,并且MRD值无法体现新辅助治疗的缩瘤效果。因此,另一指标“肿瘤降期”亦可纳入对新辅助治疗的评估,因其在缩瘤疗效的评价上具备优势,通过对比治疗前后T分期,可反映治疗效果[28]。同时,还有学者使用术后前列腺病理组织形态预测患者预后,进而评价新辅助治疗的效果[35],其主要是将RP术后组织病理学形态分为3类:未见肿瘤细胞或孤立细胞、孤立或融合腺体结构、筛状肿瘤结构及导管内癌。结果显示,3组在预后方面差异有统计学意义,并且最后一组患者BCR率明显高于前两组。另外,ARNEO研究[36]显示,PSMA PET可用于评估和预测新辅助内分泌治疗后的病理学结局,为新辅助治疗效果的评估提供了新方法。
2.2.7 术后辅助治疗
高危前列腺癌单行手术治疗难以完全控制疾病进展,肿瘤复发率高。术后辅助治疗包括内分泌治疗和(或)放疗,目的是消灭术后瘤床的残余病灶、残余阳性淋巴结及其他部位的微小转移灶,提高患者的长期生存率。
2.2.7.1 辅助内分泌治疗
RP术后,辅助内分泌治疗能显著改善高危前列腺癌患者的预后[37]。
辅助内分泌治疗高危前列腺癌患者的主要循证医学证据见表11。即刻辅助内分泌治疗较延迟内分泌治疗能够显著改善pN1期患者的OS率[38]。一项前瞻性研究[39]纳入481例(Gleason评分≥8;pT3-4期,pN+期)接受辅助内分泌治疗的高危前列腺癌患者,平均随访11.2年,10年OS率为87%,无病生存(disease-free survival,DFS)率为72%。一项回顾性研究[40]分析372例接受术后辅助内分泌治疗的患者,其中160例pT3b期患者,5和10年的无生化进展生存率分别为80.91%和62.68%;64例pT4期患者,5和10年的无生化进展生存率分别为68.82%和49.78%。因此,建议对高危前列腺癌患者根治术后即刻行长期辅助内分泌治疗。目前国内外相关指南及文献对即刻辅助内分泌治疗缺乏明确的定义,且各临床研究报道的辅助治疗时长不尽相同。本共识专家组推荐辅助治疗在根治术后开始,至少维持18个月。
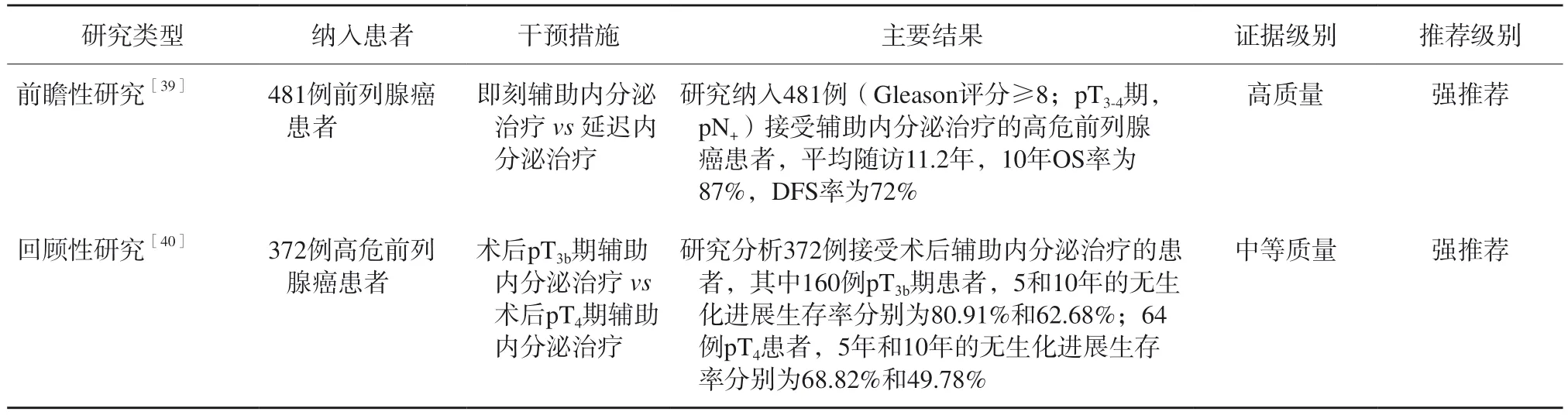
表11 辅助内分泌治疗高危前列腺癌患者的主要循证医学证据
2.2.7.2 辅助放射治疗
pT3-4期的前列腺癌患者根治术后的生化复发、临床进展及肿瘤特异性死亡风险较高。针对根治术后切缘阳性、pT3-4期等不良预后病理学特征,或伴有PSA持续存在(PSA无法降至0.1 ~ 0.2 ng/mL)的患者予以即刻辅助放疗可显著提高DFS和OS[41-42]。辅助放射治疗高危前列腺癌患者的主要循证医学证据见表12。另一项对超过26 000例患者的回顾性队列分析[43]发现,对RP术后具有不良特征的患者(Gleason 8 ~ 10,pT3-4期,pN1期)进行术后辅助放疗可显著降低患者死亡风险。此外,近期发表的3项RCT[44-46]对比了即刻辅助放疗与早期挽救性放疗的生存获益,结果显示,在随访4.90 ~ 6.25年时,两组患者的PFS差异无统计学意义;但研究中缺乏分层分析的数据及长期OS数据。因此,本共识专家组仅建议对前列腺癌根治术后具有预后不良的病理学特征(pT3-4期或切缘阳性等)的患者进行即刻辅助外放射治疗;对于复发高危因素较少、便于密切监测的患者,可推迟辅助放疗,必要时接受早期挽救性放疗。

表12 辅助放射治疗高危前列腺癌患者的主要循证医学证据
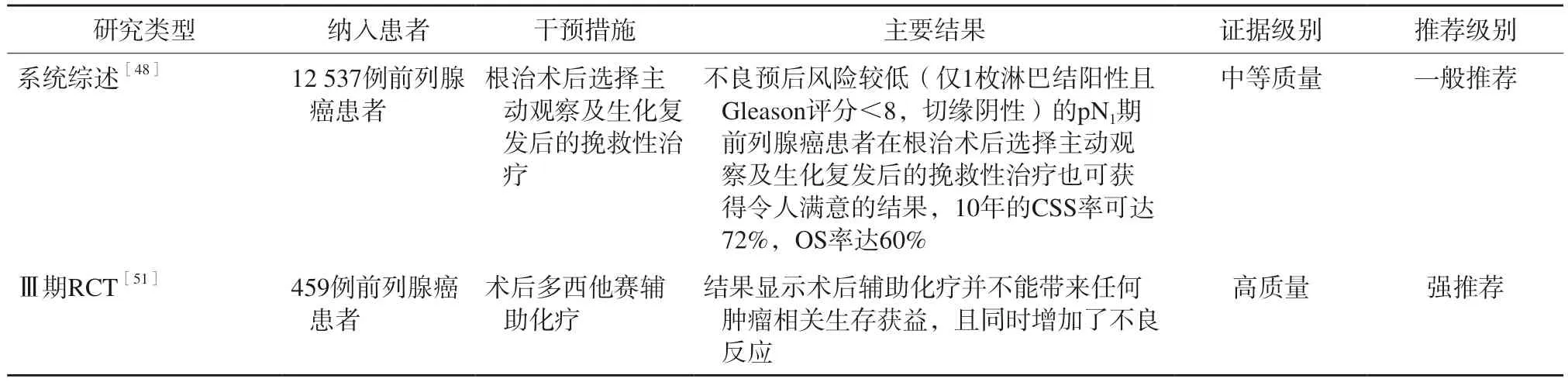
表13 主动观察及其他辅助治疗高危前列腺癌患者的主要循证医学证据
pN1期患者RP术后,对具有不良预后病理学特征(如分期≥pT3期、Gleason评分≥9、≥2枚阳性淋巴结或阳性切缘)的患者施行辅助内分泌治疗联合放疗,相比于观察/单纯内分泌治疗,可显著改善患者的OS。但没有任何不良病理学特征的患者不能从辅助联合治疗中获益[47]。因此,本共识专家组建议对前列腺癌患者根治术后pN1期伴有不良预后病理学特征的患者可选择内分泌治疗联合放疗。
2.2.7.3 主动观察及其他辅助治疗
虽然高危患者术后进行辅助治疗可显著改善预后,但仍有研究对风险因素较少的这类患者是否需要接受辅助治疗提出不同的看法。一项系统综述[48]显示,不良预后风险较低(仅1枚淋巴结阳性且Gleason评分<8,切缘阴性)的pN1期前列腺癌患者在根治术后选择主动观察及生化复发后的挽救性治疗也可获得令人满意的结果,10年的肿瘤特异生存(cancer-specific survival,CSS)率可达72%,OS率达60%。另有研究[49-50]表明,分期为pT3-4期的前列腺癌患者根治术后,如伴有不良病理学特征,术后即刻放疗是否能够获益仍存在争议。对于高危复发因素较少、便于密切监测的患者,可推迟辅助放疗,必要时接受术后早期挽救性放疗。因此,建议对于不良预后风险较低的高危前列腺癌根治术后患者也可行主动观察及生化复发后的挽救性治 疗。
一项Ⅲ期RCT[51]探索术后多西他赛辅助化疗在局部晚期前列腺癌患者中的价值,结果显示,术后辅助化疗并不能带来任何肿瘤相关生存获益,且同时增加不良反应。
3 总结
目前有一系列临床研究探索新型内分泌治疗药物在局部晚期前列腺癌术后辅助治疗中的效果,如INNOVATE NRG-GU008试验探索阿帕他胺术后辅助治疗在该类人群中的价值,EMBARK试验研究恩扎卢胺在挽救性治疗中的意义[52]。我们也期待会有不错的结果,以期为局部进展期前列腺癌患者的术后辅助治疗提供更多选择。本共识的制订希望能为广大临床医师对高危前列腺癌患者开展围手术期的治疗提供依据。
利益冲突声明:所有作者均声明不存在利益冲突。
本文作者承诺:作者间、作者与审稿人间、与指南/共识中出现的药物或器械厂商之间无利益冲突;本共识制订过程中无第三方进行赞助。
