炎症癌相关成纤维细胞介导结直肠癌细胞耐药的机制研究
2024-01-05蔡家洛朱锐秋曹亦军
蔡家洛,朱锐秋,李 森,曹亦军,黄 坊
1. 上海中医药大学附属普陀医院普外科,上海 200062;
2. 华东理工大学药学院,上海 200237;
3. 安徽医科大学上海普陀中心临床学院,上海 200062;
4. 上海中医药大学附属普陀医院病理科,上海 200062
结直肠癌(colorectal cancer,CRC)是常见的消化系统恶性肿瘤[1]。尽管针对癌症进展的新药不断涌现,但耐药性问题仍然是该领域的一个挑战[2]。近年来,肿瘤微环境(tumor microenvironment,TME)在化疗耐药中的重要性已广受关注[3]。癌相关成纤维细胞(cancer associated fibroblast,CAF)是TME的主要组成成分,其分泌的细胞因子、趋化因子等参与肿瘤的发生、增殖、侵袭、转移和耐药过程。CAF具有异质性,分为肌成纤维CAF(myofibroblastic CAF,myCAF)、炎症CAF(inflammatory CAF,iCAF)和抗原提呈CAF(antigenpresenting CAF,apCAF)[4]。CAF因其独特的细胞状态和多种机制介导的促肿瘤功能,成为分析TME在化疗耐药中作用的重要靶点[5]。iCAF作为CAF的炎症亚型,通过产生细胞因子等物质参与肿瘤的耐药过程[6]。然而,iCAF对CRC耐药的影响还有待确定。本研究以iCAF无血清培养刺激iCAF分泌炎症因子以获得条件培养基,再以iCAF条件培养基(iCAF-conditioned medium,iCAF-CM)刺激CRC细胞,探讨iCAF与CRC细胞耐药的关系。
1 材料和方法
1.1 材料
1.1.1 细胞系
人结肠癌RKO细胞、HCT116细胞购自美国典型培养物保藏中心(American Type Culture Collection,ATCC)细胞库,人肠成纤维细胞(human intestinal fibroblast,HIF)购自美国ScienCell研究实验室,CRC组织来源的CAF从CRC患者(于2022年8月-2022年9月在上海中医药大学附属普陀医院经手术切除)的癌组织中分离得到。细胞培养条件是37 ℃、CO2体积分数为5%。组织标本的使用均征得患者的知情许可。本研究获得上海中医药大学附属普陀医院伦理委员会批准[伦理批件编号:PTEC-A-2023-5(S)-1]。
1.1.2 试剂
DMEM培养基、RPMI-1640培养基、双抗、胰酶均购自美国Gibco公司,上样缓冲液、RIPA裂解液均购自美国CST公司,细胞计数试剂盒-8(cell counting kit-8,CCK-8)购自日本同仁化学研究所;Annexin Ⅴ-EGFP/PI细胞凋亡检测试剂盒购自北京全式金生物技术有限公司,TritonX-100、4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)、十二烷基硫酸钠(sodium dodecylsulphate,SDS)、免疫染色固定液、细胞核蛋白抽提试剂盒均购自上海Beyotime公司,实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)试剂盒购自美国EZBioscience公司。
1.1.3 仪器
酶标仪、PCR仪均购自美国Thermo Fisher公司,凝胶电泳仪购自美国Bio-Rad公司,共聚焦显微镜购自德国Zeiss公司,CytoFLEX流式细胞仪购自美国Beckman公司。
1.2 实验方法
1.2.1 细胞培养
分别用RPMI-1640和DMEM培养基[加入100 U/L青霉素+链霉素,10%胎牛血清(fetal bovine serum,FBS)]对冻存的HCT116、RKO和HIF细胞进行复苏,以1h105个/cm2进行培养,置于细胞培养箱中(37 ℃、CO2体积分数为5%)。待细胞数量长至对数期时,进行传 代。
1.2.2 提取原代CAF
取患者新鲜CRC组织标本,采用组织块培养法分离培养CAF。
1.2.3 免疫荧光
CAF(2h104)在显微镜玻片上接种培养过夜。用PBS洗涤2次,甲醇固定15 min,0.2% TritonX-100渗透5 min,在室温下使用5%牛血清白蛋白(bovine serum albumin,BSA)封闭1 h后,4 ℃下一抗[FAP(1∶100稀释,兔源)、血小板源性生长因子受体α(platelet derived growth factor receptor alpha,PDGFRA)(1∶500稀释,兔源)]温育过夜,然后与二抗[山羊抗小鼠IgGH&L(AlexaFluor®488)]和[山羊抗兔IgGH&L(AlexaFluor®594)]温育2 h。用DAPI进行核定位评估。
1.2.4 筛选iCAF并获得iCAF-CM
从参考文献[7]可知,PDGFRA是iCAF的标志物,因此本研究使用PDGFRA作为筛选iCAF的标志物,通过免疫荧光,从CAF中筛选出高表达PDGFRA的CAF,即为iCAF。
1.2.5 获得条件培养基
单独培养HIF和iCAF,当细胞生长至80%时,将培养基更换为不含FBS的培养基。处理48 h后,收集细胞悬液作为条件培养基。高速离心后收集条件培养基,用0.22 μm微孔膜过滤,于-20 ℃冰箱保存。
1.2.6 实验分组
将肿瘤细胞分为对照组(仅加入培养基)、实验组1[加入HIF条件培养基(HIF-conditioned medium,HIF-CM)]和实验组2(加入iCAFCM)。每组均设置HCT116和RKO两种肿瘤细胞。
1.2.7 CCK-8法检测肿瘤细胞存活率
以2h104个/孔分别接种HCT116和RKO细胞到96孔板中培养24 h,随后分别使用奥沙利铂(oxaliplatin,OXA)和5-FU药物作用24 h,以每孔100 μL CCK-8溶液加入孔中,培养温育30 min,于450 nm波长处检测吸光度(D)值。实验重复3次,取平均值。
1.2.8 流式细胞术检测肿瘤细胞凋亡率
选择各组中对照组的1/2半数抑制浓度(half inhibition concentration,IC50)作为诱导凋亡的药物浓度,给药24 h后,使用Annexin Ⅴ/PI双染法检测细胞凋亡,根据两种染料不同的激发波长,分别使用流式细胞仪所带的异硫氰酸荧光素(fluorescein isothiocyanate,FITC)和PE通道对样品进行检验。
1.2.9 蛋白质印迹法(Western blot)检测caspase-3、Bcl-2、Bcl-xL和survivin蛋白水平
分别用HIF-CM和iCAF-CM对肿瘤细胞进行刺激。48 h后,用对照组IC50浓度的OXA和5-FU分别对肿瘤细胞进行处理。24 h后,PBS冲洗且在冰上裂解后,4 ℃超速离心,提取上清液,定量。随后沸水中煮5 min,经SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)凝胶分离,转移到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,在5%脱脂奶粉中封闭1.5 h后加入一抗鼠抗β-actin(1∶5 000)、兔抗caspase-3(1∶1 000)、鼠抗Bcl-2(1∶1 000)、兔抗Bcl-xL(1∶1 000)、兔抗survivin(1∶500)于4 ℃摇床温育过夜,用含有吐温-20三乙醇胺缓冲盐溶液(tris-buffered saline Tween,TBST)漂洗后,加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗鼠免疫球蛋白G(immunoglobulin G,IgG)(1∶20 000)和山羊抗兔IgG(1∶20 000)室温温育1 h,随后用TBST漂洗,采用电化学发光(electrochemical luminescence,ECL)法,在凝胶成像系统中曝光检测,用Image J 软件对Western blot结果进行定量分析。
1.2.10 用RTFQ-PCR法检测caspase-3、Bcl-2、Bcl-xL和survivin的mRNA表达水平
裂解液裂解细胞后,使用RNA快速提取试剂盒提取细胞总RNA,反转录合成cDNA,随后用RTFQ-PCR检测caspase-3、Bcl-2、Bcl-xL和survivin的mRNA表达,扩增条件为:95 ℃预变性5 min进入循环,95 ℃变性45 s,54 ℃退火45 s,72 ℃ 1 min,共30个循环,72 ℃延伸5 min,以β-actin为内参基因。用2-ΔΔCt法计算目的基因的表达量,ΔCt=Ct目的基因-Ct内参基因。引物设计时,β-actin的上游引物序列为5'-CCC AGCACAATGAAGATCAAGATCAT-3',下游引物序列为5'-ATCTGCTGGAAGGTGGACAG CGA-3';Caspase-3的上游引物序列为5'-CCAAAGATCATACATGGAAGCG-3',下游引物序列为5'-CTGAATGTTTCCCTGAGGTTTG-3';Bcl-2的上游引物序列为5'-GACTTCGCCGAGATG TCCAG-3',下游引物序列为5'-GAACT CAAAGAAGGCCACAATC-3';Bcl-xL的上游引物序列为5'-GCATATCAGAGCTTT GAACAGG-3',下游引物序列为5'-GAAGGAGAAAAAGGC CACAATG-3';Survivin的上游引物序列为5'-CCGCATCTCTACATTCAAGAAC-3',下游引物序列为5'-CTCCTTGAAGCAGAAGAAACAC-3'。
1.2.11 通过Western blot探究iCAF对Wnt/β-catenin信号转导通路的影响
采用条件培养基和对照组IC50浓度的OXA和5-FU处理细胞,使用细胞核蛋白抽提试剂盒提取核内蛋白。采用Western blot检测肿瘤细胞总蛋白的表达水平以及细胞核中β-catenin和Lamin B1蛋白的表达水平。
1.3 统计学处理
数据用GraphPad Prism 7和SPSS 25.0软件进行统计分析。实验结果用表示,用单因素方差分析(one-way ANOVA)和Tukey’s multiple comparisons test进行组间比较,P<0.05为差异有统计学意义。
2 结 果
2.1 原代CAF提取及亚型鉴定
首先使用CRC组织标本提取原代CAF,对细胞株命名为CAF-71和CAF-95。镜下观察其形态呈长梭形(图1)。提取的原代细胞表达CAF常见表面标志物FAP和PDGFRA,表明提取的原代细胞是成纤维细胞,其中CAF-95对PDGFRA高表达,为iCAF,因此选用CAF-95细胞进行培养并获得条件培养基(95-CM),以便后续实验的进行。
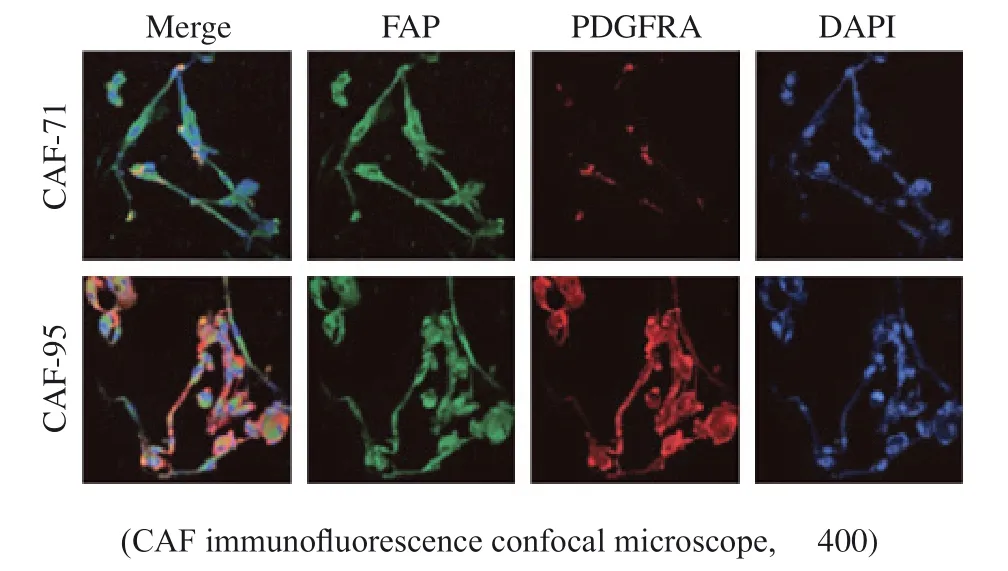
图1 原代CAF验证及筛选Fig. 1 Primary CAF verification and screening
2.2 CRC细胞的IC50升高
随着OXA和5-FU药物浓度的上升,HCT116和RKO细胞的存活率不断下降。结果显示,HCT116细胞中,对照组OXA的IC50为10.701 4 μmol/L,HIF-CM组OXA的IC50为12.972 2 μmol/L,95-CM组OXA的IC50为30.380 4 μmol/L,差异有统计学意义(P<0.000 1);RKO细胞中,对照组OXA的IC50为29.785 5 μmol/L,HIF-CM组OXA的IC50为32.536 8 μmol/L,95-CM组OXA的IC50为55.690 8 μmol/L,差异有统计学意义(P<0.000 1)。HCT116细胞中,对照组5-FU的IC50为87.531 2 μmol/L,HIF-CM组5-FU的IC50为86.861 9 μmol/L,95-CM组5-FU的IC50为135.781 0 μmol/L,差异有统计学意义(P<0.01);RKO细胞中,对照组5-FU的IC50为18.235 5 μmol/L,HIF-CM组5-FU的IC50为21.732 0 μmol/L,95-CM组5-FU的IC50为36.817 9 μmol/L,差异有统计学意义(P<0.001,图2)。95-CM培养后,HCT116和RKO细胞对OXA和5-FU的IC50明显升高,存活率升高,说明经iCAF刺激后,CRC细胞可能产生了耐药。

图2 CCK-8检测加入95-CM前后肿瘤细胞的存活率变化Fig. 2 Cell viability of tumor cells treated with or without 95-CM tested by CCK-8
2.3 iCAF抑制CRC细胞凋亡
两种癌细胞在两种抗肿瘤药物的分别作用下,相较于对照组和HIF-CM组,95-CM组中的细胞凋亡水平明显下 降(图3)。
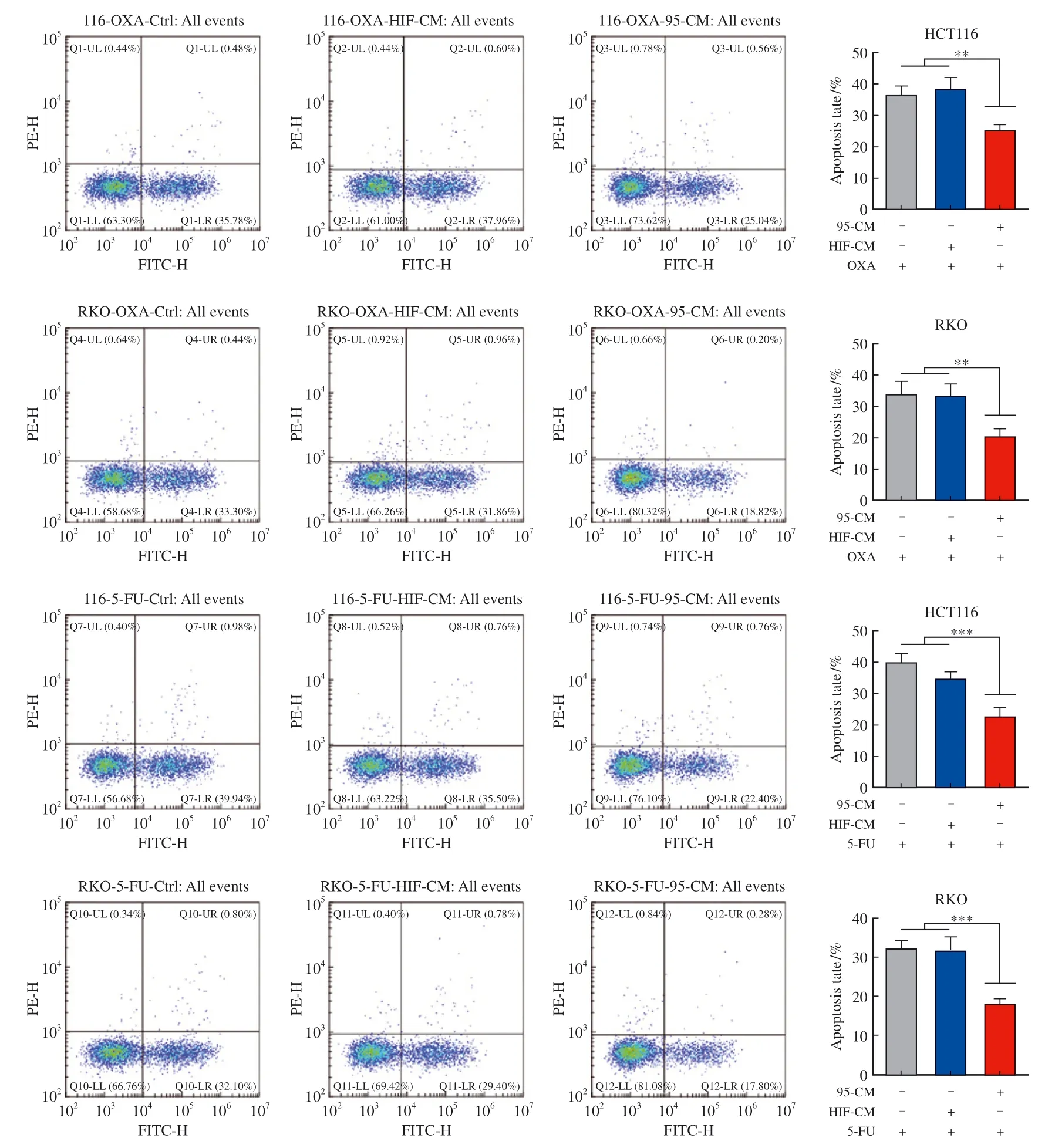
图3 流式细胞术检测加入95-CM前后肿瘤细胞的凋亡水平变化Fig. 3 Apoptosis rate of tumor cells treated with or without 95-CM tested by flow cytometry
为验证以上结果,我们进一步检测了iCAF刺激的肿瘤细胞中凋亡蛋白与抗凋亡蛋白的表达水平变化(图4)。与对照组和HIF-CM组相比,95-CM组中,凋亡蛋白caspase-3的表达水平明显下降,而抗凋亡蛋白Bcl-2、Bcl-xL和survivin的表达水平均有所上升(P<0.05)。采用RTFQPCR检测了以上几种蛋白的mRNA水平,所得结果与Western blot一致,差异有统计学意义(P<0.05,图5)。上述结果说明经iCAF刺激后,肿瘤细胞的凋亡减少,也就证明iCAF能够介导CRC细胞耐药。
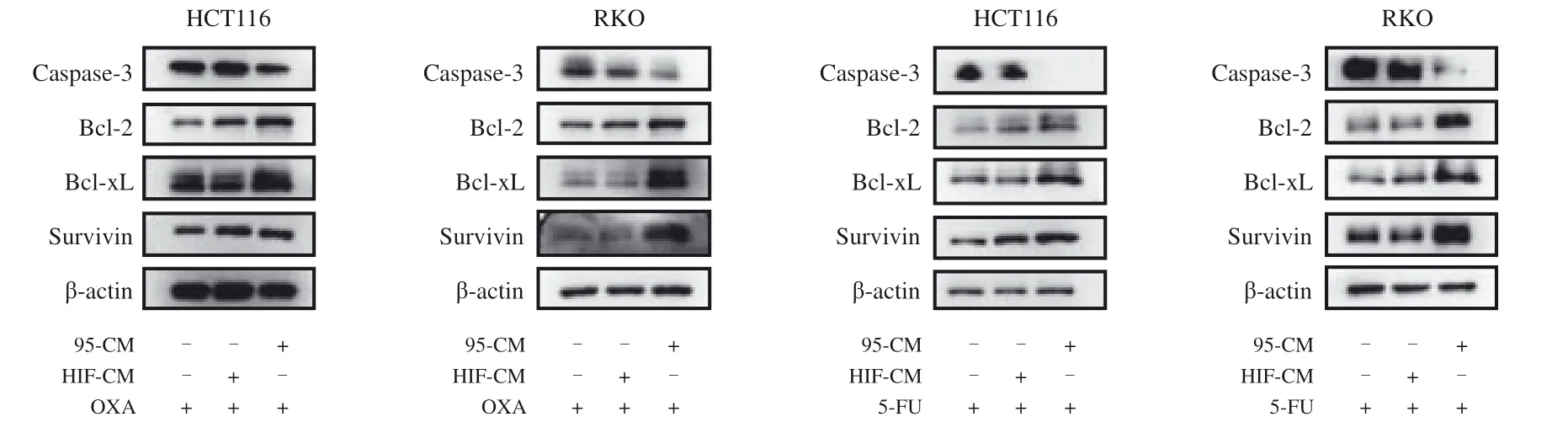
图4 Western blot检测β-actin、caspase-3、Bcl-2、Bcl-xL和survivin的表达Fig. 4 The expressions of β-actin, caspase-3, Bcl-2, Bcl-xL and survivin tested by Western blot
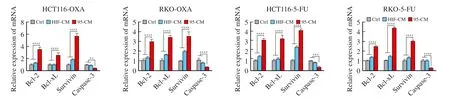
图5 RTFQ-PCR检测caspase-3、Bcl-2、Bcl-xL和survivin的mRNA水平Fig. 5 The mRNA expressions of caspase-3, Bcl-2, Bcl-xL and survivin tested by RTFQ-PCR
2.4 iCAF激活Wnt/β-catenin信号转导通路
本研究进一步探索了Wnt/β-catenin信号转导通路的变化。结果显示,3组的肿瘤细胞内β-catenin蛋白的表达水平相比较,总蛋白未见明显差异,核内蛋白表达产生明显差异(P<0.05,图6)。从图中可以看出,95-CM组中,β-catenin发生转移,在β-catenin总蛋白不变的情况下,细胞核中的β-catenin增多,说明经iCAF刺激后,Wnt/β-catenin信号转导通路被激活,从而导致CRC细胞耐药的产生。
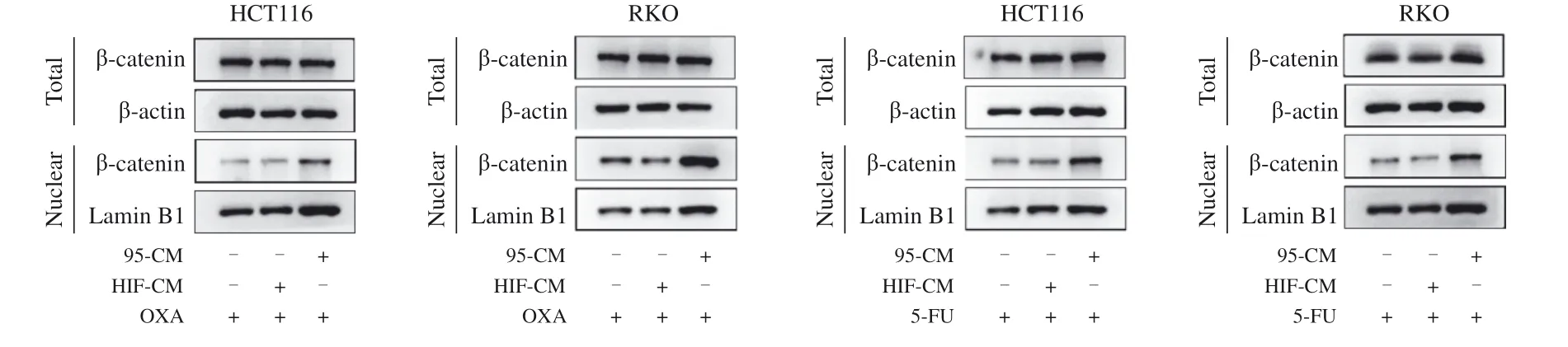
图6 经95-CM刺激后CRC细胞内Wnt/β-catenin信号转导通路的表达变化Fig. 6 Changes of Wnt/β-catenin signalling pathway in CRC cells stimulated by 95-CM
3 讨 论
CRC发病率在恶性肿瘤中重高居第3位,病死率高居第2位[8]。
近年来,TME在肿瘤耐药中的作用逐渐引起人们注意并被广泛研究[9]。其中,CAF是TME的重要组成部分,在肿瘤耐药中发挥重要作用[10]。CAF可以通过多种途径介导肿瘤细胞耐药[11]:① 抑制肿瘤细胞凋亡;② 重塑细胞外基质;③ 促进肿瘤细胞上皮-间质转化(epithelialmesenchymal transition,EMT);④ 驱动免疫抑制;⑤ 增强肿瘤代谢;⑥ 调控肿瘤干细胞。
本研究通过免疫荧光,从原代CAF中筛选出iCAF即CAF-95后,使用95-CM刺激CRC细胞,运用CCK-8法检测到经刺激后,CRC细胞对抗癌药物OXA作用的存活率上升。本研究进一步发现,经CAF-95刺激后,凋亡蛋白caspase-3及其mRNA的水平明显下降,抗凋亡蛋白Bcl-2、BclxL和survivin及其mRNA的水平均有所上升,证实iCAF能够促进CRC耐药。
Wnt/β-catenin信号转导通路对肿瘤细胞的凋亡有一定作用,同时也参与EMT的过程。有研究[12]发现,CAF激活Wnt/β-catenin信号转导通路,通过抑制细胞凋亡调节剂1和含F框WD重复域蛋白7进而抑制线粒体凋亡,增强CRC细胞对抗癌药5-FU的耐药性。另外有研究[13]发现,与对照组相比,CAF上清液培养的卵巢癌细胞E-钙黏蛋白的表达水平更低,且CAF分泌的CXCL12可以激活肿瘤细胞中的CXCR4/Wnt/β-catenin信号转导通路诱导EMT,导致顺铂抗性增强。
Wnt/β-catenin信号转导通路在多种肿瘤中都被高度激活,有许多对癌症具有潜在治疗效果的Wnt信号转导通路抑制剂药物的研究正在进行[14]。有研究[15]显示,Wnt/β-catenin信号转导通路在CRC间质的CAF中高表达。因此我们推测iCAF介导CRC细胞耐药可能与Wnt/β-catenin信号转导通路有关。本研究通过Western blot对95-CM刺激下的CRC细胞内β-catenin表达进行检测,观察到细胞质中β-catenin减少,进入细胞核增加,Wnt/β-catenin信号转导通路被激活,参与了耐药过程。
本研究仍存在一定局限性。首先,CAF具有异质性,不同表型具有不同的功能,本研究仅研究iCAF对CRC耐药的影响,但CAF的其他表型(如myCAF)是否也具备同样的功能及可能存在的机制尚不清楚。其次,本研究证明了iCAF通过激活Wnt/β-catenin信号转导通路促进一系列凋亡蛋白的变化,从而介导CRC耐药,研究还不够深入,具体机制仍有待探索。之后的研究可将重点放在Wnt/β-catenin信号转导通路如何参与耐药过程,如发现可能的结合位点和转运蛋白上。另外,Wnt信号转导通路与癌症发生密切相关,但既往研究[14]表明,阻断Wnt信号往往会伴随着不良反应的发生,如破坏组织稳态和再生等。
综上所属, iCAF可能是通过Wnt/β-catenin信号转导通路抑制肿瘤细胞的凋亡,并促进肿瘤细胞的EMT过程,进而诱导CRC细胞耐药。因此未来可以将iCAF视作设计抗癌药物的潜在靶点。
利益冲突声明:所有作者均声明不存在利益冲突。
