葎草茎纳米纤维素在聚己内酯人工血管的应用
2024-01-04吴闯王海翔孙基桔
吴闯,王海翔,孙基桔
(1.扬州大学机械工程学院,江苏 扬州 225009; 2.南通福乐达汽车配件有限公司,江苏 南通 226300)
心血管疾病是当前威胁人类健康的主要疾病之一。根据世界卫生组织的调查报告统计,每年有近1 800 万人死于心脑血管疾病,占比全球死亡人数的30%以上。同时据统计,我国现有心血管疾病人数约为2.9 亿,并且患有心血管疾病的人数仍在急剧的上升。虽然饮食、生活方式的改变和药物干预是心血管疾病的前瞻性治疗方法,但对于严重病例,手术仍然是现阶段最有效的解决方案。目前临床上对于心血管疾病主要采取血管搭桥疗法,所采用的常见血管移植物大致可分为自体血管移植、异种血管移植和组织工程人工血管。但心血管疾病的治疗往往面临自体血管来源不足、需反复手术、不利于患者的术后恢复等问题。目前,国内外开发的人工血管材料各有其优缺点,而理想的组织工程血管需要具有一定的降解性,使其在植入后由宿主细胞重塑,具有和天然血管类似的结构和功能。
研究发现聚己内酯(PCL)可以模仿天然组织,拥有良好的生物相容性以及无毒性等优点[1-4],Li等[5]采用具有细胞黏附序列精氨酰-甘氨酰-天冬氨酸(RGD)/亮氨酸-天冬氨酸-缬氨酸(LDV)角蛋白与PCL 共混材料,通过静电纺丝工艺制备人工血管,二苯基四氮唑溴盐(MTT)法检测发现角蛋白/PCL可提高细胞活力,凝血检测发现血管支架具有良好的细胞亲和力。Norouzi 等[6]采用静电纺丝与冷冻干燥法制备双层肝素(Hp)化小口径血管支架,内层静电纺丝PCL与混有Hp的明胶(GEL)层,外层通过冷冻干燥法制备混合Hp 的GEL 层,将细胞种植在人工血管上发现无明显血栓形成。虽然PCL 的加入大大提高了生物相容性,但其力学性能以及其疏水性较差等[7],无法较好地满足天然血管的条件。可见,单独使用聚合物制备得到的人工血管整体性能不佳,且降解速率不同,进而影响其力学性能。
为了解决上述PCL 作为组织工程材料所面临的问题,需提高PCL人工血管的力学性能以及使得PCL人工血管更加亲水,则需要多种材料复合以及制备技术创新实现优势互补。笔者采用静电纺丝技术,该技术是一种通过高压电源,使高分子溶液在高压电场中喷射形成纳米纤维,其所制备出的材料满足了孔隙率高、力学性能好、生物相容性好等诸多特点,形成的纳米纤维层与人体细胞基质膜类似,有利于细胞在人工血管上的生长、增殖与铺展[8]。同时在PCL 溶液中加入热塑性聚氨酯(TPU)来提高人工血管的力学性能,采用浸渍工艺将从葎草茎提取出来的高长径比植物纳米纤维素(H-CNC)[9]和海藻酸钠(SA)混合浸入到PCL与TPU纺丝成的人工血管中,并通过无水氯化钙溶液进行交联使其具备优良的生物相容性和亲水性,解决了PCL的疏水性问题,有利于细胞在人工血管的表面黏附和增殖。
1 实验部分
1.1 主要原材料
PCL:6500 型,东莞市展阳高分子材料有限公司;
TPU:东莞市展阳高分子材料有限公司;
高长径比葎草茎纳米纤维素:H-CNC,硫酸水解法制备[10],平均长径比为63.20,平均直径为6.84 nm,自制;
N,N-二甲基甲酰胺(DMF):分析纯,上海阿拉丁生化科技股份有限公司;
二氯甲烷:分析纯,上海阿拉丁生化科技股份有限公司;
无水氯化钙:10005861,国药集团化学试剂有限公司;海藻酸钠:分析纯,上海展云化工有限公司;泊洛沙姆127:F127,天津佰玛科技有限公司。
1.2 主要仪器及设备
静电纺丝机:JDF05 型,长沙纳仪仪器有限公司;
磁力搅拌水浴锅:SHJ-2A 型,常州金坛友良仪器有限公司;
扫描电子显微镜(SEM):GeminiSEM 300 型,德国Carl Zeiss公司;
微机控制电子拉伸试验机:LT-5000 型,洛泰精密仪器(东莞)有限公司;倒置荧光显微镜:M165FC型,德国徕卡公司;多功能酶标仪:Thermo MULTISKAN GO 型,美国Thermo Multiskan公司。
1.3 PCL与TPU电纺混合溶液的配制
将一定质量的PCL 溶于DFM 与二氯甲烷的混合溶液(体积比为50∶50)中,通过磁力搅拌水浴锅常温搅拌5 h。在PCL 树脂完全溶于溶剂之后,加入一定质量的TPU,其中PCL和TPU质量比为8∶2,将其在磁力搅拌水浴锅中进行37 ℃恒温水浴磁力搅拌,直至其全部溶解。
1.4 人工血管的制备
取质量分数为10%的PCL与TPU混合溶液,通过静电纺丝机,选用接收转轴为外径4 mm 的不锈钢管,纺丝针头18 G 针头,针头内径为0.84 mm 制备PCL和TPU的混合人工血管。
将PCL 和TPU 混合纺丝溶液导入10 mL 的注射器内,其次将泊洛沙姆F127水凝胶均匀涂覆在接收转轴表面,并在以下参数下进行静电纺丝:电压为15 kV,注射速度为1 mL/h,接收距离为10 cm,接收装置转速为50 r/min,相对湿度为(50±5)%,温度为25 ℃,时间为5 h。纺丝结束后将制成的人工血管连同接收转轴一起取下竖直放入0~4 ℃的环境中,待F127 液化后可从接收转轴上轻松滑落,放于无水乙醇中清洗残余的F127 水凝胶。将清洗后的人工血管放于T型杆上并置于H-CNC和SA的混合浸渍液(质量比为5∶2)中12 h,待浸渍结束将人工血管竖直拿出直至人工血管上无液滴滴落后,将其置于无水氯化钙溶液中进行交联,直至人工血管上的浸渍液完成交联,取出静置,直至无液滴滴落,放于无水乙醇中清洗残余的无水氯化钙。将人工血管从T型杆上取出,37 ℃恒温干燥12 h后得到成形的人工血管。
1.5 性能测试与表征
(1)宏、微观形态检测。
对于人工血管的外观形貌,通过使用游标卡尺对人工血管的壁厚与内径进行测量。对于人工血管的表面微观形态则通过SEM 观察人工血管的表面微观形貌[11]。之后随机选取图中的50 根纳米纤维素通过Image J 软件计算分析纳米纤维素直径后输入绘制相关图形[12]。
(2)人工血管力学性能测试。
由于人工血管置于体内血液中,而体内的血液压力使其对于人工血管的力学性能有一定要求,需要对人工血管进行拉伸强度、爆破强度等方面的强度测试,从而满足其临床一定要求[13-14]。
径向拉伸强度测试:对人工血管试样进行径向拉伸强度的测试,在测试之前,为了消除外界环境因素的影响,将其浸泡在去离子水中10 min 之后,将人工血管放入到37 ℃恒温烘箱干燥12 h。将人工血管裁剪成10 mm 长,用两根直径2 mm 的U 型细小钢棒穿过人工血管,将钢棒固定在拉力机的夹头上,使拉力机以2 mm/min的速度拉伸人工血管直至断裂,分析并记录实验数据。
轴向拉伸强度测试:对人工血管试样进行轴向拉伸强度的测试,在测试之前,为了消除外界环境因素的影响,将其浸泡在去离子水中10 min 之后,将人工血管放入到37 ℃恒温烘箱干燥12 h。将人工血管裁剪成40 mm长,将人工血管两端固定在拉力机夹头上,使拉力机以2 mm/min的速度沿轴向方向拉伸直至人工血管断开,分析并记录实验数据。
爆破压力测试:通过拉普拉斯定律[15-16],可由径向拉伸强度推算出人工血管的爆破压力。拉普拉斯定律表明,当直径为常数时,爆破压力与壁厚成正相关,故可通过提高壁厚来增加人工血管的爆破压力,其计算公式见式(1)。
式中:Pbrust为爆破强度,单位Pa;τ为人工血管的壁厚,单位mm;δc为径向极限应力,单位Pa;γ为人工血管的半径,单位mm。
(3)试样支架孔隙率的表征。
对人工血管试样进行孔隙率测试,在测试之前,将其放置于在37 ℃恒温烘箱中12 h,采用无水乙醇对人工血管孔隙率进行检测表征[17-18]。选一个10 mL 的量筒,加入一定体积的无水乙醇并标记液面高度,然后在万分之一精度天平上测量其质量为W1,把质量为Ws的样品完全浸入到无水乙醇中震荡。吸走超出液面标记的无水乙醇使其回到刻度位置,称其质量为W2,使无水乙醇充盈于人工血管的纳米纤维素孔。把浸满无水乙醇的样品取出后,剩余的无水乙醇与量筒的质量为W3,其计算公式如下:
式中:P为无水乙醇的密度,单位g/mL;Vs为样品的纳米纤维素体积,单位mL;Vp为样品人工血管体积,单位mL;H为样品人工血管的孔隙率,单位%。
(4)试样水接触角测试。
亲水性是判断人工血管生物性能的一项重要指标,该项性能可通过测量水接触角(θ)进行表征,其中θ>150°表现为超厌水,150°>θ>90°表现为厌水,90°>θ>10°表现为亲水,当θ<10°表现为超亲水。
选用超纯水作为检测液体,测试处理的人工血管试样的静态接触角。在人工血管的表面各滴加一滴5 µL的超纯水,分别在0 s与120 s时通过高速CCD 工业相机拍摄水接触角,并通过Image J 软件计算水接触角的值。
(5)生物学性能检测。
为了保证人工血管的生物相容性[19],需要将细胞接种到制备的葎草茎植物纳米纤维素的血管支架上去,通过实验检测分析血管支架的生物相容性,故根据现有实验条件选择牛乳腺上皮细胞(BMECs)作为血管支架的接种细胞。生物学性能检测将其分为4组,分别为对照组、未浸渍海藻酸钠和H-CNC 的组(简称“未浸渍”)、浸渍海藻酸纳但没有H-CNC的组(简称“浸渍-”)以及浸渍海藻酸钠和HCNC的组(简称“浸渍+”)。
细胞染色:利用活/死染试剂盒对人工血管上的细胞进行染色,在倒置荧光显微镜下观察细胞在上面的生长情况。将1 µL 的钙黄绿素与1 µL 的碘化丙啶(PI)混合在1 mL 的PBS 溶液中。用移液器将混合的溶液分别滴加在不同的人工血管上,放于培养箱中培养20 min,之后将人工血管放在倒置荧光显微镜下观察。利用Image J软件,分析计算活细胞在人工血管上的覆盖率,计算公式如式(5)。
式中:Pc为人工血管上活细胞的覆盖率;PCA为活细胞覆盖面积;PTA为人工血管面积。
细胞毒性检测:使用多功能酶标仪与CCK-8试剂盒对人工血管进行毒性与增殖检测。首先将人工血管种植于96 孔板中,分为四组。A 组为对照组,B 组为“未浸渍”,C 组为“浸渍-”,D 组为“浸渍+”。含细胞的组每孔接种细胞数104pcs,各组加入相同的细胞培养液200 µL。在培养箱中培养设定天数后分别取出。在取出后加入10 µlL 的CCK-8,再放入培养箱中,分别在2 h 后取出。用多功能酶标仪在450 nm波长处检测光吸收值(OD值)并记录实验数据。通过对OD值分析可以反映出人工血管上细胞的状态,其计算公式如下:
式中:P为细胞存活率;AS为实验孔的OD值(含有细胞培养液、CCK-8、待测物质);AC为对照孔的OD值(含有细胞培养液、CCK-8、没有待测物质);AB为空白孔的OD值(不含细胞与待测物质的培养基、CCK-8)。
2 结果与讨论
2.1 人工血管的宏微观形态分析
图1 为人工血管的宏、微观形态。通过静电纺丝机制备的人工血管,其内径为(4.3±0.2) mm,样本数(n)=5,壁厚为(0.3±0.06) mm,n=5。制备的人工血管表面光滑无外层脊凸结构,如图1a 所示;最终制备完成的人工血管成品表面相对光滑,如图1b 所示。
通过SEM观察,如图1c所示,发现纳米纤维素杂乱无章且无明显串珠生成,从其中随机选取50根纳米纤维素丝通过Image J 软件分析其直径得到图2 纤维直径分布图,其中葎草茎纳米纤维素浸渍的人工血管的纤维直径为(210±23) nm,n=50,且纤维直径服从正态分布曲线,如图2所示。

图2 纤维直径分布图
目前认为,纤维的形貌特征较大程度上影响了细胞的黏附、增殖和分化。当纺丝出无序的纤维,一般认为其无序的表面能够有利于细胞黏附。通过SEM观察分析可知,人工血管内/外层结构光滑,无损伤。所制备的人工血管的纤维成无规则取向纤维,没有明显的串珠现象,为后续细胞在人工血管上的黏附、增殖和分化提供了基础。
2.2 人工血管的力学性能探究
图3 是含H-CNC 和不含H-CNC 人工血管的径向应力和轴向应力性能测试图。由图3可知,含HCNC 人工血管的径向极限应力为22.79 MPa、轴向极限应力为18.19 MPa,不含H-CNC 人工血管的径向极限应力为15.54 MPa、轴向极限应力为12.45 MPa。含H-CNC人工血管与不含H-CNC人工血管相比,其径向与轴向极限应力都有明显提升,同时由表1 可知,与人体腹主动脉及冠状动脉所受的最大应力做对比发现,其力学性能可满足临床移植要求。
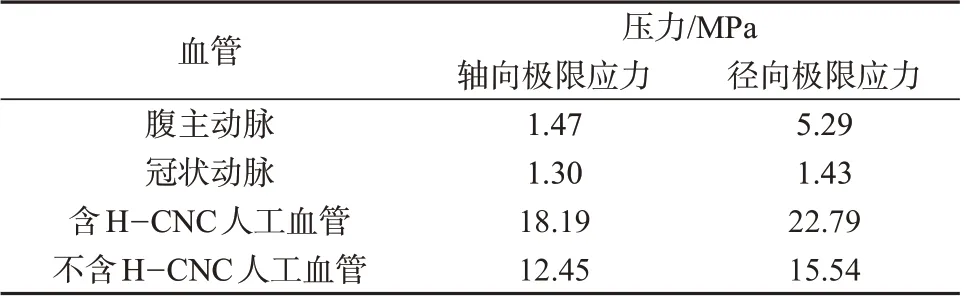
表1 人工血管的抗拉强度
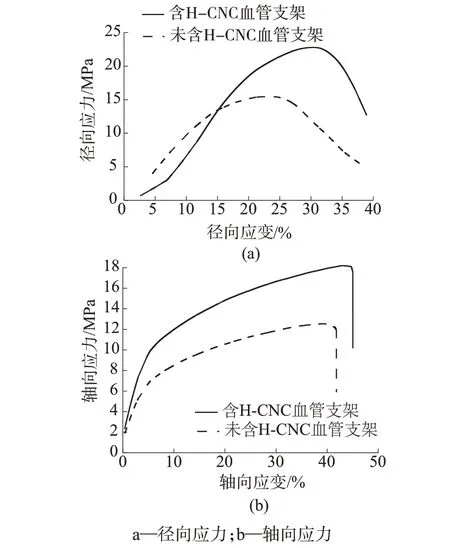
图3 含H-CNC和不含H-CNC人工血管的径向应力和轴向应力性能测试图
由公式(1)计算得到人工血管的爆破强度2 279 kPa,约为17 094 mmHg,大于人体承受最大压力的隐静脉的(1 680±307) mmHg,约为(223±40.8)kPa[20-21]。
由上述分析可知,所制备的人工血管轴向应力、径向应力、爆破强度等方面都强于人体真实血管的最大应力,表明人工血管具有优异的力学性能。
2.3 人工血管的亲水性探究
图4 为血管支架的水接触角侧视图,通过高速CCD 工业相机在固定时间拍摄水接触角的CCD图,将图片导入Image J 软件中进行分析计算[22-23]。如图4b 所示,人工血管在0 s 时的水接触角为114.591°±3.27°,n=3;如图4c所示,人工血管在120 s时水接触角不再变化,为77.43°±4.51°,n=3,其性能表现为较亲水;然而由图4d 可见,当去离子水接触到含葎草茎植物纳米纤维素的人工血管时,水滴可被大部分吸收掉,表现为超亲水,主要原因是含葎草茎纳米纤维素作为一种植物纳米纤维素具有亲水性,而PCL 具有疏水性,将葎草茎纳米纤维素加入到PCL 人工血管中可一定程度上改变其亲水性状态,增加生物相容性。

图4 血管支架的水接触角测试图
亲水性目前已被认为是组织工程人工血管的一个重要特征,支架表面的亲水性极大程度上影响了细胞在支架表面的黏附。根据上述结果分析总结可知,葎草茎植物纳米纤维素极大程度上改善了PCL人工血管的疏水性问题,葎草茎植物纳米纤维素人工血管具有良好亲水性,有利于细胞的黏附和铺展。
2.4 人工血管的孔隙率分析
表2 为对浸渍过纳米纤维素人工血管(样品1,2,3)孔隙率的三组重复检测。根据表2 数据,通过公式(2)~公式(4)对三组数据采用平均值±标准差的形式(n=3),计算得到人工血管的孔隙率为81.73%±1.21%,n=3,超过了80%,而较高的孔隙率有利于细胞的黏附增殖,使细胞向人工血管的内部生长,并增加人工血管的内部弹性空间[24-25]。

表2 人工血管的孔隙率测试数据
由上述分析可知,人工血管的孔隙率达到了81.73%±1.21%,n=3,超过了80%,表明人工血管具有高的孔隙率。
2.5 人工血管的细胞相容性分析
作为组织工程应用潜在的人工血管,葎草茎植物纳米纤维素人工血管应该能够促进细胞黏附、增殖、分化,能够正常维持细胞的生理功能。故而,在葎草茎植物纳米纤维素人工血管上种植牛乳腺上皮细胞(BMECs),测定其细胞相容性。
(1)人工血管的活/死染检测结果分析。
通过对人工血管上培养的BMECs进行活/死染实验,得到不同人工血管的活细胞荧光染色图(图5)以及死细胞荧光染色图(图6)。通过活/死细胞荧光染色图可以直观地观察到葎草茎植物纳米纤维素人工血管上的活细胞数量逐渐增多并且明显多于同一天的其它两种人工血管地活细胞数量,通过Image J软件计算牛乳腺上皮细胞的覆盖率可知,第七天细胞在人工血管上的覆盖率已达到87.48%。

图5 不同人工血管的活细胞荧光染色图
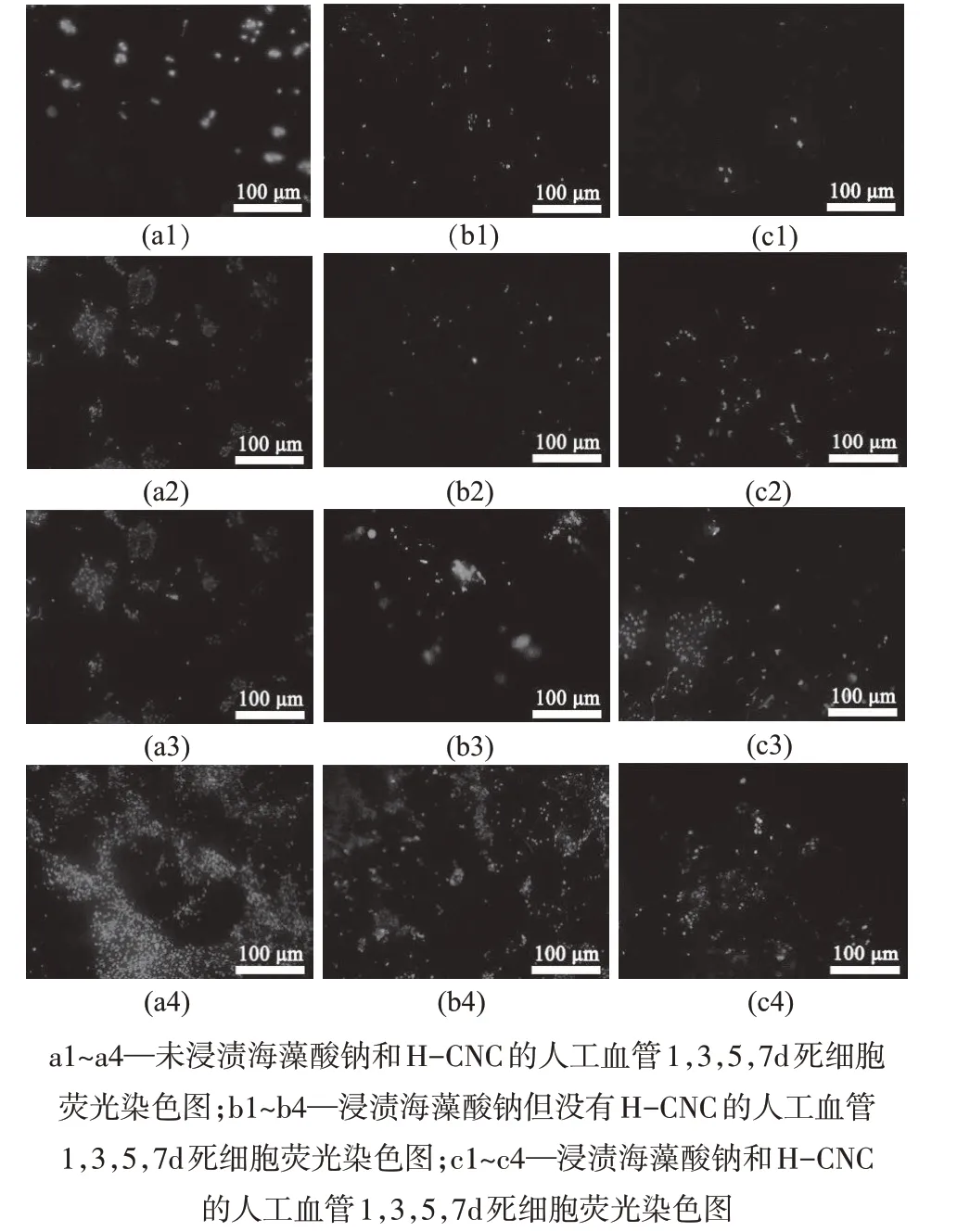
图6 不同人工血管的死细胞荧光染色图
图7和图8分别为牛乳腺上皮细胞在不同人工血管上的细胞覆盖率对比图和牛乳腺上皮细胞培养天数图。通过公式(6)计算细胞存活率并得到图7和图8,由此分析可知,开始时细胞增殖较快,在第7天时细胞的增殖放缓,可能原因是此时的细胞密度较高,产生了细胞接触抑制现象,但浸渍过葎草茎纤维素的人工血管的细胞增殖率明显高于其他两种人工血管。

图7 牛乳腺上皮细胞在不同人工血管上的细胞覆盖率对比图

图8 牛乳腺上皮细胞在浸渍+人工血管上的存活率
(2)人工血管的细胞毒性检测结果分析。
图9 和图10 分别为牛乳腺上皮细胞在不同人工血管上的OD值柱状图和牛乳腺上皮细胞在不同人工血管上的OD值百分数柱状堆积图。通过对细胞的毒性检测,并分析图7和图8可知,在第七天时不同的人工血管上的细胞的OD 值接近,材料浸提液或材料与其特定植入部位的靶细胞相互作用,反映人工血管细胞毒性的同时还能反映H-CNC 对细胞增殖、分化等功能的影响。结果显示PCL/TPU/H-CNC 浸提液对BMECs 无明显影响,且细胞覆盖率随着时间的增加相较对照组提升较大,表明HCNC对细胞增殖有明显促进作用,且细胞毒性并未有明显的变化。
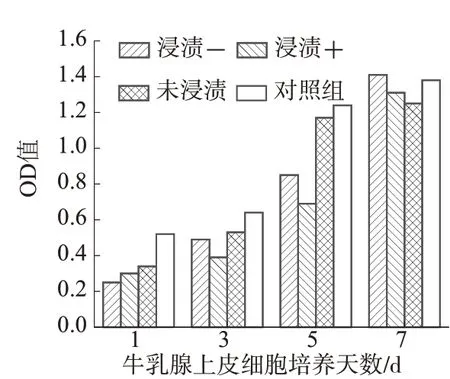
图9 牛乳腺上皮细胞在不同人工血管上的OD值柱状图
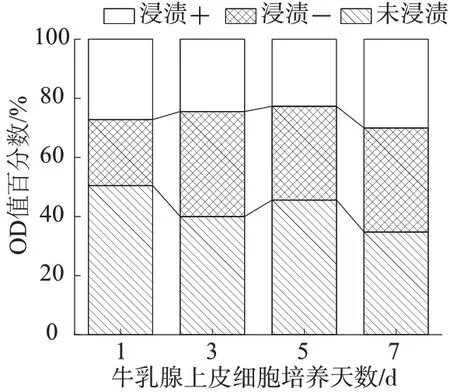
图10 牛乳腺上皮细胞在不同人工血管上OD值百分数柱状堆积图
在组织工程领域,组织工程支架的生物相容性越来越受到人们的关注,同时生物相容性也受到多种因素影响。通过对细胞的活/死染检测可知,葎草茎纳米纤维素人工血管细胞覆盖率更高,意味着葎草茎植物纳米纤维素人工血管能够使更多的活细胞更好的黏附和增殖,也意味着拥有更好的生物相容性。
3 结论
笔者采用静电纺丝法制备葎草茎纳米纤维素,并通过浸渍工艺将葎草茎纳米纤维素应用到PCL人工血管的制备。通过试验验证葎草茎纳米纤维素作为一种具有复杂生物活性和优异物理性能的纤维聚集体能够有望改善由PCL 制备的人工血管力学性能差和疏水性等问题。得出如下结论:
(1)葎草茎植物纳米纤维素采用浸渍工艺加入到人工血管的制备过程,相比于PCL的人工血管亲水性有明显提升,更加有利于细胞在人工血管表面黏附和铺展。
(2)葎草茎植物纳米纤维素人工血管的力学性能提升明显,满足人体腹主动脉及冠状动脉对于人工血管的力学要求。
(3) BMECs在葎草茎植物纳米纤维素人工血管上能够正常生长,表明H-CNC加入到人工血管中没有提高其细胞毒性,并且使得牛乳腺上皮细胞在人工血管上能够更好的黏附和增殖。
结果表明,基于静电纺丝技术制备的PCL/TPU/H-CNC复合纳米纤维素支架,通过TPU作为增强基加入到PCL人工血管的制备,相较于纯PCL人工血管,浸渍过葎草茎纳米纤维素的人工血管力学性能更加出色。浸渍葎草茎纳米纤维素对于疏水性大大改善的同时能够使更多的活细胞更好的黏附和增殖,细胞增殖作为细胞黏附铺展与功能分化的中间纽带,会给材料与机体结合的长期效果带来十分巨大的影响,也意味着其拥有更好的生物相容性。葎草茎植物纳米纤维素在聚己内酯人工血管上的应用有望为未来组织工程人工血管领域的发展提供更好的理论依据。
