免疫组化检测磷脂酰肌醇蛋白多糖-3与细胞角蛋白-19在肝细胞癌诊断中的应用价值分析
2024-01-03杨丽英朱杰
杨丽英 朱杰

【摘要】 目的 探討免疫组化检测磷脂酰肌醇蛋白多糖-3(human glypican-3,GPC-3)、细胞角蛋白-19(cytokeratin-19,CK-19)在肝细胞癌诊断中的应用价值。方法 选取2010年1月—2022年6月云南省滇南中心医院收治的103例疑似肝细胞癌患者为研究对象,所有患者均进行免疫组化检测GPC-3与CK-19,并以病理检查结果为金标准,计算免疫组化检测GPC-3、CK-19对肝细胞癌的诊断效能。比较不同病灶直径、分化程度的肿瘤组织中GPC-3、CK-19的表达情况。结果 GPC-3检测诊断肝细胞癌的灵敏度、特异度、准确度分别为86.1%(62/72)、80.6%(25/31)、84.5%(87/103),CK-19检测诊断肝细胞癌的灵敏度、特异度、准确度分别为81.9%(59/72)、74.2%(23/31)、79.6%(82/103),二者比较差异均无统计学意义(P>0.05)。Kappa检验分析结果显示,GPC-3、CK-19检测诊断肝细胞癌与病理检查结果的一致性中等(Kappa值=0.644、0.537,P<0.05)。病灶直径≥5 cm肿瘤组织中的GPC-3、CK-19的阳性表达率显著高于病灶直径<5 cm的肿瘤组织,差异有统计学意义(Z=-2.808、-2.761,P<0.05)。中低分化肿瘤组织中GPC-3、CK-19的阳性表达率显著高于高分化肿瘤组织,差异有统计学意义(Z=-4.883、-2.353,P<0.05)。结论 免疫组化检测GPC-3、CK-19对肝细胞癌具有一定的诊断价值,二者在病灶组织中的表达可能与病灶大小、分化程度有关。
【关键词】 免疫组化;GPC-3;CK-19;肝细胞癌
Analysis of the application value of immunohistochemical detection of GPC-3 and CK-19 in the diagnosis of hepatocellular carcinoma
Yang Liying, Zhu Jie. Southern Central Hospital of Yunnan Province (Honghe First People's Hospital),Honghe, Yunnan 661199
【Abstract】 Objective To explore the application value of immunohistochemical detection of GPC-3 and CK-19 in the diagnosis of hepatocellular carcinoma. Methods 103 patients with suspected hepatocellular carcinoma admitted to Southern Central Hospital of Yunnan Province from January 2010 to June 2022 were selected as study subjects. All patients were detected by immunohistochemistry for GPC-3 and CK-19, and the diagnostic efficacy of immunohistochemistry for hepatocellular carcinoma was calculated based on the pathological results as the gold standard. The expression of GPC-3 and CK-19 in tumor tissues with different lesion diameters and differentiation degrees were compared. Results The sensitivity, specificity and accuracy of GPC-3 in the diagnosis of hepatocellular carcinoma were 86.1% (62/72), 80.6% (25/31) and 84.5% (87/103), the sensitivity, specificity and accuracy of CK-19 in the diagnosis of hepatocellular carcinoma were 81.9% (59/72), 74.2% (23/31) and 79.6% (82/103), there was no significant difference between the two indexes(P>0.05). Kappa test analysis results showed that GPC-3 and CK-19 were moderately consistent with pathological Results in the diagnosis of hepatocellular carcinoma (Kappa values=0.644, 0.537,P<0.05). The positive expression rate of GPC-3 and CK-19 in tumor tissues with lesion diameter ≥ 5cm was significantly higher than that in tumor tissues with lesion diameter<5cm(Z=-2.808,-2.761,P<0.05). The positive expression rates of GPC-3 and CK-19 in medium and low differentiated tumor tissues were significantly higher than those in high differentiated tumor tissues(P<0.05). Conclusion Immunohistochemical detection of GPC-3 and CK-19 has certain diagnostic value for hepatocellular carcinoma. The expression of GPC-3 and CK-19 may be related to the size and differentiation of the lesion.
【Key Words】 Immunohistochemistry; GPC-3; CK-19; Hepatocellular carcinoma
中图分类号:R446.6 文献标识码:A 文章编号:1672-1721(2023)34-0113-03
DOI:10.19435/j.1672-1721.2023.34.037
随着我国人口老龄化进程的加快和人们饮食结构的改变,肝癌的临床发病率和致死率呈逐渐升高趋势,给患者身心健康、生活质量和生命安全带来了极大的影响[1-2]。但是,在实际临床中,由于肝癌发病早期并无明显的特异性症状表现,多数患者在确诊时已经处于中晚期阶段,错失了最佳手术治疗时机,导致预后不佳。因此,加强肝癌的早期筛查具有重要的临床意义。GPC-3属于一种癌胚蛋白,与肿瘤细胞的生长增殖、分化密切相关;CK-19是近年来发现的一种新的肿瘤标志物,尤其在非小细胞肺癌、食管癌等疾病的诊断中具有一定的参考价值。有研究指出[3-5],检测肝癌病灶组织中GPC-3和CK-19的表达可以反映肿瘤细胞的分化程度和浸润性,用于鉴别、诊断肝癌的灵敏度和准确度较高。基于此,本研究选取2010年1月—2022年6月云南省滇南中心医院收治的103例疑似肝细胞癌患者为研究对象,分析了免疫组化检测GPC-3与CK-19对肝细胞癌的诊断价值,报告如下。
1 资料与方法
1.1 一般资料 选取2010年1月—2022年6月云南省滇南中心医院收治的103例疑似肝细胞癌患者为研究对象,其中男性63例,女性40例;年龄45~72岁,平均年龄(59.18±6.33)岁。本研究经医院医学伦理委员会审核批准,且患者及其家属对免疫组化验查、病理检查以及相关注意事项均知情同意。
纳入标准:经临床诊断、实验室指标检测和影像学检查后诊断为高度可疑肝细胞癌的患者;生命体征平稳;具备正常的沟通能力和理解能力;依从性良好。
排除标准:存在其他已确诊的恶性肿瘤患者;存在穿刺或手术禁忌证者;伴有严重的肝功能、肾功能不全者;凝血功能障碍或存在严重的出血倾向者;上消化道出血患者;自愿退出者。
1.2 方法 对所有入组患者进行病灶组织取样,取样后进行固定、脱水、透明、包埋、切片等前期处理,获取切片样本后进行GPC-3、CK-19检测。
GPC-3检测,采用EnVision两步法检测,将获取的切片样本经烤片、脱蜡、逐级乙醇处理后置入质量分数为3%的过氧化氢溶液中浸泡5 min,随后取出用磷酸盐缓冲液(phosphate buffer saline,PBS)冲洗3次,每次冲洗5 min。冲洗结束后,将样本放入柠檬酸缓冲液(pH值=6.0)中使用高压锅进行高温高压修复,持续加热直到高压锅出气,2 min后调为中火继续加热,关火后继续焖10 min,再取出置于温水中冷却至37 ℃。冷却后,使用PBS冲洗3次,每次5 min,再加入GPC-3一抗,放入4 ℃的低温冰箱中保存一夜。次日再使用PBS冲洗3次,每次5 min,使用二氨基联苯胺显色,随后经PBS终止染色后以乙醇由低到高浓度逐级脱水处理后加入二苯甲,常规封片。
CK-19检测,前期处理与GPC-3检测的步骤一致,经柠檬酸缓冲液高温高压修复后进行冷却,并在冷却至37 ℃后进行胃酶消化,随后使用PBS冲洗3次,每次5 min,再加入CK-19一抗,放入4 ℃的低温冰箱中保存一夜。后续处理与GPC-3检测的步骤一致。
1.3 评价标准 GPC-3阳性表达标准为,细胞质或细胞膜染色呈黄色或棕黄色,若阳性细胞占比<10%为阴性(-),10%~30%为弱阳性(+),31%~60%为阳性(++),>60%为强阳性(+++)。
CK-19阳性表达标准为,上皮细胞质染色呈黄色或棕黄色,若阳性细胞占比<10%为阴性(-),10%~30%为弱阳性(+),31%~60%为阳性(++),>60%为强阳性(+++)。
1.4 观察指标 以病理检查结果为金标准,计算免疫组化检测GPC-3、CK-19诊断肝细胞癌的灵敏度、特异度和准确度,评估二者对肝细胞癌的诊断效能。根据病理检查结果,比较不同病灶直径、分化程度的肿瘤组织中GPC-3、CK-19的表达情况。
1.5 统计学方法 采用SPSS 21.0统计学软件进行数据处理,计量资料以x±s表示,采用t检验;计数资料以百分比表示,采用χ2检验或秩和检验;采用Kappa检验分析GPC-3、CK-19检测诊断肝细胞癌与病理检查结果的一致性;P<0.05为差异有统计学意义。
2 结果
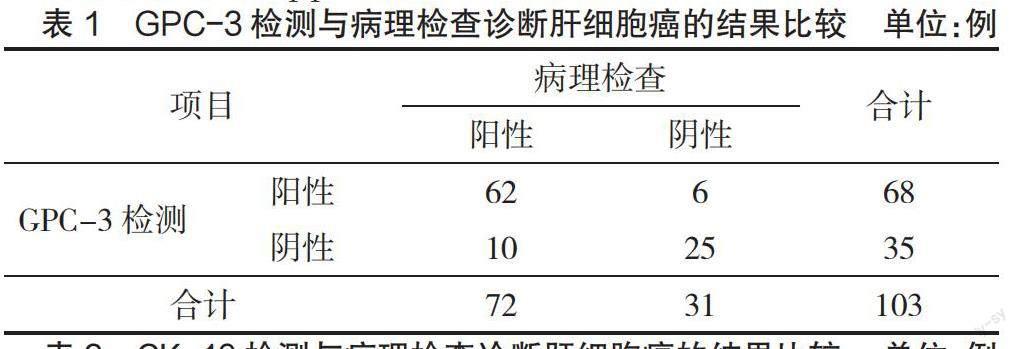
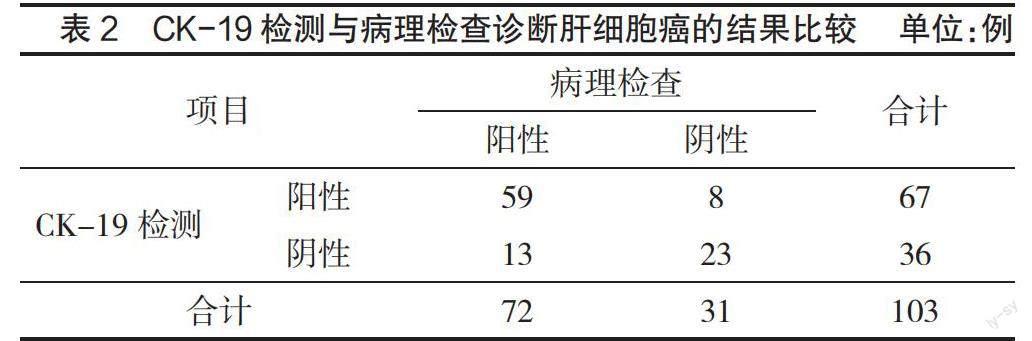
2.1 免疫组化检测GPC-3、CK-19对肝细胞癌的诊断效能比较 GPC-3检测诊断肝细胞癌的灵敏度为86.1%(62/72)、特異度为80.6%(25/31)、准确度为84.5%(87/103),CK-19检测诊断肝细胞癌的灵敏度为81.9%(59/72)、特异度为74.2%(23/31)、准确度为79.6%(82/103),二者比较差异无统计学意义(P>0.05),见表1—表3。Kappa检验分析结果显示,GPC-3、CK-19检测诊断肝细胞癌与病理检查结果的一致性中等(Kappa值=0.644、0.537,P<0.05)。
2.2 不同病灶直径肿瘤组织中GPC-3、CK-19的表达情况比较 病灶直径≥5 cm肿瘤组织中的GPC-3、CK-19的阳性表达率显著高于病灶直径<5 cm的肿瘤组织,差异有统计学意义(P<0.05),见表4。
2.3 不同分化程度肿瘤组织中GPC-3、CK-19的表达情况比较 中低分化肿瘤组织中GPC-3、CK-19的阳性表达率显著高于高分化肿瘤组织,差异有统计学意义(P<0.05),见表5。
3 讨论
肝癌是指发生在肝脏的原发性或转移性恶性肿瘤,从形态学和细胞遗传学角度来看,肝癌可分为肝细胞癌、肝内胆管细胞癌以及肝细胞癌合并肝内胆管细胞癌3种,其中以肝细胞癌最为常见[6]。相比较而言,肝细胞癌恶性程度较高,患者病情进展快,预后更差,而且大多数患者在发病早期以腹痛腹胀、高热、肝区疼痛等非特异性症状为主,容易被误诊为肝硬化。近年来,GPC-3、CK-19作为肝癌标志物在临床研究中被广泛报道,它们被认为可作为早期诊断肝癌和预后评估的有效指标[7-8]。有研究指出[9],GPC-3、CK-19在单纯肝细胞癌与良性肝脏病变组织中的阳性表达率存在显著性差异,尤其在正常的肝组织中,GPC-3的阳性表达率基本为0%。莫小滔[10]选取了40例肝细胞癌患者为研究对象,采集病灶组织和癌周组织后采用免疫组化检测2种组织中GPC-3和CP-19的表达,结果显示,病灶组织中的GPC-3阳性表达率(85.00% vs 22.50%)和CK-19阳性表达率(20.00% vs 0%)均显著高于癌周组织(P<0.05)。
GPC-3是磷脂酰肌醇蛋白聚糖家族成员之一,目前已被证实在肝细胞癌组织和血清中均呈高表达,它可通过糖基磷脂酰肌醇与靶细胞结合,介导细胞内Wnt/β-catenin信号促进胰岛素样生长因子-Ⅱ分泌,造成肝细胞异常生长增殖,导致肝细胞癌变[11]。CK-19是一种表达于胆管上皮细胞的细胞角蛋白,该物质可通过介导核因子-κB(NF-κB)信号通路影响P53、IKKβ等基因的表达,进而促进肝细胞癌上皮细胞-间充质的转化,增加癌细胞的转移、浸润能力[12]。也有研究指出[13],CK-19可以促进细胞外基质与细胞纤维骨架连接,提高肝癌肿瘤细胞的迁移能力。本研究结果显示,GPC-3检测诊断肝细胞癌的灵敏度、特异度、准确度分别为86.1%、80.6%、84.5%,CK-19检测诊断肝细胞癌的灵敏度、特异度、准确度分别为81.9%、74.2%、79.6%,二者比较差异无统计学意义(P>0.05),且Kappa检验显示二者诊断肝细胞癌与病理检查结果的一致性中等(P<0.05)。由此可见,免疫组化检测GPC-3、CK-19对肝细胞癌具有一定的诊断价值,可作为临床辅助诊断肝细胞癌的有效指标,与王泽英[14]的研究结果相符。
在国内的一项研究中,王娟等[15]选取了98例肝癌患者为研究对象,采集病灶组织后进行免疫组化检测GPC-3、CK-19发现,低分化、中分化肝细胞癌组织中GPC-3(92.31% vs 88.37% vs 53.33%)、CK-19(30.00% vs 30.51% vs 8.52%)的阳性率显著高于高分化肝细胞癌组织(P<0.05),认为GPC03、CK-19的表达情况可以反映肝细胞癌的分化程度,这在本研究中也得以体现。本研究结果显示,病灶直径≥5 cm肿瘤组织和中低分化肿瘤组织的GPC-3、CK-19的阳性表达率均显著高于病灶直径<5 cm的肿瘤组织和高分化肿瘤组织(P<0.05)。这表明,GPC-3、CK-19的阳性表达与肝细胞癌患者病情进展有关。宋微珩等[16]研究也指出,GPC-3在中低分化组织中的阳性检出率为100.00%,明显高于高分化组织阳性检出率69.23%(P<0.05)。从这些研究结果中可以看出,GPC-3、CK-19的表达可能对评估患者病情和预后具有指导意义。
综上所述,免疫组化检测GPC-3、CK-19对肝细胞癌具有一定的診断价值,二者在病灶组织中的表达可能与病灶大小、分化程度有关,可作为临床早期诊断肝细胞癌和病情评估的免疫组化指标。
参考文献
[1] 孟唤男,赵丽,刘柳,等.中西医结合防治原发性肝癌研究进展[J].中医药学报,2021,49(2):115-119.
[2] 姚敏,杨婕,姚登福.环状RNA在肝癌进展中的作用及其潜在价值[J].南通大学学报(医学版),2020,40(3):197- 202.
[3] BRYCHTOVA V,ZAMPACHOVA V,HRSTKA R,et al.Differential expression of anterior gradient protein 3 in intrahepatic cholangiocarcinoma and hepatocellular carcinoma[J].Exp Mol Pathol,2014,96(3):375-381.
[4] 梁婷,李荣,王冬梅,等.免疫组化多种抗体联合检测在肝细胞癌与相关良性结节鉴别诊断中的应用[J].当代医学,2021,27(27):99-101.
[5] 马小华,吴坤瑾,黄启超,等.外周血GPC3在肝细胞癌临床诊断中的价值[J].中国癌症防治杂志,2022,14(1):38-44.
[6] 王曦,李红.磁共振成像鉴别肝细胞癌和肝内胆管细胞癌的研究进展[J].磁共振成像,2021,12(10):109-111.
[7] ZHANG R G Y,AI J Y,WANG J K,et al.NCAPG promotes the proliferation of hepatocellular carcinoma through the CKⅡ-dependent regulation of PTEN[J].J Transl Med,2022,20(1):1-16.
[8] 韩帅,孟帆,张宏凯,等.Ki67、Ck19与肝细胞癌临床病理特征和磁共振成像表观扩散系数的相关性分析[J].中华医学杂志,2021,101(11):798-802.
[9] 刘冰,杨帅,费锡斌,等.GPC-3联合CK-19免疫组化检测在肝细胞癌诊断及鉴别诊断中的应用[J].医学信息,2019, 32(23):169-170.
[10] 莫小滔.GPC-3与CK-19免疫组化在肝细胞癌诊断中的价值[J].深圳中西医结合杂志,2019,29(17):11-12.
[11] 姚敏,沈水杰,陈洁,等.下调GPC-3转录经Wnt/β-catenin通路对肝细胞癌生长的抑制作用[J].胃肠病学和肝病学杂志,2019,28(9):972-977.
[12] 郑秀,袁春旺,崔雄伟,等.细胞角蛋白19/磷脂酰肌醇蛋白聚糖3表达模式与肝细胞癌患者介入治疗后复发的相关性[J].中华肝脏病杂志,2020,28(11):936-941.
[13] 杨晓珍,龙江,赵鹏,等.肝癌分化程度与肝脏CT强化特点及CD34、p53、GPC3、CK19、Ki-67表达的关系[J].癌症进展,2018,16(15):1892-1895.
[14] 王泽英.免疫组化测定GPC-3、CK-19对肝细胞癌的诊断价值[J].中国卫生工程学,2022,21(2):276-278.
[15] 王娟,张曙光,孙颖,等.免疫组化检测GPC-3与CK-19在肝细胞癌诊断中的应用价值[J].临床和实验医学杂志,2017,16(14):1398-1401.
[16] 宋微珩,盖赵辉,董鑫,等.CK-19与GPC-3联合检测在肝细胞癌和胆管细胞癌诊断中的价值[J].肝脏,2015,20(3):232-234.
(收稿日期:2023-10-09)
