枸杞多糖对阿尔茨海默病合并2型糖尿病小鼠学习记忆能力及脑内Tau蛋白磷酸化水平的影响
2024-01-03叶红霞贺颖西齐妍强杨光屈祖卫胡艳丽
叶红霞 贺颖西 齐妍强 杨光 屈祖卫 胡艳丽


摘要:目的 探討枸杞多糖(LBP)对阿尔茨海默病(AD)合并2型糖尿病(T2DM)小鼠学习记忆能力及脑内Tau蛋白磷酸化水平的影响。方法 5月龄C57BL/6J小鼠16只随机分为对照组、T2DM组,同月龄APP/PS1小鼠32只随机分为AD组、AD+T2DM组、LBP组(100 mg·kg-1)、多奈哌齐组(0.75 mg·kg-1),每组各8只。T2DM组、AD+T2DM组、LBP组、多奈哌齐组小鼠高糖高脂饲料联合腹腔注射链脲佐菌素建立T2DM模型。治疗组以相应剂量药物干预,其余组给予等体积生理盐水。连续给药3个月后,Morris水迷宫实验评价各组小鼠学习记忆能力,HE染色观察各组小鼠脑组织细胞形态变化,Western Blot检测各组小鼠脑内不同位点磷酸化Tau蛋白及GSK3β蛋白的表达水平。结果 LBP可缩短AD+T2DM模型小鼠逃避潜伏期、第一次穿越平台时间(P<0.05,P<0.05),增加穿越平台次数及目标象限停留时间(P<0.01,P<0.01),改善大脑皮层神经元形态损伤,降低皮层及海马Tau蛋白Ser404、Ser396及Ser199位点磷酸化水平(P<0.05,P<0.05,P<0.05;P>0.05,P<0.01,P<0.01)和GSK-3β及Tyr216位点磷酸化水平(P>0.05,P<0.01;P<0.01,P<0.01),提高GSK-3β蛋白Ser9位点磷酸化水平(P<0.01,P<0.05)。结论 枸杞多糖可改善AD+T2DM模型小鼠的学习记忆能力,降低脑内Tau蛋白的磷酸化水平。
关键词:枸杞多糖;阿尔茨海默病;2型糖尿病;Tau蛋白磷酸化;糖原合成激酶-3β
中图分类号:R749.1中图分类号文献标志码:A文献标识码
Effect of Lycium barbarum polysaccharides on learning and memory ability and
Tau protein phosphorylation level in brain withAlzheimers disease and type
2 diabetes mellitus mice
YE Hongxia,HE Yingxi,QI Yanqiang,YANG Guang,QU Zuwei,HU Yanli*
(Department of Phamacy, Shihezi University/Key Laboratory of Xingjiang Phytomedicine Resources Utilization, Ministry of Education, Shihezi,Xinjiang
832000, China)
Abstract: Objective To investigate the effect of Lycium barbarum polysaccharide(LBP)on learning and memory ability and brain Tau protein phosphorylation level in mice with Alzheimer s disease(AD)and type 2 diabetes mellitus(T2DM). Methods Sixteen 5-month-old C57BL/6J mice were randomly divided into control group and T2DM group, thirty-two APP/PS1 mice of the same age were randomly divided into AD group, AD+T2DM group, LBP group(100 mg·kg-1)and donepezil group(0.75 mg·kg-1), with 8 mice in each group. T2DM group, AD+T2DM group, LBP group and donepezil group were fed with high glucose and high fat diet combined with intraperitoneal injection of streptozotocin to establish T2DM model. The treatment group was intervened with corresponding doses of drugs, and the same volume of normal saline was given to the treatment group. After 3 months of continuous administration, Morris water maze test was used to evaluate the learning and memory ability of mice in each group. HE staining was used to observe the morphological changes of brain tissue cells in each group. Western Blot was used to detect the phosphorylation levels of Tau protein and GSK-3β protein at different sites in the brain of mice in each group. Results LBP could shorten the escape latency, the first crossing platform time(P<0.05, P<0.05), increase the number of crossing platforms and the target quadrant residence time(P<0.01, P<0.01)of AD+T2DM model mice. Improvement of nuclear condensation and vacuoles in cerebral cortex neurons. Reduced phosphorylation of Tau protein Ser404, Ser396 and Ser199 in cortex and hippocampus(P<0.05, P<0.05, P<0.05; P>0.05, P<0.01, P<0.01)、decreased the phosphorylation levels of GSK-3β and Tyr216 in cortex and hippocampus(P>0.05, P<0.01; P<0.01, P<0.01)and increased the phosphorylation level of Ser9 site(P<0.01, P<0.05). Conclusion LBP can improve the learning and memory ability of AD+T2DM model mice and reduce the phosphorylation level of Tau protein in the brain.
Key words: lycium barbarum polysaccharide;Alzheimers disease;Type 2 diabetes;Tau protein phosphorylation;glycogen synthase kinase-3β
随着人口老龄化的加剧及生活条件的改善,阿尔茨海默病(Alzheimers disease, AD)与2型糖尿病(Type 2 diabetes mellitus, T2DM)的患病率呈直线上升趋势[1-2]。AD是一种常见的中枢神经退行性疾病,其病因复杂,假说众多[3]。其中,Tau蛋白学说是主要的AD发病机制假说之一[4]。相关研究表明,神经元中过度磷酸化的Tau蛋白形成的神经原纤维缠结(neurofifibrillary tangles, NFTs)数量与AD患者的痴呆程度呈正相关,其已成为国际公认评价AD病理进程的标准之一[5-6]。流行病学研究发现,T2DM是AD发生的危险因素之一[7],T2DM患者罹患AD的风险是正常人群的1.5~2.5倍[8],且Tau蛋白的磷酸化程度是T2DM罹发AD的关键因素[9]。因此,降低脑内Tau蛋白磷酸化水平可能成为一种预防及治疗AD合并T2DM认知障碍的有效策略。
枸杞多糖(Lycium barbarum polysaccharide, LBP)是枸杞果实中提取的主要有效成分之一,具有良好的抗衰老、抗氧化以及神经保护作用[10-11]。研究发现,LBP能够改善AD模型小鼠学习记忆能力、减少海马组织内Aβ1-42的含量[12],还可改善链脲佐菌素诱导糖尿病大鼠的认知功能损伤[13]。但目前还未有相关研究报道其对AD合并T2DM小鼠学习记忆能力的影响。基于以上研究,本实验采用APP/PS1转基因小鼠给与高糖高脂饲料联合腹腔注射链脲佐菌素构建AD合并T2DM小鼠模型,初步探讨了LBP对AD合并T2DM小鼠学习记忆能力及脑内Tau蛋白磷酸化水平的影响。
1 材料与方法
1.1 实验动物及材料
1.1.1 实验动物
本实验选用5月龄C57BL/6J遗传背景的APP/PS1((APPswe, SEN1d E9) 85Dbo)小鼠32只、同月齡C57BL/6J小鼠16只,雌雄各半,体重23~26 g,购自南京君科生物工程有限公司(SPF级,合格证号:20180006018886)。实验期间自由摄食饮水,12 h明暗交替照明,所有实验均照实验规定进行,操作和管理均遵守《实验动物管理条例》。
1.1.2 仪器
安稳+型血糖仪(三诺生物传感股份有限公司);DMS-2型Morris水迷宫实验装置(中国医学科学院药物研究所);DB-09型石蜡包埋机(湖北德森科技有限公司);RM2245型石蜡切片机(德国徕卡公司);Axio Imager A2正置显微镜(德国蔡司公司);4503R型低温高速离心机(Eppendorf公司);蛋白含量测定仪(美国Quawell公司);电泳仪、电转仪(美国BIO-RAD公司);UVP 化学发光成像系统(美国Ultra-Violet)。
1.1.3 实验药品与主要试剂
枸杞多糖(LBP,含量≥90 %,南京景竹生物科技有限公司,批号:JZ21042710);盐酸多奈哌齐(卫材(中国)药业有限公司,批号:2102079);60 %高糖高脂鼠粮、10 %低脂鼠粮(Dyets,批号:20210621);链脲佐菌素(STZ,SIGMA S0130);0.1 mol·L-1 pH4.4柠檬酸-柠檬酸钠缓冲液(源叶,批号:J11GR154622);伊红、苏木精染液;p-Tau(Ser404)兔多克隆抗体、p-Tau(Ser396)鼠多克隆抗体、GSK3β鼠多克隆抗体、p-GSK3β(Ser9)兔单克隆抗体(Cell Signaling technology,批号:#11837S、#9632S、#9832S、#9336S);p-Tau(Ser199)兔单克隆抗体(life technologies,批号:786604E);p-GSK3β(Tyr216)兔单克隆抗体(Santa Cruz Blotechnology,批号:F0811);GAPDH小鼠单克隆抗体、辣根酶标记山羊抗小鼠/兔lgG(北京中杉金桥生物技术有限公司,批号:210041028、214801119、229760105)。
1.2 方法
1.2.1 动物分组、模型建立及给药
5月龄C57BL/6J小鼠16只随机分为对照组、T2DM组,同月龄APP/PS1 小鼠32只,随机分为AD组、AD+T2DM组、LBP组、多奈哌齐组,每组8只。T2DM组、AD+T2DM组、LBP组和多奈哌齐组的小鼠持续给与60 %高糖高脂鼠粮1个月后,禁食不禁水12 h,连续4 d腹腔注射60 mg·kg-1链脲佐菌素(0.1 mol·L-1 pH4.4柠檬酸-柠檬酸钠缓冲液配置),72 h后测量空腹血糖值(FBG),以FBG≥11.1 mmol·L-1作为T2DM成模标准,建立T2DM模型;对照组及AD组小鼠给与10 %低脂鼠粮,腹腔注射等体积柠檬酸-柠檬酸钠缓冲液。给药组分别给与LBP 100 mg·kg-1、多奈哌齐0.75 mg·kg-1,其它组给予等体积生理盐水,连续给药3个月。
1.2.2 Morris水迷宫实验
灌胃给药3个月后,Morris水迷宫实验检测各组小鼠的学习记忆能力。实验期间,水温需保持(22 ± 2)℃,保持光线稳定、环境安静。Morris水迷宫实验分为定位航行实验与空间探索实验。第一天至第五天为定位航行试验,记录小鼠在120 s内找到平台的时间即逃避潜伏期,若小鼠在120 s内未找到平台则其逃避潜伏期为120 s,每只小鼠训练完毕后不论是否找到平台均将之放于平台上学习15 s,每天分别从平台相邻相对象限入水学习两次;第六天进行空间探索试验,撤去平台,检测小鼠相对象限入水后第一次穿越平台时间及120 s内穿越平台的次数。
1.2.3 样本收集
行为学实验结束后,各组随机选取5只动物,深度麻醉经心脏灌注后在低温环境下取出脑组织,取左半脑在4 %多聚甲醛中固定1周后进行石蜡包埋,分离剩余小鼠海马和皮层组织,储存在-80 ℃备用。
1.2.4 HE染色
石蜡包埋的脑组织连续冠状切片,切片厚4 μm。68 ℃ 烤片15 min(不超过30 min),依次进行二甲苯脱蜡,梯度乙醇洗脱,自来水冲洗,苏木素染色5 min,自来水冲洗切片至水接近无色透明。酸酒精分化3~5 s,自来水冲洗3次,水中返蓝5 min。0.5 %伊红染色6~8 s,水洗之后进行乙醇脱水,二甲苯透明,自然晾干后封片。显微镜下拍摄脑组织海马和皮层区的神经元形态,评价LBP对阿尔茨海默病合并2型糖尿病小鼠脑组织形态学损伤的改善作用。
1.2.5 Western Blot检测脑组织p-Tau(Ser404、Ser396、Ser199)、GSK3β、p-GSK3β(Ser9、Tyr216)蛋白表达水平
精确称取适量皮层或海马组织,加入RIPA裂解液、PMSF蛋白酶抑制剂和磷酸酶抑制剂,机械匀浆后离心取上清(总蛋白),通过蛋白测定仪Q5000测定蛋白浓度。加入4×上样缓冲液和电泳液,配制成5 μg·μL-1蛋白样品。蛋白变性后进行SDS-PAGE凝胶电泳,将目的蛋白转至 PVDF膜后室温封闭1 h,一抗(1∶1 000)4 ℃ 隔夜孵育,第二天将PVDF膜置于HRP标记的相应种属二抗稀释液(1∶10 000)中室温孵育一小时,UVP 化学发光检测仪收集曝光条带图像。
1.2.6 统计学分析
使用Image J软件对Western Blot实验条带进行灰度值分析,SPSS19.0软件进行统计分析。其中,Morris水迷宫实验中定位航行实验数据采用双因素方差分析(two-way ANOVA),其它实验数据采用单因素方差分析(one-way ANOVA),结合LSD检验法,比较各组间差异,结果以均值±标准差(± SD)表示,P<0.05有统计学意义,P<0.01有极显著性差异,使用Origin 2021作图。
2 结果
2.1 Morris水迷宫
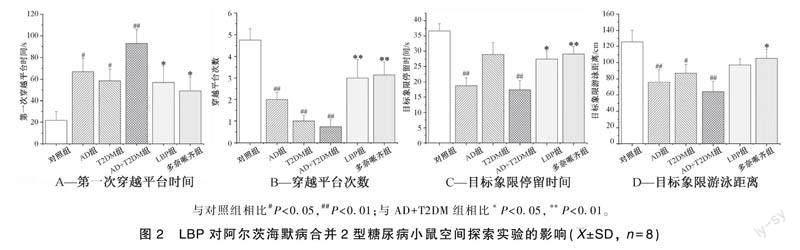
各组小鼠游泳轨迹轨迹图如图1所示。
定位航行实验结果表明,与对照组相比,AD组、T2DM组及AD+T2DM组小鼠逃避潜伏期均有所增加(P<0.01,P<0.05,P<0.01),提示AD組、T2DM组及AD+T2DM组小鼠有不同程度的空间学习障碍;与AD+T2DM组小鼠相比,LBP组与多奈哌齐组小鼠逃避潜伏期明显缩短(P<0.05,P<0.01)(表1)。
空间探索实验结果显示,与对照组相比,AD组、T2DM组、AD+T2DM组小鼠第一次穿越平台时间明显增长(P<0.05,P<0.05,P<0.01)、穿越平台次数均明显减少(P<0.01)、目标象限游泳距离明显缩短(P<0.01,P<0.05,P<0.01),AD组及AD+T2DM组小鼠目标象限停留时间均明显缩短(P<0.01),说明AD组、T2DM组及AD+T2DM组小鼠记忆能力有不同程度的降低(图2);与AD+T2DM组相比,LBP组和多奈哌齐组小鼠第一次穿越平台时间明显缩短(P<0.05)、穿越平台次数明显增多(P<0.01)、目标象限停留时间明显增长(P<0.05,P<0.01),多奈哌齐组目标象限游泳距离明显增长(P<0.05)(图2)。以上结果提示,LBP可在一定程度上改善AD合并T2DM小鼠的学习记忆能力。
2.2 LBP对阿尔茨海默病合并2型糖尿病小鼠脑组织病理学改变的影响
通过HE染色观察各组小鼠大脑皮层神经元细胞的的形态变化。与对照组相比,AD组、T2DM组、AD+T2DM组小鼠大脑皮层神经元均出现不同程度的细胞核固缩、核仁消失、空泡性变性;AD+T2DM模型小鼠经过LBP与多奈哌齐给药干预后,神经元细胞空泡减少,结构均有不同程度的改善(图3)。提示LBP可在一定程度上改善阿尔茨海默病合并2型糖尿病小鼠大脑皮层神经元细胞的病理损害。
2.3 LBP对阿尔茨海默病合并2型糖尿病小鼠脑内p-Tau(Ser404、Ser396、Ser199)、GSK3β、p-GSK3β(Ser9、Tyr216)蛋白表达水平的影响
Western Blot检测各组小鼠大脑皮层及海马组织中Tau蛋白Ser404、Ser396、Ser199位点磷酸化水平,结果如图4A、图4B所示。
与对照组相比,AD组、T2DM组、AD+T2DM组大脑皮层及海马Tau蛋白Ser404、Ser396、Ser199位点磷酸化水平均有不同程度的升高,差异均有统计学意义(P<0.05);经LBP给药后,AD+T2DM模型小鼠皮层Tau蛋白Ser404、Ser396及Ser199位点磷酸化水平明显降低(P<0.05)、海马Tau蛋白Ser396及Ser199位点磷酸化水平显著降低(P<0.01)(图4C~图4E)。LBP可降低AD合并T2DM小鼠大脑皮层及海马组织Tau蛋白Ser404、Ser396和Ser199位点磷酸化水平,从而发挥保护神经元、改善AD合并T2DM小鼠学习记忆能力的作用。
Western Blot检测各组小鼠大脑皮层及海马组织中GSK3β、p-GSK3β(Ser9)、p-GSK3β(Tyr216)蛋白表达水平结果显示(图5A,图5B),与对照组相比,AD组与T2DM组海马GSK3β蛋白表达水平明显升高(P<0.05)、AD+T2DM组小鼠皮层及海马GSK3β蛋白表达水平明显升高(P<0.05)(图5C);p-GSK3β(Ser9)蛋白表达水平在AD及T2DM组小鼠大脑皮层和海马、AD+T2DM组海马中明显降低(P<0.05),在AD+T2DM组皮层中显著降低(P<0.01)(图5D);p-GSK3β(Tyr216)蛋白表达水平在AD组小鼠皮层与海马中明显升高(P<0.05),而在T2DM组及AD+T2DM组中显著升高(P<0.01)(图5E)。与AD+T2DM组相比,LBP组与多奈哌齐组皮层及海马GSK3β蛋白表达水平有所降低(P>0.05,P<0.01;P<0.01,P<0.05)、皮层p-GSK3β(Ser9)蛋白表达水平有所升高(P<0.01,P<0.05)、皮层及海马p-GSK3β(Tyr216)蛋白表达水平显著降低(P<0.01)。以上结果提示,LBP可降低阿尔茨海默病合并2型糖尿病小鼠皮层及海马组织中升高的GSK3β、p-GSK3β(Tyr216)蛋白表达水平并提高其皮层和海马组织中降低的p-GSK3β(Ser9)蛋白表达水平。
3 讨论
AD是一种与年龄密切相关的神经系统退行性疾病,临床表现为进行性记忆功能衰退、学习能力下降、认知行为障碍及其它神经精神症状。大量研究证实, T2DM发生认知功能障碍的风险相比正常人显著增加, T2DM和各种类型痴呆的发生均具有很强相关性[14]。更有临床研究显示,AD 患者往往也会患有T2DM,二者存在着一定的相关性[15]。评价动物学习记忆功能的行为学测试方法有多种,其中,Morris水迷宫实验是一项针对啮齿动物空间学习记忆能力检测的经典实验,可用来评价各组小鼠的学习记忆能力。本实验结果显示,AD组、T2DM组及AD+T2DM组小鼠学习记忆能力均出现不同程度的下降,其中,AD+T2DM组学习记忆能力最差,而LBP改善了AD合并T2DM模型小鼠的学习记忆能力。
相关研究显示,T2DM与AD在发病过程、病理变化、临床表现和预后等方面有着很多的相似性[7]。其中,Tau蛋白过度磷酸化形成神经原纤维缠结(neurofifibrillary tangles, NFTs)是AD与T2DM共有的病理学特征之一[16-17]。Tau蛋白是神经元主要的微管相关蛋白,其主要功能是结合到微管蛋白上,促进微管蛋白组装成微管并稳定微管的结构[18]。研究发现,Tau蛋白的过度磷酸化与认知功能障碍的产生密切相关[19-20]。当tau蛋白发生异常水平的磷酸化后产生的病理性聚集将会影响微管的稳定性,引起神经元结构和功能的破坏,导致大脑认知功能障碍,而使用磷酸化Tau蛋白聚集抑制剂可有效改善人或动物的认知功能障碍[21]。本实验结果显示,AD组、T2DM组及AD+T2DM组小鼠脑内Tau蛋白Ser404、Ser396、Ser199位点磷酸化水平均明显升高,神经元产生了不同程度的病理性损伤,其中,AD+T2DM组小鼠脑内Tau蛋白磷酸化程度最大、大脑皮层神经元损伤最严重;经LBP治疗后,AD合并T2DM模型小鼠脑内Tau蛋白磷酸化水平降低、大脑皮层神经元损伤减少。以上结果提示,LBP可抑制AD合并T2DM模型小鼠脑内Tau蛋白的过度磷酸化,保护大脑神经元。
研究表明[22]Tau蛋白的磷酸化受蛋白激酶和蛋白磷酸酶的双重调节,其中,糖原合成酶激酶-3β(glycogen synthase kinase-3β, GSK-3β)是重要的蛋白激酶之一,在调节脑内Tau蛋白Ser404、Ser396、Ser199等多个位点磷酸化水平中发挥了关键的作用。而GSK-3β在Ser9位点磷酸化后使GSK-3β活性降低、抑制Tau蛋白磷酸化,Tyr216位点磷酸化则可使其活性增强并促进Tau蛋白磷酸化[23]。为进一步明确LBP降低AD合并T2DM小鼠脑内Tau蛋白磷酸化水平的作用机制,本实验进一步检测了GSK-3β蛋白表达水平及其Ser9、Tyr216位点磷酸化水平。与对照组相比,AD组、T2DM组及AD+T2DM组小鼠脑内GSK-3β蛋白及其Tyr216位点磷酸化水平均有不同程度的升高、Ser9位点磷酸化水平有所降低,且AD+T2DM组变化最大。LBP可降低AD合并T2DM模型小鼠Tyr216位点磷酸化水平、提高Ser9位点磷酸化水平,降低GSK-3β蛋白在脑内的表达水平。以上结果提示,LBP可以通过调节AD合并T2DM模型小鼠脑内GSK-3β在Ser9位點及Thr216位点的磷酸化水平,降低GSK-3β蛋白表达水平,从而抑制Tau蛋白磷酸化。
综上所述,LBP可调节AD合并T2DM模型小鼠脑内GSK-3β蛋白Ser9、Thr216位点的磷酸化,降低GSK-3β蛋白表达水平,抑制Tau蛋白磷酸化,从而改善模型小鼠学习记忆功能障碍及神经元损伤。
参考文献(References)
[1]Alzheimers Disease International. World alzheimer report 20l8: The state of the art of dementia research; new frontiers[R]. London: ADI, 2018.
[2]SHI G S, ZHU N, QIU L, et al. Impact of the 2020 China diabetes society guideline on the prevalence of diabetes mellitus and eligibility for antidiabetic treatment in China[J]. International Journal of General Medicine, 2021, 14: 6639-6645.
[3]LOERA-VALENCIA R,CEDAZO-MINGVEZ A, KENIGSBERG P A, et al. Current and emerging avenues for Alzheimers disease drug targets[J]. Journal of Internal Medicine, 2019, 286(4): 398-437.
[4]AI M A,SAHAB U M, BIJO M, et al.Toxic tau: structural origins of tau aggregation in Alzheimers disease[J].Neural Regeneration Research,2020,15(8):1417-1420.
[5]ZELAYA M V, PREZ V E, DEMORENTIN X M, et al. Olfactory bulb proteome dynamics during the progression of sporadic Alzheimers disease: identification of common and distinct olfactory targets across Alzheimer-related co-pathologies[J]. Oncotarget, 2015, 6(37): 39437-39456.
[6]DRZEZGA A, RIEMENSCHNEIDER M, STRASSNER B, et al. Cerebral glucose metabolism in patients with AD and different APOE genotypes[J]. Neurology, 2005, 64(1): 102-107.
[7]RODRIGO B M, YENA L, AILEEN J Z, et al. Determinants of cognitive function in individuals with type 2 diabetes mellitus: A meta-analysis[J]. Annals of Clinical Psychiatry, 2018, 30(1): 38-50.
[8]VAGELATOS N T, ESLICK G D. Type 2 diabetes as a risk factor for Alzheimers disease: the confounders, interactions, and neuropathology associated with this relationship[J]. Epidemiologic Reviews, 2013, 35(1): 152-160.
[9]馬玲.从Tau蛋白过度磷酸化探讨2型糖尿病所致神经纤维化的机制[J].中国现代医学杂志,2016,26(2):6-12.
MA L. To explore the mechanism of neurofibrosis induced by type 2 diabetes from the perspective of Tau protein hyperphosphorylation[J]. Modern Chinese Medical Journal, 2016, 26(2): 6-12.
[10]YI R, LIU X M, DONG Q. A study of Lycium barbarum polysaccharides (LBP) extraction technology and its anti-aging effect[J]. African Journal of Traditional, Complementary, and Alternative Medicines: AJTCAM, 2013, 10(4): 171-174.
[11]CAO S M, DU J L, Hei Q H. Lycium barbarum polysaccharide protects against neurotoxicity via the Nrf2-HO-1 pathway[J]. Experimental and Therapeutic Medicine, 2017, 14(5): 4919-4927.
[12]ZHANG Q L, DU X P, XU Y P, et al. The effects of Gouqi extracts on Morris maze learning in the APP/PS1 double transgenic mouse model of Alzheimers disease[J]. Experimental and Therapeutic Medicine, 2013, 5(5): 1528-1530.
[13]孙美娜. 枸杞多糖和漆黄素对链脲佐菌素诱导的糖尿病大鼠认知损伤的预防[D].上海:上海师范大学,2012.
[14]TALBOT K,WANG H Y, KAZI H, et al. Demonstrated brain insulin resistance in Alzheimers disease patients is associated with IGF-1 resistance, IRS-1 dysregulation, and cognitive decline[J]. Journal of Clinical Investigation, 2012, 122(4): 1316-1338.
[15]JANSON J, LAEDTKE T, PARISI J E, et al. Increased risk of type 2 diabetes in Alzheimer disease[J]. Diabetes,2004,53(2):474-481.
[16]AISEN P S, CUMMINGS J, JACK C R, et al.On the path to 2025: understanding the Alzheimers disease continuum[J].Alzheimers Research & Therapy, 2017, 9(1): 60.
[17]RAD S K, ARYA A, KARIMIAN H, et al. Mechanism involved in insulin resistance via accumulation of β-amyloid and neurofibrillary tangles: link between type 2 diabetes and Alzheimers disease[J]. Drug Design, Development and Therapy, 2018, 12: 3999-4021.
[18]GAO Y, TAN L, YU J T, et al. Tau in alzheimers disease: mechanisms and therapeutic strategies[J]. Current Alzheimer Research, 2018, 15(3): 283-300.
[19]DOS S P L C, OZELA P F, FATIMA B B M, et al. Alzheimers disease: a review from the pathophysiology to diagnosis, new perspectives for pharmacological treatment[J]. Current Medicinal Chemistry, 2018, 25(26): 3141-3159.
[20]袁芳,洪小平,段妍君,等.電针“足三里”对糖尿病大鼠胰腺及海马中tau蛋白磷酸化水平的影响[J].针刺研究,2021,46(11):901-906.
YUAN F, HONG X P, DUAN Y J, et al. Effect of EA at Zusanli on tau protein phosphorylation levels in pancreas and hippocampus of diabetic rats[J]. Acupuncture Research, 2021, 46(11): 901-906.
[21]REISBERG B, DOODY R, STFFLER A, et al. Memantine in moderate-to-severe Alzheimers disease[J]. The New England Journal of Medicine, 2003, 348(14): 1333-1341.
[22]WANG J Z, LIU F. Microtubule-associated protein tau in development, degeneration and protection of neurons[J]. Progress in Neurobiology, 2008, 85(2): 148-175.
[23]DONG H M, MAO S P, MAO S P, et al. Tanshinone IIA protects PC12 cells from β-amyloid(25-35)-induced apoptosis via PI3K/Akt signaling pathway[J]. Molecular Biology Reports, 2012, 39(6): 6495-6503.
(责任编辑:编辑唐慧)
收稿日期:中文收稿日期2022-08-28
基金项目:国家自然科学基金项目(81960665)
作者简介:叶红霞(1997—),女,硕士研究生,专业方向为神经药理学研究。
*通信作者:胡艳丽(1976—),女,教授,从事神经药理学研究,e-mail: wzx330@163.com。
