加强实验创新 提高学习兴趣
--以“自然界中的硫”为例
2024-01-03山东省博兴第一中学256500沈金龙山东省博兴县第三中学256500
山东省博兴第一中学(256500) 沈金龙 山东省博兴县第三中学(256500) 李 娜
1 教学内容分析
“硫的转化”是鲁科版必修1第3章第2节的内容,第1课时“自然界中的硫”是硫的转化知识的核心之一。通过铁及其化合物内容的探究,学生已初步建构研究物质性质的价、类二维视角,已具备一定的价-类二维思想。本课时旨在通过自然界中硫的转化,让学生认识硫元素的家族,构建含硫元素的价-类二维图,从价-类二维的视角预测并验证硫单质的化学性质,总结研究含同一元素物质间的转化方法,为接下来“不同价态硫元素之间的转化”“氮的循环”的学习做好铺垫。
2 教学目标
(1)能从物质类别和元素价态两个角度,对自然界中含硫物质进行归类;能绘制价-类二维图,建立认知模型,丰富研究物质性质的思路和方法,发展证据推理和模型认知的核心素养。
(2)能运用价-类二维图,预测硫单质的化学性质,设计、实施实验并能分析、解释有关实验现象,体会实验对认识和研究物质性质的重要作用,形成证据意识,发展证据推理与模型认知、科学态度与创新意识的核心素养。
(3)认识硫磺的用途,感受化学与生活的密切联系,体会化学在生产生活中的学科价值。通过绿色化学实验设计,增强环保意识,发展科学态度与社会责任的核心素养。
3 教学实录
引入:(PPT展示图片):我们在焚烧麦秸时会闻到轻微的刺激性气味,在倒垃圾的时候会闻到恶臭味,大家知道这是什么元素在搞怪吗?其实这是硫元素,在焚烧麦秸时硫元素会变成含有SO2的刺激性气味的气体,食物腐烂时,在微生物的作用下,硫元素转化成H2S等气体,在生命体还有人体中,硫元素是常量元素,是生命元素,是构成细胞、蛋白质、氨基酸的基本元素,没有硫元素就没有生命,那么自然界中有哪些含硫元素的物质呢?这些物质又是如何转化的呢?
设计目的:通过学生熟悉的生活常识导入本节课的学习,提高学生学习化学的兴趣,体现化学的学科价值。
3.1 任务1:构建硫及其化合物的价-类二维图
问题1:火山喷发时,大量的硫及其化合物喷涌而出,单质硫主要存在于火山周围的地域中,以化合态存在的硫多为矿物。不同价态硫元素之间是如何转化的呢?
问题2:寻找自然界中含硫的物质并根据物质的类别和硫元素的化合价,标注在学案价-类二维图上。
学生:通过阅读课本第97-98页,了解自然界中含硫物质及含硫物质之间的转化,独立构建硫的价-类二维图(如图1)。

图1 硫及其化合物的价-类二维图[1]
交流研讨1:利用硫的价-类二维图分析推测,预测硫单质有哪些化学性质。
学生:首先独立思考,根据价-类二维图,从化合价的角度和物质类别的角度,分析预测硫单质的化学性质,独立完成之后,小组之间互相交流,最后达成共识,完成硫单质的化学性质的预测(见表1)。学生展示最想通过实验验证的反应。

表1 学生预测硫单质的化学性质
设计目的:学生根据建构的价-类二维图,提炼出研究物质性质的基本方法。
过渡:实践是检验真理的唯一标准,下面我们就用实验来验证我们的预测。
3.2 任务2:探究硫单质的化学性质
实验探究1:操作台上有本实验的实验药品和器材、液封除毒气集气瓶(盛有氧气),酒精灯,硫粉。根据实验步骤完成实验并记录实验现象(如图2)。

图2 液封除毒气集气瓶及硫在氧气中燃烧的现象
实验步骤:①在燃烧匙内加入少量的硫粉,观察硫粉的颜色和状态;②将燃烧匙放在酒精灯上加热,观察硫粉状态的变化;③持续加热至燃烧,观察火焰的颜色,迅速打开液封除毒气集气瓶玻璃盖,将燃烧匙伸入,观察火焰颜色。
实验现象:①淡黄色固体;②硫粉由固体熔化成液体,硫单质的熔点低;③硫在空气中燃烧,火焰呈淡蓝色,在氧气中燃烧,火焰呈蓝紫色。

实验探究2:操作台上放有本实验的实验药品和器材,其中,小试管中盛有铁粉和硫粉混合物,根据实验步骤完成实验并记录实验现象(如图3)。
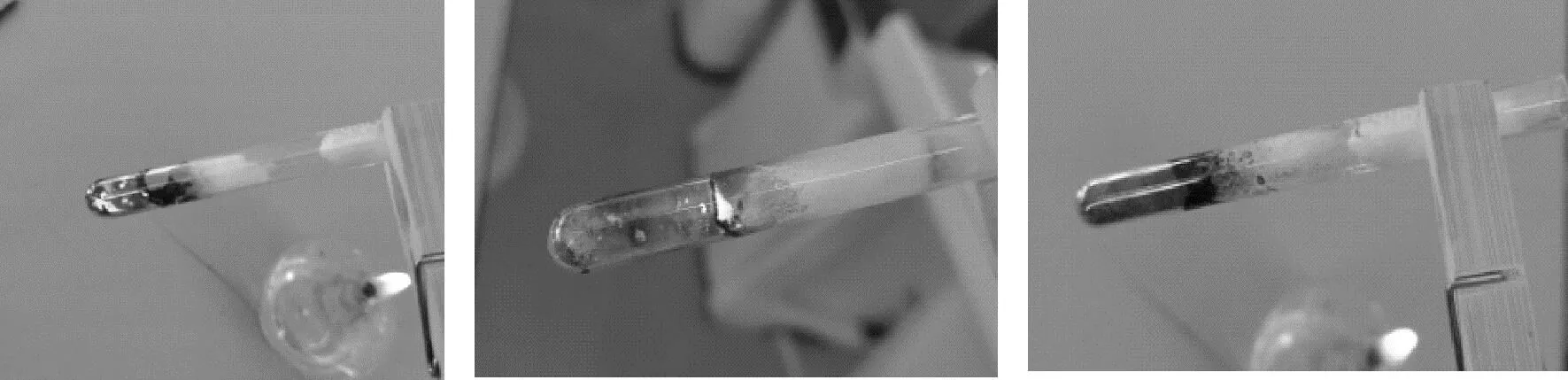
图3 铁与硫粉反应的现象
实验步骤:①向小试管中的棉花上滴加4~5滴0.5 mol/L的NaOH溶液;②将小试管放在酒精灯上加热,先预热,试管底部出现红热状态时,撤去酒精灯,观察发生的现象。
实验现象:固体混合物持续呈红热状态,剧烈反应,放出大量的热。
学生:根据实验步骤的提示,完成实验,观察实验现象并记录实验现象,从而得到实验结论,学生展示,其他同学补充,从而实现硫单质性质的验证。
追问1:请同学们思考,对于硫单质与铁粉的反应,为何不能生成Fe2S3?
学生1:根据氧化性的强弱F2>Cl2>Br2>Fe3+>I2>S,硫单质只能将铁元素氧化为亚铁离子。
学生2:根据氧气与铁反应,会生成二价的铁,根据硫单质与氧气的反应,可得硫单质的氧化性比氧气氧化性要弱,所以铁与硫单质反应生成的应该是硫化亚铁[2]。
追问2:Cu与S化合的产物呢?
教师总结:教师首先肯定学生的回答,由于硫单质具有弱氧化性,与变价的金属单质反应时,会生成低价态的硫化物。
设计目的:通过预测性质、实施实验、观察现象、得到结论、解释现象,学生构建完整的研究物质性质的基本方法和价-类二维图,学习巩固硫单质的化学性质,发展证据推理和模型认知、微观辨识和宏观探析、科学探究和创新意识的化学核心素养。
追问3:与金属单质化合体现了硫单质的氧化性,与活泼金属钠研磨就可实现; 如果不小心将水银温度计打碎了,可以用硫粉覆盖处理,请同学们写出相关方程式。
设计目的:化学与生活密切联系,生活中处处有化学,发现化学的美,使更多的学生喜欢上化学。
学生:归纳总结硫单质的化学性质。
追问4:通过对硫单质化学性质的探究,请总结研究物质化学性质可以从什么角度着手?
设计目的:巩固研究物质性质价-类二维视角的方法,帮助学生厘清思路和方法,总结提升,使学生的思路清晰化,最终达到能力的进阶,发展学生的模型认知、科学态度和社会责任的化学核心素养。
追问5:同学们完成实验后,教师在清洗试管时,遇到了一个问题,请同学们思考如何将试管壁上的硫清洗掉?
学生:用水清洗,发现硫不溶于水。
过渡:水是大家非常熟悉的溶剂,它可以包容万物,但是我们实验后,发现硫单质是不溶于水的,现在我给大家提供了乙醇和二硫化碳这两种有机溶剂,请同学们根据实验步骤完成实验。
设计目的:知识问题化、问题情景化、情景生活化,基于真实问题的解决,激发学生的思考,解决现实问题。
3.3 任务三:认识硫单质的物理性质
实验步骤:观察试管中硫磺的颜色、状态;然后分别向1号、2号、3号试管中加入2 mL水、乙醇、二硫化碳,振荡试管,观察硫固体是否溶解。
学生:完成实验,观察实验现象,记录实验现象。
实验结论:硫不溶于酒精,易溶于二硫化碳。
追问6:硫真的不溶于酒精吗?下面请同学们再完成这个实验,从2号试管中取出上清液于试管4中,向其中滴加3~4滴蒸馏水,观察现象。
学生:开展实验,分析实验现象,得出结论:硫单质难溶于水,微溶于酒精,易溶于二硫化碳,清洗试管上的硫可以用二硫化碳。
设计目的:学生通过用酒精洗涤硫磺,无法从定性和定量的角度判断出硫磺是否溶解,设计滴加到2号试管的上清液中,激发学生的认知冲突,加深学生对硫溶解性的再认识。
教师总结:由于二硫化碳有毒,在实验室中常用氢氧化钠溶液清洗试管壁上的硫磺,其原理是什么呢?
学生:从物质的类别角度,结合氯气的化学性质,展示硫单质与氢氧化钠的反应:

设计目的:从类维和价维的角度,解释硫与氢氧化钠反应的原理,凸显价-类二维研究方法的价值。
学生活动11:结合实验探究和课本内容,归纳总结硫单质的物理性质和用途,学生展示硫单质的物理性质(见表2)。

表2 学生总结硫单质的物理性质
设计目的:帮助学生整理硫单质的物理性质,从物理性质和化学性质2个方面认识硫单质,通过认识硫磺的用途,感受化学与生活的密切联系,体会化学在生产生活中的学科价值。
总之,通过3个实验任务,帮助学生构建、应用研究物质性质的思维模型。基于价态、类别两个视角预测物质的性质,实验验证预测,得出结论,形成研究元素化合物的基本方法。从重视讲授知识的完整性,上升为知识学习中重视学生化学观念的建立和学科素养的培养,强化从价、类两个视角学习物质性质的化学观念培养。
4 教学反思
4.1 应用价、类视角,建构物质转化的思路方法
学生能够形成基于物质类别、元素化合价认识物质性质的角度和思路,即价类二维系统的元素观,建立含硫元素的物质家族,建立含硫元素的物质之间转化关系,应用转化关系分析实际问题,形成知识结构和认识模型,从注重具体物质的性质和方程式的归纳总结到注重核心素养和能力的发展进阶。
4.2 改进教材实验,实现学生分组实验
化学是一门自然科学,实践是检验真理的唯一标准,学生通过设计实验,完成实验,观察实验现象,得出结论,符合学生的认知规律,加深学生对物质性质的理解。笔者就课本上的实验进行改进,将课本中敞开的实验环境改成相对密封的实验条件,笔者就实验的改进如下:①硫单质还原性实验,装置使用液封除毒气集气瓶,将硫的燃烧置于相对密封的环境中,该集气瓶还可以防止二氧化硫有毒气体外溢,保护师生安全;②硫单质氧化性的实验,将硫粉和铁粉放置于10 mm×100 mm的小试管内(防止在大试管内进行实验,由于放热多,试管受热不均匀,试管炸裂),并且用玻璃棒将混合物压实,尽可能减少硫单质与氧气反应生成有毒的二氧化硫。
4.3 设计问题精准化、情景生活化
王祖浩教授认为:知识只是素养的媒介和手段,知识转化为素养的重要途径是情境,教师需要帮助学生构建从真实问题情境中学习的认识路径。笔者在本节课的设计中,秉承“知识问题化,问题情境化,情境生活化”设计理念[3],如:垃圾桶附近为何会有恶臭味、水银温度计打碎之后的处理、试管内壁上的硫如何清理,让学生感受到化学与生活的密切联系,体会化学在生产生活中的学科价值。
