水苏糖抗衰老活性及机制研究△
2024-01-03陈旭梁佳政a李志恒丁克林高雅婷柳志诚刘永刚张园园
陈旭,梁佳政a,李志恒,丁克林,高雅婷,柳志诚,刘永刚*,张园园*
1.北京中医药大学 中药学院,北京 102488;2.安徽万花草生物科技有限公司,安徽 亳州 236000
衰老是一种常见的、自发性的生理过程,机体代谢率减慢及器官功能下降导致机体的老化[1-2]。现代医学研究证明,随着年龄的增长,体内会产生过多的活性氧(ROS)自由基,当ROS 含量高于正常值时,会诱导机体发生氧化应激,从而对机体造成损害,最终导致寿命的缩短[3]。目前研究表明,植物多糖大多数都具有抗衰老的功效[4]。利用植物多糖研发抗氧化功能性食品和保健食品具有重要意义。
秀丽隐杆线虫(以下简称线虫)是一种以多种细菌为食的无害的真核生物,具有寿命短、易操作、易观察、与人类基因高度同源的优点[5-7]。线虫老龄化标志显著,如体长明显缩短、脂褐素浓度升高、运动能力(吞咽速率、头部摆动频率)减弱和神经系统退化等[8],这些性质给实验提供了大量的可观测指标。因此,线虫能够作为一种模式生物,对药物筛选及药物抗衰老机制研究起到很大的作用。
本研究通过线虫模型探究水苏糖的抗衰老机制,以期为其在衰老及其他疾病治疗方面的应用提供参考。
1 材料
1.1 试药
水苏糖(合肥千盛生物科技有限公司,批号:221205,纯度≥98%);3%过氧化氢试剂(南京建成生物工程研究所);1-苯氧基-2-丙醇(上海麦克林生化科技有限公司);M9 缓冲液、NGM 培养基、LB培养基、线虫裂解液按照常规方法配制[16]。
1.2 菌株及线虫
菌株和线虫均由中国科学院遗传与发育生物学研究所惠赠;缺陷型大肠埃希菌Escherichia coliOP50;野生型线虫株N2;线虫株TJ356,基因型:zls356 [daf-16p::daf-16a/b::GFP+rol-6 (su1006)],绿色荧光蛋白(GFP)融合衰变加速因子-16(DAF-16)蛋白;线虫株CF1553,基因型:muls84 [(pAD76)sod-3p::GFP+rol-6 (su1006)],GFP 融合超氧化物歧化酶-3(SOD-3)蛋白;线虫株VC475,基因型:hsp-16.2 (gk249) V,hsp-16.2缺陷型。
1.3 仪器
Revco PLUS 型-80 ℃低温冰箱(美国Thermo公司);SW-CJ-2FD标准型双人单面净化工作台(苏州博莱尔净化设备有限公司);SPX-250 型生化培养箱(北京科伟永兴仪器有限公司);SMZ745 型体式显微镜、D-LH/LC 型荧光倒置显微镜(日本Nikon公司)。
2 方法
2.1 线虫培养及同期化
线虫在已接种E.coliOP50 300 μL 的培养板中,于22 ℃恒温生化培养箱中进行培养。为防止线虫生长时间过长,导致数量过多或者进入饥饿状态甚至dauer 时期,2~4 d 需要进行转板。同时为了避免细菌、螨虫等污染,要定期对线虫环境进行消毒。
为了确保实验期间所有线虫都在相同的生长时期,采用次氯酸钠漂白法对线虫进行同期化处理。用移液枪吸取M9 缓冲溶液1 mL 将成虫转移至无菌离心管中,待线虫静置沉降后,吸取上清液后再加入裂解液1 mL 对线虫进行裂解,振荡8~10 min 后,用低速离心机离心1.5 min(3000 r·min-1,离心半径为1 cm),吸取上清液。然后用M9缓冲液冲洗2~3 遍,离心弃去上清液后,用移液枪将离心管底部线虫吸出,滴在NGM无菌区内,放入培养箱中培养48 h左右,使线虫生长至L4期,用作后续给药处理。
2.2 水苏糖抗衰老活性研究
2.2.1 体长测定 实验分为4 组,分别为对照组和水苏糖低、中、高剂量组(100、150、200 μmol·L-1)。将同期化后生长至L4期的N2线虫分别转移至对照组和水苏糖组培养基中,在培养箱中生长1 d后,将线虫用M9 缓冲液冲洗转移至载玻片上,每组线虫用麻醉剂(0.5% 1-苯氧基-2-丙醇溶液)20 μL 处理,待线虫麻醉后,在倒置显微镜下观察载玻片,用倒置显微镜自带的软件对线虫的体长进行测量。每组不少于30条。
Seminar教学的核心环节就是汇报工作,宣讲自己对于课题的研究成果、某种学术观点的认识见解,然后师生在此基础上展开讨论,这都需要研究生具有较强的综合表达能力。Seminar教学过程需要学生逻辑清晰地阐明学术观点,简明扼要、重点突出地回答师生提问,并能够围绕一个主题进行有理有据的辩论,科学理性地说服他人。通过上述过程,研究生可以在逻辑思维、口头交流、PPT展示、着装仪表等综合能力方面得到明显提高,有助于其完成研究生阶段的中期开题和毕业答辩。
2.2.2 头部摆动能力测定 线虫分组及处理同2.2.1 项下,N2 线虫在培养箱中生长48 h 后,将线虫放入空NGM板上。线虫头尾来回摆动至初始位置则为1 次。用体视显微镜观察并记录20 s 内每只线虫的头部摆动次数。每组线虫不少于30条。
2.2.3 脂褐素含量测定 线虫分组及处理同2.2.1项下,N2 线虫在培养箱中生长5 d 后,将线虫转移至载玻片上,每组线虫用麻醉剂(0.5% 1-苯氧基-2-丙醇溶液)20 μL 处理,待线虫麻醉后,用荧光显微镜进行观察,采用380 nm 激发波长、420 nm 发射波长,拍下不同组别的荧光照片。每组不少于60 条线虫。
2.2.4 吞咽次数测定 线虫分组及处理同2.2.1 项下,N2 线虫在培养箱中生长5 d 后,使用显微镜观察每条线虫咽部的活动,记录其末端球状物在20 s内的吞咽次数。每组至少统计30条线虫。
2.2.5 氧化应激实验 线虫分组及处理同2.2.1 项下,N2 线虫在培养箱中生长3 d 后,将其转移到含有0.4% H2O2的培养皿中,并使用体式显微镜观察,记录每小时线虫的死亡情况,直到线虫完全死亡。每组实验最少统计30条线虫。
2.2.6 热应激实验 线虫分组及处理同2.2.1 项下,N2 线虫在培养箱中生长3 d 后,转移至空NGM板上,置于37 ℃条件下,用显微镜观察并记录每小时线虫死亡数量,直至线虫全部死亡。每组不少于30条线虫。
2.3 水苏糖抗衰老作用机制研究
2.3.1 TJ356 线虫DAF-16 蛋白核转位实验 线虫分组及处理同2.2.1 项下,TJ356 线虫给药3 d 后,线虫发育到成虫阶段,每组线虫用麻醉剂(0.5%1-苯氧基-2-丙醇溶液)处理,待线虫麻醉后,通过倒置荧光显微镜统计各组线虫总数及处于细胞质、中间、细胞核状态线虫的占比。其中当线虫体内无如图1 所示的绿色荧光斑点状的细胞核时可以判定其为细胞质状态;当线虫体内只有细胞核而无如图1 所示的细胞质时可以判定为其为细胞核状态;当线虫体内既有细胞核又有细胞质时可以判定其为中间状态。每组不少于60条。
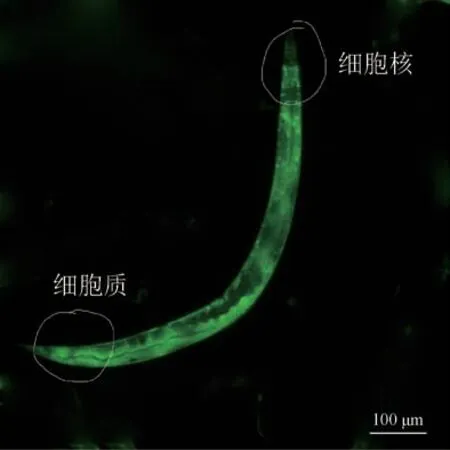
图1 线虫细胞质和细胞核圈定示意图
2.3.2 CF1553 线虫SOD-3 蛋白表达实验 CF1553线虫是一种GFP 标记SOD-3 蛋白的线虫,用荧光显微镜下观察其绿色荧光强度,可以直观反映出SOD-3 蛋白的表达情况[16]。线虫分组及处理同2.2.1项下,卵期的CF1553 线虫给药处理3 d 后,将成年线虫转移至载玻片上,每组线虫用麻醉剂(0.5%1-苯氧基-2-丙醇溶液)20 μL 处理,待线虫麻醉后置于荧光显微镜下进行观察,拍摄图片测定荧光强度。每组至少统计30条线虫。
2.4 统计学处理
应用SPSS 25 软件和单因素方差分析对结果进行定量分析,以P<0.05为差异有统计学意义。应用GraphPad Prism 6.02软件分析生存曲线的可靠度。
3 结果与分析
3.1 水苏糖抗衰老活性研究
3.1.1 体长测定 线虫体长代表性图见图2。给药1 d 后,对照组线虫体长为(461.74±38.35)μm。与对照组比较,水苏糖100、150、200 μmol·L-1组均可使线虫的体长增加,分别为(476.73±28.82)、(473.97±22.51)、(480.09±25.38)μm,其中高浓度组差异有统计学意义(P<0.05)。实验结果表明,水苏糖对线虫的体长有一定的促进作用。
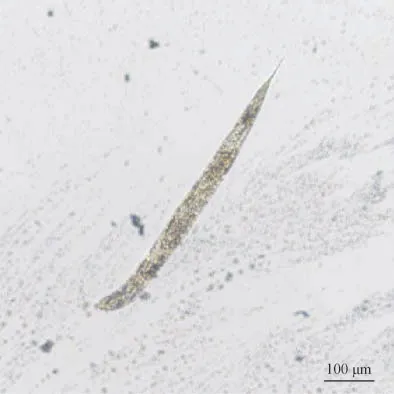
图2 测量线虫体长代表性图(×40)
3.1.2 头部摆动能力测定 对照组线虫20 s头部摆动次数为26.1±5.6。与对照组比较,水苏糖100、150、200 μmol·L-1处理可增加线虫头部摆动次数,分别为31.3±3.4、31.9±3.3、30.3±2.2,差异均有统计学意义(P<0.001)。
3.1.3 线虫脂褐素含量的测定 线虫随着衰老会出现体内蓝色荧光增加的现象。与对照组比较,水苏糖处理后线虫体内荧光强度降低且差异有统计学意义(P<0.01,图3、图4)。
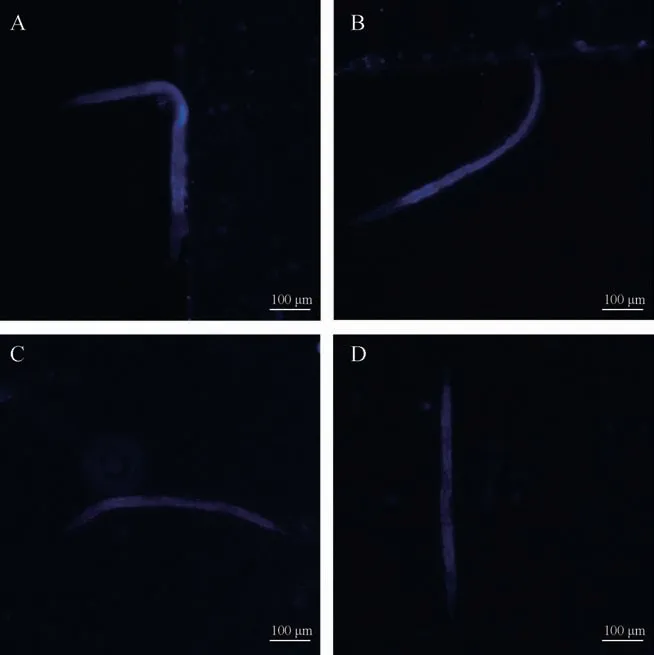
图3 水苏糖各浓度组线虫体内脂褐素荧光图(×40)
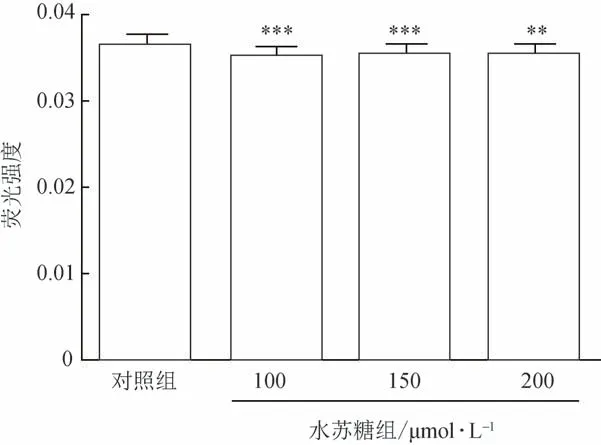
图4 水苏糖对线虫脂褐素的影响(,n=60)
3.1.4 吞咽次数测定 结果表明,对照组线虫20 s内吞咽次数为46.6±6.4。与对照组比较,水苏糖100 μmol·L-1组线虫20 s 内抽咽次数有所增加,为46.8±5.8,水苏糖150、200 μmol·L-1组线虫20 s内吞咽次数有所减少,分别为44.9±5.1、44.1±5.6,但差异均无统计学意义。
3.1.5 氧化应激实验 线虫生存曲线如图5 所示,与对照组比较,在氧化应激条件下,水苏糖各浓度组线虫生存率升高,但差异无统计学意义。
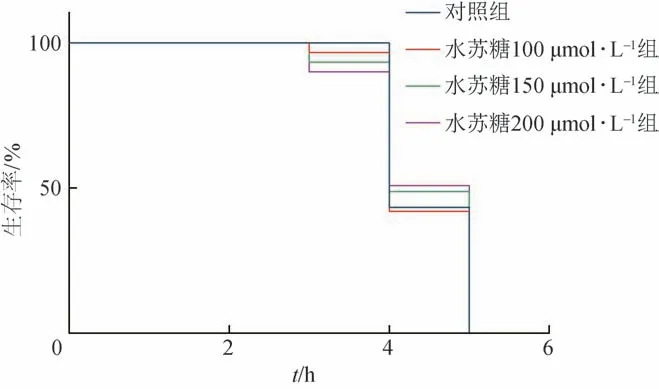
图5 氧化应激下水苏糖对线虫寿命的影响
3.1.6 热应激实验 如图6 所示,与对照组比较,水苏糖100、150、200 μmol·L-1组处理后线虫生存曲线均明显右移,100、150 μmol·L-1组线虫存活时间延长40%,200 μmol·L-1浓度组存活时间延长50%,差异均有统计学意义(P<0.001)。

图6 热应激条件下水苏糖对线虫寿命的影响
3.2 水苏糖抗衰老作用机制研究
3.2.1 TJ356 线虫DAF-16 蛋白核转位实验 在对照组中观察到的荧光点较少,DAF-16::GFP 的荧光细胞质定位占比为(61.20±0.04)%,中间定位的占比为(38.25±0.01)%,细胞核定位的占比为(0.55±0.01)%。用不同浓度水苏糖处理后观察到的荧光点明显增多,其中在100 μmol·L-1组中,DAF-16::GFP 的荧光细胞质定位占比为(14.49±0.05)%,中间定位占比为(71.74±0.11)%,细胞核定位占比为(13.77±0.02)%;150 μmol·L-1组中DAF-16::GFP 荧光细胞质定位占比为(2.03±0)%,中间定位占比为(82.43±0.12)%,细胞核定位占比为(15.54±0.03)%;200 μmol·L-1组中DAF-16::GFP 荧光细胞质定位占比为(3.15±0)%,中间定位占比为(66.93±0.07)%,细胞核定位占比为(29.92±0.10)%。水苏糖可明显促进线虫DAF-16从细胞质向细胞核迁移。
3.2.2 CF1553 线虫SOD-3 蛋白表达 各组CF1553线虫体内GFP 荧光图见图7。对照组相对荧光强度为1.00±0.29,与对照组比较,给药3 d后,水苏糖能够显著提高线虫的相对荧光强度,分别为1.27±0.41、1.28±0.45和1.26±0.39,且差异有统计学意义(P<0.01)。说明水苏糖可以有效地激活DAF-16 的核转录,使SOD-3蛋白的活性显著提升。
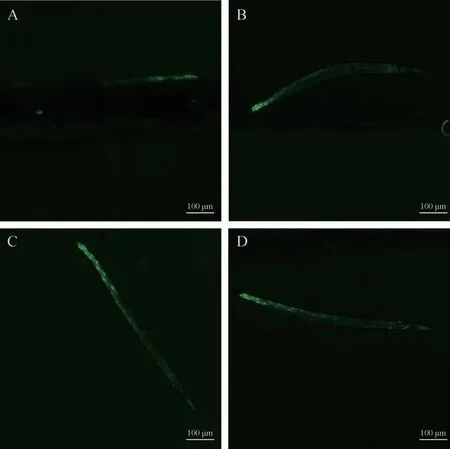
图7 水苏糖各浓度组CF1553线虫体内GFP荧光图(×40)
4 讨论
本研究探究了水苏糖抗衰老的活性作用和分子机制。随着年龄的增长、线虫衰老程度的加深,其肌肉功能不断减退,对外界刺激越来越不敏感,因此通过测定线虫头部摆动频率和应激能力可以在一定程度上了解线虫的衰老进程。脂褐素常作为衰老的检验指标之一[17]。本研究对以上指标进行测定,实验结果表明,水苏糖能够显著增加线虫头部摆动频率,提高线虫热应激能力并且降低线虫体内脂褐素的含量。以上结果证明了水苏糖能够改善线虫身体状况,延缓线虫的衰老进程,进而对其机制进行了探究。
线虫的吞咽速率与线虫的健康状况有关,也与线虫的衰老程度有关,本研究结果发现给药4 d后与对照组相比,水苏糖组线虫吞咽速率无明显变化。说明水苏糖不影响线虫对食物的摄取能力,因此水苏糖的抗衰老机制并不依赖于热量限制[18-19]。
胰岛素/胰岛素样生长因子1 信号通路(IIS)信号通路参与调节线虫机体的抗应激能力、衰老等一系列生理过程。当IIS 的上游活性因子受到抑制时,DAF-16转录因子就会被激活,从而引起核转位,这将有助于提高机体的抗逆性,从而延长线虫的寿命[20],同时也可以诱导下游的抗逆因子,如SOD-3,从而达到更好的效果。因此对DAF-16 核转位和SOD-3 结合GFP 荧光强度进行了测定,以探究水苏糖的抗衰老能力与其中的IIS信号传导途径之间的关系。实验结果表明,水苏糖能够激活DAF-16转录因子,从而促进TJ356 株线虫的核转位,并且可以显著提高CF1553 线虫荧光强度,增加SOD-3 蛋白表达量。
综上所述,水苏糖显示出较强的抗衰老活性,可能是通过IIS 通道刺激DAF-16 转录因子,引起细胞核转位,提高SOD-3 蛋白质表达水平,进而提升细胞对外界环境因素的抵御,从而实现延长线虫寿命的作用。本研究对水苏糖抗衰老的作用机制进行了初步的探索,为下一步研究DAF-16上游作用靶点提供了一定的理论基础,同时也为含有水苏糖的中药,如黄精、地黄等抗衰老作用机制研究提供参考。
