南疆棉杆黄腐酸制备及对土壤性质的影响
2024-01-03陆淑芬胡绍启严成旭时春辉
陆淑芬 胡绍启 严成旭 时春辉*
1 新疆生产建设兵团第一师环境监测站 阿拉尔 843300
2 塔里木大学化学化工学院 阿拉尔 843300
本试验对新疆棉杆中生化黄腐酸的提取进行了探究。经阅读国内外相关文献报道,发酵法与硝解法均可以作为制备生化黄腐酸的方法,由于发酵法较硝解法具有更环保、更绿色的优势,通过比较,本文选用微生物发酵法制备生化黄腐酸,硝解法作为对照试验。试验中探寻了发酵法对新疆棉杆中生化黄腐酸的提取,总结得出了发酵法对应的最佳提取条件,并对提取的生化黄腐酸进行了实际应用,总结得出了生化黄腐酸对土壤多方面性质的影响,以期为棉杆中生化黄腐酸的制备及其在土壤改良方面的应用提供合理的科学依据。
1 材料与方法
1.1 试验材料
棉杆取自于距离塔里木大学北门外2 公里处隶属十团的商用棉花地;新疆维吾尔自治区阿拉尔市周边的农田土壤(以下简称新疆土壤)、湖北省恩施苗族土家族自治州利川市团堡镇周边的农田土壤(以下简称湖北土壤)、甘肃省陇南市武都区隆兴镇周边的农田土壤(以下简称甘肃土壤)、四川省米易县白马镇黄草回族村十四社周边的农田土壤(以下简称四川土壤)。
电热恒温培养箱DHP-9162(上海善志仪器设备有限公司)、紫外-可见分光光度仪UV1700PC(上海奥析科学仪器有限公司)、FTIR-红外光谱仪LP-FTIR-300(智南精工仪器工厂)、台式离心机TDL80-2B9(上海安亭科学仪器厂)、数显恒温水浴锅HH-1(上海梅香仪器有限公司)、pH 计E-201F(雷磁凯利玻仪器有限公司)。邻菲罗啉,分析纯(AR)(上海山浦化工有限公司);硝酸,分析纯(AR)(天津致远化学试剂有限公司);生化黄腐酸标样,分析纯(AR)(上海阿拉丁控股集团)。
主要菌种:芽孢杆菌(BacillusC.)、木霉菌(Trichoderma sppP.)、酿酒酵母(Saccharomyces cerevisiaeH.),均由河南沃宝生物科技有限公司生产。
1.2 试验设计
1.2.1 生化黄腐酸的形成
本研究先采用发酵法将棉杆发酵成富含生化腐植酸的发酵物,在棉花进行机械采摘过程后,截取根部以上棉杆,除去残留叶片与花苞。修剪棉杆至5 ~8 cm 小段,使用鼓风干燥箱在60 ℃恒温烘干。烘干后剪碎并用粉碎机粉碎,过40 目筛[1],得到棉杆粉末。取粉碎好的棉杆50 g 置于培养皿中,菌种采用芽孢杆菌、木霉菌、酿酒酵母的混合菌种,其用量比例为2 ∶1 ∶2,菌种活化采用混合菌种20 g、玉米粉40 g、超净水200 mL,30 ℃恒温培养3 d,取悬液。每一份样品取5 mL 菌液,用超净水调节棉杆粉含水量至60%~70%,置于恒温培养箱中分别在不同的温度梯度下以及不同的发酵时间梯度下进行恒温发酵。
1.2.2 生化黄腐酸的提取及收率测定
发酵后的提取过程采用碱溶酸析法[2,3],生化黄腐酸粗品利用容量法测定,其中黄腐酸收率的计算公式如下[4]:
式中,V1——样品消耗硫酸亚铁铵标准滴定溶液的体积,mL;V0——空白对照消耗硫酸亚铁铵标准滴定溶液体积,mL;K——不同黄腐酸来源碳系数,本次试验黄腐酸碳系数为0.49[4];c——硫酸亚铁铵标准滴定溶液浓度,mol/L;m——试样质量,g;x——生化黄腐酸收率,%。
1.2.3 生化黄腐酸的紫外定性分析
本研究采用紫外-可见分光光度仪测量样品黄腐酸的吸光度。将此次研究所得到的不同条件下的黄腐酸溶于0.05 mol/L 的碳酸氢钠溶液中,配成浓度为100 mg/L 的溶液,用紫外-可见分光光度仪,在波长为190 ~350 nm 下测定出黄腐酸的相应吸光度,以探究制备的棉杆黄腐酸和标准品性质是否相同。
1.2.4 生化黄腐酸E4/E6测定及红外测定
将此次研究所得到的不同条件下的黄腐酸溶于0.05 mol/L 的碳酸氢钠溶液中,配成浓度为100 mg/L 的溶液在紫外- 可见分光光度仪上对比465 nm(E4)和665 nm(E6)吸光度,以探究生化黄腐酸的缩合程度和芳构化程度。另外,通过红外吸收光谱的测定分析,以探究所得产品出现的芳香化结构及共轭结构。
1.2.5 对初始土壤性质的测定
将取回的土壤去除其中的枯枝、根系、残留物等杂质,研磨后过2 mm 筛装入密封袋中备用。采用烘干法测定每种土壤的含水量,先称取10 g土壤,将土壤装入试管中放入140 ℃的烘箱内烘干4 h,称量剩余土壤的重量,湿重与干重的差值即为土壤含水量;取25 mL 1 mol/L KCl 溶液,加入质量比为1 ∶5 的土壤,摇匀,静置30 min 后,用pH 计测定浸出液pH 值,即为土壤pH 值。
1.2.6 利用生化黄腐酸培养土壤的方法
将4 种土壤每组分别称取100 g 于烧杯中,每类土壤共称取7 组。每组土壤中依次加入0、0.5、1.0、1.5、2.0、2.5、3.0 g 生化黄腐酸,将生化黄腐酸与土壤充分搅拌,混合均匀,然后将烧杯放置在室温、通风的条件下模拟自然环境进行培养,培养40 d。培养完成后,再测定土壤各项指标变化。
1.2.7 探究生化黄腐酸对土壤饱和导水率的影响
土壤饱和导水率系在单位水压梯度下,通过垂直于水流方向的单位土壤截面积的水流速度,又称土壤渗透系数。本法可在田间进行测定,但易受下层土体性质的影响。在饱和水分的土壤中,土壤的饱和导水率(渗透系数)是根据达西(H. Darcy)定律,在预定时间将渗透筒取出,挂在适当位置,漏斗下接一烧杯。在渗透筒在上部加8 cm 深的土层,在土层上方加入蒸馏水使之一直保持水层深度为10 cm,待漏斗下面滴下第1 滴水时开始用秒表计时,记录30 min 每种土样的渗水量并分别用量筒计量渗透过水量Q1、Q2、Q3……Qn。试验所用的土壤在培养土样40 d[5]之后,测定土壤饱和导水率变化情况。其中,生化黄腐酸对土壤饱和导水率的影响采用渗透筒法进行探究,按下式进行计算[6,7]。
式中,Q——流量,渗透过一定截面积S(cm2)的水量,mL;L——饱和土层厚度,渗透经过的距离,cm;S——渗透筒的横截面积,cm2;t——渗透过水量Q时所需的时间,s;h——水层厚度,水头(水位差),cm;K——饱和导水率(渗透系数),cm/s。
1.2.8 探究生化黄腐酸对土壤饱和含水量的影响
土壤饱和含水量是指在自然条件下,土壤孔隙全部充满水分时的含水量,包括毛管孔隙和非毛管孔隙含水量。它代表土壤最大容水能力,也就是土壤颗粒间所有孔隙都充满水时的含水量[8]。首先称量含水土样的质量,然后称量去除水分后的土样质量,将土样分批次放入120 ℃的烘箱中烘干6 h 除去土样中的结合水,取10 g 干土于透明玻璃管中,装柱后向土柱中滴加蒸馏水,待土柱下方第1 滴液体流出时停止滴加,静止10 min 土柱,称量湿土重量。湿土质量减去干土质量,即为土样饱和含水量。
2 结果与分析
2.1 处理时间对生化黄腐酸收率的影响
发酵试验中通过改变发酵时间进行单因素试验。随着发酵时间的延长,生化黄腐酸收率增加,含量在10 ~15 d 出现最高区间。从图1 可观察出15 d 发酵出的生化黄腐酸最多;5 d 生化黄腐酸提取量过少是由于发酵时间过短导致发酵不完全;而20 d 生化黄腐酸含量低可能是由于缺氧导致其他微生物生长,在20 d 培养皿中可以明显观察到绿色和白色的菌丝。通过改变提取时间,进行单因素试验。由图2 可知,1.5 h 的提取结果明显量少,2.5 h、3 h的收率并没有很大的差距。综合因素考虑,提取时间为2 h 在试验中成果最佳。
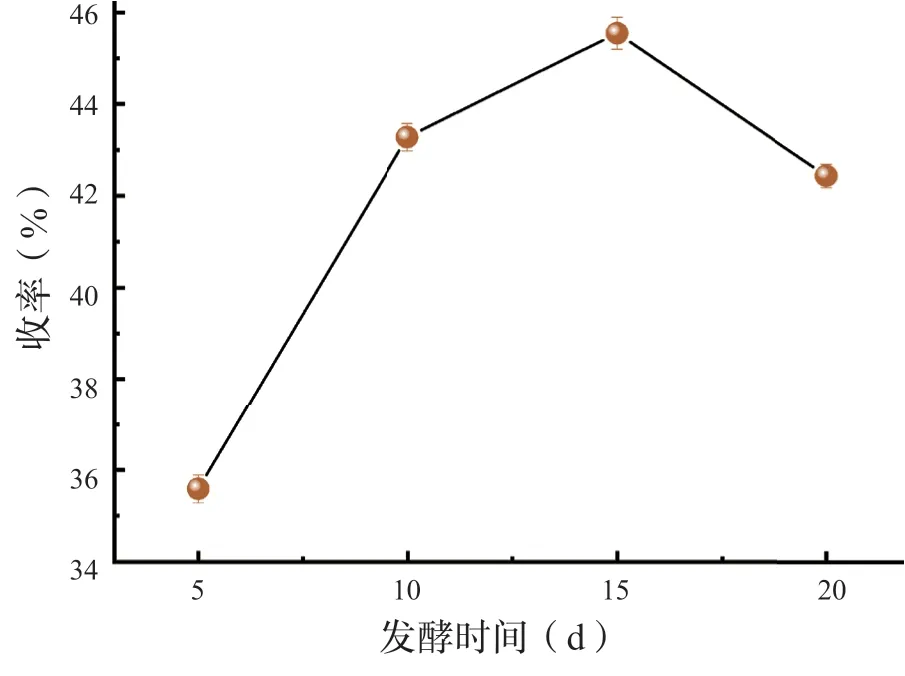
图1 发酵时间对生化黄腐酸收率的影响Fig.1 Eff ects of fermentation time on the yield of biochemical fulvic acid
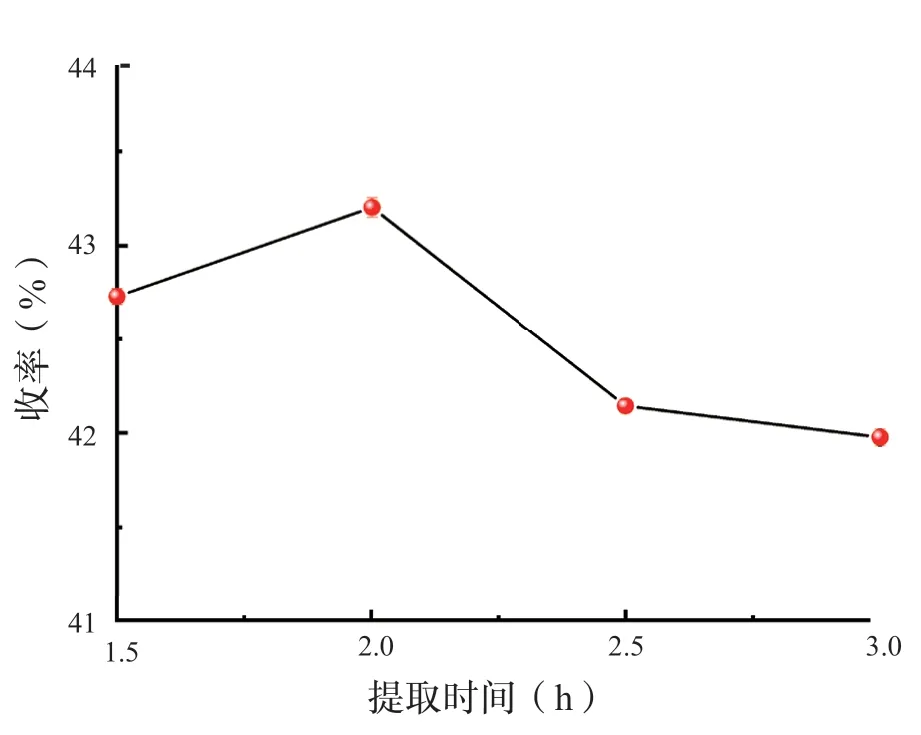
图2 提取时间对生化黄腐酸收率的影响Fig.2 Eff ects of extraction time on the yield of biochemical fulvic acid
2.2 处理温度对生化黄腐酸收率的影响
发酵试验中在不同恒温培养箱设置不同温度进行有氧发酵,由图3 可知,发酵温度在35 ℃时,生化黄腐酸收率最高。25 ℃、40 ℃生化黄腐酸收率偏低,25 ℃可能是由于发酵温度不在菌种适宜的发酵温度区间,导致杂菌占据主导。通过改变提取温度,进行单因素试验。不同提取温度单因素试验结果如图4 所示,提取温度愈高,生化黄腐酸收率愈大。65 ℃条件下收率突然降低,这种情况可能由于碱热浸提温度过高导致还未发酵的纤维或其他杂质被分解成小于过滤袋缝隙的物质,随着滤液一起被提取。随后酸析过程中转变为盐类,混入酸液中一起被烘干导致。综合因素考虑,提取温度60 ℃在试验成果中最佳。
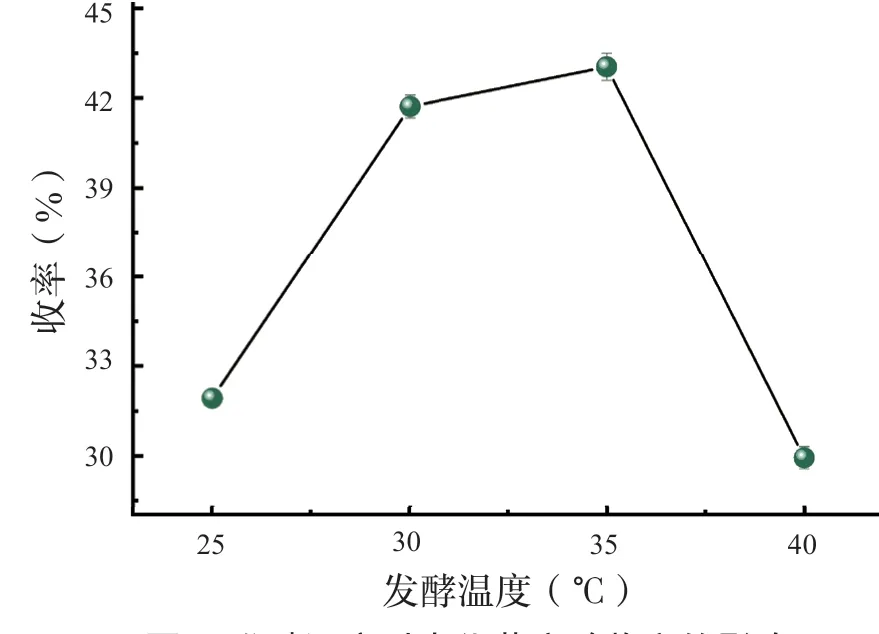
图3 发酵温度对生化黄腐酸收率的影响Fig.3 Eff ects of fermentation temperature on the yield of biochemical fulvic acid
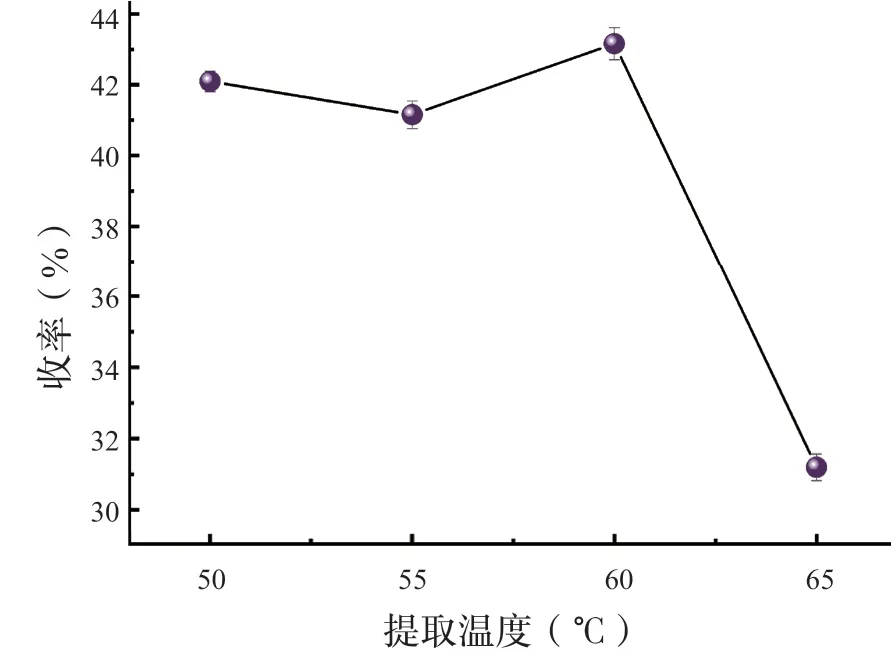
图4 提取温度对生化黄腐酸收率的影响Fig.4 Eff ects of extraction temperature on the yield of biochemical fulvic acid
2.3 正交试验结果分析
考虑到发酵法中不同发酵温度、发酵时间、提取温度及提取时间对结果的影响不同,本研究通过SPSS(23 版)设置4 因素4 水平正交试验表(表1),采用正交试验进行筛选。结果及直观分析见表2,由极差分析可知4 个因素的影响大小为:发酵温度>提取时间>发酵时间>提取温度,通过方差分析,反应各因素之间的显著性差异,方差分析如表3所示,分析结果表明:4种因素中发酵温度显著;提取时间、发酵时间与提取温度不显著。通过正交试验设计得出提取的最佳因素为:发酵温度35 ℃、发酵时间15 d、提取温度50 ℃、提取时间2 h,且最佳因素条件下生化黄腐酸的收率为40.39%。

表1 制备生化黄腐酸因素水平表Tab.1 Factor levels of biochemical fulvic acid preparation
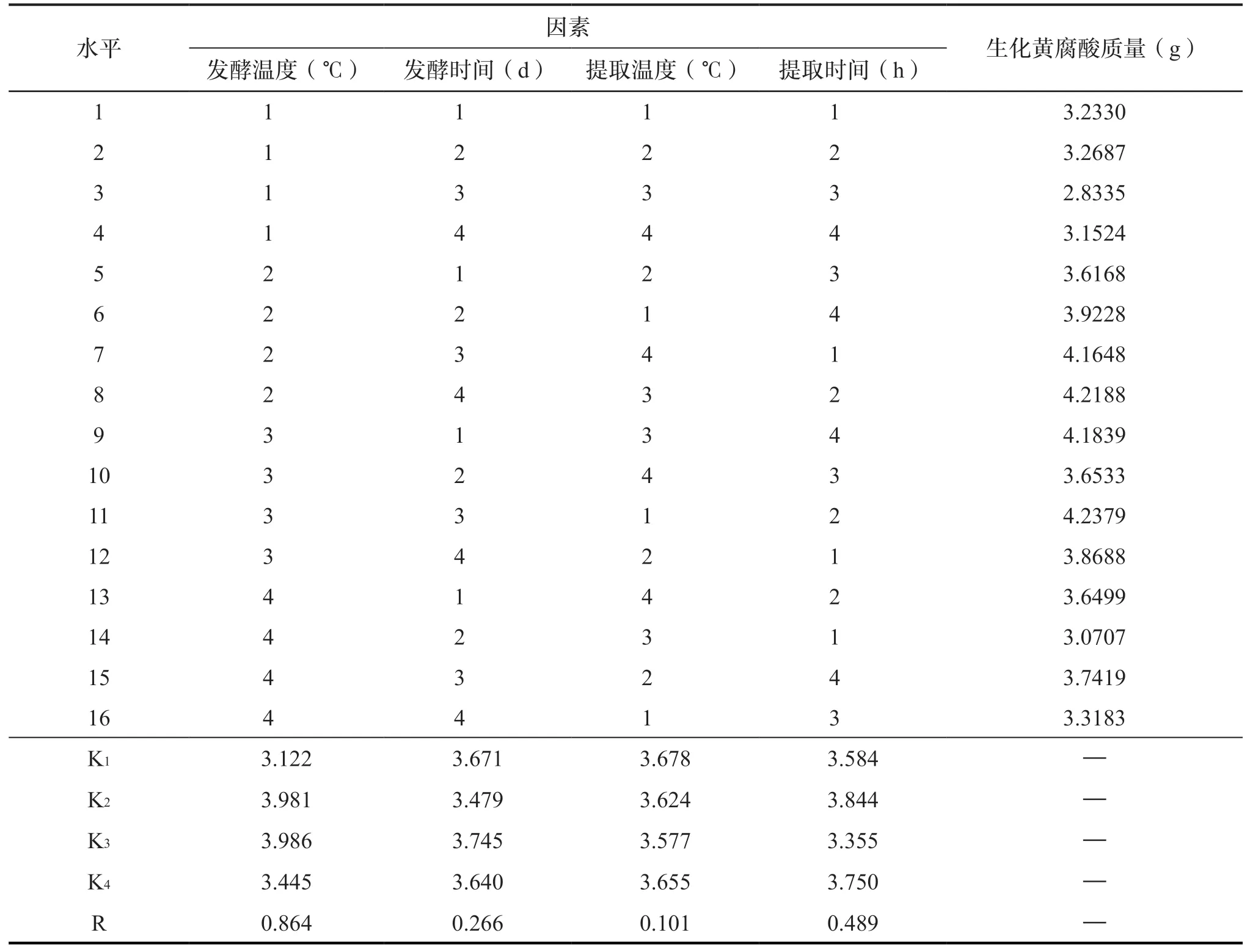
表2 制备生化黄腐酸正交试验结果及分析Tab.2 Orthogonal experimental results and analysis of biochemical fulvic acid preparation

表3 制备生化黄腐酸收率的方差分析(α=0.05)Tab.3 Analysis of variance for the yield of biochemical fulvic acid preparation(α=0.05)
2.4 红外光谱分析
图5 为最优制备条件下生化黄腐酸与标样的红外光谱图,样品对比生化黄腐酸标样可以看出,红外峰形基本一致,这表明样品与黄腐酸标样的结构大致相同;2 种物质在3500 ~2500 cm-1出现明显羟基吸收峰,说明两者具有类似的羟基结构;在1622 cm-1处出现了羰基的伸缩振动峰,而羰基的峰小于1700 cm-1说明样品可能存在共轭作用,表现出生化黄腐酸的特性之一。在1034 cm-1都出现醇的碳氧单键的伸缩振动,在1379 cm-1出现脂肪族中的甲基吸收峰。由图可知,2 种物质虽然在光谱中有细微差异,峰形结构基本一致,表明该试验制得的物质为生化黄腐酸。

图5 生化黄腐酸样品与黄腐酸标样的红外光谱图Fig.5 Infrared spectra of biochemical fulvic acid and standard fulvic acid
2.5 紫外-可见吸收光谱分析
生化黄腐酸是由多种化学性质相近的物质组成的混合物,含有大量不饱和烃的共轭结构、羧类以及一些具有芳香性的化合物。这些官能团在紫外-可见光区域都有吸收值。本研究测量在190 ~350 nm 波长下的紫外-可见光谱数据,测量时设置波长10 nm 为间隔测试生化黄腐酸的紫外吸收峰值。由图6 可知,黄腐酸标样与最优条件下所制得的生化黄腐酸的紫外-可见光谱变化趋势基本一致。2 份样品在波长为210 nm 左右呈现一个最高峰值,随后则是随着波长增加吸收度不断减少,发现研究所制取的样品与标品中结构类似,为同一物质。

图6 生化黄腐酸样品与标样黄腐酸的紫外-可见吸收光谱图Fig.6 UV absorption spectra of biochemical fulvic acid and standard fulvic acid
2.6 E4/E6 比值分析
E4/E6即生化黄腐酸在465 nm 和665 nm 的吸光度值的比值,该比值能表征生化黄腐酸的基本特征、能表示出生化黄腐酸的缩合程度和芳构化程度,测试结果见表4。发酵法制得的生化黄腐酸发酵时间5 d 与20 d 的E4/E6值明显小于10 d 及15 d 的样品。10 d、15 d 样品的E4/E6值无较大差异,标样的E4/E6值略小于发酵法制得的生化黄腐酸样品。说明标样的芳构化程度大于发酵法制得生化黄腐酸样品,分子量同样大于制得的样品。
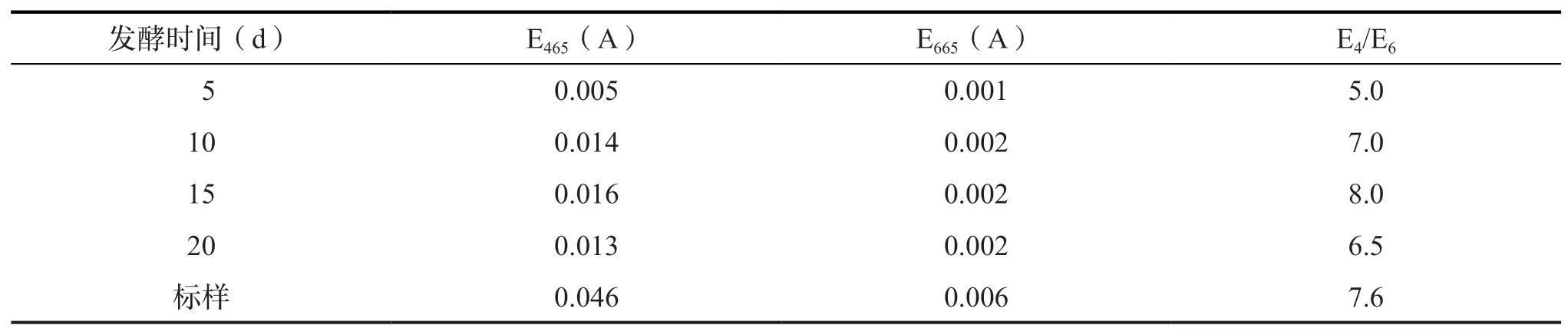
表4 不同时间变量下发酵法制得的生化黄腐酸与标样的E4/E6 值变化Tab.4 Changes in E4/E6 values of biochemical fulvic acid obtained by fermentation method and standard samples under diff erent time variables
2.7 对初始土壤含水量、pH 值测定及土壤种类划分
试验结果(表5)与我国土壤系统分类结合可知,试验采用的新疆土壤为砂质土、湖北土壤为壤土、甘肃土壤为砂质土、四川的土壤为壤土。
2.8 生化黄腐酸对土壤含水量的影响
在各组土样培养40 d 后,将所有土样补水至100 g,每2 d 记录一次土样剩余质量,共记录20 d即10 组数据(图7)。结果表明:随着生化黄腐酸的加入量增大,土样的含水量也会随之上升,这可能是由于生化黄腐酸是一种大分子多官能团结构,能吸附土样中的水,以减缓土样中水的蒸发。
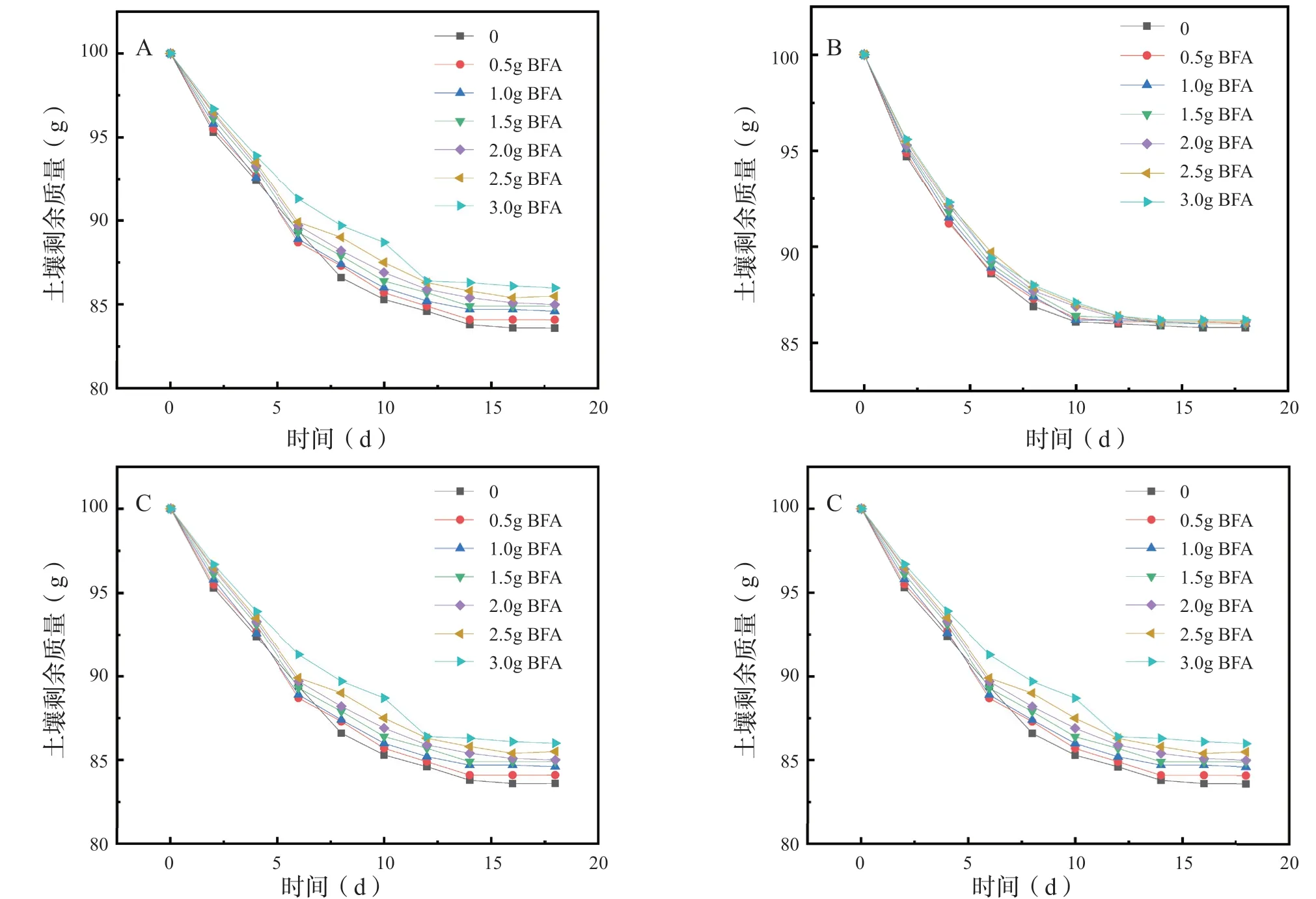
图7 不同土样含水量的变化Fig.7 Changes in water content of diff erent soils
2.9 生化黄腐酸对土壤饱和含水量的影响
随着最优条件下制备的生化黄腐酸的加入,4种土壤的饱和含水量均有所提高,其中对四川土壤的影响最大,对新疆土壤的影响最小(图8)。结果表明:生化黄腐酸可使土壤饱和含水量增大。
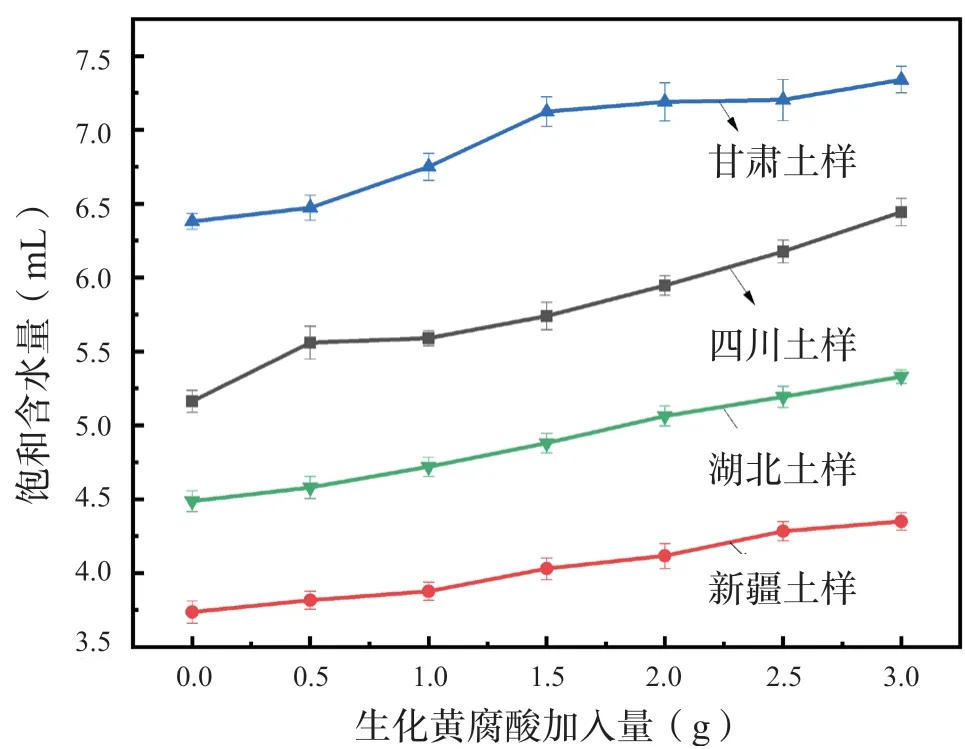
图8 不同生化黄腐酸加入量对土壤饱和含水量的影响Fig.8 Eff ects of diff erent additions of biochemical fulvic acid on soil saturated water content
2.10 生化黄腐酸对饱和导水率的影响
随着最优条件下制备的生化黄腐酸的加入,4种土壤的饱和导水率均呈上升趋势,而且加入量越多,土壤的饱和导水率也提升得越多(图9)。其中,对甘肃土壤饱和导水率的提升效果最为明显,当加入量达到1.5 g 时,甘肃土壤的饱和导水率明显上升;而对新疆土壤饱和导水率的提升效果最小。结果表明:生化黄腐酸能够增加土壤的饱和导水率。

图9 不同生化黄腐酸加入量对土壤饱和导水率的影响Fig.9 Eff ects of diff erent additions of biochemical fulvic acid on soil saturated hydraulic conductivity
2.11 生化黄腐酸对土壤pH 值的影响
每种、每组土壤均采用100 g,分别加入0、0.5、1.0、1.5、2.0、2.5、3.0 g 生化黄腐酸,以探究添加不同比例生化黄腐酸对土壤pH 值的影响。
如图10 所示,新疆土壤具有偏碱性,生化黄腐酸本身是弱酸,二者发生酸碱中和反应,降低了新疆土壤的pH 值,使之趋于中性;相较于新疆土壤的偏碱性,其余3 种土壤具有弱酸性,而提取的生化黄腐酸中含有一定量的生化黄腐酸盐,具有弱碱性,与3 种酸性土壤发生了酸碱中和反应,升高了土壤的pH 值,使之趋于中性。由此说明,生化黄腐酸及其盐组成了酸碱缓冲体系[9]。
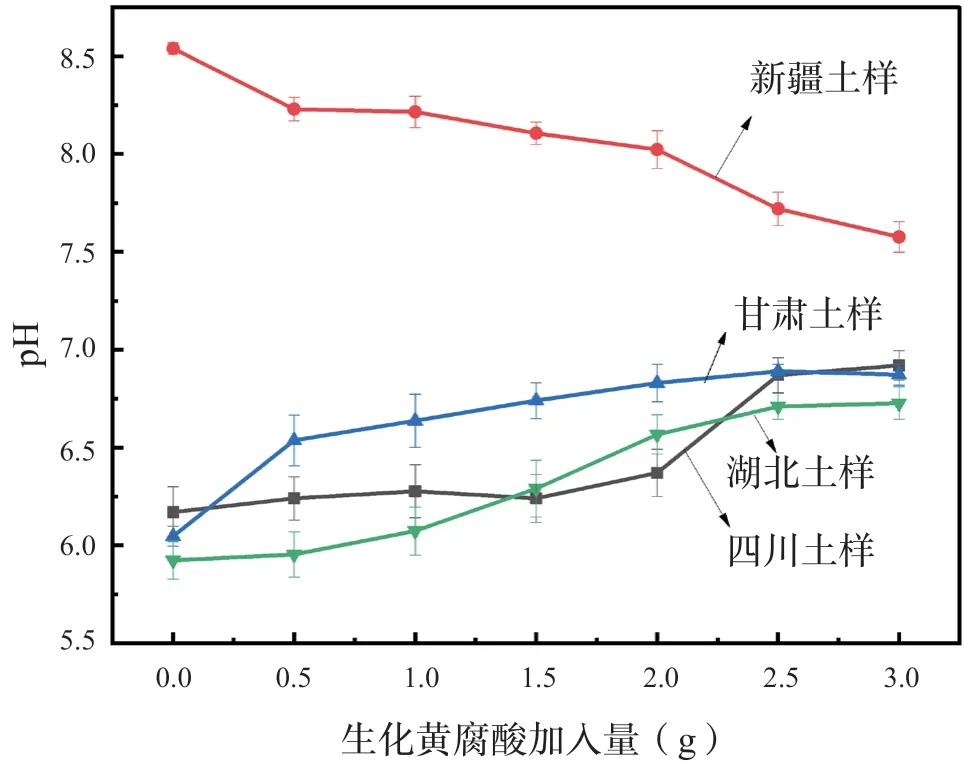
图10 不同生化黄腐酸加入量对土壤pH 值的影响Fig.10 Eff ects of diff erent additions of biochemical fulvic acid on soil pH value
3 结论
(1)在利用发酵法提取生化黄腐酸的试验中,通过单因素变量试验得出,发酵时间单因素变量试验最佳条件为15 d,发酵温度单因素变量试验最佳条件为35 ℃,提取时间单因素试验变量最佳条件为2 h,提取温度单因素变量试验最佳条件为60 ℃。正交试验结果如下,制备生化黄腐酸的最佳条件为发酵温度35 ℃、发酵时间15 d、提取温度50 ℃、提取时间2 h,收率40.39%。通过极差分析得出因素对试验影响大小排序为:发酵温度>提取时间>发酵时间>提取温度。
(2)在利用生化黄腐酸改良土壤性质的试验中得知:随着生化黄腐酸加入量的增加,土壤的含水量会增加,加入量为1.5 g 之前含水量变化较为显著,同时也增大了土壤的最大容水能力;加入量继续增加后,含水量变化不明显。随着生化黄腐酸加入量的增大,土样的饱和导水率也会随之增加,出现这种情况考虑是由于生化黄腐酸的结构有利于形成多孔的土壤团聚体,从而增大了土壤的饱和导水率。生化黄腐酸本身是弱酸,可降低碱性土壤的pH 值;生化黄腐酸盐用于酸性土壤,发生酸碱中和反应,升高了土壤pH 值。由此,生化黄腐酸及其盐组成了酸碱缓冲体系。
