安罗替尼联合免疫抑制剂治疗晚期肺癌有效性与安全性
2024-01-03郭兴来钱和生梅新宽梁万霞陈盈盈
赵 宇, 郭兴来, 钱和生, 梅新宽, 梁万霞, 陈盈盈
阜阳市肿瘤医院 肿瘤内科,安徽 阜阳 236000
肺癌为全球高发的恶性肿瘤[1-10],多数患者就诊时已处于中晚期,经放疗、化疗后效果不理想。近年来,基于驱动基因的分子靶向精准治疗彻底改变了晚期肺癌的治疗模式,不同靶点的靶向药物和免疫治疗在晚期肺癌的临床治疗中取得了突破性进展[11]。安罗替尼是中国自主研发的新型小分子多靶点酪氨酸激酶抑制剂,具有良好的抗肿瘤效应,治疗晚期肺癌可延长患者生存期,且安全性高,已被批准用于晚期肺癌患者的三线及以上治疗[12-13]。在国外研究中,帕博利珠单抗、卡瑞利珠单抗等程序性死亡受体-1单抗已成为晚期肺癌二线及后线的常用治疗药物[14]。目前,临床上对于晚期肺癌患者在使用安罗替尼进行治疗的基础上是否有必要联合程序性死亡受体-1单抗尚无统一定论。有学者认为,抑制血管新生是晚期肺癌的重要治疗策略,抗血管生成药物联合免疫治疗可以发挥协同增效的作用,也是一种能让晚期肺癌患者获益的选择[15],但仍需更多的研究数据支持。本研究旨在探讨安罗替尼联合免疫抑制剂治疗晚期肺癌的有效性与安全性。现报道如下。
1 资料与方法
1.1 一般资料 选取阜阳市肿瘤医院自2020年3月至2022年3月收治的86例晚期肺癌患者为研究对象。纳入标准:经组织病理学诊断为非小细胞肺癌;临床分期为Ⅲ、Ⅳ期;年龄18~80岁,体能状态评分0~2分,预计生存期≥3个月;心、肝、肾功能正常;既往接受一线或二线治疗后疾病仍进展,有可测量的靶病灶。排除标准:伴咯血症状及未能控制的高血压;有肺栓塞或脑血管意外史;影像学显示肿瘤侵犯重要血管或伴深静脉血栓形成;合并其他原发恶性肿瘤及影响生存时间的晚期恶性病;存在安罗替尼治疗禁忌证;有自身免疫性疾病史或正在接受其他免疫抑制剂治疗;伴精神疾病。将患者随机分入安罗替尼组和联合组,每组各43例。安罗替尼组中,男性23例,女性20例;平均年龄(62.23±4.85)岁;临床分期Ⅲ期5例,Ⅳ期38例;体能状态评分0~1分31例,2分12例;既往一线治疗27例,二线治疗16例;程序性死亡受体配体-1阳性表达16例,阴性表达27例。联合组中,男性26例,女性17例;平均年龄(63.81±4.49)岁;临床分期Ⅲ期3例,Ⅳ期40例;体能状态评分0~1分33例,2分10例;既往一线治疗30例,二线治疗13例;程序性死亡受体配体-1阳性表达14例,阴性表达29例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。患者及其家属均签署知情同意书。本研究经医院伦理委员会批准。
1.2 治疗方法 安罗替尼组:每天早餐前顿服安罗替尼胶囊(福可维,正大天晴药业集团股份有限公司,规格12 mg/10 mg/8 mg×7粒)12 mg/d,连服2周后停药1周,3周为1个治疗周期;无法耐受者可将剂量减至8~10 mg/d,仍无法耐受则停止治疗并剔除研究。联合组:采用安罗替尼联合卡瑞利珠单抗进行治疗,安罗替尼胶囊用法与安罗替尼组相同;卡瑞利珠单抗第1天剂量为200 mg,静脉滴注,滴注时间≥30 min,3周为1个治疗周期。两组患者均治疗至疾病进展或无法耐受时停止用药,结束疗程。
1.3 观察指标 比较两组的临床治疗效果、随访结果及不良反应发生率。临床治疗效果:在完成2个周期治疗时参照实体瘤治疗效果评价标准(RECIST 1.1)[16]评价治疗效果,治疗效果分为完全缓解、部分缓解、疾病稳定、疾病进展。随访结果:对两组患者进行随访,随访起点为治疗开始时间,终点事件为疾病进展、死亡或随访结束。不良反应:参照世界卫生组织抗癌药物毒性分级标准[17]评价不良反应。
疾病控制率=(完全缓解+部分缓解+疾病稳定)例数/总例数×100%
客观有效率=(完全缓解+部分缓解)例数/总例数×100%

2 结果
2.1 两组临床治疗效果比较 安罗替尼组部分缓解3例、疾病稳定31例、疾病进展9例,疾病控制率为79.1%(34/43),客观有效率为7.0%(3/43)。联合组部分缓解10例、疾病稳定25例、疾病进展8例,疾病控制率为81.4%(35/43),客观有效率为23.3%(10/43)。两组疾病控制率比较,差异无统计学意义(P>0.05)。联合组客观有效率高于安罗替尼组,差异有统计学意义(P<0.05)。
2.2 两组随访结果比较 截至2023年3月,86例患者的随访时间为12~22个月,平均(18.87±5.19)个月。安罗替尼组治疗2~3个周期,平均(2.44±0.28)个周期;联合组治疗2~3个周期,平均(2.52±0.33)个周期。两组治疗周期比较,差异无统计学意义(P>0.05)。安罗替尼组总生存期为(11.74±2.78)个月,低于联合组的(14.23±2.49)个月,差异有统计学意义(P<0.05)。见图1。
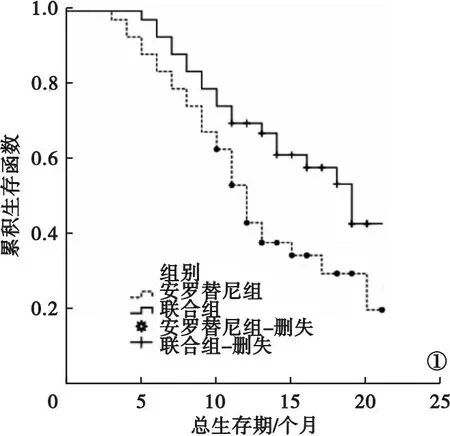
图1 两组总生存期曲线
2.3 两组不良反应发生率比较 安罗替尼组发生乏力4例(9.3%)、高血压5例(11.6%)、咯血6例(14.0%)、腹泻7例(16.3%)、手足综合征6例(14.0%)、反应性毛细血管增生0例(0);联合组发生乏力8例(18.6%)、高血压7例(16.3%)、咯血3例(7.0%)、腹泻8例(18.6%)、手足综合征5例(11.6%)、反应性毛细血管增生4例(9.3%)。两组不良反应发生率比较,差异无统计学意义(P>0.05)。
3 讨论
安罗替尼单药已经是晚期非小细胞肺癌的三线治疗标准,其联合免疫治疗可通过协同增效作用使患者受益。本研究结果显示,安罗替尼联合程序性死亡受体-1单抗可发挥协同抗肿瘤作用,提高晚期肺癌的治疗效果。有研究表明,安罗替尼属于多靶点小分子酪氨酸激酶抑制剂,可通过对肿瘤组织的血管内皮生长因子受体、成纤维生长因子受体、干细胞生长因子等靶点的作用,避免下游一系列信号通路被激活,从而抑制肿瘤新生血管生成,最终抑制肿瘤细胞的增殖、侵袭及转移等生物学行为[18-20]。有研究发现,程序性死亡受体-1抑制剂会受到肿瘤微环境的影响,当血管处于高新生状态时,机体的免疫反应会受到一定影响,同时减弱程序性死亡受体-1抑制剂的作用[21-22]。安罗替尼联合程序性死亡受体-1抑制剂可通过对肿瘤细胞的抗血管生成作用缓解血管高新生状态,促进血管正常化并增强肿瘤组织免疫反应,为程序性死亡受体-1抑制剂的抗肿瘤作用创造有利条件,使得程序性死亡受体-1抑制剂的抗肿瘤作用实现最大化,通过二者之间的协同增效提高对晚期肺癌患者的治疗效果[23-24]。
本研究随访结果显示:安罗替尼联合免疫治疗有利于延长患者生存期。引起肿瘤细胞的免疫应答是免疫治疗的关键,其中,细胞免疫起主导作用。T细胞上有程序性死亡受体-1结合受体,而肿瘤细胞上有相应配体,受体和配体结合后会减弱T细胞对肿瘤的杀灭作用[25-26]。卡瑞利珠单抗属于程序性死亡受体-1单抗,其可与配体结合,使T细胞对肿瘤细胞的杀灭作用得到增强,进而增强机体对肿瘤的免疫应答。程序性死亡受体-1进入体内后,在治疗前已经扎营在瘤内的肿瘤反应性T细胞和已经存在于肿瘤周围淋巴结、外周血中的肿瘤反应性T细胞会对肿瘤展开第一波攻击,使肿瘤释放抗原物质并被树突状细胞吞噬,树突状细胞进一步游走至周围淋巴结,刺激扩增肿瘤反应性初始T细胞形成新的效应T细胞,并随外周血液循环进入肿瘤,再次展开第二波肿瘤攻击,发挥抗肿瘤效应[27-28]。有研究发现,细胞毒性T细胞在肿瘤微环境中的募集功能对免疫治疗效果有明显影响,若细胞毒性T细胞的募集增多,则免疫治疗效果可获得强化[29]。而T细胞要想发挥募集功能,首先需穿过内皮屏障进入肿瘤,而血管内皮细胞表面的粘附分子与T细胞之间的相互作用会对T细胞穿过内皮屏障的作用产生影响[30]。当安罗替尼发挥良好的抗血管生成作用时,可减轻细胞表面的粘附分子对T细胞的粘附作用,有利于促进T细胞进入肿瘤细胞,进而增强T细胞的募集功能,二者联合可发挥协同作用,通过互相之间的促进作用强化抗肿瘤效应和免疫治疗效果,使晚期肺癌患者生存时间延长[31-32]。
在安全性方面,两组不良反应发生率比较,差异无统计学意义(P>0.05)。这提示,两种治疗方案患者均可耐受,联合卡瑞利珠单抗并未造成不良反应明显增加,安全性较高。有研究报道,安罗替尼治疗晚期肺癌的患者获益情况会受到多种因素影响,如病理类型、表皮生长因子受体突变情况等[33-34]。本研究样本量较少,未能对不同患者的获益情况进行亚组分析,有待后续扩大样本量并进一步研究验证。
综上所述,与安罗替尼单药治疗比较,安罗替尼联合免疫治疗的客观有效率更高,生存时间更长,且不良反应未明显增加,具有较高的有效性和安全性。
