TRPV4抑制剂HC067047对小鼠膝骨关节炎软骨组织的影响
2024-01-03刘德龙杨瞻宇陈昕彤王奕威关蕊盛斌
刘德龙, 杨瞻宇, 陈昕彤, 王奕威, 关蕊, 盛斌
湖南师范大学附属第一医院骨科,湖南长沙 410000
膝骨关节炎(knee osteoarthritis,KOA)主要表现为膝关节疼痛和活动受限,其主要病理性改变为软骨细胞、细胞外基质以及软骨下骨的合成和降解偶联失衡[1]。瞬时受体电位香草素受体4型通道蛋白(transient receptor potential vanilloid receptor 4,TRPV4)是一种多模式的钙渗透性阳离子通道,能被多种细胞外刺激所激活,进而调控钙离子内流,从而引发生物学效应[2]。研究发现,TRPV4既可在软骨细胞膜上参与低渗透压引起的炎性反应,又可在软骨细胞中引起钙离子内流导致软骨破坏[3]。因此,抑制TRPV4的表达可能对KOA的软骨组织发挥保护作用。研究发现,细胞焦亡可能参与了KOA疾病的发生发展[4-5]。本研究通过体内实验探讨TRPV4抑制剂HC067047对小鼠膝骨关节炎软骨组织的影响。
1 材料和方法
1.1 材料与试剂
10周龄雄性SPF级C57BL/6小鼠30只,体质量20~25 g,由湖南斯莱克景达动物有限公司提供,合格证号:SCXK(湘)2019-0018。白细胞介素(interleukin,IL)-1β、IL-18 ELISA试剂盒购于武汉Elabscience生物技术有限公司;GSDMD抗体、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein,ASC)抗体、Caspase-1抗体、核苷酸结合寡聚化结构域样受体家族热蛋白结构域蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)抗体、IL-1β和IL-18抗体购于美国Santa Cruz公司;TRPV4抗体、HE染液购于美国Sigma公司;生物素化兔抗羊抗体购于北京康为试剂生物科技有限公司;HC067047购于美国TargetMol公司;ABC试剂盒购于北京Biolead生物科技有限公司;DAB显色试剂盒购于北京Zsbio生物技术有限公司;酶联免疫吸附法检测试剂盒、番红固绿染色液购于广州劳斯生物科技有限公司。
1.2 动物分组及模型建立
将30只小鼠均分为假手术组、模型组、HC067047组。假手术组仅切开右侧膝关节髌韧带内侧皮肤,不予处理膝关节囊内结构。模型组、HC067047组手术切除小鼠板股韧带及内侧半月板前角以构建膝骨关节炎模型,HC067047组每天10 mg/kg HC067047灌胃6周[6],假手术组、模型组等量生理盐水灌胃6周。所有小鼠在18~22 ℃、相对湿度50%~65%环境中饲养,活动、饮食、饮水自由。
1.3 番红固绿染色及软骨下骨骨量检测
膝关节软骨组织固定,切成石蜡切片,脱蜡,浸入番红O染色液染色,然后酸性乙醇分化液分化15 s,用35%、50%、70%、80%乙醇脱色,随后水洗1 min,再入固绿染色液内浸染,然后蒸馏水下冲洗1 min,无水乙醇脱水3~5 min,50%二甲苯+50%乙醇透明5 min,二甲苯5 min,最后用树脂封固,每张切片选取5个不同视野。采用国际骨关节炎研究学会(international association for the study of osteowrthritis,OARSI)评分[7]评定软骨及软骨下骨骨量,总分20分,评分越高表示病情越严重。
1.4 HE染色检测
取膝关节软骨组织的石蜡切片,二甲苯脱蜡,经乙醇逐步脱水,二甲苯5 min×2,100%乙醇2 min,95%乙醇1 min,80%乙醇1 min,75%乙醇1 min,蒸馏水洗2 min,苏木精染色5 min,自来水冲洗,盐酸乙醇分化30 s,自来水浸泡15 min,置伊红液2~3 min,常规脱水,透明,封片,95%乙醇30 s,100%乙醇30 s×2,100%乙醇1 min×2,二甲苯15 min,中性树脂封片,显微镜下观察软骨下骨变化情况。
1.5 qRT-PCR检测TRPV4 mRNA表达水平
假手术组、模型组膝关节软骨组织磨碎匀浆提取总RNA,然后加入反转录反应体系,反应条件:95 ℃变性15 min、94 ℃变性30 s、37 ℃退火30 s、72 ℃延伸30 s,28~36个循环,4 ℃保存反转录产物。TRPV4引物序列:正向为5′-ACCTTCTGCACCAACCTCCT-3′,反向为5′-AGCCCGTAGAGCATGAATTG-3′;GAPDH引物序列:正向为5′-ACAGCTTFTGGGTGGGTCCACGAC-3′,反向为5′-TTTGAGGGACGTCCGAACTT-3′。采用2-ΔΔCt计算法分析实验数据。
1.6 免疫印迹检测TRPV4和焦亡相关蛋白水平
取膝关节软骨组织磨碎匀浆,加入裂解液充分振荡摇匀并放置冰上充分裂解30 min,4 ℃、12 000 r/min离心20 min,取组织上清,参照BCA蛋白定量试剂盒要求测定其中总蛋白含量,90 V、90 min电泳后转移至硝酸纤维素膜上,5%脱脂奶粉封闭2 h,加入TRPV4(1∶1 000)、NLRP3(1∶1 000)、Caspase-1(1∶1 000)、ASC(1∶1 000)、GSDMD(1∶1 000)、IL-1β(1∶1 000)、IL-18(1∶1 000)、β-actin(1∶1 000)、β-tubulin(1∶1 000)一抗,4 ℃孵育过夜,TBST缓冲液洗涤3次,每次10 min,室温下加二抗(1∶5 000)孵育2 h。采用凝胶成像仪显影。
1.7 ELISA检测
将100 μL各组血清加入标准孔和样品孔中,置于37 ℃温育箱中90 min,甩干孔中液体后加入100 μL抗体工作液置于37 ℃温育箱中1 h,甩干液体后加225 μL洗涤液,静置1 min甩干板内液体,加100 μL酶结合物,置于37 ℃温育箱30 min;弃去孔内液体洗板5次,在每孔中加90 μL底物溶液,置于37 ℃避光孵育15 min,加终止液50 μL,测量各孔在450 nm波长的光密度值。
1.8 统计学分析
2 结 果
2.1 TRPV4对KOA小鼠关节软骨及软骨下骨骨量的影响
番红固绿染色结果显示,假手术组膝关节软骨与软骨下骨界限清楚,潮线清晰,骨小梁排列正常,番红染色范围大、颜色深,软骨表面光滑。模型组软骨表面膜样结构破坏,软骨层明显变薄,潮线不完整,骨小梁排列紊乱,番红染色范围减小、颜色较浅,OARSI评分较假手术组升高(P<0.05)。与模型组比较,HC067047组减缓软骨破坏进程,软骨层变薄改善,潮线完整,骨小梁排列轻微紊乱,番红染色范围增加、颜色较深,OARSI评分降低(P<0.05)。HE染色结果发现,与假手术组比较,模型组膝关节软骨下骨骨量显著增高(P<0.001),给予HC067047干预后,膝关节软骨下骨骨量显著降低(P<0.05;图1)。
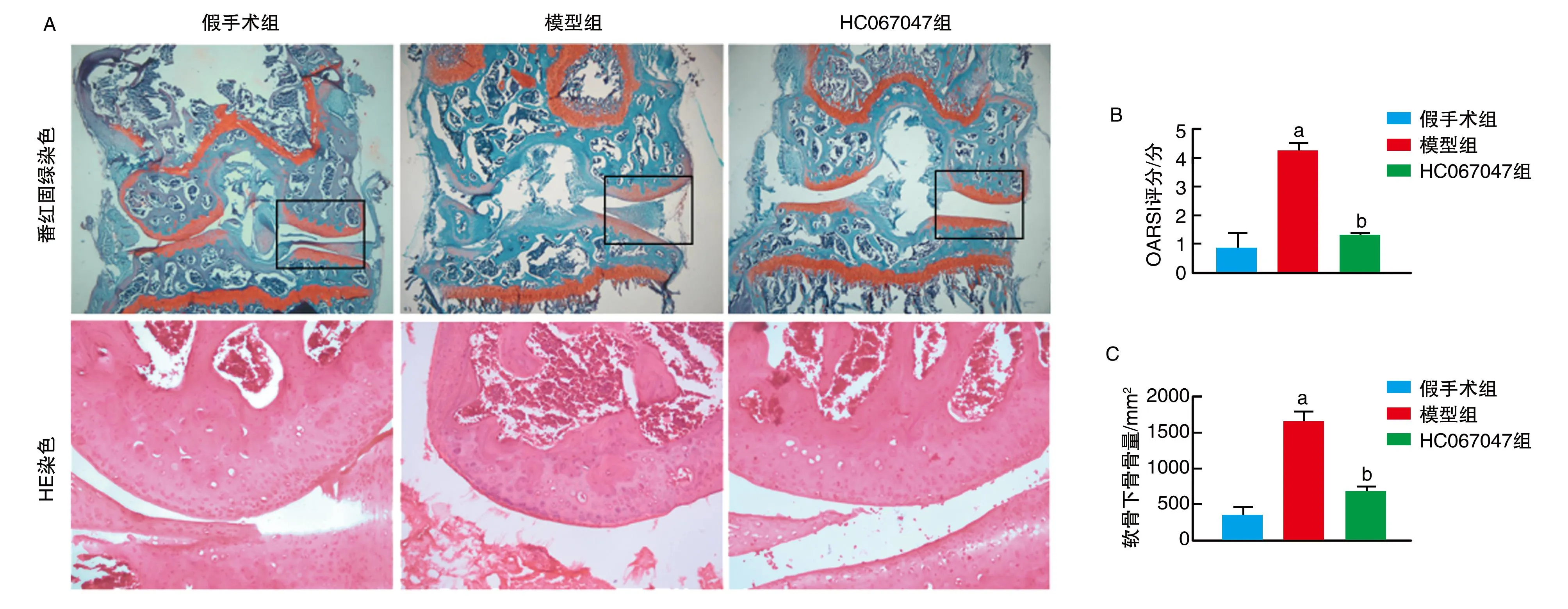
图1 TRPV4对膝骨关节炎小鼠关节软骨及软骨下骨骨量的影响A为番红固绿染色(4×)和HE染色结果(20×);B为OARSI评分;C为软骨下骨骨量。a为P<0.05,与假手术组比较;b为P<0.05,与模型组比较。
2.2 KOA小鼠软骨组织中TRPV4的表达水平
与假手术组比较,模型组小鼠膝关节软骨组织中TRPV4 mRNA及其蛋白表达水平明显增加(P<0.05;图2)。

图2 膝骨关节炎小鼠软骨组织中TRPV4的表达水平A为RT-PCR检测TRPV4 mRNA;B为Western blotting检测TRPV4蛋白。a为P<0.05,与假手术组比较。
2.3 TRPV4对KOA小鼠关节软骨组织中焦亡相关蛋白表达水平的影响
与假手术组比较,模型组膝关节软骨组织中NLRP3、ASC、Caspase-1、GSDMD-N蛋白表达水平显著升高(P<0.05);与模型组比较,HC067047组NLRP3、ASC、Caspase-1、GSDMD-N蛋白表达水平显著降低(P<0.05;图3)。
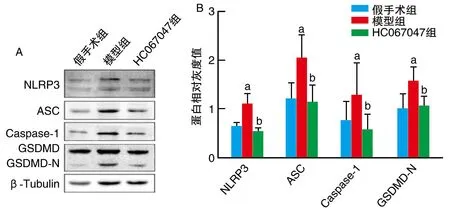
图3 TRPV4对KOA小鼠关节软骨细胞焦亡相关蛋白表达水平的影响A为Western blotting;B为柱状图。a为P<0.05,与假手术组比较;b为P<0.05,与模型组比较。
2.4 TRPV4对KOA小鼠血清和关节软骨组织中炎症因子表达水平的影响
与假手术组比较,模型组小鼠血清及关节软骨组织中IL-1β、IL-18水平显著升高(P<0.05);与模型组比较,HC067047组小鼠血清及关节软骨组织中IL-1β、IL-18水平显著降低(P<0.05;图4)。
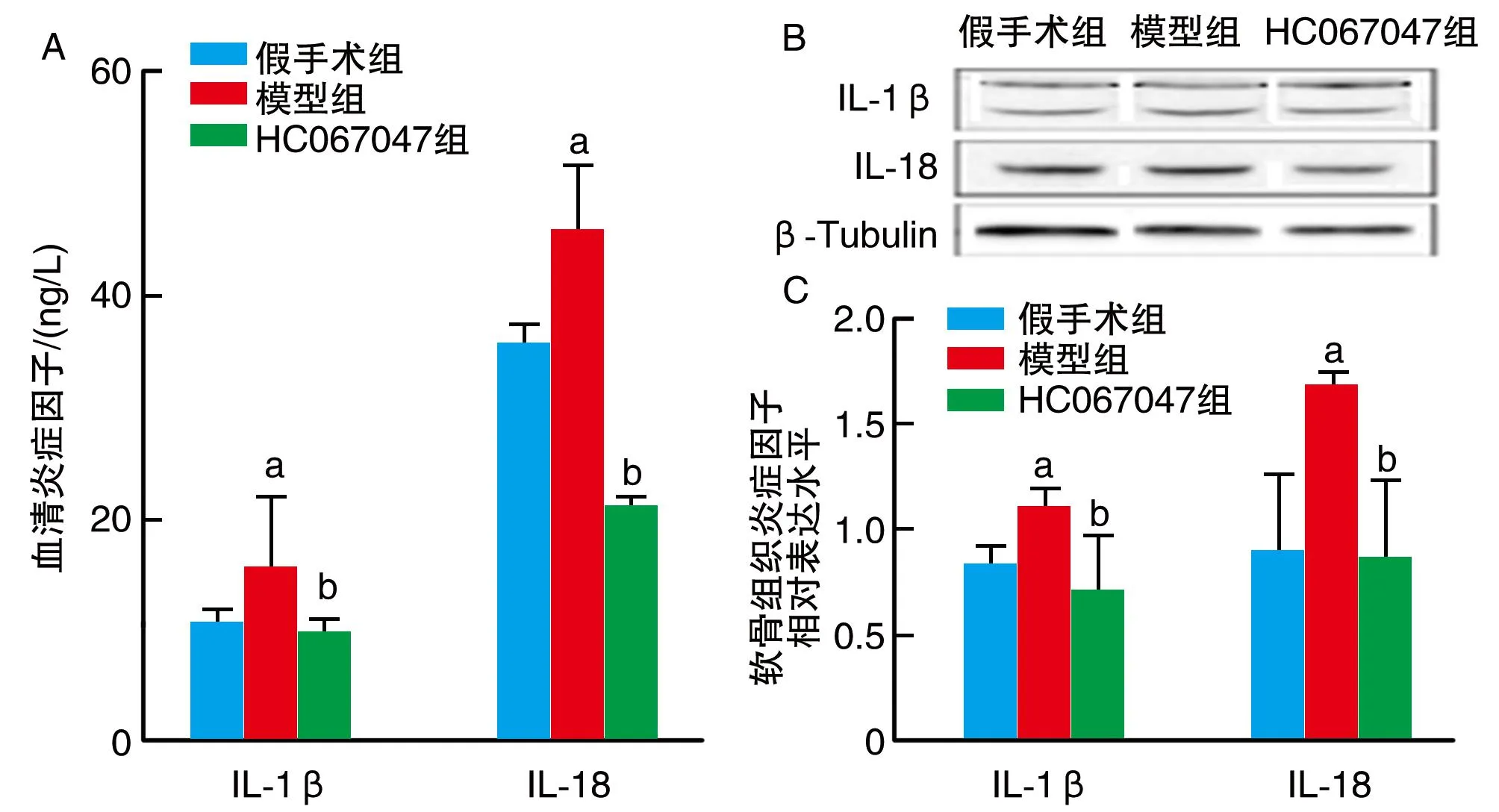
图4 TRPV4对KOA小鼠血清和关节软骨组织中炎症因子表达水平的影响A为ELISA检测小鼠血清炎症因子的水平;B为软骨组织炎症因子蛋白相对表达水平;C为软骨组织炎症因子相对灰度值。a为P<0.05,与假手术组比较;b为P<0.05,与模型组比较。
3 讨 论
膝骨关节炎是一种发病以逐年年轻化且不可逆的慢性变性关节炎疾病,以软骨、半月板、韧带退化,滑膜炎症,软骨下骨改变为特征[8-9]。尽管多种因素如衰老、创伤、炎症等一系列因素都能影响KOA的发生发展[10],但是,目前对KOA的病理机制仍知之甚少。研究表明,炎症在促进骨关节炎发展过程中扮演重要角色,因此抗炎治疗可有效延缓KOA的发病[11],然而目前长期服用非甾体类抗炎药会引起高血压、充血性心力衰竭和肾毒性等不良反应[12-13],因此寻找新的KOA抗炎靶点至关重要。
TRPV4在多种细胞类型中表达,可被多种内源性物质、炎症等多种刺激激活。研究发现,TRPV4受体在银肩病关节炎和类风湿性关节炎的发病中表达上调[14-15],而TRPV4的缺失可能促进骨关节炎的恶化[16]。Walter等[17]发现,在退变的椎间盘组织中TRPV4表达增多,参与椎间盘的退变过程。而姚旺祥等[18]研究证实,关节软骨组织中TRPV4的阳性细胞率与骨关节炎严重程度呈正相关。本研究结果显示,与假手术组小鼠比较,KOA小鼠的膝关节软骨组织中TRPV4 mRNA及其蛋白表达水平显著增加,表明抑制软骨组织中TRPV4的表达可能延缓KOA的发展;与模型组比较,HC067047处理组小鼠膝关节中的软骨层变厚,潮线完整,骨小梁排列紊乱减轻,OARSI评分降低,提示抑制TRPV4的表达水平能够改善骨关节炎小鼠的膝关节软骨退变,但TRPV4影响软骨退变的机制目前尚不十分清楚。
细胞焦亡是一种伴有炎症反应的程序性细胞死亡,可由多种病理刺激引起,如氧化应激、高血糖、炎症等[19-21],主要包括由Caspase-1的介导经典途径和由Caspase-4、5、11介导的非经典途径[22]。细胞内的炎症小体有NLRP3、AIM2和pyrin等[23],当细胞内的NLRP3被刺激因子激活,激活后NLRP通过ASC蛋白连接Caspase-1前体即pro-Caspase-1,pro-Caspase-1被活化后能够发生自我剪切,形成Caspase-1[24]。研究发现,Caspase-1的活化一方面能够促进促炎因子的成熟,另一方面也能切割GSDMD蛋白使其生成GSDMD-N片段,GSDMD-N片段能够转移至细胞膜,造成细胞膜穿孔,导致细胞内促炎因子如IL-1β、IL-18的大量释放,进而使细胞发生肿胀形成焦亡[25-26]。研究证实,IL-1β是骨关节炎滑膜炎症的重要诱导因子,能促进软骨破坏,而IL-18促进软骨细胞外基质降解方面发挥重要作用[27-28]。本研究结果显示,HC067147能显著抑制KOA小鼠软骨组织中NLRP3、Caspase-1、AIM2和GSDMD-N的表达,降低KOA小鼠血清和软骨组织中IL-1β、IL-18的水平,提示TRPV4抑制剂HC067047在KOA小鼠的软骨组织中能够抑制细胞焦亡。TRPV4可能通过促进细胞焦亡影响小鼠骨关节炎软骨退化,但细胞焦亡的发生在此过程中也可能是伴随发生的,因此后续实验需要通过特异性敲除TRPV4证实其与细胞焦亡在骨关节炎小鼠软骨组织中的直接关系。
综上,TRPV4可能通过抑制细胞焦亡促进骨关节炎小鼠软骨退变,TRPV4抑制剂HC067047有望成为骨关节炎的治疗靶点。
