溶剂诱导萃取/UPLC-MS/MS法检测农田土壤中20种除草剂
2024-01-02瞿德业王彩虹朱梦晨杨明月柴文博杨山泉
瞿德业,王彩虹,陈 静,朱梦晨,杨明月,夏 搏,柴文博,杨山泉
(1.西北师范大学 地理与环境科学学院,甘肃 兰州 730070;2.甘肃省绿洲资源环境与可持续发展重点实验室,甘肃 兰州 730070)
农业生产中常需使用农药,根据防治对象的不同,农药可分为除草剂、杀虫剂、杀菌剂、脱叶剂、植物生长调节剂等[1]。在所有类型的农药中,除草剂占世界产量的最大份额,并已成为现代农业实践的重要组成部分[2]。除草剂可以减少杂草生长、提升农业产量,因此我国每年在农林牧业生产中会使用大量的除草剂[3]。由于除草剂具有良好的水溶性和稳定的化学结构,大量和频繁地使用会使其残留在农田土壤中。残留除草剂通过食物链的生物积累和传播进一步扩散[4],对人体健康造成危害[5-7]。因此,除草剂残留对土壤的污染不容忽视,建立一种高效的土壤中除草剂残留检测方法具有重要意义。
土壤中除草剂残留检测的难点在于复杂基质的干扰,且待测目标化合物的含量通常很低,因此,在处理前对样品进行有效的清洗成为准确分析和检测的条件,同时也能避免进样口、色谱柱及检测器等污染[8-9]。目前,已被广泛使用的除草剂样品前处理技术有液液萃取、固相萃取、固相微萃取、QuEChERS 方法、加速溶剂萃取等[10-12]。以上样品前处理方法操作过程复杂,制约因素多,耗时久。本研究采用溶剂诱导萃取样品前处理技术,该方法是在匀相的乙腈-水体系中添加一种疏水且与乙腈互溶的有机溶剂,从而诱导乙腈-水体系分层。溶剂诱导萃取最大的优势为经诱导萃取剂诱导分离的乙腈层和水层能够将疏水性和亲水性物质在线分离,从而实现样品的净化和浓缩,且有机相与反相液相色谱流动相兼容,可直接进样分析[13]。该前处理方法已被用于中药成分和血浆中药物的分析[14-15],但很少用于土壤中除草剂残留测定。本文拟建立一种优化后的溶剂诱导萃取前处理方法,使之更适用于土壤样品的处理,并结合超高效液相色谱-串联质谱法对土壤中20种除草剂进行多残留检测。
1 实验部分
1.1 仪器与试剂
ACQUITY UPLC I-Class 型高效液相色谱仪(美国Waters 公司)、Quattro Premier XE 型三重四极杆液质联用仪(美国Agilent 公司);BC-100 型多管涡旋混合仪(美国Scientific Industries);3K30 型台式高速冷冻离心机(德国Sigma 公司);BSA 822 电子天平;移液枪(10~100 µL,100~1 000 µL,美国Thermo Electron公司)。
乙腈、乙酸乙酯(色谱纯,德国默克公司);甲酸铵、二氯甲烷、氯化钠(分析纯,国药集团化学试剂有限公司);甲酸(纯度>98%,德国默克公司);实验用水为蒸馏水(屈臣氏);20种除草剂混合标准溶液购于阿尔塔科技有限公司。样品来自河南省开封市某农业种植大棚基地的土壤,自然风干后,去除杂草、植物根茎叶和碎石等杂物,用土壤研磨仪粉碎后,过60目筛网,待用。
1.2 实验方法
1.2.1 样品前处理称取上述处理好的土壤样品10 g,加入5 mL乙腈、5 mL纯净水,涡旋8 min,充分混合均匀后,在6 ℃下以12 000 r/min 离心5 min;吸取上清液,并记录上清液体积。加入1.5 mL 二氯甲烷至上清液中,涡旋8 min,静置3 min,离心5 min。溶液产生分层现象,上层为乙腈层,下层为水层;记录上下层体积,分别取1.0 mL过0.22 µm有机滤膜,装入棕色进样小瓶,待测。
1.2.2 标准溶液配制20 种除草剂混合标准溶液:准确移取一定量的标准溶液用乙腈-水(体积比1∶1)定容于10 mL棕色容量瓶中,配制成1 mg/L的20种除草剂混合标准溶液,冷藏待用。
基质标准溶液:取空白的土壤样品,按照“1.2.1”方法进行前处理。取农药混合标准溶液,以空白样品溶液为溶剂,配制 0.1~100 µg/L的系列基质标准溶液。
1.3 色谱-质谱条件
1.3.1 色谱条件色谱柱:ZORBAX Eclipse Plus C18色谱柱(100 mm×2.1 mm,1.8 µm,美国Agilent公司);流动相A:0.1%甲酸水,B:乙腈;进样量:3 µL;柱温:30 ℃;流速:0.30 mL/min。流动相洗脱梯度:0~1 min,30% B;1~2 min,30%~40% B;2~5 min,40%~50% B;5~8 min,50%~30% B;8~8.5 min,30% B。
1.3.2 质谱条件采用电喷雾离子源(ESI),多反应监测(MRM)正离子方式扫描,毛细管电压为3 500 V;雾化气:2.76×105Pa;干燥气温度为350 ℃,干燥气流速为10 L/min。20 种除草剂的保留时间、定量定性离子对、碰撞能量及碎裂电压见表1。
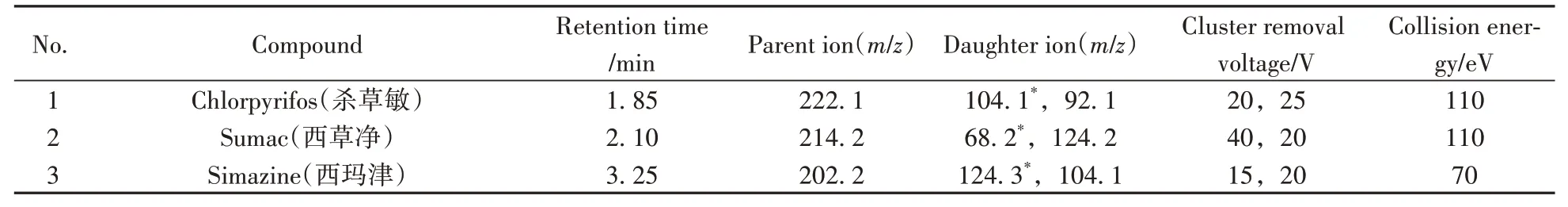
表1 20种除草剂的保留时间及MRM参数Table 1 Retention times and MRM parameters of 20 herbicides
1.4 数据分析
数据采用Excel 2010 进行处理,采用Origin 2022 绘制柱状图,采用Design Expert 10 软件进行响应面分析。
2 结果与讨论
2.1 仪器方法的优化
2.1.1 质谱参数的选择常用的质谱电离源有ESI和大气压化学电离源(APCI)两种,ESI电离源适用于多电荷、中高极性、分子量较大、热不稳定的物质[16],实验发现ESI 电离源的灵敏度较高,故选择ESI 电离源。采用正离子模式扫描,选择峰强度较大的离子作为定性定量离子。对所选离子对的去簇电压和碎裂电压进行优化,并对电喷雾电压、离子源温度和驻留时间等参数进行优化,优化后的质谱条件如“1.3.2”所示。通过梯度洗脱可实现多种化合物的有效分离。离子色谱图虽有重叠,但各峰的定量离子和定性离子不同,因此不影响定量分析[17]。20种除草剂的总离子流图如图1所示。
2.1.2 色谱柱的选择选择色谱柱对于分离样品非常重要,通常不同填料的色谱柱对同一样品有不同的保留时间[18]。考察了ACQUITY UPLCTMBEH C18(1.0 mm×50 mm,1.7 µm)和ZORBAX Eclipse Plus C18(100 mm×2.1 mm,1.8 µm)2 种色谱柱的分离效果。其中,前者的填料为三官能键合BEH 颗粒,可适用的pH 范围更宽(pH 1~12),低pH 稳定性好,柱渗漏非常低,适用于高灵敏度MS 应用;而后者可在高压下操作(达到6.00×107Pa),且装填的C18填料适用于高速反相HPLC,该柱对所有类型化合物分析均能得到高柱效和优异峰形。实验结果显示,使用ZORBAX Eclipse Plus C18色谱柱能使20 种目标物的峰形对称,色谱响应较高,所以选用该色谱柱进行分离。
2.1.3 流动相的优化考察了0.1%甲酸水-乙腈、0.1%甲酸水-乙腈(0.01%甲酸水+2 mmol/L 甲酸铵)、0.1%甲酸水(含2 mmol/L甲酸铵)-乙腈(0.1%甲酸水+2 mmol/L甲酸铵)、0.1%甲酸水(含2 mmol/L甲酸铵)-乙腈(0.1%甲酸水)4 种流动相的分离效果,结果表明,以0.1%甲酸水-乙腈为流动相时,所有目标化合物的响应强度最高,出峰时间最短。因此,选择0.1%甲酸水-乙腈为流动相。
2.2 前处理单因素实验的优化
2.2.1 提取剂体积的选择为了验证不同体积的提取剂乙腈是否对目标物回收率产生影响,将乙腈与水分别按照体积比2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2 移取10 mL,按照“1.2”进行实验,发现目标物主要集中在上层乙腈层,因此主要比较上层物质的回收率。当乙腈与水的比例为5∶5即乙腈体积为5 mL 时出峰效果最好,回收率较高。对实验结果用SPSS 软件采用单因素方差进行差异性分析,结果表明不同体积的乙腈间存在显著性差异。确定选择乙腈体积为5 mL进行实验。
2.2.2 萃取剂的选择萃取剂是决定萃取效率的重要因素,萃取剂的选择必须考虑萃取剂的密度、挥发性、萃取目标物的能力以及对后续色谱分离分析的影响[19]。大多数与乙腈互溶的疏水性溶剂均能作为萃取剂诱导乙腈-水体系分层[15],因此本实验考察了二氯甲烷、乙酸乙酯、NaCl 以及二氯甲烷+NaCl 的萃取效果。在空白土壤中添加20 种除草剂混合标样,按照“1.2.1”处理,比较20 种除草剂的含量,并通过计算回收率确定20 种除草剂的转移率。图2 结果表明,选择二氯甲烷为萃取剂进行萃取时,目标物的回收率最高,因此选择二氯甲烷作为萃取剂。

图2 不同萃取剂对目标物回收率的影响Fig.2 Effect of different extractants on the recoveries of target compounds
2.2.3 萃取剂添加量的确定比较了二氯甲烷的添加量对目标化合物回收率的影响。在其他条件一致的情况下,配制10 µg/L 空白加标土壤样品,分别添加1.0、1.2、1.5、1.8、2 mL 的二氯甲烷,按照“1.2.1”处理后上机测定。结果表明,二氯甲烷添加量为1.5 mL 时,20 种除草剂的回收率最高,因此选择二氯甲烷添加量为1.5 mL。
2.2.4 涡旋时间的影响土壤和提取剂乙腈充分混合,会使实验结果更加准确,因此涡旋至关重要。考察了涡旋时间对20种除草剂回收率的影响,由图3 可知,涡旋时间在5~8 min范围内目标物的回收率呈上升趋势,在8~10 min 范围内回收率呈下降趋势,因此选择涡旋时间为8 min。对实验结果用SPSS 软件采用单因素方差进行差异性分析,结果表明不同涡旋时间存在显著性差异。
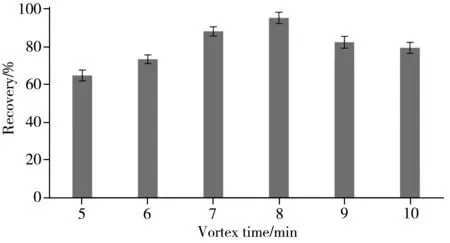
图3 涡旋时间对目标物回收率的影响Fig.3 Effect of vortex time on the recoveries of target compounds
2.3 响应面实验结果分析
2.3.1 响应面设计及结果由“2.2”的结果可知,二氯甲烷体积为1.5 mL、提取剂乙腈体积为5 mL、涡旋时间为8 min 时目标物的回收率较好。因此,通过极差对单因素水平进行筛选,最终选择二氯甲烷添加量、提取剂乙腈体积、涡旋时间为考察因素,通过响应面法对3 个单因素进行分析,实验方案及结果见表2。
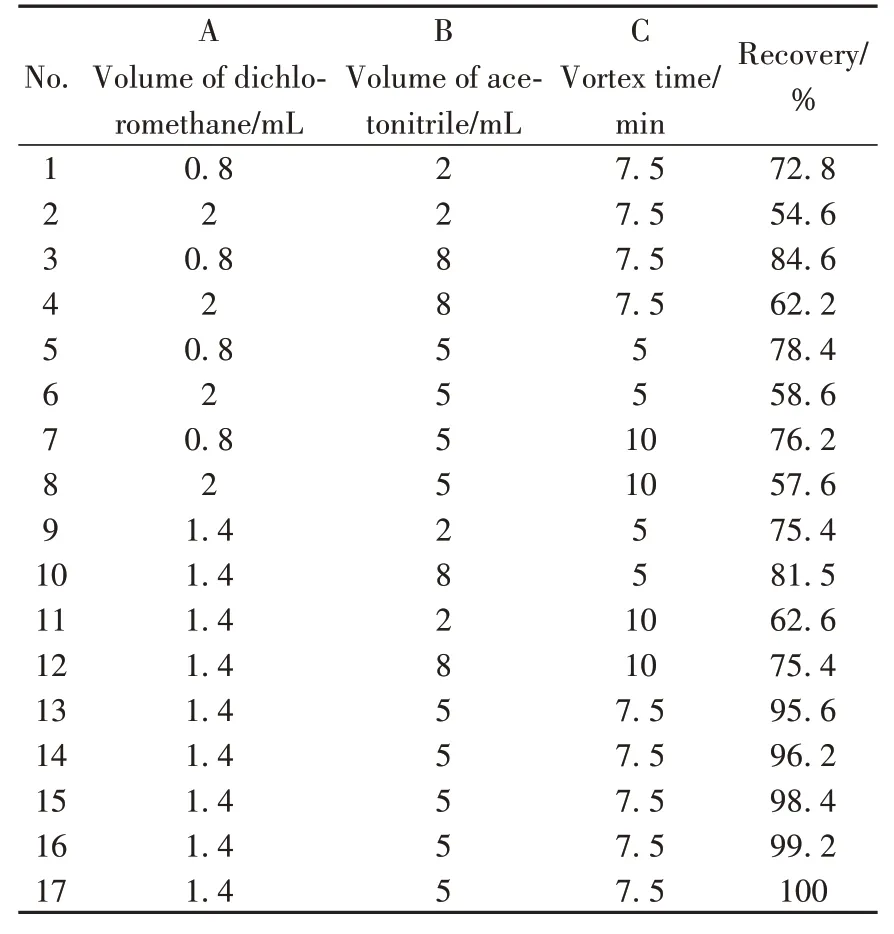
表2 响应面试验设计及结果Table 2 Experimental design and results for response surface analysis
以二氯甲烷体积、乙腈体积、涡旋时间为因素,20种除草剂的回收率为响应值(Y),经回归拟合后,得到回归方程:Y=97.94-9.87A+4.79B-2.76C-1.05AB+0.30AC+1.68BC-17.71A2-11.68B2-12.83C2。利用Design Expert 10 软件对表2 数据进行方差分析,结果如表3所示。
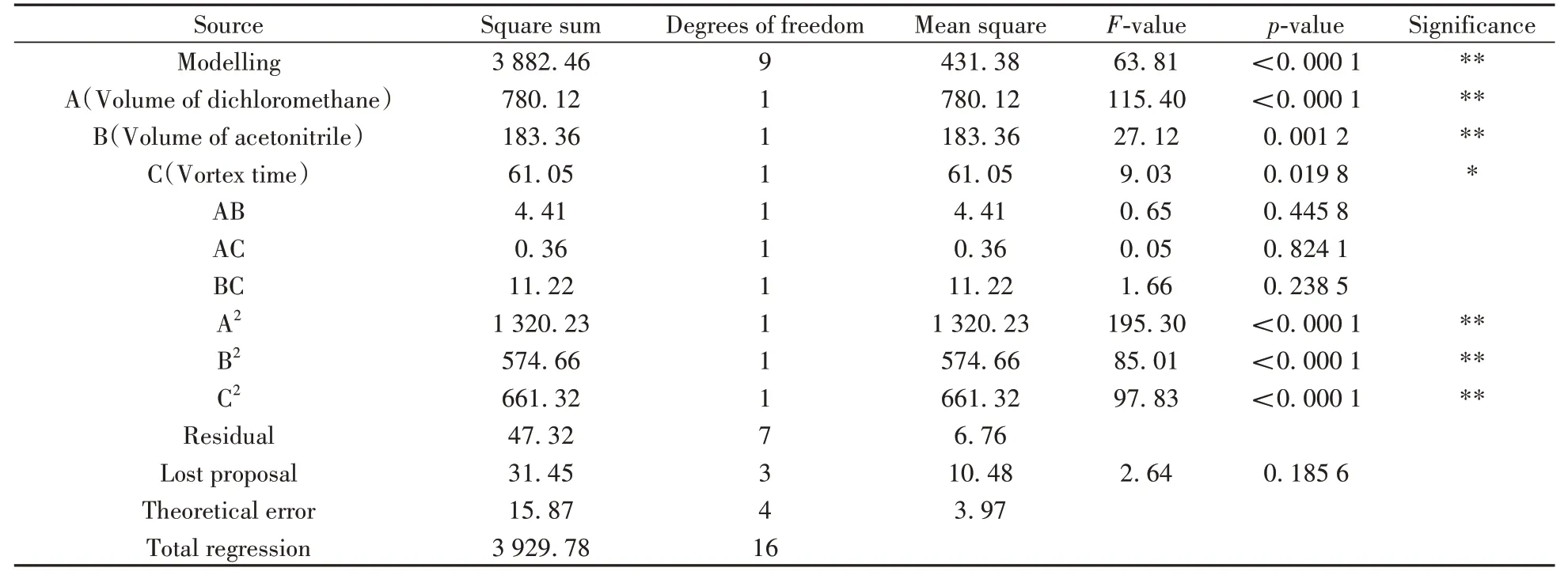
表3 回归模型的方差分析Table 3 Variance analysis of regression model
根据方差分析结果,该模型的相关系数(R2)为0.993,说明模型的可信度高。该响应面回归模型达到极显著水平(p<0.01),表明该二次模型能够拟合实际结果,误差较小。综上,可以利用此回归方程确定20 种除草剂的最佳萃取条件。A、B、A2、B2、C2对20种除草剂的回收率产生极显著影响(p<0.01),而AB、AC、BC对目标物回收率的影响不显著。
2.3.2 响应面结果各实验因素交互作用的响应面和等高线图见图4。响应面图可较直观地体现各因素交互作用对除草剂回收率的影响,曲线越陡峭,则表明该因素影响越大[20]。从表3 及图4 可以看出,二氯甲烷体积对除草剂回收率的影响最大,乙腈体积、二氯甲烷体积、涡旋时间之间的交互作用对目标物回收率的影响不大。根据软件计算结果,预测20 种除草剂的最佳回收率为93.8%,乙腈体积为5.6 mL,二氯甲烷体积为1.4 mL,涡旋时间为7.5 min。将上述最优萃取条件简化为乙腈体积5 mL、二氯甲烷体积1.5 mL、涡旋时间8 min,进行5 次重复实验,得到20 种除草剂的平均回收率为95.2%,测定结果稳定,证明该结果合理可靠。

图4 各因素交互作用的响应面和等高线图Fig.4 Response surface and contour plots of interaction of experimental factors
2.4 方法验证
2.4.1 基质效应样品中内源性组分和样品前处理过程中引入的杂质对目标物检测结果的影响称为基质效应,它可能影响线性关系、检出限等测定指标[21]。通过基质匹配标准曲线斜率与纯溶剂配制标准曲线斜率的比值评价基质效应(ME),该比值等于或接近1 时(在0.8~1.2 之间),表明基质效应不明显;小于0.8 时,表明存在明显基质抑制作用;大于1.2 时,表明存在明显基质增强作用[22]。使用“1.2.2”配制的基质混合标准溶液和溶剂混合标准溶液,考察了20种除草剂在土壤中的基质效应。结果表明,经前处理后,20种除草剂的ME值为0.89~1.07,基质效应不明显。
2.4.2 线性方程与检出限在优化的实验条件下,用乙腈-水(1∶1)配制0.1、0.2、0.5、1.0、2.0、5.0、10.0、20.0、50.0、100.0 µg/L的系列标准溶液,以质量浓度为横坐标,对应的峰面积响应值为纵坐标绘制标准曲线。结果表明,20 种除草剂在对应质量浓度范围内线性良好,相关系数均不小于0.999 0。以3倍信噪比计算目标化合物的检出限(LOD)为0.1~1.0 µg/kg,以10倍信噪比计算目标化合物的定量下限(LOQ)为0.2~5.0 µg/kg,结果见表4。
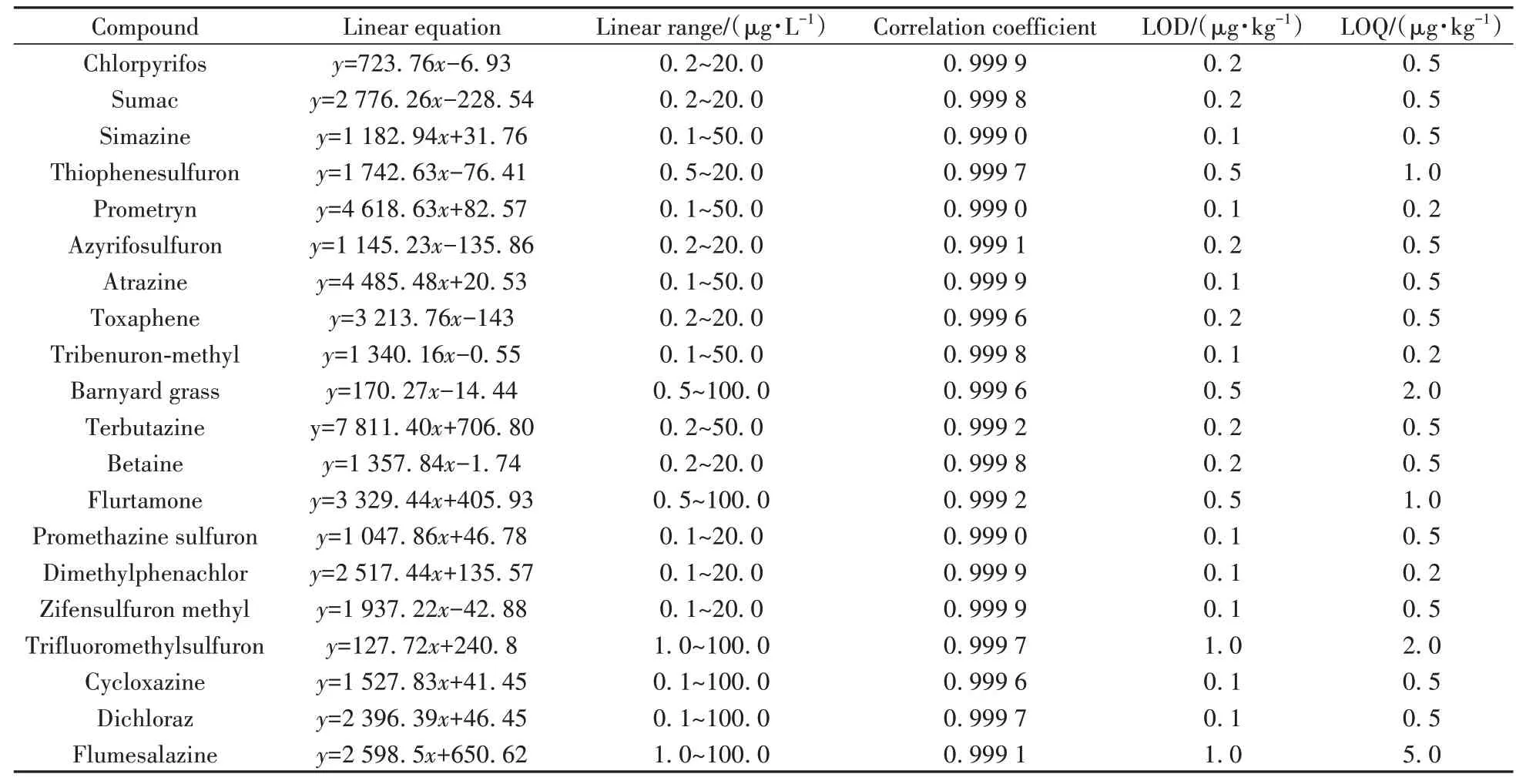
表4 20种除草剂的线性关系、检出限及定量下限Table 4 Linear relations,detection limits and quantitation limits of 20 herbicides
2.4.3 准确度与精密度选用空白土壤样品,准确加入混合标准溶液,配制成低(1 µg/kg)、中(10µg/kg)、高(50 µg/kg)水平的加标样品,按照优化后的实验条件进行处理和测定,每个加标水平重复测定5 次。表5 结果显示,20 种除草剂的加标回收率为77.6%~115%,相对标准偏差(RSD)为0.40%~3.8%,本方法具有较好的准确度与精密度。

表5 加标土壤样品的平均回收率及相对标准偏差Table 5 Average recoveries and relative standard deviations of spiked soil samples
2.5 与相关行业标准比较
因本研究与NY/T 1616-2008[23]检测的目标物部分重合,比较发现,本方法前处理只需乙腈、二氯甲烷2 种试剂,而NY/T 1616-2008 方法需使用乙腈、磷酸二氢钾、磷酸氢二钾、磷酸、冰乙酸、氢氧化钠6 种试剂;本方法前处理时间缩短,且检出限(0.1~1.0 µg/kg)低于标准方法(0.6~3.8 µg/kg)。综上,本方法所用试剂少,操作简单,前处理时间短,检出限低。
2.6 实际样品测定
采用本方法对采集的245 份土壤样品中的20 种除草剂进行检测(见表6),结果表明:上述实际样品中有48 份样品有检出,共检出9 种除草剂,其中莠去津的检出含量较高,表明莠去津除草剂使用较广,使用效率较高。与孟繁磊等[24]的研究相比,该采样区土壤中莠去津的浓度较低,但当地居民长期食用受污染的蔬菜,对身体会造成一定危害。所以在农业土壤的管理中对以上被检出的9 种除草剂应给予更多关注。

表6 土壤样品中除草剂的检测结果Table 6 Detection results of herbicide residues in soil samples
3 结 论
本研究通过单因素实验结合响应面分析,得到最优的前处理条件:萃取剂为1.5 mL二氯甲烷、提取剂为5 mL乙腈、涡旋时间为8 min。在该条件下,20种除草剂的平均回收率为77.6%~115%,RSD 为0.40%~3.8%,检出限为0.1~1.0 µg/kg,定量下限为0.2~5.0 µg/kg,均能满足检测要求。溶剂诱导萃取不仅能够提高检测通量,而且试剂用量少,能够在线完成净化和富集,操作简单,有效降低了成本。本方法为其他除草剂或农药残留的高通量检测提供了新的思路。
