基于液相色谱-高分辨质谱测定不同加工方式丹参的化学成分
2024-01-02范佳丽纪文华郭兰萍李丽丽
范佳丽,纪文华,王 晓,郭兰萍,李丽丽*
(1.齐鲁工业大学(山东省科学院) 山东省分析测试中心 山东省大型精密分析仪器应用技术重点实验室,山东济南 250014;2.中国中医科学院 中药资源中心 道地药材国家重点实验室培育基地,北京 100007;3.齐鲁工业大学(山东省科学院) 药学院 山东省高等学校天然药物活性成分研究重点实验室,山东 济南 250014)
丹参是唇形科植物丹参Salvia miltiorrhizaBge. 的干燥根和根茎,是常用的大宗中药材之一。据[1-2]2020年版《中国药典》记载,丹参具有活血祛瘀、通经止痛、清心除烦和凉血消痈等功效,用于胸痹心痛、胶腹胁痛、症痕积聚、热痹疼痛、心烦不眠、月经不调、痛经经闭、疮疡肿痛[3]。现代药理学研究表明,丹参在治疗心血管疾病[4-5]、神经系统疾病[6]、消化系统疾病[7]、慢性肾病[8]等方面疗效显著,应用广泛。
近年来,丹参药材的需求量持续增加。丹参药材大多采用人工栽培,干燥后切片使用。按照加工方法不同,丹参切片可分为干切片和鲜切片两大类。传统切片往往是将丹参干燥后,水洗润软切片,闷润过程中可能会导致有效成分的损失[9-10]。丹参趁鲜加工是先切片后干燥,干燥方式会影响其成分含量[11]。丹参加工方法的研究已有一些报道,以往研究往往只关注丹参中几种成分。赵志刚等[12]通过测定迷迭香酸、丹酚酸B、隐丹参酮和丹参酮ⅡA 的含量,对整体和切断加工的丹参质量进行了比较分析。张雪梅等[13]基于丹酚酸B、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA的含量,研究了丹参趁鲜加工与传统加工对其饮片质量的影响。王小平等[14]对不同加工方式丹参中的丹参酮ⅡA、丹酚酸B和丹参素进行了研究,指出不同加工方式对丹参品质有重要影响,其成片率、有效成分含量有显著性差异。
植物中含有丰富的化学成分,基于在植物中的功能不同,可分为初生代谢物和次生代谢物。初生代谢物为植物生长发育提供物质和能量,次生代谢物是植物抵抗外来胁迫(抗病、抗逆)的关键成分[15-16]。液相色谱-高分辨质谱联用(LC-HRMS)法,由于具有高灵敏、高通量等优点,在植物化学成分分析,特别是农产品加工研究中应用广泛[17-19]。本研究基于液相色谱-高分辨质谱联用技术对丹参进行化学成分分析,首先对丹参中的初生代谢物和次生代谢物进行定性分析,然后探究不同切片加工方法下丹参中初生和次生代谢物成分的变化趋势,探究切片加工方法对丹参品质的影响。
1 实验部分
1.1 试剂与仪器
甲醇、乙腈(色谱级,德国Merck 公司);甲酸(色谱级,德国Honeywell Fluka 公司);超纯水由Millipore Direct-Q8UV-R 超纯水系统(美国)制备。超高效液相色谱仪(ACQUITY,H-Class,美国沃特世公司),飞行时间质谱仪(Q-TOF MS,ImpactⅡ,德国布鲁克公司),快速水分测定仪(ATXY-101,潍坊中特电子仪器有限公司)。涡旋振荡器(Vortex-Genie 2,美国Scientific Industries 公司)。标准品:丹参酮Ⅰ购自上海源叶生物科技有限公司,丹参酮ⅡA、隐丹参酮、丹酚酸B、咖啡酸、色氨酸、苯丙氨酸、柠檬酸、脯氨酸购自成都德思特生物技术有限公司。标准品纯度均大于98%。
1.2 样品信息
丹参采自济南市莱芜区苗山镇丹参种植基地,经山东省分析测试中心王晓研究员鉴定为唇形科植物丹参Salvia miltiorrhizaBge.。分别制备丹参鲜切片和干切片:鲜切后分别进行晒干和烘干干燥处理;干切分为全干切片和传统切片。将采收的整支丹参除去杂质和残茎,分成四组进行处理。丹参鲜切片晒干样品(X-S):将新鲜丹参切成2~3 mm的厚片后晒干(8 h)。丹参鲜切片烘干样品(X-H):将新鲜丹参切成2~3 mm 的厚片后,放入烘箱中烘干(60 ℃,3 h)。全干切片样品(G-Q):将丹参整支晒干至轻折可断(8 d),喷洒微量水使丹参表面稍润后切成2~3 mm 的厚片,晒干。传统切片样品(G-C):将丹参整支晒干至轻折可断(8 d),分多次将少量水喷洒在丹参上,翻动使水分缓缓浸入丹参中而不使水分流失,切成2~3 mm厚片,晒干。测试4种样品的含水量均不大于13%,符合2020版药典要求。
1.3 样品制备
将不同处理丹参样品粉碎成粉末,过筛(药典三号筛)。准确称取100 mg 样品于2 mL Eppendorf 管中,加入1.5 mL 甲醇/水溶剂(3∶1,体积比)[20],使用涡旋振荡器涡旋2 min (3 000 r/min),离心15 min,取上清液。每个样品平行6份。取不同处理丹参样品粉末各1 g,混合均匀,制备质控(QC)样品。
1.4 LC-MS分析条件
色谱柱为Agilent SB-C18柱(2.1 mm × 100 mm,1.8 µm,美国Agilent 公司),流速为0.3 mL/min,柱温35 ℃。流动相A 和B 分别为0.1 %甲酸水溶液和乙腈溶液。洗脱梯度如下:0~2 min,5% B;2~3 min,5%~30% B;3~8 min,30% B;8~9 min,30%~40% B;9~18 min,40%~46% B;18~28 min,46%~54% B;28~43 min,54%~85% B;43~45 min,85%~100% B;45~50 min,100% B;50~55 min,100%~5% B。总时间为55 min。
质谱条件:毛细管电压分别为3 500 V(正离子模式)和3 000 V(负离子模式);干燥气温度为200 ℃;干燥气体流速为8 L/min;雾化气压力为200 kPa;碰撞池射频电压振幅为750 Vpp;脉冲前等待时间为5 µs;传输时间为60 µs;碰撞能量为7 eV;质量数扫描范围m/z为50~1 500;二级质谱分析时碰撞能为10~50 eV。
1.5 数据处理
将采集得到的LC-MS数据导入MS-DIAL软件进行峰识别、峰匹配、峰对齐等处理,得到包含质量数、保留时间和峰面积的表格。基于不同样品的峰面积值进行后续的数据分析。使用SIMCA 软件(瑞典)进行主成分(PCA)分析;由SPSS软件(美国)进行非参数检验;由MEV软件(美国)进行聚类分析。
2 结果与讨论
2.1 丹参代谢物定性分析
基于质量数、保留时间、二级质谱数据以及相关数据库,并查阅相关文献[21-26],对丹参中的初生代谢物和次生代谢物进行定性分析。丹参在正离子模式和负离子模式下的总离子流图见图1。在丹参样品中共鉴定出44种化合物(表1),包括27种初生代谢物和17种次生代谢物。初生代谢物包括7种氨基酸类、13种脂肪酸类、5种有机酸类和2种核苷类,次生代谢物包括5种丹酚酸类和12种丹参酮类。

表1 丹参中定性的代谢物Table 1 The identified metabolites in Salvia miltiorrhiza Bge.
图1 丹参在正离子(A)和负离子(B)模式下的总离子流图Fig.1 Total ion chromatograms of Salvia miltiorrhiza Bge. in the positive ion(A) and negative ion(B) modes
2.2 方法学考察
使用QC样品考察方法的重复性和稳定性。制备5个QC样品,每间隔6 h采样1次。计算5个QC样品中每个峰对应峰面积的相对标准偏差(RSD),统计不同RSD 范围(0~10%、10%~20%、20%~30%、>30%)内的峰个数,以及相应的峰面积之和。计算不同RSD 范围内峰个数占比和累计峰面积占比。结果显示,在正离子模式下有95.1%的峰的RSD 在30%以内,峰面积占比为93.6%;在负离子模式下有93.2%的峰的RSD 在30%以内,峰面积占比为94.1%。说明该方法具有良好的重复性和稳定性,满足代谢组学分析的要求。
2.3 不同切片方式丹参样品的代谢组学分析
2.3.1 PCA分析对鲜切片晒干样品(X-S)、鲜切片烘干样品(X-H)、全干切片样品(G-Q)、传统切片样品(G-C)进行PCA 分析。分别将正离子和负离子模式下不同化合物的峰面积数据导入SIMCA 软件,选择PCA-X 模型,设置不同分组,确定主成分,绘制4 种处理方式下丹参样品的PCA 得分图。如图2 所示,不同加工方式的丹参样品在主成分1(PC1)有明显分离。在正离子模式下(图2A)PC1为0.38,在负离子模式下(图2B)PC1 为0.552。从图2 可以看出鲜切片样品烘干和晒干处理差异较小,与传统切片和全干切片差异较大。
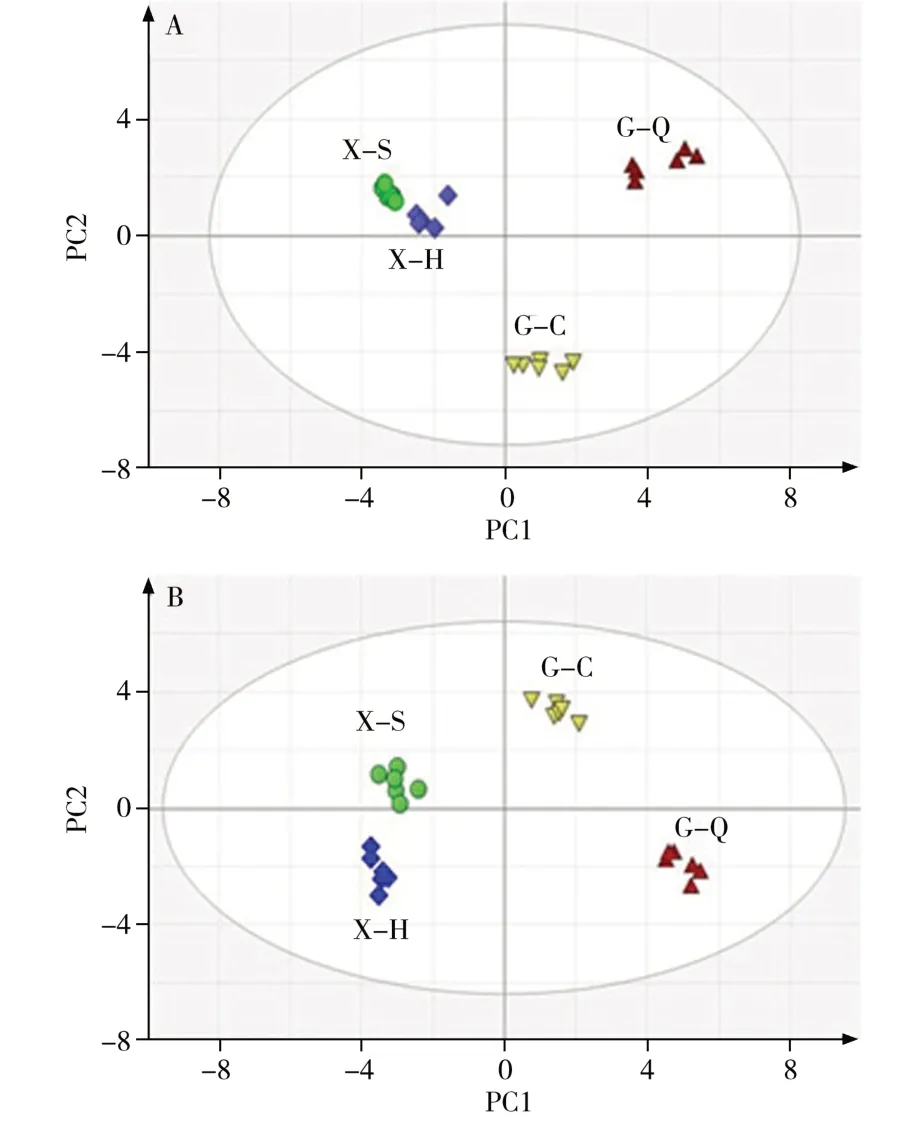
图2 不同切片方式下丹参的PCA得分图Fig.2 The score plots of Salvia miltiorrhiza Bge. with different processing methods
对不同处理方式下的丹参样品进行非参数检验,得到p值,并计算两组样品之间的峰面积比值。筛选p<0.05 和比值>1.5 的代谢物为差异化合物。结果显示,鲜切片烘干样品和晒干样品相比有5 个差异化合物;鲜切片烘干样品与传统切片样品相比有16 个差异化合物;鲜切片晒干样品与传统切片样品相比有16 个差异化合物;鲜切片烘干样品和全干切片样品相比有18 个差异化合物;鲜切片晒干样品与全干切片样品相比有19 个差异化合物;传统切片样品与全干切片样品相比有16 个差异化合物。说明鲜切片烘干和晒干处理差异较小,传统切片与全干切片差异较大,鲜切法与干切法差异较大。
2.3.2 次生代谢物9 种丹参酮类和1 种丹酚酸类物质被筛选为差异次生代谢物。差异次生代谢物在不同样品中的分布图见图3。丹参酮Ⅰ、丹参酮ⅡA、隐丹参酮和丹酚酸B 是药典的指标性成分。丹参酮Ⅰ在全干切片样品中的峰面积值(平均值±SD,3 868 167±466 537)分别是鲜切片烘干样品(2 269 407±93 997)、鲜切片晒干样品(2 616 672±120 916)和传统切片样品(3 514 229±399 576)的1.70倍、1.48倍和1.10倍。丹参酮ⅡA 在全干切片样品中的峰面积值(17 385 237±4 374 738)分别是鲜切片烘干样品(11 284 460±2 228 373)、鲜切片晒干样品(11 046 136±733 077)和传统切片样品(14 762 916±3 776 880)的1.54 倍、1. 57 倍和1.17 倍。隐丹参酮在全干切片样品中的峰面积值(70 704 673±2 314 886)分别是鲜切片烘干样品(67 093 994±5 235 287)、鲜切片晒干样品(61 949 314±1 237 301)和传统切片样品(36 708 048±1 649 559)的1.05倍、1.14倍和1.92倍。丹酚酸B在全干切片样品中的峰面积值(1 274 115±22 245)分别是鲜切片烘干样品(859 757±40 055)、鲜切片晒干样品(1 009 508±15 811)和传统切片样品(784 800±13 593)的1.48 倍、1.26 倍和1.62 倍。丹参酮I 和丹参酮ⅡA 在全干切片和传统切片中丰度相当,高于鲜切片。隐丹参酮在传统切片中的丰度显著低于其他3 种。丹酚酸B 在全干切片中的丰度较高。
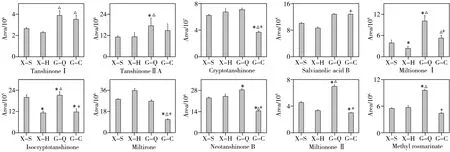
图3 差异次生代谢物在不同加工方式丹参样品中的分布图Fig.3 Histograms of differential secondary metabolite in different processing methods of Salvia miltiorrhiza Bge.
对于其他丹参酮类代谢物,鲜切片烘干样品和晒干样品相比,丹参新酮Ⅰ和异隐丹参酮具有显著性差异,丹参新酮Ⅰ在鲜切片晒干样品中的峰面积值(385 494±90 013)是烘干样品(233 350±68 377)的1.65 倍。异隐丹参酮在鲜切片晒干样品中的峰面积值(2 000 566±148 268)是烘干样品(1 126 942±90 192)的1.78倍。全干切片样品与传统切片样品相比,次丹参酮、丹参新酮Ⅰ、丹参新醌乙、丹参新酮Ⅱ、亚甲基丹参醌、异隐丹参酮具有显著性差异,其在全干切片样品中的峰面积值(27 028 020±935 733、1 004 468±154 400、28 363 504±915 903、691 372±22 912、9 574 806±230 702、2 120 150±195 371)分别是传统切片样品(11 504 494±396 042、522 273±87 393、14 486 140±393 821、295 515±5 838、4 388 218±173 931、1 177 546±177 314)的2.35 倍、1.92 倍、1.96 倍、2.34 倍、2.18 倍和1.80倍。全干切片样品与鲜切片晒干样品相比,丹参新酮Ⅰ、丹参新酮Ⅱ、亚甲基丹参醌变化明显,其在全干切片样品中的峰面积值分别是鲜切片晒干样品(385 494±90 013、451 633±11 633、5 531 431±144 917)的2.61 倍、1.53 倍和1.73 倍。传统切片样品与鲜切片晒干样品相比,次丹参酮、丹参新醌乙、丹参新酮Ⅱ和异隐丹参酮具有显著性差异,其在鲜切片晒干样品中的峰面积值(28 469 799±553 917、23 084 728±627 683、451 633±11 633、2 000 566±148 268)分别是传统切片样品(11 504 494±396 042、14 486 140±393 821、295 515±5 838、1 177 546±177 314)中的2.47 倍、1.59 倍、1.53 倍和1.70倍。以上结果说明,鲜切片晒干处理比烘干处理得到更多的丹参酮和丹酚酸类物质。大部分丹参酮和丹酚酸类物质在全干切片样品中丰度最高,高于鲜切晒干片和传统切片样品。有研究指出,丹参整体晒干处理显著优于切段晒干,切段晒干处理下丹参酮等活性成分损失较大[9,12]。干燥是一个复杂的生化过程,在干燥的过程中,植物的生物合成仍在进行,当含水量极低时,生物合成被中止[27]。相对于鲜切加工,干切加工方式下,丹参的完整度高,水分损失慢,可以积累更多的丹参酮和丹酚酸类物质。传统切片中闷润处理易造成丹参酮和丹酚酸类物质的流失[10]。
2.3.3 初生代谢物脂肪酸类、氨基酸类、有机酸类以及核苷类初生代谢物在不同加工方式的丹参样品中具有显著性差异。图4为差异脂肪酸类代谢物的热图。脂肪酸类代谢物在全干切片样品中丰度最高,在传统切片中次之,在鲜切片样品中较低。这是因为脂肪酸类化合物的脂溶性较强,在传统切片的闷润处理中损失较少。
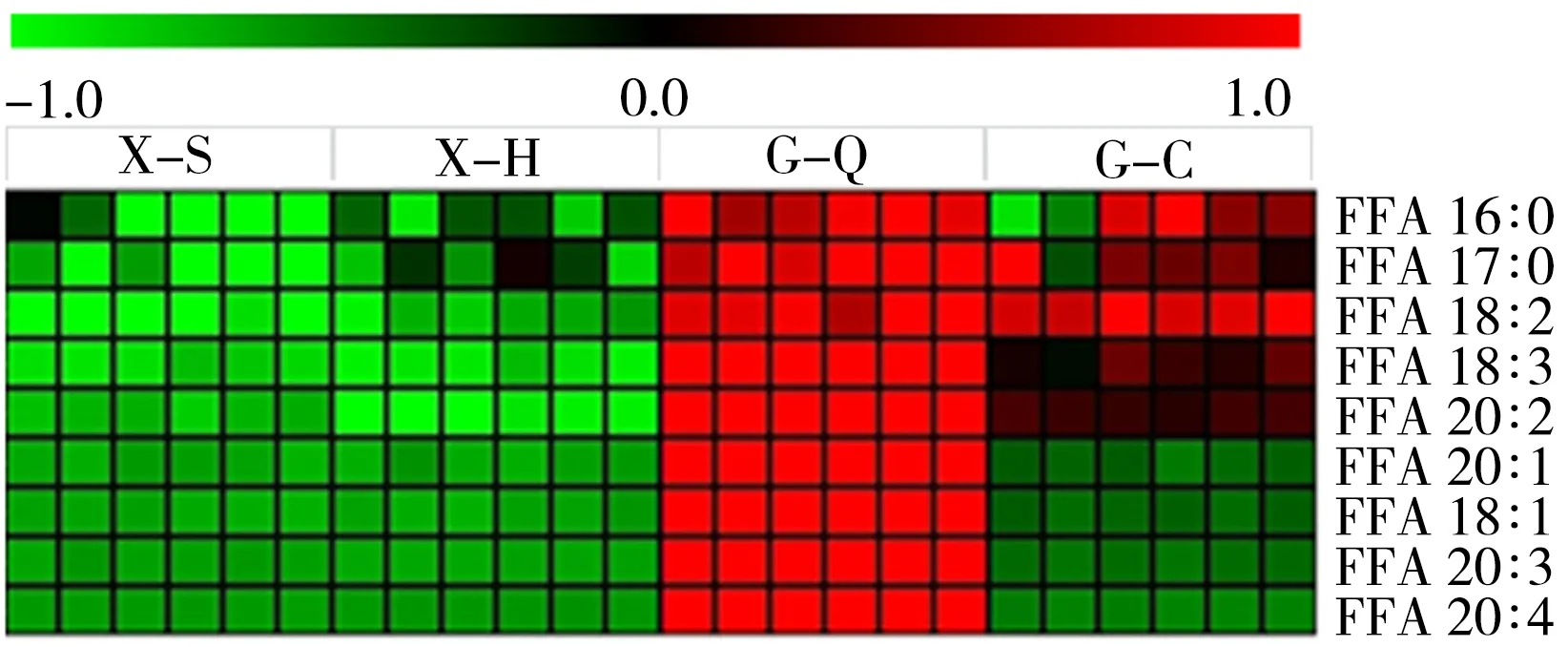
图4 差异脂肪酸类代谢物热图Fig.4 Heat map of differential fatty acids metabolites
鲜切片烘干样品与鲜切片晒干样品相比,脯氨酸、色氨酸、鸟嘌呤有显著性差异,在鲜切片烘干样品中的峰面积值分别是晒干样品的1.51 倍、1.87倍和2.83倍(图5)。全干切片样品与传统切片样品相比,亮氨酸、2-异丙基苹果酸有显著性差异,两者在全干切片样品中的峰面积值分别是传统切片样品的1.62倍和1.63倍。全干切片与鲜切片晒干样品相比,苯丙氨酸、酪氨酸、脯氨酸、色氨酸、谷氨酰胺、2-异丙基苹果酸、鸟嘌呤、腺嘌呤有显著性差异,其在全干切片样品中的峰面积值分别是鲜切片晒干样品的1.71 倍、1.59 倍、3.93 倍、1.61倍、1.64倍、1.82倍、2.80倍和1.57倍。传统切片样品与鲜切片晒干样品相比,脯氨酸、色氨酸、2-异丙基苹果酸、鸟嘌呤、腺嘌呤有显著性差异,其在传统切片样品中的峰面积值是鲜切片晒干样品的5.41 倍、2.20 倍、2.96 倍、2.40 倍和1.71 倍。以上结果说明,氨基酸类成分受加工方式的影响较为显著。全干切片和传统切片中氨基酸的丰度均较高。芳香族氨基酸(如苯丙氨酸、色氨酸、酪氨酸)是次生代谢物合成的前体物质,其在干切样品中丰度较高,与丹酚酸和丹参酮类化合物的趋势一致。
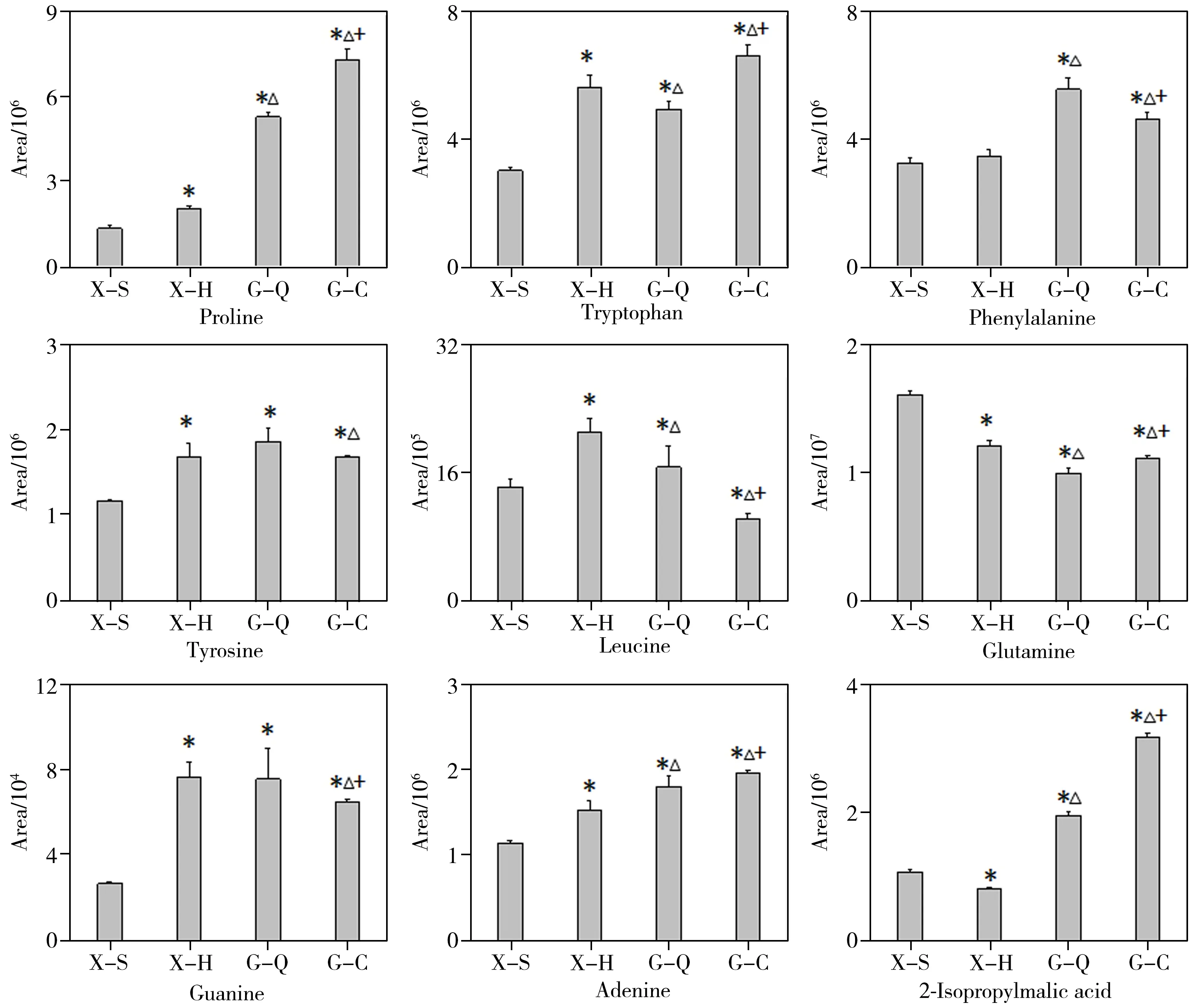
图5 有机酸类、核苷类、氨基酸类成分在不同加工方式丹参样品中的分布图Fig.5 Histograms of organic acids,nucleosides and amino acids in different processing methods of Salvia miltiorrhiza Bge.
3 结 论
本文基于LC-HRMS 对不同加工方式下的丹参切片样品进行初生代谢物和次生代谢物分析,结果发现大部分初生和次生代谢物的丰度在干切法样品中高于鲜切法样品。这可能是由于干切法丹参的完整性好,水分流失慢,代谢活动较活跃,积累了更多的有效成分。全干切片中丹参酮和丹酚酸类成分高于传统切片,品质较好。但在实际量产中也要考虑全干切片在切制时易裂开、成片率低等问题。
