基于超高效液相色谱-四极杆/静电场轨道阱高分辨质谱筛查茶叶中166种农药残留方法研究
2024-01-02方俊兰张丹阳伊岳星刘颖颖柴云峰李祖光陈红平
方俊兰,张丹阳,伊岳星,刘颖颖,柴云峰,李祖光*,陈红平*
(1.中国农业科学院茶叶研究所,浙江 杭州 310008;2.浙江工业大学 化学工程学院,浙江 杭州 310014)
茶叶是世界上仅次于水的消费最广泛的饮料。茶叶中富含茶多酚、氨基酸、黄酮、茶多糖等营养功能性物质,不仅形成了茶叶特色风味品质,而且赋予茶叶降血压、抗菌、预防肿瘤等功效[1-2]。茶树喜温湿环境,易发生病虫草害,不可避免使用化学农药以提高茶叶产量与质量[3-4]。茶叶中化学农药残留问题一直备受关注,包括我国在内的许多国家和地区通过规定茶叶中的最大残留限量(MRLs)[5]对茶叶农药残留进行监测,以避免不合格茶叶产品被消费者饮用。我国国家标准GB 2763.1-2022[6]规定了茶叶中110 种农药的MRLs,欧盟、日本分别规定了508 种、236 种农药的MRLs,并采用“一律标准”规定其他农药的MRLs 为0.01 mg/kg[7-8]。因此,建立茶叶中农药残留的高通量检测与筛查技术是确保茶叶饮用安全与出口安全的基本技术条件。
色谱和质谱结合的方法是茶叶中农药残留检测的通用方法,包括气相色谱-质谱(GC-MS)和液相色谱-质谱(LC-MS)等。目前,气相色谱或液相色谱串联三重四极杆质谱(LC-MS/MS 或GC-MS/MS)由于其高灵敏度和选择性,已广泛用于茶叶中农药的多残留分析[9-10]。三重四极杆串联质谱能够在一次运行中对100 多种目标分析物进行高选择性和高灵敏度的定量和确认,但需对大量化合物的相关参数进行优化且同时监测的化合物数量有上限,不适用于非靶向高通量筛选[11]。高分辨质谱仪(HRMS),包括飞行时间质谱(TOF MS)和四极杆/静电场轨道阱质谱(Orbitrap MS),具有质量范围广、分辨率和质量精度高、分析速度快的优点,可在全扫描模式下采集多组分、多离子信息,实现化合物的非靶向筛选和可追溯性分析[11],因而广泛用于环境、食品等不同基质中农药的高通量检测与筛查[12-13]。
基于液相色谱-高分辨质谱技术检测茶叶中农药残留的研究较多,农药残留检测数量与种类不断扩增,定性定量功能更加完善,并逐渐由靶向筛查过渡到非靶向筛查的新阶段,显著提升了茶叶中农药残留高通量检测水平。卢巧梅[14]建立了茶叶中18 种农药的高效液相色谱-飞行时间质谱(HPLC-TOF MS)检测方法,Zhang 等[15]建立了茶叶中8 种新烟碱类与4 种氟虫腈农药的超高效液相色谱-四极杆/静电场轨道阱高分辨质谱(UHPLC-Q-Exactive Orbitrap MS)检测方法,金莉莉等[16]建立了UHPLC-QExactive Orbitrap MS 测定茶叶中21 种农药的检测方法,张蓉等[17]建立了茶叶中95 种农药的UHPLC-QExactive Orbitrap MS 检测方法,Chen 等[18]建立了茶叶中117 种农药的UHPLC-Q-Exactive Orbitrap MS 检测与筛查方法。上述方法的线性范围、精密度与灵敏度等关键指标可与LC-MS/MS 方法相媲美,但UHPLC-Q-Exactive Orbitrap MS 在定性分析、阳性样品确证等性能上优于LC-MS/MS。
茶叶富含非挥发性化学成分,在电喷雾离子源中会增强或抑制靶标物质离子化,在定量分析中易产生基质效应(ME)[19],成为液相色谱-电喷雾离子源质谱用于农药残留痕量分析的难点。由于加工工艺差异,导致茶叶的基础物质在不同种类茶叶之间存在较大差异,如发酵工艺显著影响茶多酚、茶多糖等特征组分含量,从而呈现出不同茶叶中农药残留电喷雾质谱检测的基质效应差异,然而目前UHPLC-Q-Exactive Orbitrap MS 分析不同茶叶中农药残留的基质效应研究甚少,农药残留高分辨质谱数据库有待进一步完善。本文根据我国新修订的国家标准GB 2763.1-2022[6]规定的茶叶中农药最大残留限量、茶树上已登记农药、国内外茶叶质量安全通报的农药,建立了针对茶叶样品的农药残留高通量筛查与定量分析方法。通过对农药标准物质的分析,建立农药质谱数据库。采用UHPLC-Q-Exactive Orbitrap MS 结合TraceFinder 软件进行筛查分析、方法学验证及基质效应评价,并应用建立的方法分析市场上部分茶叶的农药残留情况。本方法可用于茶叶中农药残留的高通量筛查分析,具有快速、高效的特点,可为化学污染物残留的高通量筛查检测提供参考。
1 实验部分
1.1 仪器与试剂
四极杆/静电场轨道阱高分辨质谱仪(Q-Exactive-Orbitrap HRMS,美国Thermo Fisher 公司);超高效液相色谱仪(Ultimate 3 000 UHPLC,美国Thermo Fisher 公司);多管涡旋混合仪(杭州米欧仪器有限公司);高速冷冻离心机(德国Sigma 公司);Milli-Q 去离子水发生器(美国Millipore 公司)。使用Xcalibur™ 2.2.1版本和TraceFinder 3.3版本(Thermo Fisher Scientific 公司)处理数据。
166 种农药标准品(1 000 mg/L)购自农业农村部环境质量监督检验测试中心(天津);乙腈(HPLC级,上海Sigma-Aldrich贸易有限公司);实验用水由Milli-Q 去离子水发生器(美国Millipore公司)纯化。醋酸钠、无水硫酸镁(分析纯,浙江医药股份有限公司);异丙基乙二胺(PSA)和石墨化炭黑(GCB)(Bonna-Agela Technologies,天津)。样品来源:茶叶样品从流通市场抽取采集,包括绿茶和红茶。
1.2 仪器分析条件
色谱条件:采用Waters Acquity UPLC HSS T3 色谱柱(100 mm × 2.1 mm,1.8 µm),柱温为35 ℃。流动相为含0.1%甲酸和1 mmol/L 甲酸铵的水溶液(A 相)及乙腈(B 相),洗脱程序为:0~5 min,95%~50% A;5~18 min,50%~5% A;18~23.1 min,5%~95% A。流速为0.3 mL/min,进样量为1 µL。
质谱条件:采用可加热电喷雾离子源(HESI);检测模式为正离子模式,电磁频率为50 Hz,喷雾电压为3 kV,毛细管温度为320 ℃,加热电压器温度为300 ℃,鞘气(N2>99%)流速为35 arb,辅助气(N2>99%)流速为12 arb,扫描模式为全扫描(Full MS)以及全扫描/二级扫描(Full MS/dd-MS2)模式,质谱扫描范围为m/z75~750 ,Full MS 与dd-MS2分辨率分别为70 000 与35 000 FWHM(m/z200),阶梯标准化碰撞能量(NCEs)为30、50、70 eV。
1.3 实验步骤
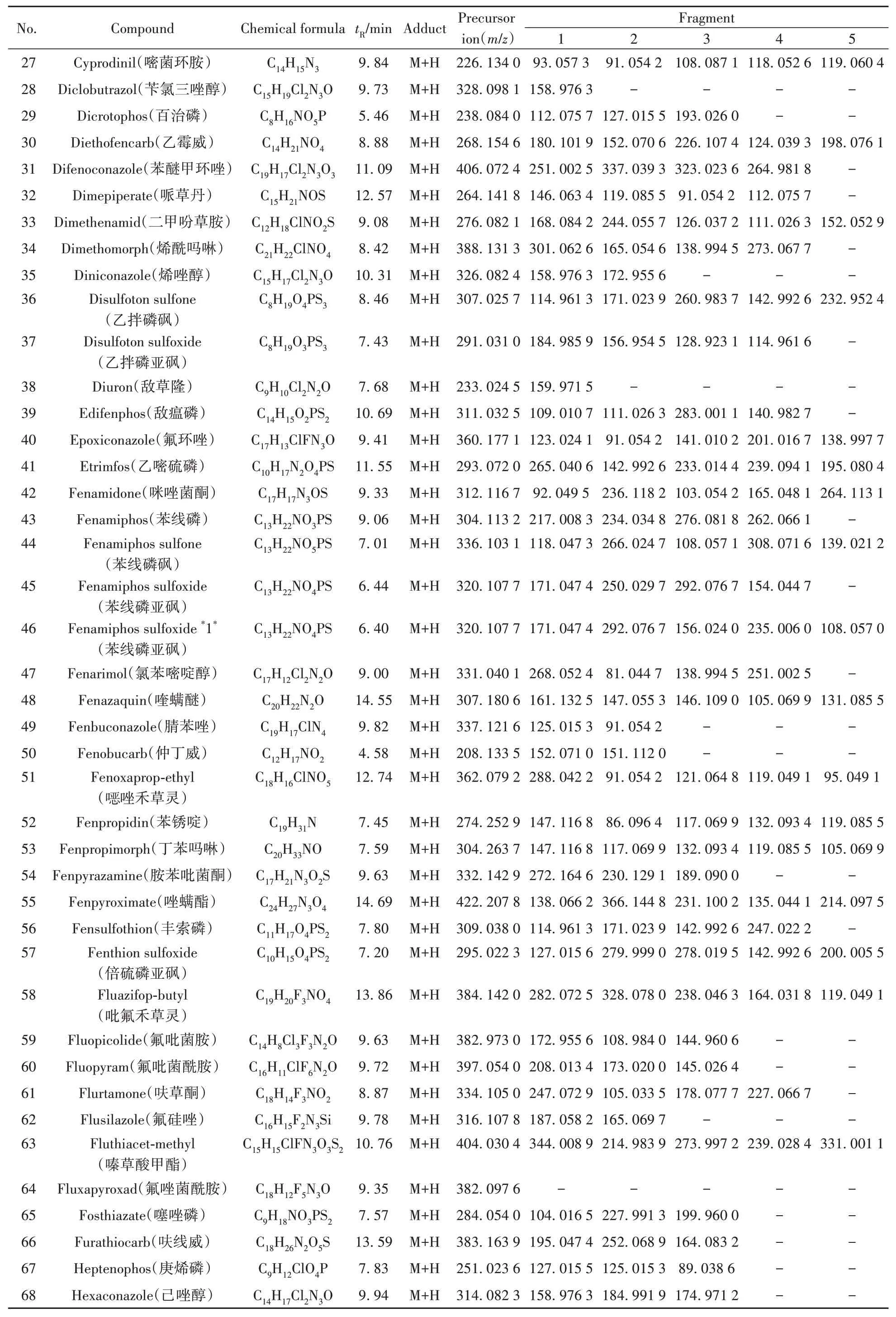
1.3.1 数据库的建立采用UPLC Q-Exactive Orbitrap MS 对200 µg/L 农药的混合标准溶液进行分析,在Full MS 模式下获得精确质量信息。Xcalibur 软件采集质量数和保留时间。将所有农药的名称、分子式、保留时间、精确质量数、碎片离子质量数等信息制作成Excel 表格,导入TraceFinder3.3 软件,建立农药质谱数据库。
1.3.2 样品前处理茶叶样品采用改良QuEChERS 前处理方法。称取研磨后的茶叶试样2 g(精确至0.01 g)于50 mL离心管中,每个离心管中加入5 mL水和10 mL乙腈。超声15 min后加入6 g无水硫酸镁和1.5 g醋酸钠,在10 000 r/min条件下离心5 min。取2 mL上清液加入含有200 mg PSA和50 mg GCB的2 mL离心管中,涡旋1 min,在10 000 r/min条件下离心5 min。最后将上清液过膜转移至进样瓶。
1.3.3 农药化合物的筛查与鉴定净化后的样品在“1.2”条件下进行分析,将数据导入TraceFinder与建立的农药数据库对比。
1.3.4 标准曲线及线性范围测试绿茶和红茶2个品种的空白样品经前处理后得到空白提取液,配制质量浓度分别为2、4、10、20、40、100、200 µg/L的基质标准溶液。以色谱峰面积与对应的质量浓度进行线性回归,考察线性关系并评价基质效应。
1.3.5 方法学验证选取绿茶与红茶空白样品进行回收率实验,分别添加10、20、25、50 µg/kg的混合标准溶液,每个浓度平行5 次,按照“1.3.2”进行前处理后在“1.2”条件下进行仪器分析,并评价该方法的精密度和准确度。
1.4 实际样品筛查检测
选取20份实际茶叶样品(包括14份绿茶、6份红茶),应用本方法进行定性及定量检测。
2 结果与讨论
2.1 高分辨质谱数据信息采集与数据库构建
UHPLC Q-Exactive Orbitrap MS 包含多种监测模式,一般采用Full MS 和Full MS/dd-MS2模式进行定性筛选和定量分析[20]。其中,Full MS/dd-MS2可提供更多的碎片离子信息,有利于目标化合物的鉴定,但会导致单个碎片离子的扫描时间下降,进而使得灵敏度下降[21]。因此采集农药化合物的数据信息时首先选择Full MS模式以获得更高的灵敏度,但在阳性样品确证时采用Full MS/dd-MS2扫描模式。
构建农药化合物数据库是进行高通量筛选的基础,前体离子的精确质量、碎片离子的精确质量和保留时间是数据库中的关键参数。采集农药混合标准品数据,获得总离子流图(如图1)。对于每种农药,将质子化离子([M+H]+)的精确质量数输入Xcalibur Qual Browser,作为特征离子信息。对于确定的前体离子,一般选取至少两个碎片离子的理论质量。开发的质谱数据库见表1,包含166 种农药的名称、化学式、保留时间、前体离子的精确质量、碎片离子的精确质量信息。质量精度是高分辨率质量测量的一个重要参数,SANTE 文件建议m/z>200 的质量精度<5 ppm,m/z<200 的精度<1 mDa[22]。经计算,数据库中所有农药化合物的质量精度均小于5 ppm。将这些信息整合在Microsoft Excel 模板中,然后导入TraceFinder 3.3创建可使用的筛查方法。
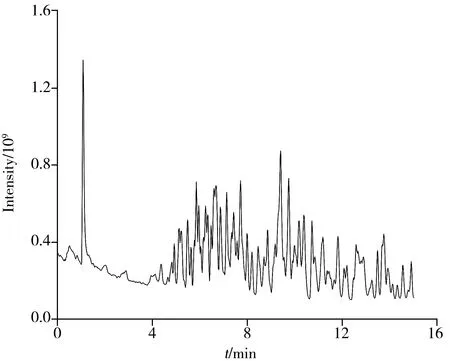
图1 166种农药混合标准溶液(200 µg/L)的总离子流色谱图Fig.1 Total ion chromatogram(TIC) of 166 pesticides in the mixture standard solution at 200 µg/L
2.2 基质效应
选取红茶、绿茶两个茶叶样品,作为空白基质进行前处理净化,获得空白基质提取液。分别使用乙腈和空白基质提取液配制7个质量浓度的混合标准溶液,按照“1.3.3”进行筛查分析,得到溶剂和不同茶叶基质中农药残留的线性方程及相关系数。
(续表1)
通过比较由空白基质配制的标准溶液和乙腈制备的标准溶液得到的标准曲线斜率来评估基质效应(ME)。计算公式为:ME(%)=(基质标准溶液曲线的斜率/溶剂标准溶液曲线的斜率-1)×100。
根据制作工艺的不同茶叶可分为六大类,受遗传、环境和生产加工等因素的影响,不同类型茶叶中基质成分存在明显差异。因此,不同茶叶中农药的基质效应不尽相同[15]。如图2 所示,绿茶和红茶中不同农药的基质效应分别为-56%~63%、-19%~110%。绿茶和红茶基质中分别有79 种农药(48%)和20 种农药(12%)的基质效应介于-20%~20%。根据SANTE/11312/2021[23],ME在±20%的范围内表明基质效应可忽略,可通过溶剂标准曲线进行定量。总体上,红茶比绿茶的基质增强效应更强,表明不同加工方式对茶叶基质效应具有影响。因此本研究采用空白基质溶液定量,以校正基质效应产生的定量偏差。
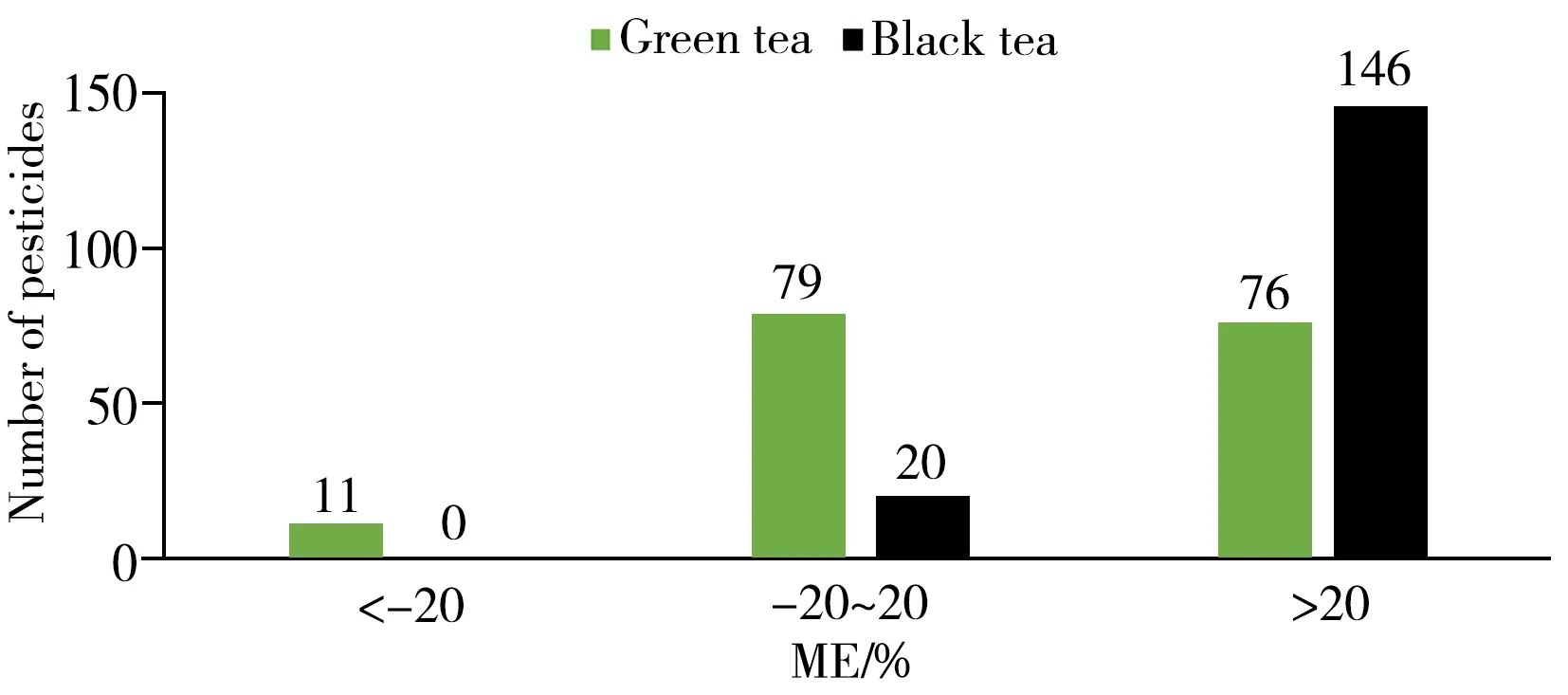
图2 绿茶与红茶中166种农药在不同基质中的基质效应Fig.2 Matrix effects of 166 pesticides in green tea and black tea
2.3 方法验证
按照“1.3.4”方法进行线性关系评价,结果表明,绿茶中氟环唑、乙嘧硫磷、丁苯吗啉、鱼藤酮、噻嗪酮、乙霉威、喹螨醚、仲丁威、苯锈啶、唑螨酯、抗蚜威、烯丙苯噻唑、氟唑环菌胺、虫酰肼和甲基硫菌灵15 种农药在4~200 µg/L 范围内线性良好,其余151 种农药在2~200 µg/L 范围内线性良好;红茶中166种农药在2~200 µg/L范围内线性良好;相关系数(r)均大于0.99。
以绿茶和红茶为基质,按照“1.3.5”方法进行加标回收实验。绿茶样品中151种农药和红茶样品中166 种农药的加标回收率均在70%~130%之间。在绿茶样品中166 种农药的RSD 均小于22%,其中150种(99%)农药的RSD在20%以下;在红茶样品中166种农药的RSD均小于29%,其中144种(87%)农药的RSD 在20%以下。结果表明,该方法的准确度和精密度良好,可用于茶叶中农药残留的筛查。根据线性范围、相关系数及回收率满足70%~130%,且RSD小于20%的要求,可知绿茶中氟环唑、乙嘧硫磷、丁苯吗啉、鱼藤酮4 种农药的定量下限为20 µg/kg,噻嗪酮、乙霉威、喹螨醚、仲丁威、苯锈啶、唑螨酯、抗蚜威、烯丙苯噻唑、氟唑环菌胺、虫酰肼、甲基硫菌灵11 种农药的定量下限为25 µg/kg,其余151种农药的定量下限为10 µg/kg;红茶中166种农药的定量下限均为10 µg/kg。
2.4 实际样品分析
为验证本方法在日常茶叶中农药残留检测的适用性,将其应用于绿茶与红茶样品的实际筛查。对20 份样品(14 份绿茶,6 份红茶)进行分析,有4 份绿茶样品(28%)检出9 种农药,含量为0.001 1~0.137 4 mg/kg;有3 份红茶样品(50%)检出9 种农药,含量为0.001 1~0.233 7 mg/kg,均未超过国家标准最大残留限量。绿茶中吡虫啉的检出率最高(25%),红茶中吡虫啉、啶虫脒、噻嗪酮的检出率均为25%。
高分辨质谱最大的优势在于可获得二级碎片离子以及离子精确质量数,这对于鉴定化合物十分有利。农药化合物的鉴定过程以噻嗪酮为例,其化学式为C16H23N3OS,在电喷雾正离子模式下可获得稳定的[M+H]+加合离子峰,精确质量为m/z306.163 6,根据精确质量数可找出保留时间为13.76 min 的色谱峰(如图3)。在Full MS 模式下标准溶液和实际样品的一级质谱图中均存在精确前体离子,m/z分别为306.163 8 和306.163 6(如图4A、B)。确证农药化合物时采用Full MS/dd-MS2模式以获取更多碎片信息。标准溶液和实际样品在该模式下获得的m/z60~240 前体离子生成的二级谱图如图4C、D 所示,对比可发现噻嗪酮离子的质量精度和丰度与标准溶液中噻嗪酮离子几乎一致。实际样品中存在m/z86.060 2、m/z106.065 4、m/z116.053 1、m/z145.043 3和m/z201.106 0的碎片离子,且其质量误差均小于5×10-6。
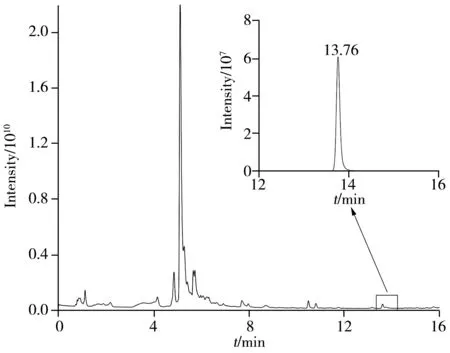
图3 实际样品的总离子流图及噻嗪酮保留时间为13.76 min时的色谱峰Fig.3 Total ion current diagram of a actual sample and the chromatographic peak of buprofezin at retention time of 13.76 min
根据碎片离子信息可对噻嗪酮的裂解方式进行推测(如图5):首先在杂原子S上加合氢离子成为前体离子,然后发生由正电荷引起的i断裂或氢重排。所有碎片离子信息与二级谱图信息对应,可以进一步确证化合物的存在。
3 结 论
本研究基于超高效液相色谱-四极杆/静电场轨道阱高分辨质谱技术,建立了同时测定茶叶中166种农药残留的分析方法。利用农药标准品,构建了166 种农药的分子离子、特征碎片离子以及二级质谱的谱库。目标农药在UHPLC-Q-Exactive Orbitrap MS 的Full Scan 监测模式下,采用分子离子质子化[M+H]+为定量离子,特征碎片离子及二级质谱离子为定性离子。评价了绿茶与红茶进行UHPLC-QExactive Orbitrap MS 分析时的基质效应。方法验证结果表明,本方法准确、可靠,操作简便、快速,可应用于茶叶中农药多残留的检测,也可为其他化学污染物残留的高通量筛查检测提供参考。
