车前草多糖对高脂日粮饲喂小鼠脂代谢和氧化应激的影响
2024-01-02张力凡朱俊义
张力凡,朱俊义
(通化师范学院生命科学学院 吉林省长白山生物种质资源评价及应用重点实验室,吉林 通化 134002)
在动物生产中,日粮能量过剩会造成动物体内脂肪沉积,导致肥胖以及相关疾病的发生,进而降低动物的生产性能。先前的研究已经表明,日粮脂肪摄入是机体脂肪沉积的重要因素,而动物日常饮食中高脂肪日粮摄入增加会导致机体的氧化应激反应[1]。氧化应激会导致疾病的出现,从而对动物的生产性能产生负面作用。近年来,中草药中所含的丰富的多糖、多酚和黄酮等生物活性物质受到越来越多的关注[2]。车前草具有清肝明目、清热解毒和抗菌抗炎等功效。此外,车前草还具有免疫调节和抗氧化作用,其发挥作用的主要成分是多糖、黄酮、萜类和皂苷等活性成分[3]。研究表明,车前草多糖(Plantain polysaccharide,PLP)能够清除体内自由基,降低氧化应激反应,同时能够通过调节Toll样受体通路,提高机体免疫能力[4,5]。关于PLP是否可改善高脂日粮饲喂导致的机体脂代谢异常和氧化应激的研究较少。因此,本试验通过在高脂日粮中添加不同剂量PLP,探究PLP对高脂诱导小鼠的脂代谢和氧化应激的影响。
1 材料与方法
1.1 药物制备 车前草,购自吉林大药房;PLP,由吉林医药学院公共卫生学院动物生理教研室使用水提醇沉法提取、分离制备得到,提取步骤参照李官浩等[6]方法进行,得率1.63%,纯度>97%。
1.2 主要试剂 天冬氨酸氨基转移酶(Aspartate aminotransferase,AST)检测试剂盒、丙氨酸氨基转移酶(Alanine aminotransferase,ALT)检测试剂盒、过氧化氢酶(Catalase,CAT)检测试剂盒、丙二醛(Malondialdehyde,MDA)检测试剂盒、高密度脂蛋白胆固醇(High-density lipoprotein cholesterol,HDL-C)检测试剂盒、超氧化物歧化酶(Superoxide dismutase,SOD)检测试剂盒、低密度脂蛋白胆固醇(Low-density lipoprotein-cholesterol,LDL-C)检测试剂盒、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)检测试剂盒、甘油三酯(Triglycerides,TG)检测试剂盒、总胆固醇(Total cholesterol,TC)检测试剂盒和葡萄糖(Glucose,GLU)检测试剂盒,均购自南京建成生物工程有限公司。
1.3 试验设计与饲养管理 试验所需的150只SPF级雄性健康昆明小鼠由吉林省实验动物中心提供[生产许可证号:SCXK(吉)2021—0001],初始体重为(21.36±1.08) g。试验小鼠在(23±3) ℃,光照黑暗时间为12 h/12 h的环境中适应性饲养1周。将小鼠随机分成5个组,分别为对照(Control,CK)组、高脂日粮(High fat,HF)组、HF+100 mg/(kg·bw)PLP组、HF+200 mg/(kg·bw)PLP组和HF+400 mg/(kg·bw)PLP组,每组30只。CK组小鼠自由采食基础日粮,每天灌胃0.5 mL纯净水;HF组小鼠自由采食高脂日粮,每天灌胃0.5 mL纯净水;HF+PLP组小鼠自由采食高脂日粮,每天灌胃0.5 mL PLP,每2天对各组小鼠进行1次称重,根据小鼠的平均体重配置PLP溶液,连续灌胃4周。每天记录小鼠的采食量和饮水量。试验期间日粮配方设计方案见表1。

表1 日粮配方设计方案Table 1 Diet formula design plan
1.4 样品采集 试验结束前1天,对小鼠进行禁食不禁水12 h,使用戊巴比妥钠腹腔注射麻醉,每组分别选取6只小鼠进行采血,将血液样本于4 ℃、3 000 r/min离心10 min,分离血清,置于4 ℃保存备用。无菌采集小鼠肝脏,置于液氮中迅速冷冻,然后置于-80 ℃保存,用于后续相关指标的测定。
1.5 指标的测定
1.5.1 小鼠血液生化指标的测定 使用检测试剂盒对小鼠血清中ALT和AST活性以及TG、TC、HDL-C和LDL-C含量进行测定,具体操作步骤按照试剂盒说明书进行。GLU采用己糖激酶法进行测定,操作步骤按照试剂盒说明书进行。
1.5.2 小鼠肝脏中TC和TG含量的测定 将小鼠肝脏组织匀浆,4 ℃、3 500 r/min离心15 min,取上清液,按照试剂盒说明书进行操作测定小鼠肝脏中TC和TG含量。
1.5.3 小鼠肝脏抗氧化能力的测定 取小鼠肝脏组织匀浆离心获得的上清液,按照试剂盒说明书操作测定小鼠肝脏中SOD、GSH-Px和CAT活性以及MDA含量,肝脏中活性氧自由基(Reactive oxygen free species,ROS)含量使用荧光染料2′,7′-二氯荧光素二乙酸酯并参考Kumar等[7]方法进行测定,以相对荧光强度反映ROS含量。
1.5.4 小鼠肝脏中抗氧化和脂代谢相关基因表达的检测 将小鼠肝脏在液氮中进行研磨,随后按照试剂盒说明书操作提取小鼠肝脏中总RNA并进行反转录,获得cDNA样品。运用 Primer Premier 5.0软件设计用于实时荧光定量PCR检测的引物,引物序列见表2,由生工生物工程(上海)股份有限公司合成,目标基因 mRNA 的相对表达水平使用2-ΔΔCt方法计算并以β-actin为内参基因进行校正。

表2 引物信息Table 2 Primer information
1.6 数据分析 使用SPSS 21.0软件对数据进行单因素方差分析,数值表示为“平均值±标准偏差”,P<0.05表示差异显著。
2 结果
2.1 PLP对小鼠体重和血液生化指标的影响 由表3可知,与CK组相比,HF组和HF+PLP组小鼠末体重均显著升高(P<0.05),血清中TC、TG、LDL-C 和GLU含量以及ALT和AST活性均显著升高(P<0.05)。与HF组相比,HF+200 mg/(kg·bw)PLP组和HF+400 mg/(kg·bw)PLP组小鼠末体重显著降低(P<0.05),血清中TC、TG、LDL-C和GLU含量以及AST和ALT活性均显著降低(P<0.05),HDL-C含量显著升高(P<0.05);而HF+100 mg/(kg·bw)PLP组小鼠末体重、HDL-C和TG含量以及ALT活性差异不显著(P>0.05)。

表3 车前草多糖对小鼠体重和血液生化指标的影响Table 3 Effects of plantain polysaccharides on body weight and blood biochemical indexes in mice
2.2 PLP对小鼠肝脏中TC和TG含量的影响 由图1可知,与CK组相比,HF组小鼠肝脏中TC和TG含量均显著升高(P<0.05)。与HF组相比,添加不同浓度PLP均可降低小鼠肝脏中TC和TG含量,且该作用呈剂量依赖性,HF+200 mg/(kg·bw)PLP组和HF+400 mg/(kg·bw)PLP组均差异显著(P<0.05)。
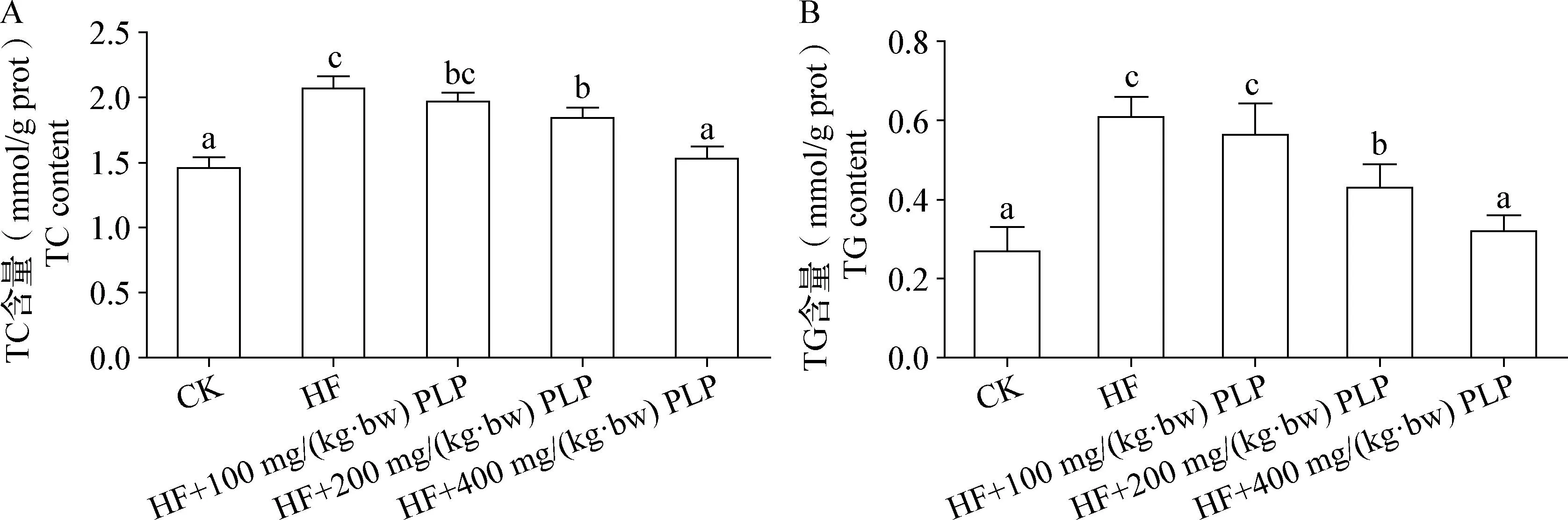
图1 车前草多糖对小鼠肝脏中TC(A)和TG(B)含量的影响Fig.1 Effects of plantain polysaccharides on TC (A) and TG (B) contents in mouse liver不同小写字母表示组间差异显著,P<0.05Different lowercase letters mean significant difference among groups,P<0.05
2.3 PLP对小鼠肝脏氧化应激的影响 由表4可知,与CK组相比,HF组小鼠肝脏中SOD、CAT和GSH-Px活性显著降低(P<0.05),而ROS和MDA含量显著升高(P<0.05)。与HF组相比,添加200 mg/(kg·bw)和400 mg/(kg·bw)PLP显著提高了高脂饮食小鼠肝脏中SOD、CAT和GSH-Px活性(P<0.05),而显著降低了ROS和MDA含量(P<0.05);HF+100 mg/(kg·bw)PLP组小鼠肝脏中ROS含量显著降低(P<0.05),SOD活性显著升高(P<0.05),而CAT和GSH-Px活性以及MDA含量差异不显著(P>0.05)。

表4 车前草多糖对小鼠肝脏氧化应激的影响Table 4 Effects of plantain polysaccharides on oxidative stress in mouse liver
2.4 PLP对小鼠肝脏中抗氧化和脂代谢相关基因表达的影响 如图2所示,与CK组相比,HF组小鼠肝脏中抗氧化相关基因Nrf2和HO-1 mRNA相对表达量显著降低(P<0.05);日粮中添加PLP则显著提高了Nrf2和HO-1 mRNA的相对表达量(P<0.05)。与CK组相比,HF组小鼠肝脏中脂代谢相关基因Lpl和Scd1 mRNA相对表达量显著升高(P<0.05),而Cyp7αl mRNA相对表达量显著降低(P<0.05)。与HF组相比,日粮中添加PLP则显著提高了CyP7αl mRNA相对表达量(P<0.05),显著降低了Lpl和Scd1 mRNA相对表达量(P<0.05)。

图2 车前草多糖对小鼠肝脏中抗氧化和脂代谢相关基因表达的影响Fig.2 Effects of plantain polysaccharides on expressions of antioxidant and lipid metabolism related genes in mouse liverA:Nrf2; B:HO-1; C:Lpl; D:Cyp7αl; E:Scd1
3 讨论
肥胖症被认为是一个重要的健康问题,主要是因为它与危及生命的慢性疾病密切相关[8]。本试验结果显示,HF饮食饲喂的小鼠出现了血糖异常、高脂血症和脂肪肝,这些是代谢综合征的主要参数。而这些由HF饮食引起的小鼠异常病理生理状况通过在日粮中补充PLP得到改善。
临床中常用TC、TG、LDL-C和HDL-C指标来诊断高脂血症,本试验结果表明,HF日粮可引起小鼠高脂血症的发生,这与其他研究的结果一致[9,10];给小鼠饲喂HF饮食可导致小鼠血清中TC、TG和LDL-C含量升高,在小鼠日粮中添加PLP后,小鼠血清中TC、TG和LDL-C含量显著降低,HDL-C含量显著升高,小鼠脂代谢异常得到改善。有研究表明,肥胖引起的小鼠脂代谢异常往往伴随着机体糖代谢异常[11]。Miah等[12]研究表明,HF饮食喂养的大鼠出现了葡萄糖耐受不良。张利娜等[13]研究也指出,给小鼠饲喂高脂饮食后,小鼠GLU显著升高,与本试验结果一致;而日粮中添加PLP降低了HF日粮引起的小鼠GLU升高。研究表明,多糖可通过改善机体胰岛素敏感性、调节糖代谢过程中关键酶α-葡萄糖苷酶的活性和改变肠道菌群等方式改善肥胖引起的机体糖代谢异常[14]。血清中ALT和AST活性增高提示肝脏中线粒体被破坏,细胞膜通透性增加,机体出现肝损伤[15]。本试验结果显示,饲喂小鼠HF日粮会引起小鼠血清中ALT和AST活性以显著升高,而日粮中添加PLP降低了小鼠血清中ALT和AST活性,表明PLP改善了小鼠高脂饮食引起的肝损伤。
肥胖与日粮中脂肪的摄入密切相关,且高脂日粮会增加哺乳动物的氧化应激反应。氧化应激反应增加可导致体内ROS增加,而ROS增多可引起抗氧化酶活性的变化[16]。研究表明,高脂日粮摄入会导致肾脏中的ROS含量和肝脏中的MDA含量显著升高,肾脏中SOD和CAT活性显著降低[17]。陈丽梅等[18]研究发现,高脂饲喂小鼠能够显著提高肝脏中ALT和AST活性,对肝脏功能有一定损伤,此外,该研究还发现,小鼠肝脏中MDA含量显著升高,SOD活性和总抗氧化能力(Total antioxidant capacity,T-AOC)显著降低,这些结果与本试验结果一致,HF饮食显著降低肝脏中SOD、CAT和GSH-Px活性,而显著提高ROS和MDA含量。研究表明,在HF饮食中添加植物多糖能够提高动物体内抗氧化酶(如SOD和CAT等)活性[19,20]。本试验结果也显示,日粮中添加PLP提高了HF饮食导致的小鼠肝脏中SOD、CAT和GSH-Px活性的降低,并降低了ROS和MDA含量。在本试验中,日粮中添加PLP显著上调了HF饮食小鼠肝脏中Nrf2和HO-1的表达,表明PLP可能通过激活Nrf2-HO-1通路和提高抗氧化酶活性来缓解HF饮食导致的氧化应激。
此外,本试验还测定了脂代谢相关基因Lpl、Cyp7αl和Scd1的表达。Cyp7αl是胆汁酸合成经典途径的限速酶,催化胆固醇在肝脏分解为胆汁酸;Scd1是催化肝细胞中饱和脂肪酸转化为单不饱和脂肪酸的限速酶;Lpl是影响乳糜微粒(Chylomicron,CM)和极低密度脂蛋白(Very low density lipoprotein,V-LDL)等脂蛋白代谢的关键因子,Lpl基因表达异常可造成严重的以甘油三酯水平升高为主要特征的高乳糜微粒血症,并出现一系列临床症状[21,22]。研究表明,HF饮食导致小鼠肝脏中Cyp7αl mRNA的表达下调,Lpl和Scd1 mRNA的表达显著上调;而类虫草多糖巨寡糖的添加显著上调HF饮食小鼠肝脏中Cyp7αl mRNA的表达,显著下调了Lpl和Scd1 mRNA的表达[22]。本试验结果与此一致,日粮中添加PLP显著上调HF饮食小鼠肝脏中Cyp7αl基因的表达,显著下调Lpl和Scd1基因的表达,表明PLP可通过调节小鼠肝脏中脂代谢相关基因的表达而改善HF饮食导致的小鼠肝脏脂代谢异常。
综上所述,本试验结果表明,饲喂小鼠HF饮食会引起其脂代谢异常和氧化应激,并导致小鼠高脂血症。而PLP能够改善HF饮食小鼠脂代谢相关指标,提高肝脏中抗氧化酶的活性,并改善HF饮食引起的小鼠氧化应激。
