干酪乳杆菌SY13对小鼠免疫功能和肠道菌群的影响
2024-01-02贾震虎杨云琪王腾宇逄晓阳吕加平
贾震虎,杨云琪,王腾宇,逄晓阳,吕加平
(1.山西师范大学生命科学学院,山西 太原 030000 ; 2. 中国农业科学院农产品加工研究所,北京 海淀 100193)
干酪乳杆菌SY13(LactobacilluscaseiSY13) 属于厚壁菌门乳杆菌属,分离自我国牧区传统发酵乳制品,前期研究表明,SY13作为兼性异型发酵乳酸菌,其活菌制剂能有效提高亚急性衰老小鼠的抗氧化能力,具有一定的延缓衰老作用,并且SY13和低聚糖组成的合生元可调节小鼠肠道内与肥胖和糖尿病代谢相关的嗜黏蛋白阿克曼菌(Akkermansiamuciniphila)的丰度,表明SY13具有潜在的抗氧化、降脂和降糖等功能[1-3]。但是,SY13活菌制剂口服剂量、口服时间和低聚糖种类都可影响其益生功能,相关机制有待深入研究。
研究表明,乳酸菌和特定寡糖益生元可通过调节肠道菌群结构,即增加肠道中有益菌、降低肠道中致病菌以改善肠道菌群失调,并可通过调节机体肠道致炎细胞因子和抗炎细胞因子的平衡,维持免疫稳态,在提高机体免疫的同时避免炎症的发生,从而维护宿主健康[4-6]。因此,本试验拟探究SY13是否可通过调节宿主免疫和肠道菌群来实现益生功能,从而进一步揭示其益生机制。
1 材料与方法
1.1 主要试剂 低聚果糖和乳果糖,均购自上海源叶生物科技有限公司;血清白细胞介素-1β(Interleukin 1β,IL-1β)、IL-2、IL-4、IL-10和分泌型免疫球蛋白A(Secretory immunoglobulin A,sIgA)ELISA检测试剂盒,均购自Sigma公司;TaqMan®Universal PCR Master Mix(4304437),购自美国应用生物系统中国公司;粪便基因组 DNA 提取试剂盒(DP328),购自天根生化科技有限公司。
1.2 主要仪器 多功能酶标仪(SPARK2M):帝肯(上海)贸易有限公司;荧光定量 PCR仪(7500):美国 ABI 公司;TP600型PCR仪:宝生物工程(大连) 有限公司。
1.3 试验菌种和动物 干酪乳杆菌SY13:由中国农业科学院吕加平课题组分离自传统乳制品;实验动物:6周龄SPF级BALB/c雄性小鼠,购自北京维通利华实验动物技术有限公司[生产许可证号:SCXK(京) 2016—0011]。
1.4 试验方法
1.4.1 菌液制备 将稳定期的SY13菌液于6 000 r/min离心10 min,收集菌体,无菌PBS洗涤2次,弃去上清液,用PBS悬浮并调节菌液浓度至109CFU/mL,取部分悬浮菌液,分别加入低聚果糖和乳果糖混匀,使SY13+低聚果糖和SY13+乳果糖的浓度为50 mg/mL,4 ℃保存备用。
1.4.2 试验设计 小鼠饲养于中国农业大学动物医学院实验动物中心,环境温度24 ℃,湿度40%~60%,光照12 h,试验前先用标准饮食饲养7 d以适应环境。随机将48只小鼠分为4个组,分别为无菌PBS组(BP1组)、SY13组(BP2组)、SY13+低聚果糖(15 mg/mL)组(BP3组)和SY13+乳果糖(15 mg/mL)组(BP4组)。每天12:00进行灌胃,灌胃体积为0.3 mL/只,连续灌胃28 d,分别于第1、3、5、7天时,每组取3只小鼠,摘眼球采集全血,分离血清并放入4 ℃冰箱备用;处死小鼠,分别取空肠、回肠、盲肠和结肠内容物,液氮保存备用。
1.4.3 血清sIgA和细胞因子定量检测 取第1、3、5、7天采集的试验各组小鼠血清样本,采用ELISA试剂盒按说明书操作,检测血清sIgA以及血清细胞因子IL-1β、IL-2、IL-4和IL-10的含量。
1.4.4 TaqMan-MGB 探针检测肠道SY13含量 取第1天采集的试验各组小鼠空肠、回肠、盲肠和结肠内容物,使用粪便基因组 DNA 提取试剂盒提取其基因组DNA,用探针Taqman-MGB(FAM-CTCAAAAATGGATCTTG-MGB)进行实时荧光定量PCR,检测SY13含量。反应体系总体积20 μL:上游引物06232F(10 μmol)1 μL、下游引物06232R(10 μmol)1 μL、06232P(10 μmol)1 μL、模板DNA 1 μL、TaqMan®Universal PCR Master Mix 10 μL、灭菌超纯水6 μL。反应条件:50 ℃酶激活2 min;95 ℃预变性10 min;循环阶段,95 ℃变性15 s,58 ℃退火和延伸60 s,共40个循环;荧光检测设定在退火和延伸阶段。
1.4.5 肠道微生物多样性检测 取第1、7天采集的试验各组小鼠盲肠内容物,进行肠道微生物多样性检测,利用PCR方法扩增细菌 16S rRNA 的V3和V4区中338~806 bp区域,上下游引物分别为 338F 5′-ACTCCTACGGGAGGCAGCA-3′,806R 5′-GGACTACHVGGGTWTCTAAT-3′。将PCR产物构建测序文库,由北京奥维森科技有限公司采用 Illumina Miseq平台完成测序,分析小鼠肠道菌群α多样性、Beta多样性和肠道菌群结构[7]。
1.5 统计分析 试验结果以“平均值±标准差”方式表示。采用SPSS 20.0软件对所得数据进行统计分析,P<0.05为差异有统计学意义。
2 结果
2.1 血清sIgA定量检测 结果如表1所示,在第3天时,BP2组小鼠血清sIgA含量显著高于其他各组 (P<0.05);在第7天时,BP1组小鼠血清sIgA含量显著低于其他各组 (P<0.05)。

表1 各组小鼠血清sIgA含量Table 1 Serum sIgA level of mice in each group (pg/mL,n=3)
2.2 血清细胞因子定量检测
2.2.1 IL-1β定量检测 结果如表2所示,在第3天时,BP4组小鼠血清 IL-1β含量显著高于其他各组 (P<0.05)。

表2 各组小鼠血清IL-1β含量Table 2 Serum IL-1β level of mice in each group (pg/mL,n=3)
2.2.2 IL-2定量检测 结果如表3所示,在第1、5天时,BP2组小鼠血清IL-2含量显著高于其他各组(P<0.05);在第7天时,BP2组和BP3组小鼠血清IL-2含量显著低于BP1组和BP4组(P<0.05)。

表3 各组小鼠血清IL-2含量Table 3 Serum IL-2 level of mice in each group (pg/mL,n=3)
2.2.3 IL-4定量检测 结果如表4所示,在第5天时,BP4组小鼠血清 IL-4含量显著高于其他各组 (P<0.05)。

表4 各组小鼠血清IL-4含量Table 4 Serum IL-4 level of mice in each group (pg/mL,n=3)
2.2.4 IL-10定量检测 结果如表5所示,在第3天时,BP2组、BP3组和BP4组小鼠血清 IL-10含量显著高于BP1组 (P<0.05);而在第5天时,BP4组小鼠血清 IL-10含量显著高于其他各组 (P<0.05)。

表5 各组小鼠血清IL-10含量Table 5 Serum IL-10 level of mice in each group (pg/mL,n=3)
2.3 TaqMan-MGB 探针检测小鼠肠道SY13含量 结果如表6所示,BP1组小鼠肠道菌群中未检测到SY13;BP4组小鼠空肠、回肠和盲肠菌群中SY13含量显著高于其他各组 (P<0.05);BP3组和BP4组小鼠结肠菌群中的SY13含量显著高于BP2组(P<0.05)。

表6 各组小鼠肠道菌群中SY13含量Table 6 Content of SY13 in the intestinal flora of mice in each group
2.4 小鼠肠道微生物多样性分析 结果如表7所示,BP1组的Shannon、Ace指数和Chao 1均低于其他各组,表明SY13可以增加小鼠肠道的微生物丰富度。各组检测覆盖率达到约99%,表明当前测序量能够覆盖样本中的绝大部分物种信息,可满足后续生物信息学分析的要求。
2.5 肠道菌群群落组成分析 Beta多样性分析表示不同分组条件下样本之间微生物结构的相似性或差异性。聚类热图基于样本属水平分类,表示不同组间微生物结构的相似性或差异性。结果如图1所示,各组小鼠盲肠菌群有部分聚类的趋势,菌落能明显区分开,但是均以拟杆菌门和厚壁菌门为主,说明各组有一定的同源性和相似性。
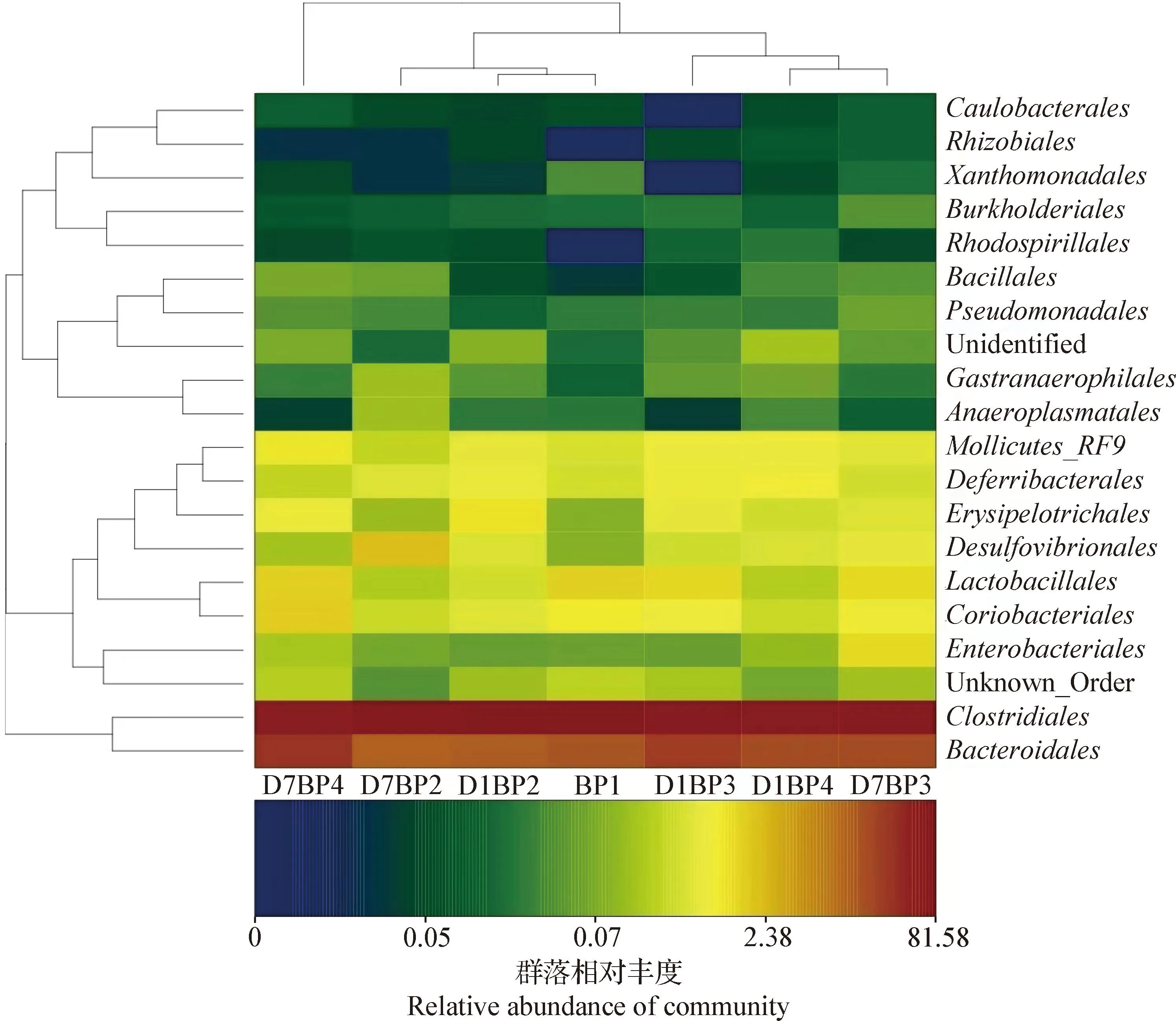
图1 各组间共享属聚类热图Fig.1 Heatmap of shared genus cluster among groupsD1:第1天; D7:第7天D1:Day 1; D7:Day 7
2.6 肠道菌群结构分析
2.6.1 菌群门水平分布 结果如表8所示,在第1、7天时,BP3组和BP4组小鼠盲肠菌群中的拟杆菌门丰度显著高于BP1组(P<0.05);BP1组小鼠盲肠菌群中的变形菌门丰度显著高于其他各组(P<0.05);BP3组小鼠盲肠菌群中厚壁菌门与拟杆菌门的丰度比值低于其他各组。
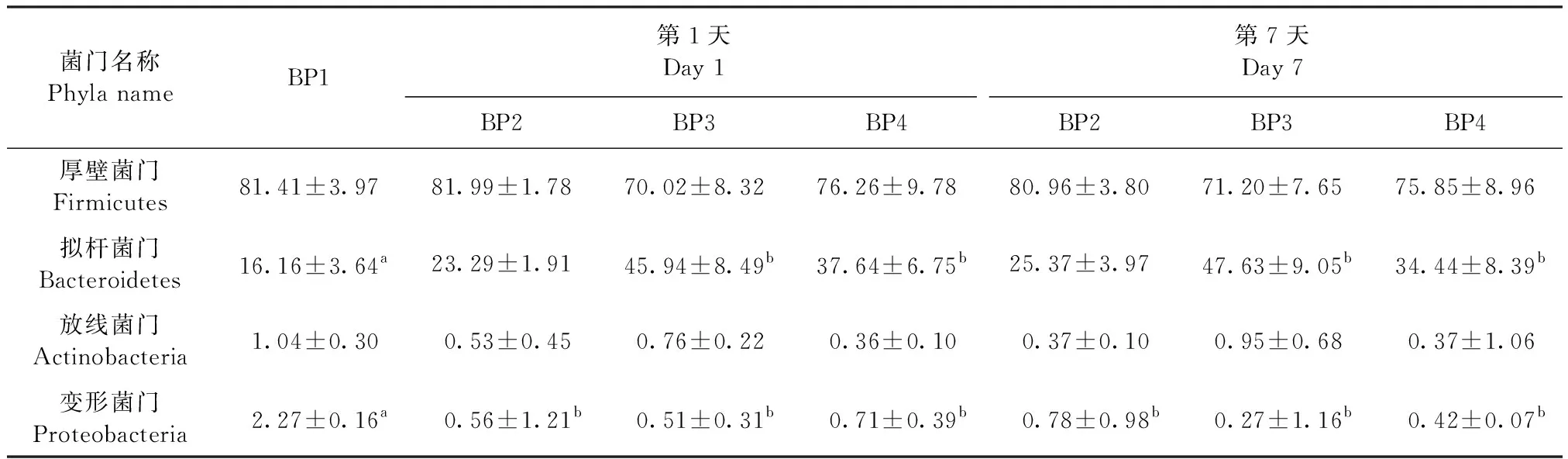
表8 干酪乳杆菌SY13对小鼠盲肠菌群门水平的影响Table 8 Effects of Lactobacillus casei SY13 on the phylum level of cecal flora in mice (%)
2.6.2 菌群属水平分布 结果如表9所示,在第7天时,BP3组和BP4组小鼠盲肠菌群中另枝菌属丰度显著高于BP1组(P<0.05)。
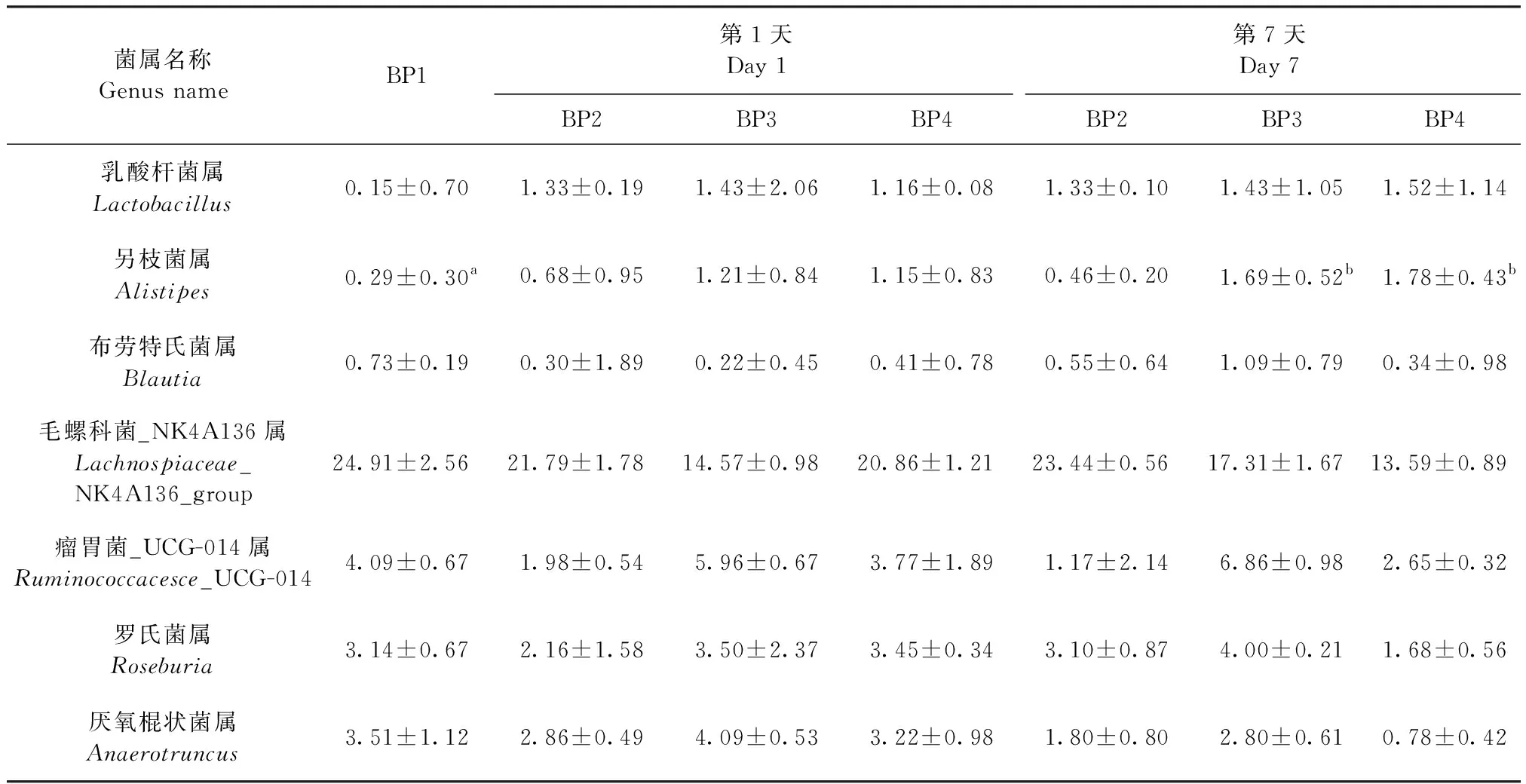
表9 干酪乳杆菌SY13对小鼠盲肠菌群属水平的影响Table 9 Effects of Lactobacillus casei SY13 on the genus level of cecal flora in mice (%)
3 讨论
研究表明,宿主口服益生菌后,益生菌在肠上皮粘附和定植,可对宿主肠道上皮细胞发挥直接作用而调节免疫应答[8]。肠道微生物对益生元糖进行发酵可产生短链脂肪酸(Short-chain fatty acids,SCFAs),SCFAs 受体(G蛋白偶联受体41和43)能结合至肠道相关淋巴组织(Gut-associated lymphoid tissue,GALT) 的免疫细胞,调控Toll样受体2(Toll-like receptor 2,TLR2)或Toll样受体4(Toll-like receptor 4,TLR4)信号通路,调节细胞因子表达,通过调节机体肠道致炎细胞因子和抗炎细胞因子的平衡,维持免疫稳态,在提高机体免疫的同时避免炎症的发生[9,10]。细胞因子根据在炎性反应中的作用不同分为致炎细胞因子(IL-1、IL-2等) 和抗炎细胞因子(IL-4、IL-10等)。本试验中BP2组小鼠血清IL-2含量在第3天时显著升高,而后又逐渐降低,说明SY13前期在宿主肠黏膜肠道微生物定植和占位过程中诱发了炎性反应;第5天时BP4组小鼠血清IL-4和IL-10均显著升高,表明SY13和乳果糖可调节小鼠血清抗炎细胞因子的表达,维持机体肠道致炎细胞因子和抗炎细胞因子的平衡,同时用TaqMan-MGB探针检测到BP4组小鼠空肠、回肠和盲肠菌群中SY13含量显著高于其他各组,表明长时间灌胃可使SY13在小鼠肠道中粘附和定殖,与Grattepanche等[11]和Zhang等[12]描述的益生菌在肠道内的分布是一致的。由于BP4组中给小鼠灌服的是SY13和乳果糖,说明乳果糖不仅有助于SY13在肠道粘附和定殖,并且可被肠道微生物发酵利用,产生的代谢产物可显著调节宿主免疫功能。
研究表明,动物胃肠道内的微生物群中约90%属于厚壁菌门和拟杆菌门,如果厚壁菌门与拟杆菌门比值逐渐增大,机体肠道微生物菌群的构成和多样性将下降,导致胃肠道疾病多发[13],而益生菌能够调控宿主肠道菌群恢复稳定状态[14]。本试验第1、7天时,BP3组和BP4组小鼠盲肠拟杆菌门菌群丰度显著低于其他各组,BP3组小鼠盲肠厚壁菌门与拟杆菌门菌群的丰度比值低于其他各组,表明BP3组(SY13+低聚果糖)小鼠盲肠菌群丰富度增加,可降低宿主疾病感染概率。低聚果糖和乳果糖对于小鼠肠道不同的调节作用,表明不同益生元对益生菌的作用效果存在差异[15]。
肠道菌群物种分布相对丰度大于1%的微生物属,在代谢-免疫关系网络中发挥着重要的调控作用。瘤胃球菌属菌群不仅可降解肠道内碳水化合物,而且与疾病相关[16,17];另枝菌属菌群可以减缓肠道炎症,提高宿主对碳水化合物的利用,增加体内脂肪的降解[18,19]。本试验第7天时,BP3组和BP4组小鼠盲肠另枝菌属菌群丰度显著高于BP1组,表明低聚果糖和乳果糖可加强SY13对宿主代谢的调控,影响宿主肠道菌群和免疫。
本试验结果表明,SY13可通过粘附和定殖肠黏膜调节小鼠免疫应答和肠道菌群,乳果糖不仅有助于SY13在肠道粘附和定殖,并且可被肠道微生物发酵利用,产生的代谢产物可显著调节宿主免疫功能;低聚果糖可增加小鼠盲肠菌群丰富度,降低宿主感染疾病概率,可见不同益生元对益生菌的作用效果存在差异。
