右美托咪啶对异氟烷诱导大鼠PC12细胞线粒体氧化损伤的影响
2024-01-02关佳佳刘萌萌于志勇于权麟王思爽李继文刘焕奇
关佳佳,刘萌萌,于志勇,于权麟,王思爽,李继文,迟 良,刘焕奇
(1. 青岛农业大学动物医学院,山东 青岛 266109 ; 2. 青岛市智慧乡村发展服务中心,山东 青岛 266100)
异氟烷(Isoflurance,ISO)是常用的吸入型挥发麻醉剂,主要用于全身麻醉的诱导和维持,研究显示,异氟烷作用于发育期的脑组织可导致中枢神经系统受损,加剧某些神经退行性疾病的发生和机体的认知功能障碍[1]。活性氧(Reactive oxygen species,ROS)主要在线粒体电子传递链由Ⅲ状态向IV状态转换过程中产生。异氟烷可导致神经细胞产生大量的ROS,引起氧化损伤,导致细胞凋亡和神经功能退化[2]。从神经干细胞的产生到神经元的维持和最终的死亡,线粒体在调节神经通路的稳态中起着关键的作用,过量的ROS作用于线粒体,破坏线粒体结构,导致线粒体膜电位下降触发线粒体凋亡信号通路,引起细胞凋亡[3,4]。因此,猜测异氟烷有可能通过产生过量的ROS诱导细胞氧化损伤来影响线粒体功能,从而引起细胞凋亡。
右美托咪啶(Dexmedetomidine,DEX)是一种α2-肾上腺素受体激动剂,可通过降低去甲肾上腺素的分泌,发挥镇静和镇痛作用。研究发现,右美托咪啶与麻醉药联合使用可改善神经变性和长期认知功能损伤[5]。右美托咪啶具有抗氧化和清除氧自由基的能力,Wang等研究证实,右美托咪啶对利多卡因诱导的大鼠肾上腺嗜铬细胞瘤细胞(Pheochromocytoma-12 cell,PC12细胞)氧化损伤具有保护作用[6]。虽然有研究证明,右美托咪啶与麻醉药合用可以有效降低麻醉药所产生的术后认知功能障碍等相关并发症[7]。然而,右美托咪啶在异氟烷诱发的细胞线粒体氧化损伤中的作用尚不清楚。因此,本试验通过建立异氟烷诱导PC12细胞线粒体氧化损伤模型,探究右美托咪啶是否对异氟烷诱导的线粒体氧化损伤具有保护作用。
1 材料与方法
1.1 主要试剂 DMEM高糖培养基,购自美国Cytiva公司;胎牛血清(Fetal bovin serum, FBS),购自赛默飞世尔科学(美国)科技有限公司;右美托咪啶(Dexmedetomid, DEX)、异氟烷(Isoflurane, ISO)、活性氧(Reactive oxygen species, ROS)、丙二醛(Malondialdehyde, MDA)、过氧化氢酶(Catalase, CAT)、谷胱甘肽过氧化物酶(Glutathione peroxidase, GPX)、超氧化物歧化酶(Superoxide dismutase,SOD)测定试剂盒和线粒体膜电位检测试剂盒(JC-1),均购自索莱宝生物科技有限公司;细胞色素C(Cytochrome C, Cyt-C)检测试剂盒、Fura-2 AM荧光探针和TUNEL检测试剂盒,均购自Abcam 生物有限公司。
1.2 主要仪器 Matrx小动物专用吸入麻醉机,购自美国MIDMARK公司;倒置显微镜,购自美国Scilogex公司;BILON-650Y型超声波细胞破碎仪,购自韦克斯科技(北京)有限公司;超净工作台,购自赛默飞世尔科技有限公司;SPAVK型全波长酶标仪,购自上海帝肯贸易有限公司。
1.3 细胞株和细胞培养 PC12细胞,购自中国科学院细胞型培养库(中国上海),使用含10% FBS的DMEM高糖培养基,37 ℃恒温培养。
1.4 线粒体氧化损伤模型的建立和细胞分组 对照组(Control组)、右美托咪啶处理组(DEX组,25 μg/mL DEX预处理30 min)、异氟烷处理组(ISO组,细胞培养板置于特定的密闭容器中连接麻醉机,持续通入流量为2 L/min的氧气,并通过吸入麻醉药挥发罐给予2% ISO处理,持续作用4 h)以及右美托咪定和异氟烷共同处理组(DEX+ISO组,25 μg/mL DEX预处理30 min后通入2% ISO处理4 h)。本试验所有试验方法均设3组重复,进行数据统计分析。
1.5 试验方法
1.5.1 细胞内ROS检测 PC12细胞于6孔板中培养24 h,加药处理,吸出旧培养液,PBS清洗3次,原位装载DCFH-DA荧光探针,细胞培养箱37 ℃孵育20 min,无血清细胞培养液洗涤3次,荧光显微镜下观察结果。
1.5.2 细胞内MDA、CAT、GPX和SOD检测 PC12细胞于6孔板中培养24 h,加药处理,1.5 mL离心管收集细胞,离心,弃上清,收集沉淀。向沉淀中加入1 mL PBS,清洗3次。加入1 mL PBS重悬细胞,使用超声细胞破碎仪充分破碎细胞。根据MDA、CAT、GPX和SOD 测定试剂盒说明书中的反应体系和步骤操作进行检测。
1.5.3 线粒体膜电位检测 PC12细胞于6孔板中培养24 h,加药处理,吸出旧培养液,PBS清洗3次,加入JC-1 染色工作液,充分混匀,细胞培养箱37 ℃孵育20 min,JC-1染色缓冲液洗涤2次,加入2 mL细胞培养液。通过荧光显微镜进行观察和采集图像,通过荧光的转变分析线粒体膜电位的变化。
1.5.4 Cyt-C检测 PC12细胞于96孔板中培养24 h,加药处理,吸出旧培养液,PBS清洗2次,胰蛋白酶消化收集细胞于1.5 mL离心管中,离心弃上清,使用超声波破碎仪充分破碎细胞,2 500 r/min离心20 min,收集上清。按照Cyt-C检测试剂盒说明书步骤进行操作,以空白孔调零,于450 nm波长依序测量各孔的光密度(Optical density,OD)值。
1.5.5 细胞凋亡检测 PC12细胞于96孔板中培养24 h,加药处理,室温下用含4%多聚甲醛的PBS溶液固定细胞30 min。除去固定液,添加通透剂(含0.2% Triton X-100的PBS溶液)室温孵育30 min,BSA Working Solution洗涤细胞3次。参考TUNEL检测试剂盒说明书配置TdT反应体系,加入50 μL反应混合物,37 ℃孵育60 min,PBS溶液洗涤3次,每次5 min。DAPI复染细胞核10 min,PBS洗涤3次,每次5 min,荧光显微镜下观察结果。
1.5.6 细胞质Ca2+浓度检测 PC12细胞接种至6孔板中培养24 h,加药处理,PBS清洗3次,然后装载 Fura-2 AM荧光分子探针,37 ℃ 孵育30 min,HBSS缓冲液清洗3次,荧光显微镜下观察结果。
1.6 统计学分析 使用GraphPad Prism 7.04软件进行数据统计分析和作图,使用Image J 软件对细胞荧光图片进行定量分析,统计方法采用单因素方差分析,配合Tukey事后检验。试验结果以“平均值±标准差”表示,以P<0.01 表示有极显著性差异,以P<0.05表示有显著性差异,以P>0.05表示无显著性差异。
2 结果
2.1 右美托咪啶对异氟烷诱导PC12细胞氧化应激的影响 氧化应激相关指标检测结果显示,与Control组 (图1A)相比,ISO组(图1C)细胞绿色荧光明显增多,而DEX组(图1B)细胞绿色荧光基本一致,DEX+ISO组(图1D)细胞绿色荧光较ISO组显著减少。荧光定量分析结果显示,与Control组相比,DEX组细胞ROS水平变化不显著(P>0.05),而ISO组细胞ROS水平极显著升高(P<0.01),右美托咪定能够极显著降低ISO引起的ROS水平上调(P<0.01)(图2)。另外,与Control组相比,ISO组MDA(图3A)含量极显著升高(P<0.01),CAT(图3B)、GPX(图3C)和SOD(图3D)酶活性极显著降低(P<0.01),DEX对细胞MDA含量及CAT、GPX和SOD酶活性无显著影响(P>0.05);而与ISO组相比,DEX+ISO组细胞内MDA含量极显著降低(P<0.01),CAT和SOD酶活性极显著升高(P<0.01),GPX酶活性极显著升高(P<0.01)。结果表明,异氟烷可诱发PC12细胞氧化应激损伤,右美托咪啶对异氟烷诱导PC12细胞氧化应激具有保护作用。

图1 右美托咪啶对异氟烷诱导PC12细胞ROS的影响Fig.1 Effect of dexmedetomidine on isoflurane induced ROS in PC12 cellsA:Control组; B:DEX组; C:ISO组; D:DEX+ ISO组A:Control group; B:DEX group; C:ISO group; D:DEX+ISO group

图2 右美托咪啶对异氟烷诱导PC12细胞ROS影响的定量分析Fig.2 Quantitative analysis of the effect of dexmedetomidine on isoflurane induced ROS changes in PC12 cells与对照组比较,*:P<0.05,**:P<0.01; 与ISO组比较,#:P<0.05,##:P<0.01;下同Compared with the Control group,*:P<0.05,**:P<0.01; Compared with the ISO group,#:P<0.05,##:P<0.01.The same as blow
2.2 右美托咪啶对异氟烷诱导PC12细胞线粒体膜电位的影响 与Control组(图4A)相比,DEX组(图4B)细胞绿色荧光基本一致,ISO组(图4C)细胞绿色荧光明显增强;与ISO组相比,DEX+ISO组(图4D)细胞绿色荧光显著减少,红色荧光恢复。荧光定量分析结果显示,与Control组相比,ISO组细胞的线粒体膜电位极显著降低(P<0.01),DEX组无显著变化(P>0.05);而与ISO组相比,DEX+ISO组细胞的线粒体膜电位显著升高(P<0.05)(图5)。结果表明,右美托咪啶可以减轻异氟烷诱导的线粒体膜电位降低。
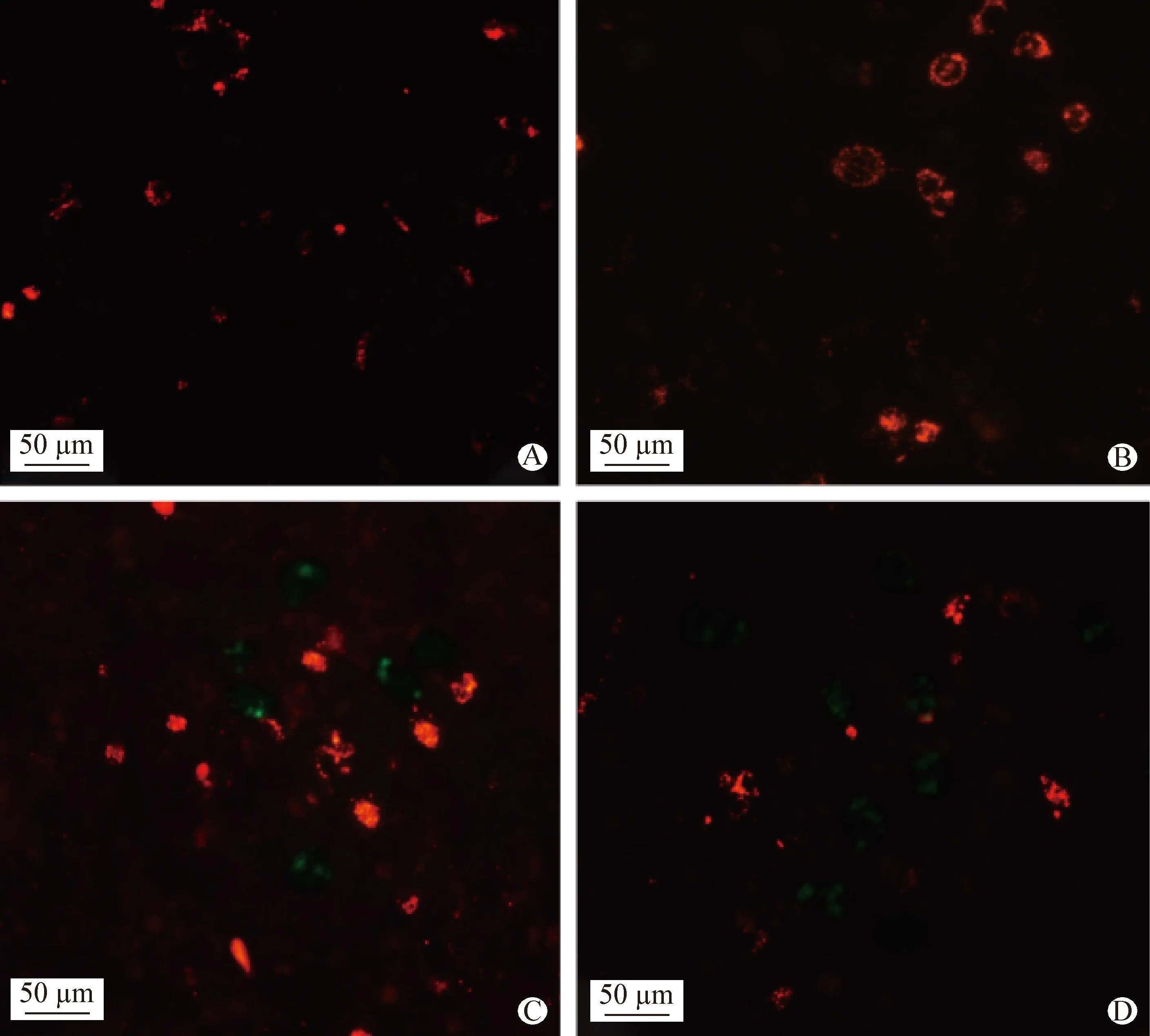
图4 右美托咪啶对异氟烷诱导PC12细胞线粒体膜电位的影响Fig.4 Effect of dexmedetomidine on isoflurane induced mitochondrial membrane potential in PC12 cellsA:Control组; B:DEX组; C:ISO组; D:DEX+ISO组(红色荧光:高膜电位; 绿色荧光:低膜电位)A:Control group; B:DEX group; C:ISO group; D:DEX+ISO group (Red fluorescence:High membrane potential; Green fluorescence:Low membrane potential)

图5 右美托咪啶对异氟烷诱导PC12细胞线粒体膜电位影响的定量分析Fig.5 Quantitative analysis of the effect of dexmedetomidine on isoflurane induced mitochondrial membrane potential in PC12 cells
2.3 右美托咪啶对异氟烷诱导的PC12细胞Cyt-C浓度的影响 与Control组相比,ISO组细胞中Cyt-C浓度极显著升高(P<0.01),DEX组细胞中Cyt-C浓度无显著变化(P>0.05);而与ISO组相比,DEX+ISO组细胞中Cyt-C浓度显著降低(P<0.05)(图6)。结果表明,右美托咪啶可以降低异氟烷导致的Cyt-C浓度升高。

图6 右美托咪啶对异氟烷诱导PC12细胞Cyt-C浓度的影响Fig.6 Effect of dexmedetomidine on isoflurane induced Cyt-C concentration in PC12 cells
2.4 右美托咪啶对异氟烷诱导PC12细胞细胞凋亡的影响 与Control组相比,ISO组细胞绿色荧光显著增多,而DEX组细胞绿色荧光基本不变,提示异氟烷可诱导细胞凋亡;而与ISO组相比,DEX+ISO组细胞绿色荧光显著减少(图7)。荧光定量分析结果显示,与Control组相比,DEX组绿色/蓝色荧光强度比差异不显著(P>0.05),ISO组绿色/蓝色荧光强度比极显著升高(P<0.01);而与ISO组相比,DEX+ISO组绿色/蓝色荧光强度比极显著降低(P<0.01)(图8)。结果表明,右美托咪啶可以抑制异氟烷诱导的凋亡细胞。

图7 右美托咪啶对异氟烷诱导PC12细胞细胞凋亡的影响(100×)Fig.7 Effect of dexmedetomidine on isoflurane induced apoptosis in PC12 cells (100×)
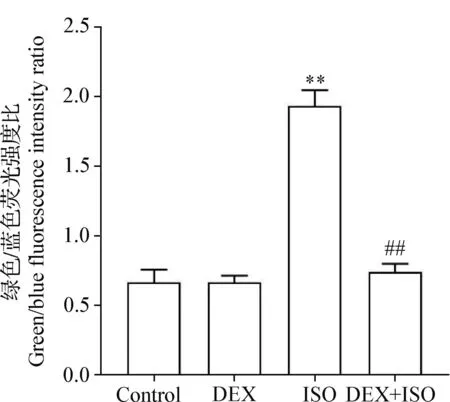
图8 右美托咪啶对异氟烷诱导PC12细胞细胞凋亡影响的定量分析Fig.8 Quantitative analysis of the effect of dexmedetomidine on isoflurane induced apoptosis in PC12 cells
2.5 右美托咪啶对异氟烷诱导的PC12细胞胞质内Ca2+浓度的影响 与Control组(图9A)相比,ISO组(图9C)细胞绿色荧光显著增强,而DEX组(图9B)细胞绿色荧光基本一致;DEX+ISO组(图9D)荧光较ISO组绿色荧光显著减少。荧光定量分析结果显示,与Control组相比,ISO组细胞胞质Ca2+浓度极显著升高(P<0.01),DEX组无显著变化;而与ISO组相比,DEX+ISO组细胞胞质Ca2+浓度显著降低(P<0.05)(图10)。结果表明,右美托咪啶可以降低异氟烷诱导的细胞胞质Ca2+浓度的增加。

图9 右美托咪啶对异氟烷诱导PC12细胞细胞质中Ca2+浓度的影响Fig.9 Effect of dexmedetomidine on isoflurane induced cytoplasmic Ca2+concentration in PC12 cellsA:Control组; B:DEX组; C:ISO组; D:DEX + ISO组A:Control group; B:DEX group; C:ISO group; D:DEX + ISO group

图10 右美托咪啶对异氟烷诱导PC12细胞细胞质中Ca2+浓度影响的定量分析Fig.10 Quantitative analysis of the effect of dexmedetomidine on isoflurane induced cytoplasmic Ca2+ concentration in PC12 cells
3 讨论
研究表明,吸入麻醉剂异氟烷可诱导半胱天冬酶-3(Caspase-3)激活、β-淀粉样肽(Amyloid peptide,Aβ)聚集增加、Tau蛋白磷酸化甚至引起认知功能障碍[8,9]。右美托咪啶主要用于全身麻醉的手术患者气管插管和机械通气时的镇静。研究发现,右美托咪啶与麻醉药合用可以有效降低麻醉药的使用剂量[10]。因此,本试验选取右美托咪啶与异氟烷联合用药,通过建立PC12细胞氧化损伤模型,探究右美托咪啶对异氟烷诱导的线粒体氧化损伤的影响,为临床安全使用异氟烷提供理论支持。
在离体研究中发现,异氟烷可以增加ROS水平,诱导线粒体功能障碍,降低ATP水平,导致认知功能障碍[11-15]。谢玉珍等[16]在评估不同麻醉对颅脑损伤老年患者氧化应激反应的影响时发现,异氟烷能显著降低SOD和GPX的酶活性。本试验结果显示,PC12细胞经2%异氟烷刺激4 h后产生大量的ROS,说明异氟烷可诱导细胞内ROS大量聚集。同时本试验也检测了MDA、CAT、GPX和SOD等氧化应激相关指标,结果发现,ISO可上调PC12细胞MDA含量,降低抗氧化物酶CAT、GPX和SOD的酶活性,说明异氟烷可导致PC12细胞氧化损伤。而添加右美托咪啶后可提高CAT、GPX和SOD的酶活性并减少MDA含量。推断右美托咪啶可以抑制PC12细胞ROS产生或激活抗氧化物酶活化的相关通路,发挥减轻氧化应激的作用,但仍需进一步试验验证。
线粒体跨膜通透性和线粒体膜电位与线粒体膜电位超微结构密切相关[17]。线粒体超微结构发生改变会导致ROS、凋亡相关蛋白Cyt-C、Apaf-1、Caspase-3和Caspase-9等的释放,最终导致细胞凋亡。本试验结果显示,异氟烷处理可降低PC12细胞线粒体膜电位,说明异氟烷能导致线粒体功能紊乱,而添加右美托咪啶能稳定线粒体膜电位,减少异氟烷导致的线粒体功能紊乱。已有研究显示,异氟烷可能通过提高胞质钙水平来诱导细胞凋亡[18]。本试验结果显示,异氟烷处理上调了细胞胞质内的Ca2+、Cyt-C的表达并导致凋亡细胞数目的增加,说明异氟烷造成细胞线粒体功能障碍和细胞凋亡,而添加了右美托咪啶处理后可逆转上述结果。
综上所述,本试验采用PC12细胞作为研究对象,通过检测氧化应激指标,ROS水平、线粒体膜电位、细胞质内Ca2+浓度、促凋亡因子Cyt-C和细胞凋亡,证实右美托咪啶可通过减少ROS释放、稳定线粒体膜电位、降低Ca2+浓度,减少Cyt-C释放和抑制细胞凋亡来减轻异氟烷诱导的线粒体功能障碍。本试验为进一步阐述右美托咪啶对异氟烷诱导的线粒体功能障碍的保护作用机理的相关研究提供数据支持。
