成纤维细胞生长因子2在椎间盘退行性变中的作用及机制
2024-01-02王一范2施强慧钟华建
李 磊 ,王一范2,施强慧,钟华建
1.温州医科大学附属衢州医院(衢州市人民医院)骨科,衢州 324000
2.海军军医大学长征医院健康管理科,上海 200003
3.中国人民解放军63680 部队医院骨科,江阴 214400
4.海军军医大学长征医院骨科,上海 200003
椎间盘是相邻椎体之间的软骨组织,由中央髓核、外围纤维环及上下两端软骨终板构成,在维持脊柱稳定性、缓冲生物应力中发挥重要作用,当椎间盘发生退行性变时,其内在弹性丧失,易在急性应力作用下发生纤维环破裂、髓核突出、椎间高度丢失,导致颈腰痛等临床症状[1]。目前,临床针对椎间盘退行性变(IDD)相关疾病(如颈椎病、腰椎椎间盘突出、椎管狭窄等)的治疗主要包括非手术治疗(功能锻炼、热疗、物理治疗,口服解热镇痛药、局部神经阻滞等)和手术治疗(椎间盘切除融合术、人工椎间盘置换术、椎板切除植骨融合术、椎管扩大椎板成形术等),部分患者症状可获得有效缓解,但易复发[2-3],究其原因是IDD 发生机制尚不明确,现有治疗手段均不能从发生机制着手,无法延缓甚至逆转退行性变进程。
IDD 主要表现为髓核细胞凋亡、细胞外基质(ECM)代谢紊乱(合成减少、分解增加)、炎性反应、神经和血管长入椎间盘等病理过程,其中以ECM代谢紊乱最为重要[4]。椎间盘ECM主要包含蛋白聚糖(主要是糖胺聚糖)和Ⅱ型胶原,椎间盘发生退行性变时,糖胺聚糖和Ⅱ型胶原表达显著减少,导致椎间盘ECM减少、含水量丢失[5]。多项研究[6-7]表明,Wnt/β-catenin信号通路可诱导髓核细胞凋亡及ECM降解,进而加速IDD 进程。成纤维细胞生长因子2(FGF2)对ECM代谢具有重要影响,Meo Burt等[8]在FGF2过表达的小鼠软骨组织中发现Wnt/β-catenin信号通路显著激活,说明FGF2 对该通路具有调控作用,而这种调控作用是否同样存在于椎间盘组织尚未可知。因此,本研究拟探索FGF2在IDD中的功能及对Wnt/β-catenin信号通路活性的影响,旨在为阐明IDD关键致病因子及调控机制提供理论依据。
1 材料与方法
1.1 试剂和仪器
FGF2 抗 体(ab92337)、ACAN 抗 体(ab3778)、MMP3 抗体(ab52915)、ADAMTS-4 抗体(ab185722)均购自Abcam 公司,active β-catenin 抗 体(05-665)购自Millipore 公司,phospho-β-catenin 抗体(2009)、β-catenin 抗体(8480)购自Cell Signaling Technology公司,cleaved-caspase3(ab32042)、BAX(ab32503)、Bcl2(182858)购自Abcam 公司;促炎因子白细胞介素-1β(IL-1β)购自Peprotech公司,FGF2重组蛋白(3718-FB)购自R&D公司,Wnt/β-catenin信号通路抑制剂PRI-724购自Selleck公司;TB Green® Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒(RR820A)及反转录试剂盒(RR047A)购自TaKaRa 公司。GeneAmp 9700 型荧光定量PCR 仪为Applied Biosystems 公 司产品。ELISA 检测试剂盒(ERA4RB)购自Thermo Fisher 公司,干扰RNA 均购自吉玛基因。
1.2 小鼠组织标本获取及处理
6 月龄和24 月龄小鼠各10 只,购自海军军医大学实验动物中心[动物生产许可证号:SCXK(沪)2022-0002]。将6 月龄小鼠椎间盘设定为正常椎间盘,将24 月龄小鼠椎间盘设定为老年退行性变椎间盘。采用CO2吸入法处死小鼠,而后沿背部正中线剪开皮肤及皮下软组织,分离肌肉后离断腰椎部分,剔除腰椎周边肌肉,取出椎间盘组织。部分标本置于4%多聚甲醛中固定24~ 36 h,按常规方法脱钙、石蜡包埋、切片,进行HE 染色、Masson染色和番红固绿染色,评估IDD 情况。对切片进行免疫组织化学染色,观察FGF2 的表达情况。剩余标本冻于液氮中,用于蛋白质印迹法检测FGF2 表达水平。
1.3 髓核细胞培养及处理
根据Risbud 等[9]的方法提取髓核细胞,从140~ 160 g Sprague-Dawley 大鼠[20 只,购自海军军医大学实验动物中心,动物生产许可证号:SCXK(沪)2022-0002)]髓核组织中分离原代髓核细胞,用含10%胎牛血清的DMEM 高糖培养基制备细胞悬液后置于37℃、5% CO2细胞培养箱中静置72 h,观察细胞贴壁情况并更换细胞培养基,之后每3 d更换一次培养基,待细胞生长至约80%汇合时进行传代或冻存,取2~ 4 代的髓核细胞进行实验。①收集大鼠髓核细胞,分别采用0、10、25、50 ng/mL促炎因子IL-1β 刺激诱导细胞退行性变,通过蛋白质印迹法和ELISA 分别检测FGF2 在细胞内表达及分泌至细胞外的含量。②采用0、5、10、50 ng/mL FGF2 重组蛋白刺激正常髓核细胞,采用0、0.5、1.0、5.0 μg/mL FGF2中和抗体干预经25 ng/mL IL-1β预处理的退行性变髓核细胞,采用FGF2 干扰RNA(siFGF2,25 pmol)和阴性对照(siNC,25 pmol)转染经25 ng/mL IL-1β 预处理的退行性变髓核细胞,通过流式细胞术及TUNEL 染色检测髓核细胞凋亡情况,通过蛋白质印迹法检测髓核细胞内凋亡相关蛋白(cleaved-caspase3、BAX、Bcl2)和Wnt/β-catenin信号通路相关蛋白(active β-catenin、β-catenin、磷酸化β-catenin)的表达水平,通过实时荧光定量PCR和蛋白质印迹法检测ECM 代谢相关基因(ACAN、COL2A1、MMP3、MMP13、ADAMTS-4、ADAMTS-5)的表达水平。③采用Wnt/β-catenin 信号通路抑制剂(PRI-724)处理FGF2 重组蛋白刺激后的大鼠髓核细胞,通过流式细胞术和TUNEL 检测髓核细胞凋亡情况,通过蛋白质印迹法检测髓核细胞内凋亡相关蛋白(cleaved-caspase3、BAX、Bcl2)表达水平,通过实时荧光定量PCR 和蛋白质印迹法检测ECM代谢相关基因(ACAN、COL2A1、MMP3、MMP13、ADAMTS-4、ADAMTS-5)的表达水平。
1.4 统计学处理
采用Graphpad 9.0 软件对数据进行统计分析。各组数据采用D’Agostino-Pearson omnibus normality和Shapiro-Wilk normality 检验进行正态性分析,符合正态分布的计量资料以表示,组间比较采用Studentt检验,多组间比较采用单因素方差分析;以P<0.05 为差异有统计学意义。
2 结果
2.1 FGF2在椎间盘退行性变时表达水平上调
小鼠椎间盘组织病理学染色结果显示,相较于6 月龄小鼠,24 月龄小鼠椎间盘内类圆形髓核细胞数目显著减少,分布散在稀疏,ECM 中胶原纤维排列紊乱,蛋白聚糖含量显著降低,符合IDD 组织学变化(图1a)。免疫组织化学检测结果显示,发生退行性变的椎间盘内FGF2 阳性的髓核细胞比例显著高于正常椎间盘(P< 0.05,图1b、c);蛋白质印迹法检测结果显示,发生退行性变的椎间盘内FGF2蛋白含量显著高于正常椎间盘(P< 0.05,图1d)。以上结果从组织学层面说明FGF2 在IDD 时表达增加。

图1 IDD 时FGF2 表达变化Fig.1 Expression of FGF2 during IDD
为进一步验证IDD 对FGF2 表达的影响,收集大鼠髓核细胞,采用不同浓度促炎因子IL-1β 刺激诱导细胞发生退行性变,通过蛋白质印迹法和ELISA 分别检测FGF2 在细胞内表达及分泌至细胞外的含量,结果显示,FGF2在促炎因子IL-1β诱导发生退行性变的髓核细胞内表达及分泌水平显著上调,其峰值出现在IL-1β浓度为25 ng/mL时(图1e、f)。因此,将25 ng/mL 定为IL-1β 最适作用浓度用于后续实验。
2.2 FGF2促进髓核细胞凋亡
流式细胞术、TUNEL 和蛋白质印迹法检测结果显示,FGF2 重组蛋白显著促进正常大鼠髓核细胞凋亡,增加正常大鼠髓核细胞内凋亡相关蛋白(cleaved-caspase3、BAX、Bcl2)表达水平(图2a~ f);采用FGF2 中和抗体或siFGF2 干预IL-1β 预处理的退行性变髓核细胞,细胞凋亡比例及凋亡相关蛋白均显著下调(图2g~ r)。上述结果提示FGF2 能促进髓核细胞凋亡发生。
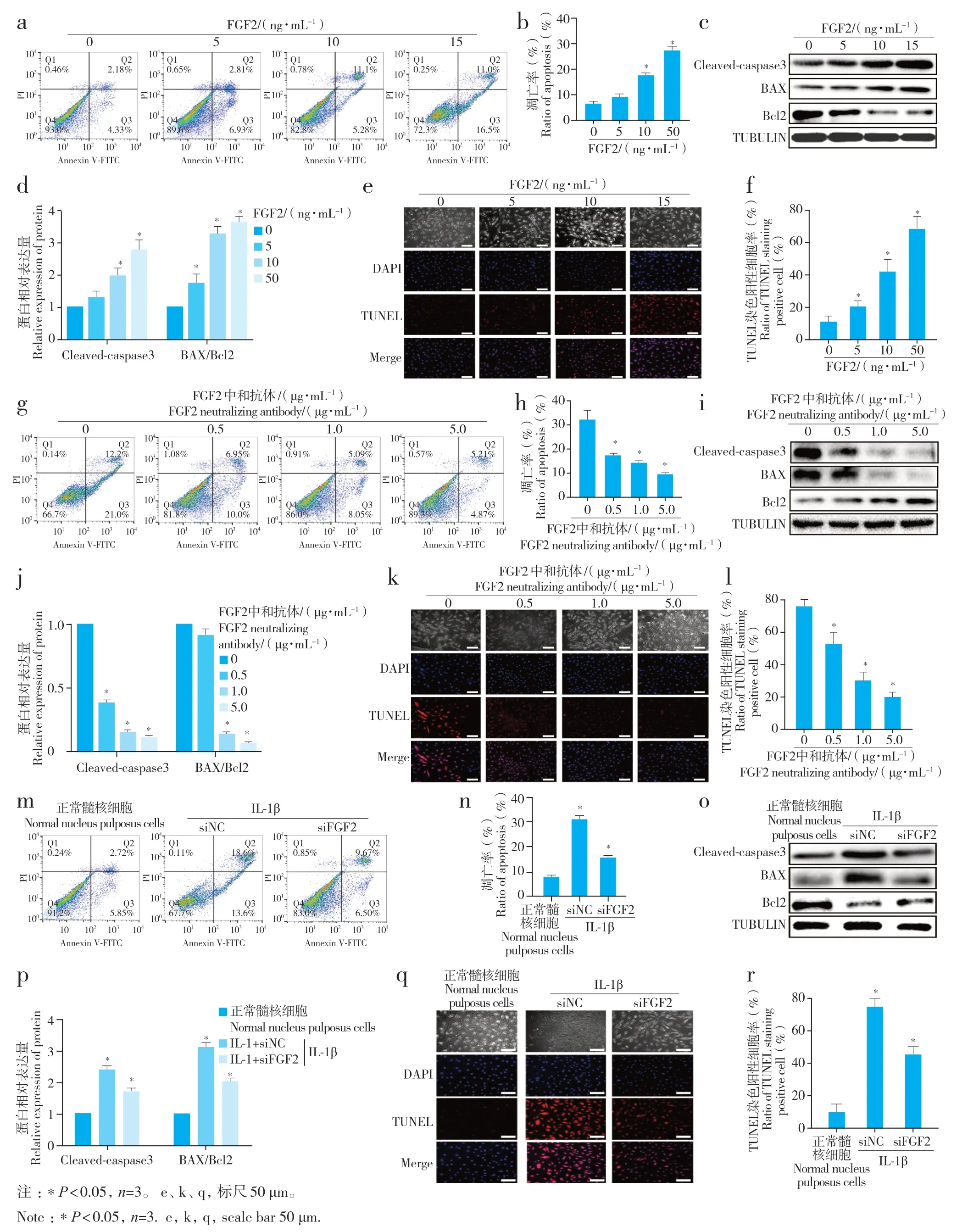
图2 FGF2对大鼠髓核细胞凋亡的影响Fig.2 Effect of FGF2 on nucleus pulposus cell apoptosis
2.3 FGF2促进髓核细胞ECM 代谢紊乱
实时荧光定量PCR 和蛋白质印迹法检测结果显示,FGF2 重组蛋白显著减少正常髓核细胞内ECM 合成相关基因(ACAN、COL2A1)表达,增加ECM 分解相关基因(MMP3、MMP13、ADAMTS-4、ADAMTS-5)表达,而FGF2 中和抗体或siFGF2 对退行性变髓核细胞的作用趋势与之相反(图3)。以上结果说明FGF2 对髓核细胞ECM 代谢具有抑制合成、促进分解的作用。
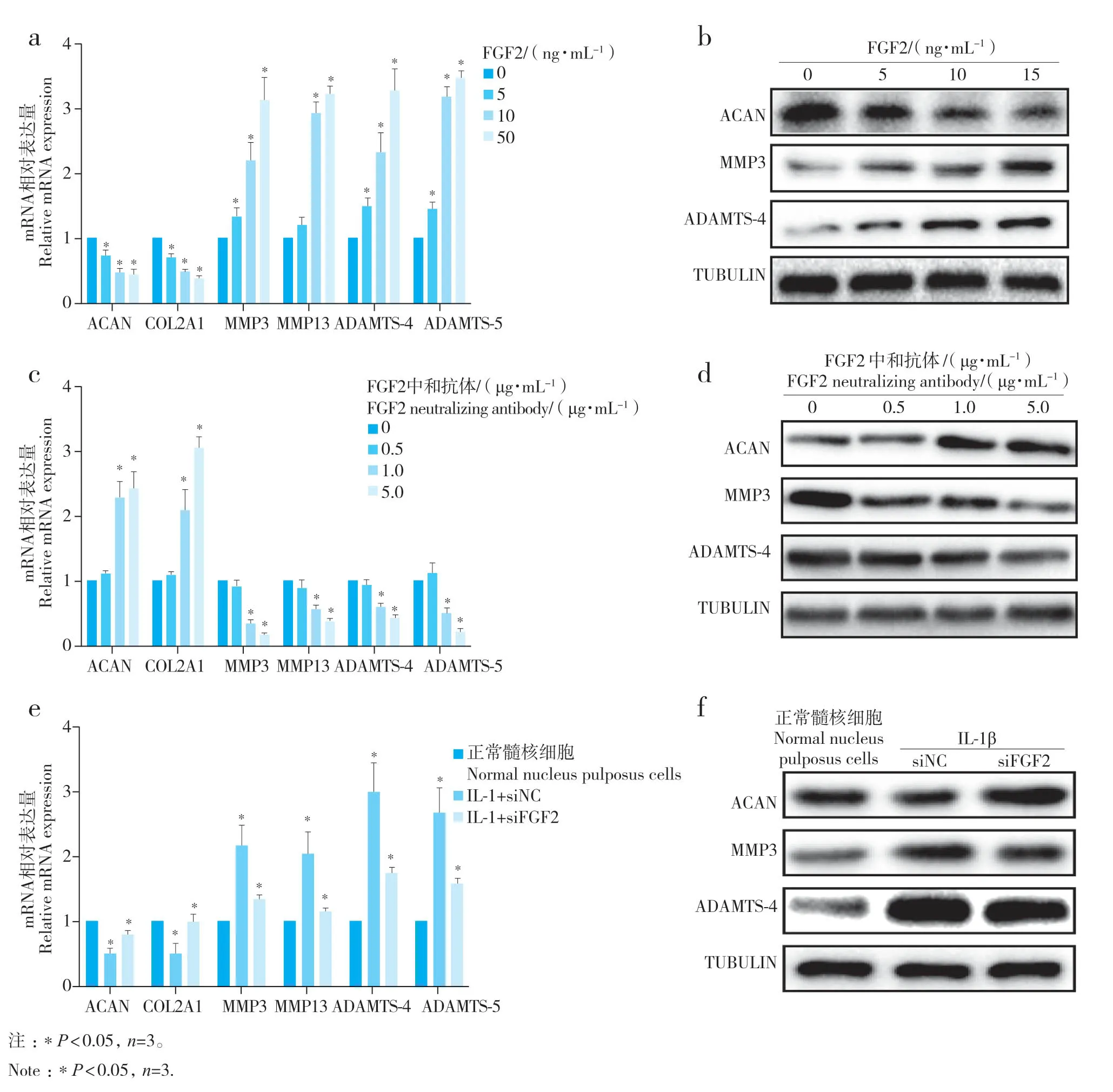
图3 FGF2对大鼠髓核细胞ECM 代谢的影响Fig.3 Effect of FGF2 on ECM metabolism of rat nucleus pulposus cells
2.4 FGF2 通过Wnt/β-catenin 信号通路调控髓核细胞退变
蛋白质印迹法检测结果显示,active β-catenin在FGF2 重组蛋白刺激后表达水平显著升高,而FGF2中和抗体或siFGF2可显著降低IL-1β刺激所上调的active β-catenin 水平;此外,phospho-β-catenin表达趋势与active β-catenin相反,总体β-catenin水平变化不明显(图4a、b)。以上结果说明,Wnt/β-catenin信号通路在IDD 时显著激活,而这种激活作用可能与FGF2表达升高有关。
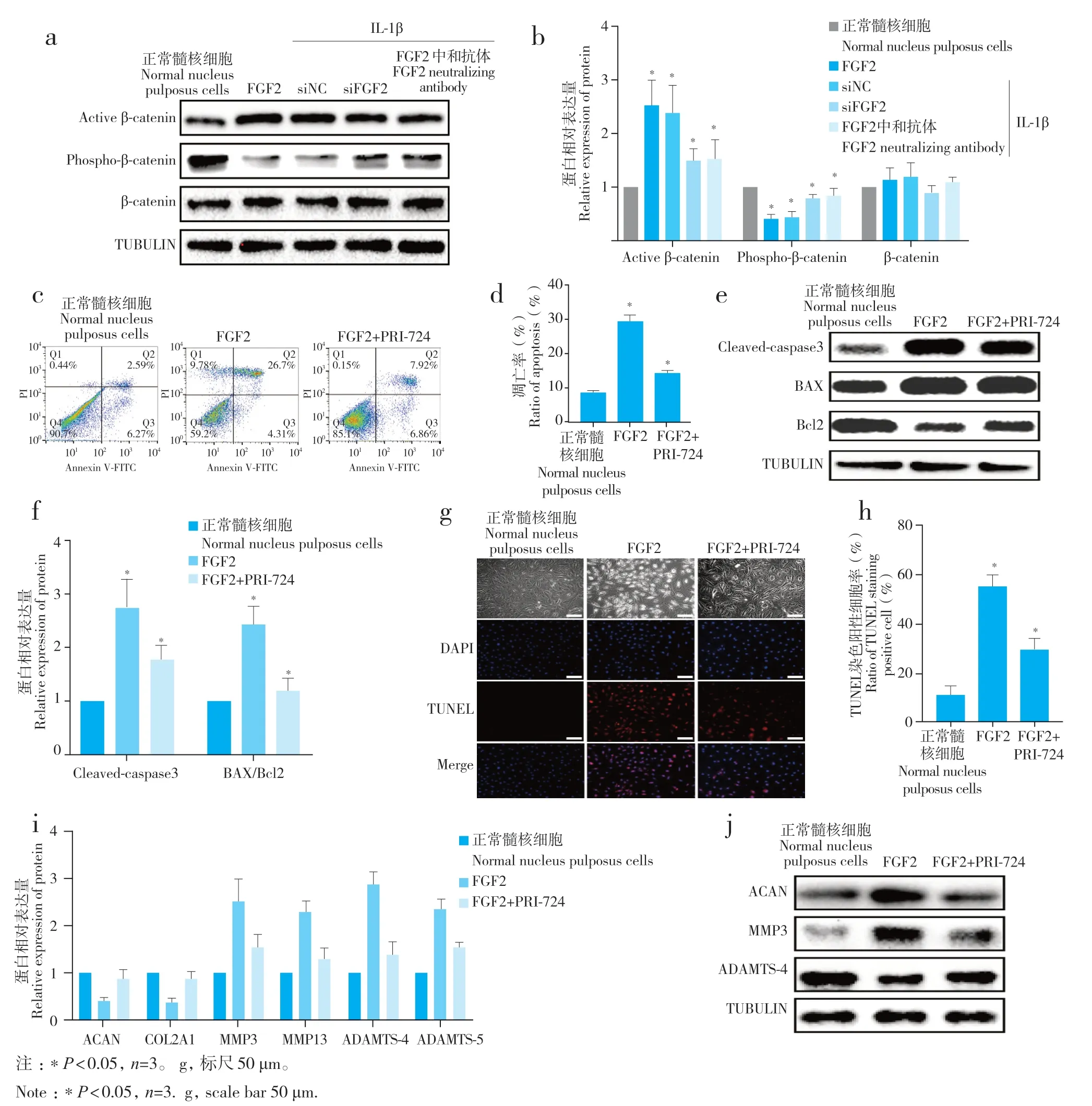
图4 Wnt/β-catenin信号通路在FGF2调控IDD 中的作用Fig.4 Effect of Wnt/β-catenin signaling pathway on FGF2 regulating IDD
为明确Wnt/β-catenin 信号通路在FGF2 调 控IDD 中的作用,在FGF2 重组蛋白刺激髓核细胞基础上添加Wnt/β-catenin 信号通路抑制剂(PRI-724),流式细胞术、TUNEL 染色、蛋白质印迹法及实时荧光定量PCR 检测结果显示,在PRI-724 作用下,FGF2对髓核细胞引发的促凋亡作用减轻,而FGF2导致的髓核细胞ECM合成减少、降解增加等代谢异常也有所恢复(图4c~ j)。以上结果说明Wnt/β-catenin信号通路是介导FGF2调控髓核细胞凋亡和ECM代谢紊乱的重要环节,提示FGF2可能通过Wnt/β-catenin信号通路调控IDD。
3 讨论
本研究基于大鼠原代髓核细胞开展细胞及分子实验,通过促炎因子IL-1β 诱导髓核细胞退行性变构建IDD 细胞模型,结果发现,髓核细胞发生退行性变时FGF2 表达水平显著上调,并且FGF2 能显著促进髓核细胞凋亡,促进ECM 降解代谢、抑制ECM 合成代谢。FGF2 也称碱性成纤维细胞生长因子(bFGF),是FGF家族的重要成员。人类共有22种FGF蛋白,根据分泌形式分为自分泌、旁分泌和内分泌三大类,其中FGF2通过旁分泌形式发挥作用[10]。FGF2 在人体多处组织器官中表达,参与多种疾病的发生、发展。20 世纪90 年代有学者针对FGF2 在IDD 中的作用进行研究。Thompson 等[11]基于犬组织培养的研究发现,FGF2 促进髓核ECM 成分蛋白聚糖合成;Nagano 等[12]报道FGF2促进大鼠髓核细胞增殖,提示FGF2 对椎间盘具有保护作用。然而,部分学者在髓核细胞及关节软骨细胞中发现FGF2抑制ECM 合成代谢,促进分解代谢[13-16],与本研究结果一致。值得注意的是,IDD的病理表现多样,仅评估FGF2 对髓核ECM 代谢影响无法明确FGF2 对IDD 的作用。因此,本研究针对FGF2 调控髓核细胞凋亡及ECM 代谢展开探索,发现FGF2 显著促进髓核细胞凋亡及ECM 降解代谢,抑制ECM 合成代谢,并由此从细胞层面提出FGF2促进IDD。
2018 年,Meo Burt 等[8]构建基因过表达小鼠,发现FGF2 过表达促进小鼠骨关节炎发生,伴随软骨组织中Wnt/β-catenin 信号通路激活;此外,该信号通路抑制剂显著缓解FGF2 过表达诱导的骨关节炎表型,提示FGF2 正向调控Wnt/β-catenin 信号通路,后者在FGF2 影响骨关节炎中发挥关键作用。Wnt/β-catenin 是生物进化中高度保守的信号通路,参与胚胎发育和组织稳态维持。Wnt/β-catenin 信号通路包括细胞膜Wnt 信号转导、细胞质β-catenin 信号稳定及细胞核靶基因转录调控3 部分,当Wnt 未被激活时,细胞质内的β-catenin 蛋白易被支架蛋白Axin、结肠腺瘤息肉易感蛋白(APC)、糖原合成酶激酶3(GSK-3)及酪蛋白激酶1(CK1)组成的蛋白降解复合体磷酸化后降解;而Wnt 激活可抑制β-catenin 蛋白磷酸化,未被磷酸化的β-catenin 蛋白在细胞质中稳定存在,并逐步向细胞核内移位,与转录因子T 细胞因子/淋巴样增强因子结合,调控靶基因转录[17]。Wnt/β-catenin 信号异常与人体多种疾病息息相关,目前认为其对椎间盘的作用主要是通过刺激髓核细胞凋亡,影响ECM 代谢平衡等诱导IDD[7]。此外,Xu 等[18]发现Wnt/β-catenin 信号对终板软骨细胞的退行性变具有促进作用;Hao 等[19]在动物体内发现Wnt/β-catenin 信号抑制可缓解椎间盘发生退行性变表现,延缓退行性变进程;说明Wnt/β-catenin 信号对IDD 具有重要影响。本研究发现,Wnt/β-catenin信号在介导FGF2调控髓核细胞凋亡及ECM 代谢紊乱中发挥重要作用,如前所述,位于细胞膜的Wnt 主要负责细胞内外的信号转导,而FGF2 蛋白作为FGF 家族旁分泌亚类中一员,通常经由细胞膜FGF 受体实现信号转导,Wnt 和FGF 受体是否存在相互关联尚未见文献报道。本课题组将在后续研究中对FGF2 调控髓核细胞及IDD 所涉及的细胞信号转导机制深入探索。
综上所述,本研究通过动物和细胞实验发现,发生IDD 的髓核细胞FGF2 表达水平升高,通过Wnt/β-catenin信号通路诱导髓核细胞凋亡及ECM代谢紊乱,从而加剧IDD进程,揭示了FGF2在椎间盘中的促退行性变作用及调控机制,为阐明IDD 发生机制提供了理论依据。
