用于SARS-CoV-2疫苗免疫后血浆筛选的不同ELISA试剂盒适用性评估
2024-01-02周志军王倩彭焱岳胜兰熊伟纪德铭冯璐李娟李策生胡勇李陶敬
周志军,王倩,彭焱,岳胜兰,熊伟,纪德铭,冯璐,李娟,李策生,胡勇,李陶敬
1.国药集团武汉血液制品有限公司,湖北 武汉 430207;2.中国生物技术股份有限公司,北京 100020;3.成都蓉生药业有限责任公司,四川 成都 610041
COVID-19 是一种由SARS-CoV-2 感染引起的急性传染性疾病[1]。当前国内多款SARS-CoV-2 疫苗已上市,其安全性和有效性已获得大量数据支撑[2-4]。截至2022 年4 月25 日,31 个省(自治区、直辖市)和新疆生产建设兵团累计报告接种SARS-CoV-2 疫苗33 3401.8 万剂次,使采用SARS-CoV-2 疫苗免疫后健康人血浆大规模制备COVID-19 人免疫球蛋白成为可能。目前市场上提供的多为用SARS-CoV-2 中和抗体相关受体结合位点(receptor binding domain,RBD)作为抗原检测血浆中SARS-CoV-2 IgG 抗体的定性试剂盒[5]。国药集团武汉血液制品有限公司(现更名为国药集团武汉生物制药有限公司)是最早进行COVID-19康复期血浆疗法实践和COVID-19人免疫球蛋白制备的单位。COVID-19 疫情早期我们比较了5 家在售试剂盒,选定1 家试剂盒,用自制的内控参考品,建立了SARS-CoV-2 IgG 抗体定量检测的间接ELISA方法[6]。随着SARS-CoV-2疫苗的加强免疫,血浆中SARS-CoV-2 抗体效价逐步提高,因此对于SARS-CoV-2 IgG 高效价血浆,需增加稀释倍数才能使结果在线性范围内。另外,随着体外诊断技术的发展,市场上出现了一批替代细胞水平中和试验的试剂盒[7-12],为更精细研究血浆筛选方法,本研究收集了国内上市的2 个RBD 作为抗原的间接ELISA 法检测试剂盒和2 个原理相同(模拟中和过程)但操作步骤不同的研发中的国产中和抗体检测试剂盒,对现有收浆方案进行比较,从收浆合格率和操作便利性两方面对试剂盒的适用性进行评估[13]。
1 材料与方法
1.1 血浆及标准品 SARS-CoV-2疫苗免疫后血浆均由国药集团武汉血液制品有限公司辖属浆站提供,经过标定的内控标准品B2由该公司自制[13]。
1.2 主要试剂及仪器 新型冠状病毒(2019-nCoV)IgG 抗体检测试剂盒(酶联免疫法)体外诊断试剂(仅供研究及临床试验用,批号:NCOG20210201B、NCOG20210702B,cutoff = 0.19)由北京万泰生物药业股份有限公司(厂家A)提供;新型冠状病毒(2019-nCoV)IgG 抗体检测试剂盒(酶联免疫法)(仅供研究及临床试验用,批号:20200601、20210602,cutoff =0.105)、新型冠状病毒(2019-nCoV)中和抗体检测试剂盒(酶联免疫法)(批号:20210802)由北京华大吉比爱生物技术有限公司(厂家B)提供;新冠病毒中和抗体定量检测试剂盒(批号:ES20210901)由上海捷诺生物科技有限公司(厂家C)提供;酶标仪(型号:SpectroMAX plus384)由美国MD公司提供。
1.3 假病毒中和试验 该方法由中国食品药品检定研究院建立,本实验引进并行方法验证后,用于血浆样品检测[13-14]。
1.4 供筛选单份血浆样品的准备 SARS-CoV-2 IgG抗体检测按照厂家A ELISA-IgG 抗体检测试剂盒说明书进行。用样品稀释液对内控标准品B2[13]在酶标板孔外进行1∶10、1∶20、1∶40、1∶80、1∶160、1∶320、1∶640稀释,孔外稀释为样品在加样前稀释后取100 μL 直接加入包被板孔中,而试剂盒要求样品按照10倍(10 μL 样品+100 μL 样品稀释液)稀释上样,因此样品稀释倍数≥cutoff 的最高孔外稀释倍数/起始稀释倍数。该试剂盒显示B2 的稀释倍数为32,线性范围为1 ~ 32。单份血浆样品首先在孔外进行40 倍稀释,取100 μL 直接上样,计算其稀释倍数(范围覆盖4~128);稀释倍数>64 样品重新在孔外稀释800 倍,取100 μL 直接上样,计算其稀释倍数(范围覆盖80~2 560)。厂家A ELISA-IgG 抗体检测试剂盒按照该稀释方式检测免疫后血浆,进行稀释倍数分档。按照稀释倍数分档制备混合血浆(简称混浆),编号分别为Pp16、32、64、128、200,用于后续试剂盒与中和试验的相关性评估。同时选取稀释倍数> 16(档位代号WT >16)的单份血浆留样共2 857 份,其中稀释倍数16 ~ 32(档位代号WT16 ~32)936 份,稀释倍数32 ~ 64(档位代号WT32 ~ 64)1 081 份,稀释倍数>64(档位代号WT>64)840 份,用于适用性评估。
1.5 不同试剂盒检测 将上述制备的不同档位混浆及B2 按照不同厂家说明书进行检测,将检测结果与假病毒中和试验结果进行相关性分析,计算绝对系数,确定是否可用于免疫后血浆的筛选。
1.6 不同试剂盒筛选单份血浆及制备不同档位混浆
1.6.1 厂家C 中和抗体定量检测试剂盒检测WT >16 的血浆 具体操作按照试剂盒说明书进行,以试剂盒附带的标准品绘制标准曲线,按照不同效价分档制备混浆。共进行2 轮血浆筛选和混浆制备,第1轮覆盖WT>16的血浆所有范围,样品稀释5倍后上样;第2轮根据第1轮结果缩小范围至WT16~64,此为与厂家A ELISA-IgG 抗体检测试剂盒产生主要差异的稀释倍数范围,样品原倍上样。第1轮混浆编号为JN<50、50~100、100~250、250~500、500~1 000、1 000~2 000、>2 000;第2 轮混浆编号为JNY<50,50~100,100~250,>250。
1.6.2 厂家B 中和抗体检测试剂盒检测WT16 ~ 64的血浆 具体操作按照试剂盒说明书进行,以试剂盒附带的标准品绘制标准曲线,按照不同效价分档制备混浆。混浆编号为GN<50、50~100、100~200、200~400、400~1 000、>1 000。
1.6.3 厂家B ELISA-IgG 抗体检测试剂盒检测WT>16 的血浆 具体操作按照试剂盒说明书进行,以B2为标准品绘制标准曲线,用样品稀释液对B2 在酶标板孔外进行1∶10、1∶20、1∶40、1∶80、1∶160、1∶320、1∶640稀释,孔外稀释为样品在加样前稀释后取100 μL 直接加至包被板孔中,而试剂盒要求样品按照10倍(10 μL 样品+100 μL 样品稀释液)稀释上样,因此样品稀释倍数≥ccutoff 的最高孔外稀释倍数/起始稀释倍数。该试剂盒显示B2 稀释倍数为8,按照不同稀释倍数分档制备混浆。混浆编号为GB<4、4~8、>8。
1.7 不同厂家分档混浆的假病毒中和抗体检测及收浆合格率计算 将3 种试剂盒筛选后制备的混浆进行假病毒中和试验,根据检测结果确定收浆标准,再根据收浆标准对应的试剂盒效价档位计算收浆合格率;3种试剂盒检测结果不一致样品再次混合后进行中和试验,对收浆合格率排序重新确认。
1.8 不同厂家按照收浆标准的操作便利性评估 按照收浆标准判断单份血浆的稀释倍数,综合考虑操作步骤及时间,给出便利性排序。
1.9 数据采集及分析 采用Softmax 5.2软件计算血浆样品效价,EXCELL 软件采集数据,GraphPad Prism 9.0软件分析相关性。
2 结果
2.1 不同厂家试剂盒与假病毒中和试验的相关性4 种试剂盒检测结果与假病毒中和试验检测结果均具有相关性(P<0.05),均能用于免疫后血浆筛选,相关性强度排序为:厂家B 中和抗体检测试剂盒> 厂家A ELISA-IgG 抗体检测试剂盒>厂家B ELISA-IgG抗体检测试剂盒> 厂家C 中和抗体定量检测试剂盒。见表1和表2。
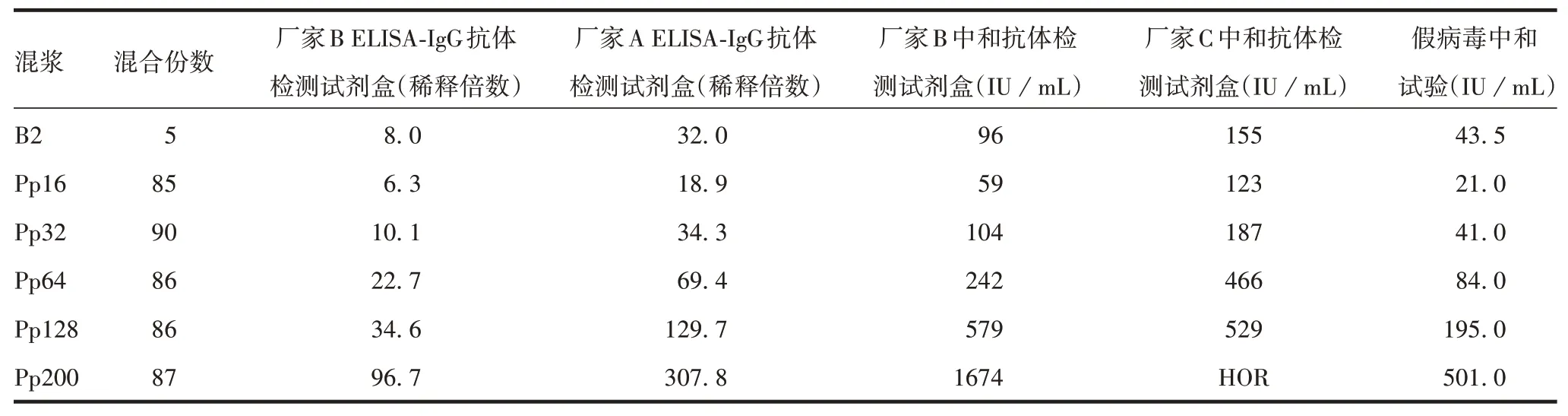
表1 B2及分档混浆不同试剂盒及假病毒中和试验检测结果Tab.1 Results of different kits and pseudovirus neutralization tests for detection of B2 and graded pooled plasma
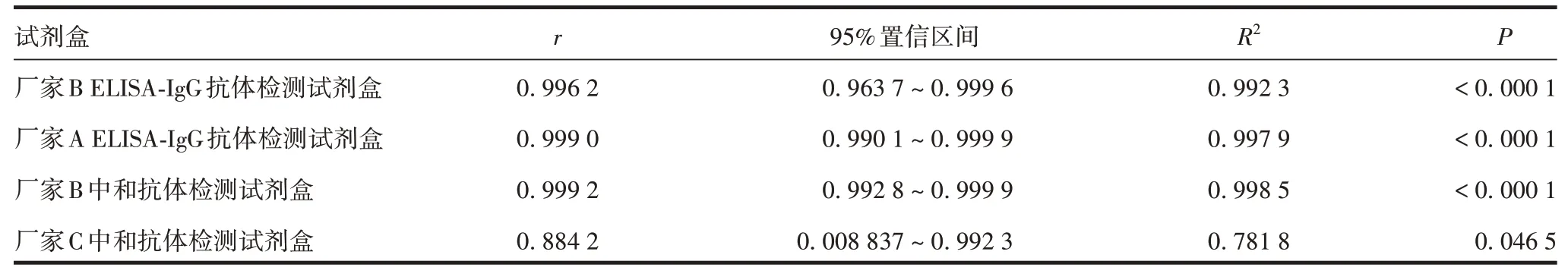
表2 4种试剂盒检测结果与假病毒中和试验检测结果的相关性分析Tab.2 Correlation analysis between detection results of four kits and pseudovirus neutralization test results
2.2 WT > 16 血浆厂家C 中和抗体检测试剂盒检测结果 如以假病毒中和效价50 U/mL 为收浆标准,第1 轮混浆JN ≥100 满足要求,即按照JN100 为标准筛选血浆能保证混浆的假病毒中和抗体水平>50 U/mL。则在826份WT>32的血浆中,厂家C 的收浆合格率为92.5%[1 -(56 + 6)/826],略低于厂家A 的ELISA-IgG 抗体检测试剂盒的收浆合格率(100%,此轮选取的样品均为厂家A 的合格血浆样品),主要差异在WT32~64 的血浆中(41/380),而在WT>64的血浆中差异不大,因此第2轮样品调整为WT16 ~ 64,以进行进一步分析。见表3。第2 轮混浆如以JN100 为收浆标准,则在536 份WT16~64的血浆中,厂家C 的收浆合格率为42.5%[(102 +125)/536],低于厂家A ELISA-IgG 抗体检测试剂盒的收浆合格率(50.2%,269/536)。同时发现,厂家C和A在WT16~32的血浆中检测结果一致率为70%[1 -(45 + 35)/267],在WT32 ~ 64 的血浆中一致率为54.6%[(57 + 90)/269],表明该中和抗体试剂盒与现用ELISA-IgG 抗体检测试剂盒在抗体谱上存在较大差异。见表4。
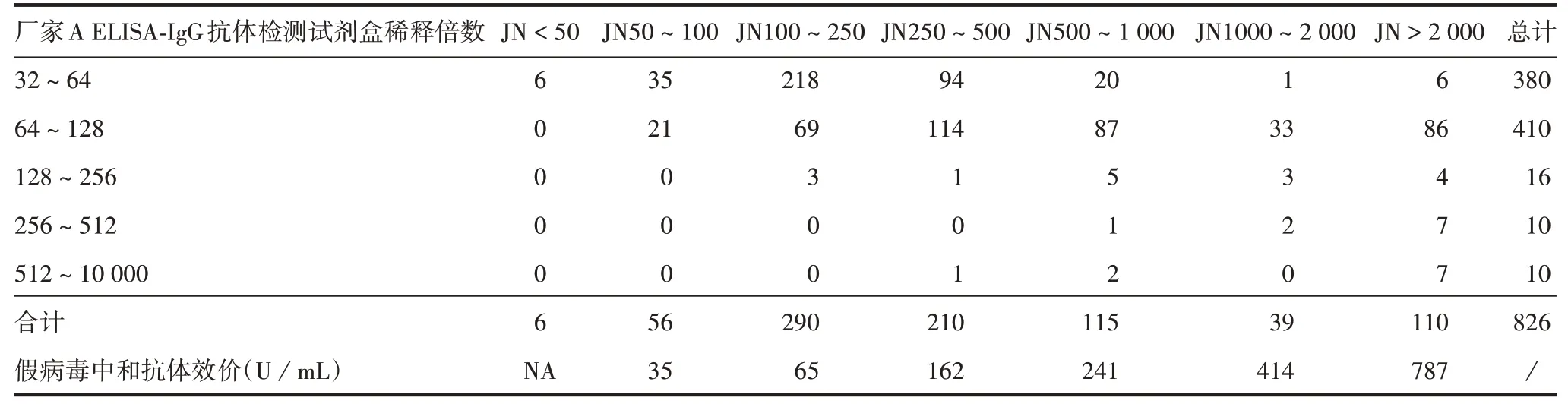
表3 厂家C中和抗体定量检测试剂盒第1轮血浆筛选结果(份)Tab.3 Results of the 1st round of plasma screening by neutralizing antibody kit of manufacture C(copies)
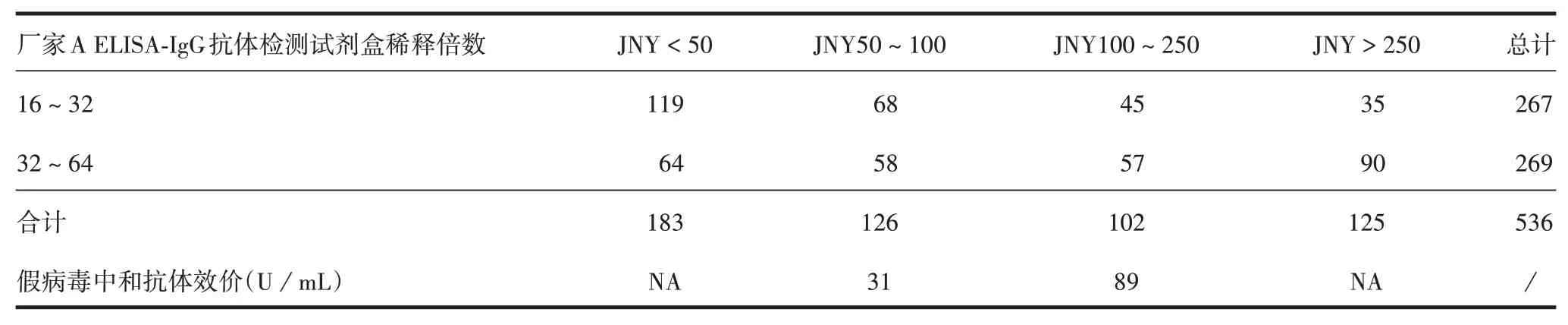
表4 厂家C中和抗体定量检测试剂盒第2轮血浆筛选结果(份)Tab.4 Results of the 2nd round of plasma screening by neutralizing antibody kit of manufacture C(copies)
2.3 WT16~64血浆厂家B中和抗体检测试剂盒检测结果 如以假病毒中和抗体50 U/mL 为收浆标准,混浆GN ≥50 满足要求,即按照GN50 为标准筛选血浆能保证混浆的假病中和抗体水平>50 U/mL。则在387 份WT16~64 的血浆中,厂家B 中和抗体检测试剂盒收浆合格率为66.4%(1 - 130/387),高于厂家A ELISA-IgG 抗体检测试剂盒的收浆合格率(42.1%,163/387)。同时厂家B中和抗体检测试剂盒与厂家A ELISA-IgG 抗体检测试剂盒在WT16 ~32 的血浆中检测结果一致率为58.0%(130/224),在WT32~64 的血浆中一致率为100%,表明该中和抗体检测试剂盒能提高现用厂家A ELISA-IgG 抗体检测试剂盒在WT16 ~ 32 的血浆的收浆合格率。见表5。
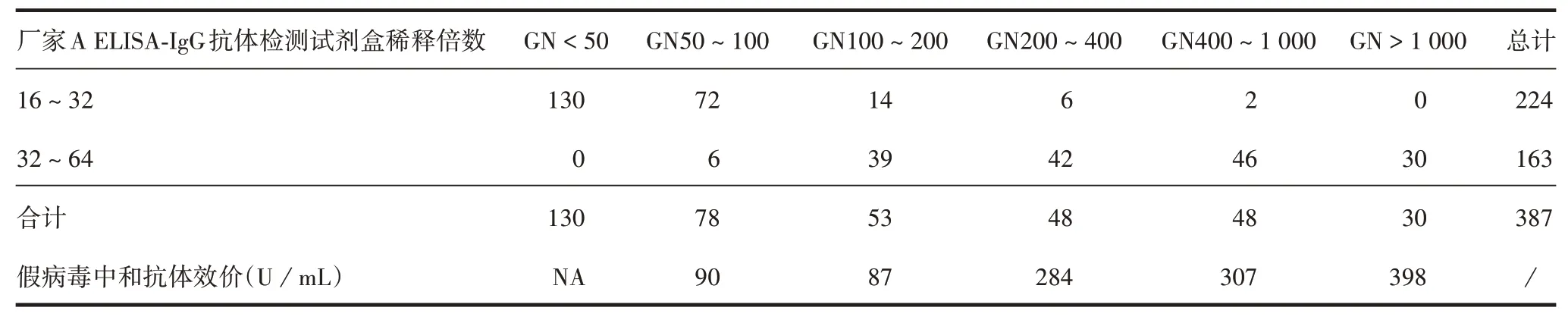
表5 厂家B中和抗体检测试剂盒血浆筛选结果(份)Tab.5 Results of plasma screening by neutralizing antibody kit of manufacture B(copies)
2.4 WT16 ~ 64 血浆厂家B ELISA-IgG 抗体检测试剂盒检测结果 B2 在厂家B ELISA-IgG 抗体检测试剂盒检测稀释倍数为8,假病毒中和抗体效价为43.5 U/mL。若以B2作为收浆标准,即以GB8为标准,厂家B 的ELISA-IgG 抗体检测试剂盒在WT16 ~32的血浆中收浆合格率为70.8%(315/445),在WT32~64的血浆中收浆合格率为82.9%(223/269),在WT >64 的血浆中收浆合格率为94.4%(372/394),在共1 108份WT>16的血浆中收浆合格率为82.1%(910/1108),高于厂家A ELISA-IgG 抗体检测试剂盒的收浆合格率[59.8%(1-445/1 108)]。厂家B 与A ELISA-IgG抗体检测试剂盒在WT16~32的血浆中检测结果一致率为29.2%(1 - 315/445),在WT32 ~64的血浆中一致率为82.9%(223/269),在WT>64的血浆中一致率为94.4%(372/394)。见表6。将厂家B ELISA-IgG 抗体检测试剂盒筛选合格(GB>8),其他3 种试剂盒筛选不合格的血浆(JNY < 50、WT32 ~ 64 共50 份;JNY < 50、WT16 ~ 32 共74 份;GN < 50、WT16 ~ 32 共82 份)重新混浆进行中和抗体检测,中和抗体效价分别为79、58、61 U/mL,均>50 U/mL,表明厂家B ELISA-IgG 抗体检测试剂盒能减少现用厂家A ELISA-IgG 抗体检测试剂盒及厂家B 和C 中和抗体检测试剂盒在WT16 ~ 64 的漏检率。收浆合格率排序为:厂家B ELISA-IgG 抗体检测试剂盒> 厂家B 中和抗体检测试剂盒> 厂家A ELISA-IgG 抗体检测试剂盒> 厂家C 中和抗体检测试剂盒。
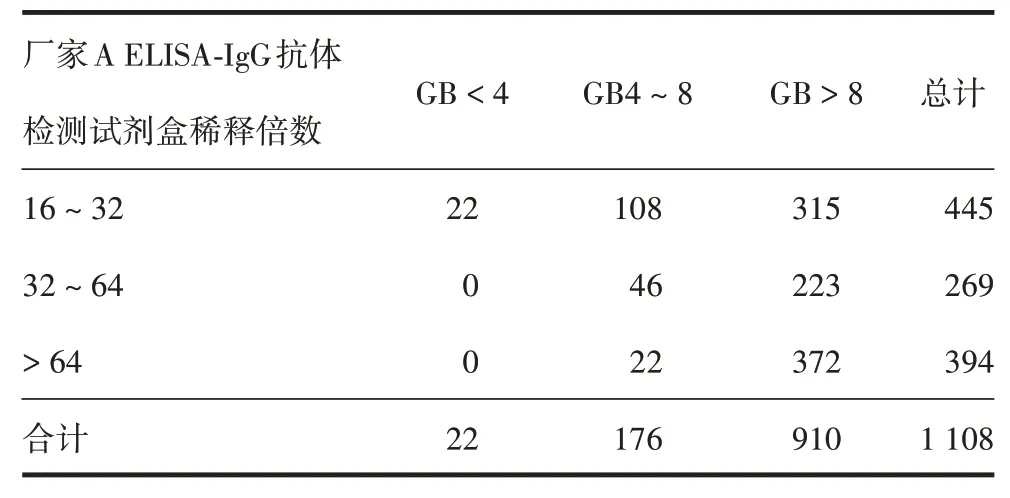
表6 厂家B ELISA-IgG抗体检测试剂盒血浆筛选结果(份)Tab.6 Results of plasma screening by ELISA-IgG kit of manufacture B(copies)
2.5 4种试剂盒的操作便利性比较 从操作原理、反应时间、操作方法及线性范围对比,见表7,操作便利性排序为:厂家B ELISA-IgG 抗体检测试剂盒>厂家B 中和抗体检测试剂盒> 厂家A ELISA-IgG 抗体检测试剂盒>厂家C中和抗体检测试剂盒。
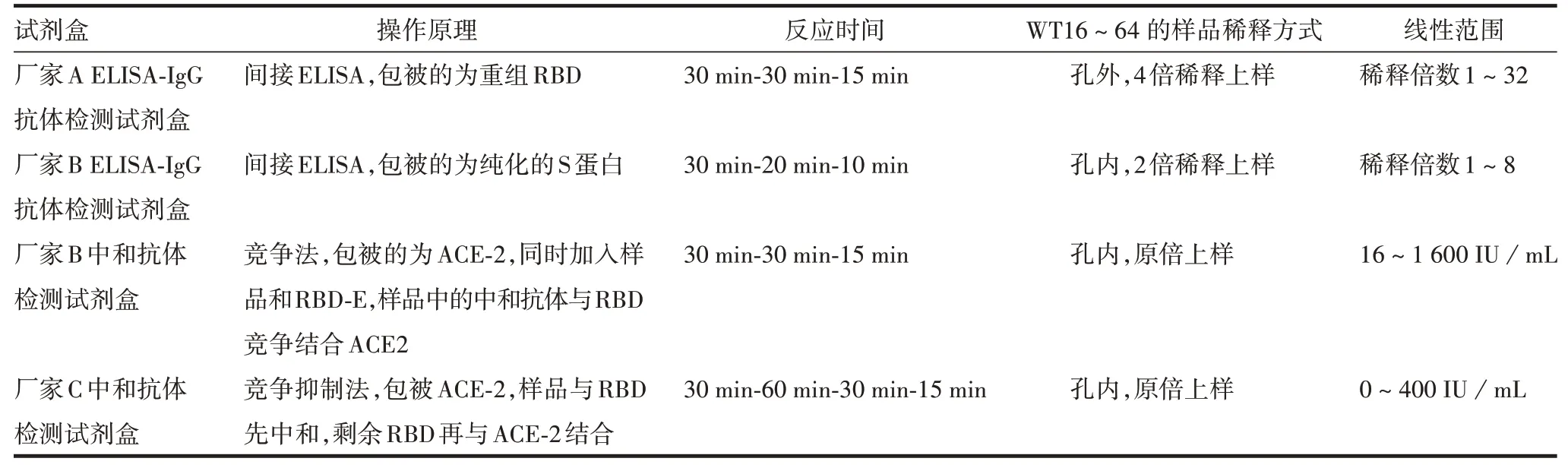
表7 4种试剂盒比较Tab.7 Comparison of four detection kits
综上,4种试剂盒优选顺序为:厂家B ELISA-IgG抗体检测试剂盒>厂家B 中和抗体检测试剂盒>厂家A ELISA-IgG 抗体检测试剂盒> 厂家C 中和抗体检测试剂盒。
3 讨论
目前SARS-CoV-2 中和抗体检测金标准为中和试验,一般采用细胞病变抑制法[14-15],中国食品药品检定研究院采用假病毒法中和试验[16-18],中国科学院武汉病毒所采用传统的蚀斑法中和试验,本研究以假病毒中和试验结果作为筛选混浆是否合格的最终判断标准。
SARS-CoV-2的S蛋白由S1和S2两个亚基组成,S1 亚基包含RBD,其与存在于上皮细胞表面的细胞表面受体血管紧张素转换酶2(angiotensin converting enzyme 2,ACE2)结合[19-21],而中和抗体是活细胞被病毒感染后在血液中产生的能阻断SARS-CoV-2 细胞浸润和病毒复制的结合抗体亚群,通过与病毒RBD竞争结合细胞表面的ACE2 来阻断病毒对细胞的侵入[22]。目前我们收集到3家体外中和抗体ELISA 检测试剂盒,其中厂家A 中和抗体检测试剂盒采用竞争法,在酶标板上包被的为S 蛋白基因重组抗原,可捕获样本中的SARS-CoV-2 中和抗体,形成抗原抗体复合物,再加入HRP 标记的S-RBD 抗体与中和抗体竞争结合包被抗原,未完全模拟抗体中和的全过程,有3步孵育,时长2 h,但其线性范围窄(0~0.5 U/mL),WT > 16 的样品需孔外20 倍稀释才能在线性范围内,因此不适用于大规模筛选高效价血浆,未在本研究中采用。本研究采用了2 家完全模拟抗体中和的全过程的中和抗体检测试剂盒,抗体效价与A450呈负相关。如厂家B 采用的竞争法,厂家C 采用的竞争阻断法[23-24],包被酶标板的均为ACE2,酶标记抗体为HRP 酶标记的RBD,但两个厂家在样品中和程序上有所不同,其中厂家C 中和抗体检测试剂盒与FDA 批准的金斯瑞中和抗体检测试剂盒相似并进一步改良,虽然按照其标准制备的混浆在Pp16~64 与假病毒中和抗体效价有一定相关性,但整个操作过程繁琐,且同一样品不同稀释度检测结果差异较大,收浆合格率低于厂家A ELISA-IgG 抗体检测试剂盒,因此非最佳选择。厂家B 中和抗体检测试剂盒线性范围宽(16~1 600 IU/mL),在Pp16~200与假病毒中和抗体效价有最高的相关性,目前在WT16~128的样品无需稀释上样即可检测,操作简便,反应时间短,收浆合格率也较高,但非SARS-CoV-2 的特异性免疫球蛋白产品和人免疫球蛋白使用该试剂盒检测时,SARS-CoV-2抗体效价为30~50 IU/mL,因此需进一步用未接种疫苗的健康人群血清(无SARSCoV-2 感染史)或SARS-CoV-2 疫情暴发前血浆样本作为阴性样本进行检测,以确认其特异性。
虽然厂家B ELISA-IgG 抗体检测试剂盒不如其他试剂盒线性范围宽(稀释倍数1~8,共4 个2 倍稀释度),但在内控参考品和收浆标准已确定情况下,仅需3 个档位线性范围即可满足筛浆要求。且本研究结果显示,该试剂盒还能提高WT16 ~ 32 的收浆合格率,可能由于其包被抗原采用的为纯化的病毒裂解物,主要成分为RBD蛋白,其覆盖的抗体谱比重组RBD-IgG 更广。另外,厂家B ELISA-IgG 抗体检测试剂盒操作最简便,步骤少,因此可将该试剂盒作为优选试剂盒,后期我们对该试剂盒进行了全区段血浆筛选,制备混浆,与假病毒中和抗体效价进行相关性分析,最终确认其优势[25]。
本研究通过试剂盒的适用性评估建立了SARSCoV-2 抗体混浆血清盘和筛选高效价抗体所需试剂盒的评估系统,即用普通静注人免疫球蛋白和特异性人免疫球蛋白作为阴性对照评估其特异性;用不同档位混浆样品盘(具有不同厂家中和抗体和IgG特异性抗体结果及SARS-CoV-2 假病毒中和试验结果)作为阳性对照评估其线性;计算不同备选试剂盒对现有试剂盒不同稀释度档位单份血浆检测的结果符合率,确定结果存在差异的档位区间;制备各种档位的混浆,灭活后用假病毒中和试验检测中和抗体效价,根据混浆中和效价检测结果确定起始收浆档位,并计算收浆合格率,确定合格率是否提高;最后比较线性范围及样品稀释度,反应时间和步骤,确定操作便理性。通过本研究可在众多备选试剂盒中筛选出性价比满足要求的试剂盒,也可为同类问题提供参考。
