基于ELISA与NMR方法的降钙素基因相关肽抗体的抗原表位鉴定
2024-01-02路晶晶余飞孙百平于晓萍刘万卉
路晶晶,余飞,孙百平,于晓萍,刘万卉
1.滨州医学院医药研究中心,山东 烟台 264003;2.烟台大学药学院,山东 烟台 264005;3.山东博安生物技术股份有限公司,山东 烟台 264670
偏头痛是一种复杂、常见的原发性神经血管疾病,影响全球16%的人口[1-2],尽管已经进行了深入研究,但其复杂的病理机制仍未被精确阐明,主要假设之一为:基于三叉神经血管系统(trigeminovascular system,TS)的激活,几种肽参与了TS 激活,而降钙素基因相关肽(calcitonin gene-related peptide,CGRP)在其中起着至关重要的作用[3]。
CGRP 是一种内源性的强效血管扩张剂和神经源性炎性疾病的关键介质,由37 个氨基酸组成[4-7],可分为α和β亚型,两者具有类似活性,α-CGRP是最丰富的亚型。CGRP 已成为偏头痛药物研发的热门靶点,靶向CGRP或其受体的单克隆抗体药物与CGRP或其受体特异性结合,可阻止CGRP 与受体结合,从而抑制血管舒张,缓解偏头痛[8]。截至目前,已有4款以CGRP及其受体为靶点的单抗上市,包括Eptinezumab、Galcanezumab、Fremanezumab、Erenumab。
抗体表面的抗原决定簇可与抗原的B 细胞表位发生互补性结合。鉴定B 细胞表位的方法主要包括X-射线晶体衍射(X-ray diffraction,XRD)、核磁共振光谱(nuclear magnetic resonance,NMR)、基于ELISA分析的肽扫描、氨基酸定点突变、多肽噬菌体展示、免疫亲和质谱技术等[9-11];另外,随着生物信息学和免疫技术的发展,利用计算机生物信息学软件预测和筛选抗原表位也进行了大量的研究。其中,XRD和NMR 技术可从原子水平解析抗原-抗体复合物结合位点,被认为是分析单抗识别表位的最可靠方法;且NMR 技术可避免XRD 技术存在的需要获得抗原-抗体复合物晶体的限制,能够解析更接近生理状态的溶液结构,与XRD 技术具有互补性[12-14]。但仅采用单一方法鉴定特定抗体的抗原表位可能存在准确性低、误差大的问题,无法获得系统、全面的抗原表位。鉴于以上情况,本研究建立了基于间接ELISA法的肽扫描技术与NMR 技术相结合的方法鉴定一种新的CGRP 抗体及其对照抗体的抗原表位,并利用液相色谱-质谱联用(liquid chromatography-mass spectrum,LC-MS)技术辅助归属抗原表位的精氨酸NMR 信号。明确了抗体结合抗原的具体位置,旨在完善抗体作用的物质基础,为设计靶向新的CGRP抗体药物提供理论依据。
1 材料与方法
1.1 药物 新抗体CGRP-BOAN-IgG2由山东博安生物技术股份有限公司应用全人抗体转基因小鼠和噬菌体展示技术平台筛选获得,对照抗体CGRP-TEVA-IgG2由该公司根据Fremanezumab抗体序列瞬转表达获得。
1.2 主要仪器及试剂 α-CGRP 购自江苏金斯瑞生物技术有限公司;D2O、PBS-Tween、碳酸盐缓冲液、牛血清白蛋白(BSA)、辣根过氧化物酶标记的山羊抗人IgG 抗体、苯乙二醛、胰蛋白酶购自美国SIGMAALDRICH公司;TMB显色液购自美国SeraCare Life Sciences 公司;磷酸购自国药集团化学试剂有限公司;超滤离心管购自德国Sartorius公司;核磁管购自美国Wilmad公司;色谱柱购自美国Waters公司;AVANCE 600 核磁共振波谱仪购自美国BRUCK 公司;AB SCIEX ExionLC™液相系统、TRIPLE QUAD 4500 型三重四极杆串联质谱仪购自美国AB SCIEX公司;Spectra-Max190 酶标仪购自美国MOLECULAR DEVICES 公司;ELx405Rs洗板机购自美国BIO-TEK公司;Advantage A10 Milli-Q 型超纯水系统购自美国Millipore 公司;Nanodrop 超微量紫外分光光度计购自美国THERMO FISHER公司;ACQUITY UPLC Peptide CSH C18 column(1.7 μm,2.1 mm×150 mm)购自沃特世科技(上海)有限公司。
1.3 ELISA法分析CGRP抗体的抗原表位
1.3.1 抗原抗体结合活性检测 采用间接ELISA法。用PBS-Tween 将抗体稀释至10 000 ng/mL,再进行5 倍系列稀释,共9 个稀释度。用包被液(碳酸盐缓冲液,pH 9.6)将抗原稀释至2 μg/mL,加至高吸附96 孔板,100 μL/孔,4 ℃包被过夜;加封闭液(含1%BSA 的PBS-Tween 溶液),200 μL/孔,37 ℃封闭1 h;洗板,加入系列稀释的抗体药物,100 μL/孔,37 ℃孵育2 h;洗板,加入辣根过氧化物酶标记的山羊抗人IgG抗体(1∶7 000 稀释),100 μL/孔,37 ℃孵育1 h;洗板,加入TMB,100 μL/孔,室温显色15 min;终止反应。上酶标仪,以650 nm为参比波长,450 nm为检测波长,读取吸光度值。以抗体浓度为横坐标,吸光度值为纵坐标,使用四参数回归模型拟合生成S型曲线,剂量效应曲线的C 值即为EC50值。使用SoftMax Pro软件,按下式计算相对结合活性。

1.3.2 截短抗原与抗体结合活性检测 分别以截短抗原片段CGRP(1-18)、CGRP(19-37)、CGRP(19-24)、CGRP(25-37)及CGRP(25-37,无C-端酰胺)包被96孔板,参考1.3.1 项方法检测截短抗原与两种抗体的结合活性。
1.4 NMR检测CGRP抗体的抗原表位
1.4.1 样品制备 将2份α-CGRP蛋白8 mg溶于450 μL 20 mmol/L NaHCO3溶液,1 份不加抗体蛋白,1 份加入50 μL 150 mg/mL 抗体蛋白,37 ℃结合反应2 h;加入55 μL D2O,用5 mol/L HCl调节pH至4.5。
1.4.2 NMR 采集条件 采集CGRP 的二维氢-氮相关(2D1H-15N HSQC)谱,探头为5 mm的超低温探头,实际采集温度为298 K,去耦采集,在T1维中,每256次增量,160次扫描。
1.5 LC-MS辅助归属抗原中精氨酸MNR信号
1.5.1 精氨酸专属性修饰反应 以40 mmol/L 苯乙二醛(phenylglyoxal monohydrate,PG)溶液作为精氨酸专属性修饰试剂[15-16]。将8 mg α-CGRP 蛋白溶于500 μL 20 mmol/L NaHCO3溶液后,加入不同体积的PG 溶液,使PG 与α-CGRP 反应的摩尔比分别为0∶1、0.25∶1、0.5∶1、1∶1,37 ℃反应1 h;超微量紫外分光光度计测定蛋白浓度。
1.5.2 LC-MS定量分析α-CGRP中精氨酸修饰速率
1.5.2.1 样品制备 取修饰后蛋白100 μg,20 mmol/L NaHCO3溶液稀释至1 μg/μL,加入胰蛋白酶5 μg,37 ℃酶切4 h,加入1 μL甲酸终止反应。
1.5.2.2 色谱条件 色谱柱:ACQUITY UPLC Peptide CSH C18 column(1.7 μm,2.1 mm×150 mm);柱温:60 ℃;流速:0.2 mL/min;流动相:0.1%甲酸水(A)-甲醇(B);梯度洗脱条件:0~20 min 2%~98%A,20~20.1 min 98% ~ 2% A,20.1 ~ 30 min 2% A;进样体积:5 μL。
1.5.2.3 质谱条件 电喷雾离子源(electron spray ionization,ESI),正离子模式扫描,扫描方式为多反应监测(multiple reaction monitorin,MRM),卷帘气、雾化气(gas 1)、加热气(gas 2)分别为:35、55、55 psi;电子喷雾电压:4 000 V;离子源温度:550 ℃。使用Skyline软件预测酶切肽段及离子对,目标肽段和内标肽段离子对见表1。

表1 目标肽段和内标肽段的参数Tab.1 Parameters of target peptides and internal standard peptides
1.5.2.4 结果计算 LC-MS 定量结果以每个未修饰的目标肽段的量表示,按下式计算。试验重复3 次,每次均单独制备样品,每个样品检测2 次。所有数据取平均值。

式中Pept(R)mod和Pept(R)con分别代表修饰的和未被修饰的样品的精氨酸肽段的峰面积;Pept(ref)con和Pept(ref)mod分别代表未被修饰的和修饰的样品的内标肽段的峰面积。
1.5.3 NMR 定量分析α-CGRP 中精氨酸修饰速率取500 μL 修饰后蛋白,加入55 μL D2O,用5 mol/L HCl溶液调整pH 至4.5。按1.4.2项采集条件采集。试验重复3 次,每次均单独制备样品,每个样品检测2 次,所有数据取平均值。NMR 定量结果以未修饰的氨基酸的量表示,按下式计算。

式中Rcon和Rmod分别代表未修饰和修饰后样品的精氨酸ε-NH 信号的积分值;refcon和refmod分别代表未修饰和修饰后样品的内标信号的积分值。
1.6 数据采集及分析 使用Skyline软件预测酶切肽段及离子对;使用SoftMax Pro软件处理相对结合活性数据。
2 结果
2.1 各截短CGRP 与抗体的结合活性 剂量效应曲线见图1,以α-CGRP(1-37)为抗原,经四参数方程拟合,拟合优度R2> 0.99。经6 次测定,与对照抗体CGRP-TEVA-IgG2 比较,与新抗体GRP-BOAN-IgG2的相对结合活性为102.2%,RSD为5.22%,表明新抗体对α-CGRP 具有良好的结合活性。分别以截短抗原片段CGRP(1-18)、CGRP(19-37)、CGRP(19-24)、CGRP(25-37)、CGRP(25-37,无C-端酰胺)包被96 孔板,ELISA结果表明,两种抗体与CGRP(1-18)、CGRP(19-24)无结合活性,无法拟合出四参数曲线。与CGRP(19-37)、CGRP(25-37)有结合活性,呈现良好的四参数拟合曲线,CGRP(19-37)段与抗体结合活性的EC50值分别为16.60 和33.85 ng/mL,CGRP(25-37)段与抗体结合活性的EC50值分别为75.30和94.95 ng/mL;去掉C-端酰胺时,抗原抗体无结合活性。见表2。表明两种CGRP抗体的抗原表位位于α-CGRP的C-末端。
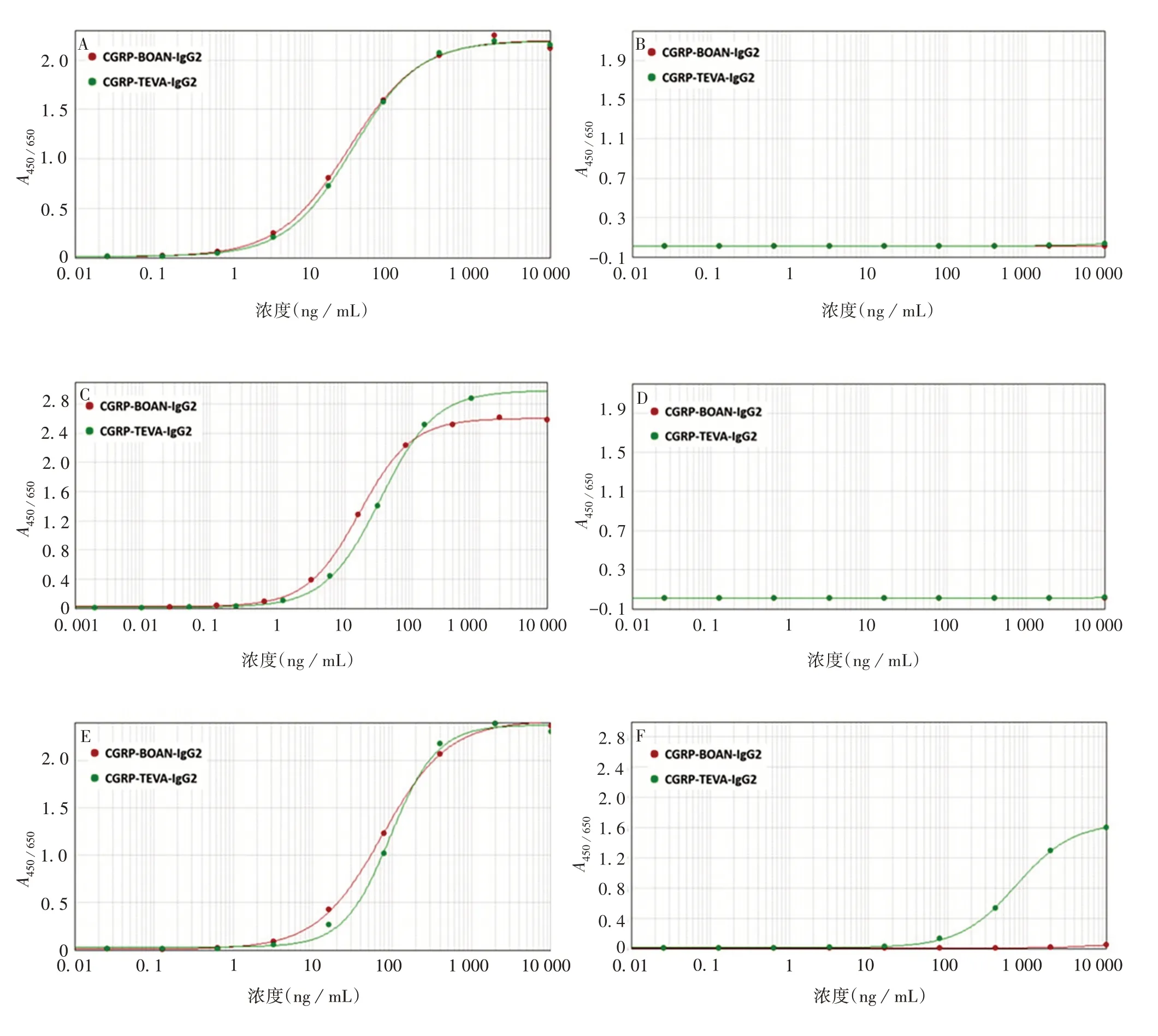
图1 CGRP抗体与α-CGRP结合的拟合曲线Fig.1 Fitting curves of CGRP antibodies binding with α-CGRP
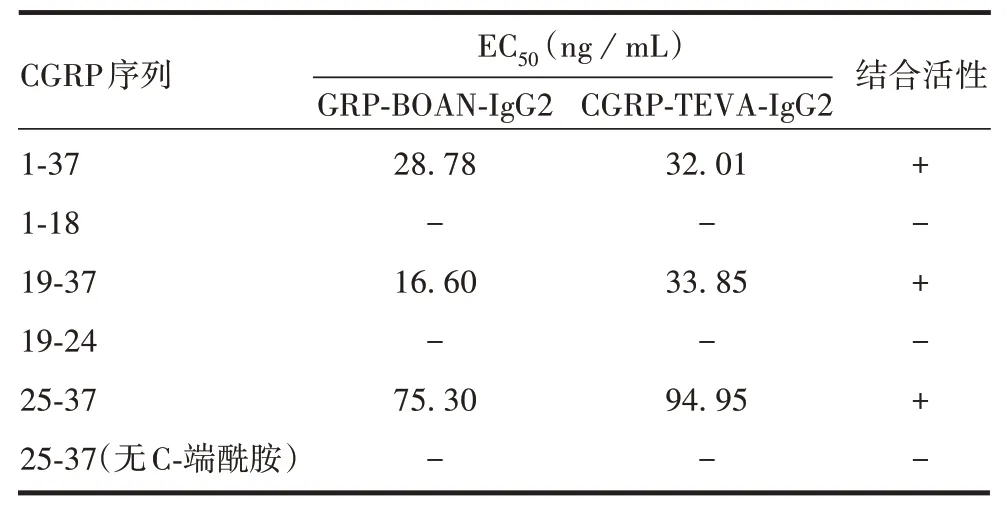
表2 ELISA法检测CGRP抗原抗体结合活性Tab.2 Detection of CGRP antigen-antibody binding activity by ELISA
2.2 CGRP 与抗体结合前后的NMR 自然丰度α-CGRP(pH 4.5)的2D1Η-15Ν HSQC 谱中,2 个精氨酸(R11和R18)侧链ε-NH NMR信号分别在A[7.14 ppm/84.6 ppm(1H/15N)]和B[7.10 ppm/84.7 ppm(1H/15N)]的位置,见图2。与对照抗体CGRP-TEVA-IgG2 结合后,精氨酸(R11 和R18)NMR 信号(图中圆圈处)消失,见图3A。表明R11和R18可与对照抗体结合。而CGRP 与新抗体CGRP-BOAN-IgG2 结合后,2 个精氨酸(图中圆圈处)依然存在,见图3B。表明R11和R18不与新抗体结合。

图2 α-CGRP(pH 4.5)在600 MHz核磁上采集的2D 1Η-15 Ν HSQC谱Fig.2 2D 1Η-15Ν HSQC spectrum of α-CGRP at pH 4.5 recorded on 600 MHz spectrometer
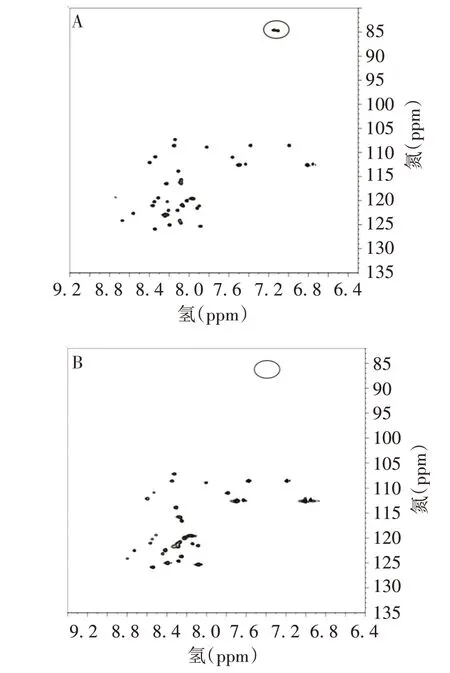
图3 α-CGRP与抗体结合后的2D 1Η-15Ν HSQC谱Fig.3 2D 1H-15N HSQC spectra of α-CGRP combined with antibodies
2.3 LC-MS辅助归属CGRP中精氨酸MNR信号 以[7.49 ppm/112.5 ppm(1H/15N)]为内标信号,修饰后,2 个精氨酸的NMR 信号A 和B 均可见不同程度的衰减,见图4。

图4 不同反应摩尔比的苯乙二醛修饰α-CGRP的1Hε-15Nε HSQC谱图局部放大图Fig.4 Local enlargement of 1Hε-15Nε HSQC spectra of α-CGRP modified with different molar ratios of PG
NMR 结果显示,修饰速率A ˃B;LC-MS 结果显示,修饰速率R11 ˃R18。通过修饰速率的直接排序比对获得精氨酸ε-NH 信号归属,即A 对应R11,B 对应R18。见表3。

表3 未被修饰的精氨酸量的LC-MS和NMR技术检测结果(%)Tab.3 LC-MS and NMR method quantitation results for α-CGRP remaining unmodified arginine(%)
3 讨论
α-CGRP的关键结构特征是残基2-7之间的二硫键、1个潜在的α-螺旋区(残基8-18)和1个C-端酰胺(见图5)。遵循两步机制来激活其受体,C-末端与受体的胞外域结合;N-末端(二硫键环)与受体的跨膜结构域和细胞外环区域结合[4]。靶向CGRP 抗体与CGRP 特异性结合后,可阻断其与受体结合,从而抑制生物活性[17]。抗体与抗原的反应性取决于其所识别的抗原表位。基于ELISA 法的肽扫描技术操作简便,常用于线性表位鉴定,而大多数目前鉴定到的线性表位可能仅是构象表位的一部分。NMR 技术可用于抗原-抗体间直接相互作用的氨基酸残基或原子的精确定位研究,尤其适合分子量较小的蛋白质。
本研究采用ELISA 法与NMR 技术相结合鉴定CGRP 抗体的抗原表位,避免了单一方法的局限性,兼顾线性表位和构型表位,并对常处于抗原抗体结合位点的精氨酸进行信号归属。ELISA 方法中,通过检测各段截短抗原与两种抗体的结合活性,不断缩小抗体识别区域,从而鉴别抗原表位。NMR 技术中,CGRP 有2 个精氨酸:R11 和R18,通过抗体与抗原之间相互作用,使用2D1H-15N HSQC检测CGRP在结合抗体前后的NMR 信号,分析抗体对CGRP 精氨酸侧链NMR 信号的扰动。结果显示,两种抗体的抗原表位均位于α-CGRP 的C-末端;同时,α-CGRP 上的精氨酸R11 和R18 可与对照抗体结合,但不与新抗体结合。ELISA 法鉴定对照抗体线性表位的结果与文献报道一致[18]。通过LC-MS 辅助归属CGRP 中精氨酸ε-NH MNR 信号,即A 对应R11,B 对应R18,与文献归属相符[19]。NMR 技术目前仅涉及精氨酸的鉴别,因其特殊性,常处于蛋白间相互作用位点、酶活位点以及蛋白质核酸识别位点[20-22]。
抗原表位鉴定是单抗研发的关键步骤,在新抗体研发过程中,本研究对于明确新抗体作用的物质基础以及抗体药物的结构和功能分析具有重要意义,也可为其他治疗偏头痛的CGRP 抗体候选药物的研发提供参考。
