投喂水平对稻田养殖中华鳖摄食生态的影响
2024-01-01吴本丽黄龙吴仓仓陈静陈夏君梅耀萍何吉祥

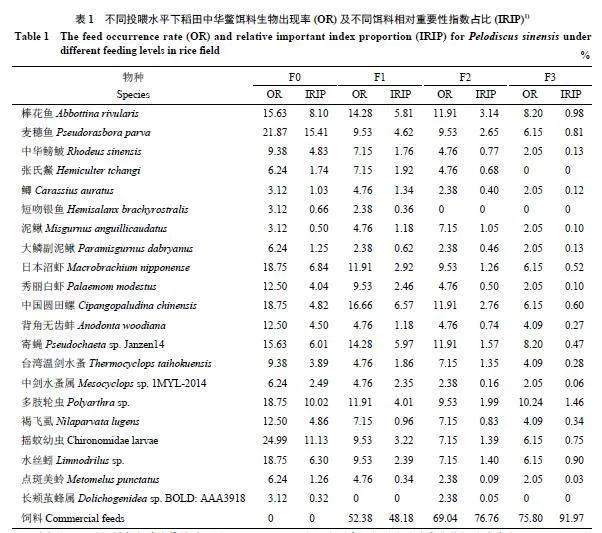

摘要: 【目的】调查不同投喂水平条件下中华鳖Pelodiscus sinensis 在稻田摄食天然饵料的种类和强度,探索稻鳖共作模式下中华鳖的摄食生态,为优化稻田综合种养投喂策略、揭示生态效益形成过程和机制提供依据。【方法】在大田稻鳖共作模式中设置0.7%、1.4% 和2.1%(w) 3 个投喂水平,运用胃含物形态学分析以及胃含物和环境DNA 高通量测序分析方法,获得各组中华鳖对天然饵料和人工饲料的摄食习性,分析不同饵料在不同处理组中的相对重要性指数等。【结果】中华鳖摄食率随投喂水平的提高有所上升。胃含物形态学分析中共识别出鱼类8 种、虾类2 种、软体动物2 种、昆虫和轮虫等9 种,出现率较高的物种包括棒花鱼、麦穗鱼、日本沼虾、中华圆田螺、多肢轮虫、摇蚊幼虫和水丝蚓等。随着投喂水平的上升,胃含物中饲料出现率和相对重要性指数占比(IRIP) 均上升,天然饵料IRIP 下降;当投喂水平为2.1% 时,饲料IRIP 高达91.97%,天然饵料IRIP 之和仅为8.03%。环境DNA 高通量测序分析结果显示,在某一或多个样本中DNA 相对丰度大于0.5% 的鱼类有16 种,其中,棒花鱼、麦穗鱼、中华鳑鲏、张氏䱗、泥鳅、大鳞副泥鳅、鲫和短吻银鱼与胃含物形态学分析结果吻合;共注释大型水生脊椎动物36 种,胃含物中DNA 相对丰度大于1.0% 的物种主要包括寄蝇、秀丽白虾、中国圆田螺、摇蚊幼虫、水丝蚓、轮虫等。【结论】中华鳖在稻田摄食的天然饵料主要包括小型鱼类、软体动物、节肢动物以及轮虫等。高投喂水平导致天然饵料的摄食率和IRIP 更低,可能降低稻田共作的生态效益。
关键词: 稻鳖共作;投喂水平;摄食生态;胃含物;环境DNA
中图分类号: S966.5 文献标志码: A 文章编号: 1001-411X(2024)06-0929-10
近年来,在经济、生态效益和政策驱动下,稻渔综合种养迅猛发展,截至2023 年,我国稻渔综合种养面积280 余万公顷,生产稻谷约2 150 万t、水产品387 万t;稻虾、稻鱼、稻鳖、稻蟹、稻鳅、稻蛙等模式均形成了一定产业规模[1]。随着养殖规模的不断扩大,制约产业持续健康发展的问题也日益显现,绿色循环、稳粮高效是稻渔综合种养产业可持续发展的基础要求[2]。
稻田生物多样性非常丰富,可为水产动物提供广阔的活动空间、种类丰富的天然饵料和遮蔽物,可减少群体竞争压力和配合饲料投入,降低水资源消耗和污染[3]。水产动物田间活动可影响稻田土壤结构、理化性质和微生物群落结构功能[4-7];水产动物饲料、粪便和残饵等增加了营养投入,可提高稻田土壤营养水平[ 8 ];养殖动物摄食稻田中天然饵料,对病虫害有一定防控作用,可减少养分消耗,提高稻田营养元素转化和利用效率[ 9 - 1 0 ]。综合看来,稻渔综合种养是基于共作互利、生态位和食物链等生态学原理实现生态效益[11-13]。综合种养使稻田营养层次增多,食物链延长,其对生产者、消费者和分解者均会产生不同影响[14]。但种养品种间的耦合关系、生态效益形成机制还需要进一步深化研究。
水产动物的摄食活动在生态效益形成过程中起到关键作用,但水产动物对稻田生态系统中天然饵料和饲料的摄食尚缺乏量化研究,摄食种类和数量难以评估,另外,外源饲料投喂策略,包括投喂水平、投喂时间等也可能导致其摄食生态适应性改变[15]。中华鳖Pelodiscus sinensis,即甲鱼,属水陆两栖的爬行动物,肉食性为主,具有较高的营养价值和药用价值。随着野生甲鱼资源逐渐衰退,加上温室集约化养殖鳖品质不佳,鳖健康养殖模式亟待发展优化。稻鳖共作可有效缓解中华鳖野生资源衰减和集约化养殖带来的品质及环境问题[16],是一种稳定、生态效益显著的综合种养模式,稻田鳖品质和风味与野生鳖相似,受到广大消费者的喜爱,经济效益突出,目前主要在湖北、安徽、广西等地区广泛发展。
目前,关于稻鳖共作的生态效益研究多集中在共作模式对稻田水质、土壤环境、养殖品质等的影响,基于稻田鳖摄食产生的生态效益有待进一步量化[17]。本研究以期通过胃含物分析和高通量测序的手段更加精确地判断不同投喂水平下中华鳖对天然饵料的摄食种类和丰度,为科学评价稻鳖共作的生态效益提供一定依据,也为其他稻渔综合种养模式生态效益提升提供一定参考。
1 材料与方法
1.1 稻鳖共作模式
养殖监测试验在安徽省农业科学院水产研究所太湖县稻鳖共作基地开展。单块试验田面积约2 000 m2,每块稻田一侧设置200 m2 鳖池。水稻品种为‘徽两优688’,移栽时间为2022 年6 月15 日,行株距25 cm×20 cm。甲鱼养殖品种为中华鳖日本品系,投放时间为2022 年7 月10 日,采用较大规格苗种,规格为600~700 g/只,每块试验田投放80 只。每天09:00 和16:00 分别投喂1 次专用配合饲料(浙江金甲水产饲料有限公司,粗蛋白质量分数为45%),投喂水平按照甲鱼投放质量的0、0.7%、1.4% 和2.1% 设置,分别标记为F0、F1、F2、F3,每组设置3 个平行试验田块。
1.2 取样时间和方法
分别在7 月29 日、8 月25 日和9 月23 日采集中华鳖样本,每块试验田采集6 只,采样前一天下午暂停投喂。中华鳖快速断头致死后解剖,完整剥离消化道,擦拭表面后,用剪刀剪开胃肠部,观察充塞度,依据消化道内含物的含量将充塞度分为6 级(0~5 级),用于分析摄食强度,胃肠道无明显内含物计为0 级,内含物空间占比[0,10%],(10%,20%],( 2 0 % , 3 5 % ] , ( 3 5 % , 5 0 % ] , gt; 5 0% 依次计为1~5 级。称量所有胃含物,将肉眼可辨的残体、残肢、种子等未完全消化的食物置于纱绢上,用纯水冲洗,将肉眼可辨别的物种分类、计数、称重后用甲醛固定,其余匀质弥散食团称重,80% 计为饲料质量。同时,收集同一采样时间、同一试验田的甲鱼弥散食团,混合后置于冻存管,液氮速冻用于后续DNA 提取。另外,采集稻田表层土壤(0~5 cm)、稻田水体等环境样本。土壤样本按照S 形取样方式,每块稻田取10 个点土样,去除石砾、植物根系等杂质,等量混合均匀后取5~10 g 保存于无菌管中,冷冻保存至DNA 提取;田面水体也按照S 形取样方式,每块稻田取10 个点的水样,每点取样300 mL,混合均匀后取1 L 置于无菌广口瓶;鳖池水样用采水器分别取上、中、下层水体各1 L,混合后均匀后取1 L 置于无菌广口瓶。所有水样用0.45 μm 微孔滤膜过滤后,将滤膜冷冻保存至DNA 提取。
1.3 环境和胃含物DNA 提取及高通量测序分析
依照相关试剂盒说明书对所制备的稻田表面土壤样本、稻田水体样本及甲鱼胃含物样本进行DNA 提取(QIAamp tissue extraction kit , Qiagen)。完成基因组DNA 抽提后,利用10 g/L 琼脂糖凝胶电泳检测抽提的基因组。参考中华鳖的天然食性,本试验采用淡水鱼类(Tele02_F:5′-AAACTCGTGCCAGCCACC-3′,Tele02_R:5′GGGTATCTAATCCCAGTTTG-3′) 和大型水生脊椎动物(BF1:5′-ACWGGWTGRACWGTNTAYCC-3′, BR1:5′-ARYATDGTRATDGCHCCDGC-3′) 两对特异性引物进行扩增(TransStart FastPfu DNA Polymerase,ABI GeneAmp® 9700 型),引物合成及测序委托上海凌恩生物科技有限公司完成。每个样本3 个重复,将同一样本的PCR 产物混合后用20 g/L 琼脂糖凝胶电泳检测,使用AxyPrepDNA 凝胶回收试剂盒(AXYGEN 公司) 切胶回收PCR 产物,Tris-HCl 洗脱;20 g/L 琼脂糖凝胶电泳检测。参照电泳初步定量结果,将PCR 产物用QuantiFluor™ -ST 蓝色荧光定量系统(Promega 公司) 进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合。构建Illumina 文库,进行Illumina 测序。基于测序数据进行OTU 聚类,对高于97% 序列相似度的O TU 进行生物信息统计分析,获得O TU 信息(Usearch,V10),进行物种注释(Blastn,v2.5.0),开展物种多样性分析(Mothur,v1.35.1)、物种组成分析(R,v3.6.3) 和差异分析(LEfSe,v1.0)。
1.4 数据统计分析
基于胃含物中天然饵料出现率、数量百分比、质量百分比分析稻田甲鱼摄食生态,主要计算公式如下:
摄食率=(含有食物肠道数/解剖的肠道数)×100%,
出现率=(胃含物中出现某种饵料的肠道数/含有食物总肠道数)×100%,
数量百分比=(某种饵料数量/胃含物中饵料总数量)×100%,
质量百分比=(某种饵料质量/胃含物中饵料总质量)×100%,
饵料相对重要性指数= (某种饵料数量百分比+某种饵料质量百分比)×出现率,
饵料相对重要性指数占比(Relative importance index proportion, IRIP)= IRI/ΣIRI×100%。
2 结果与分析
2.1 不同投喂水平下中华鳖胃含物分析
2.1.1 基于形态学的中华鳖胃含物种类组成分析
所有胃含物样本中共识别出动物种类21 种,其中鱼类8 种,虾类2 种,软体动物2 种,昆虫、轮虫等9种,另外,少数个体中还存在一些植物残渣和种子。出现率较高的物种包括棒花鱼、麦穗鱼、日本沼虾、中华圆田螺、多肢轮虫、摇蚊幼虫和水丝蚓等。随着投喂水平的上升,胃含物中饲料出现率和IRIP均上升;当投喂水平为2.1% 时,饲料的IRIP 高达91.97%,F1、F2 和F3 不同投喂水平组天然饵料的IRIP 之和分别为51.82%、23.24% 和8.03%(表1)。
2.1.2 消化道充塞度
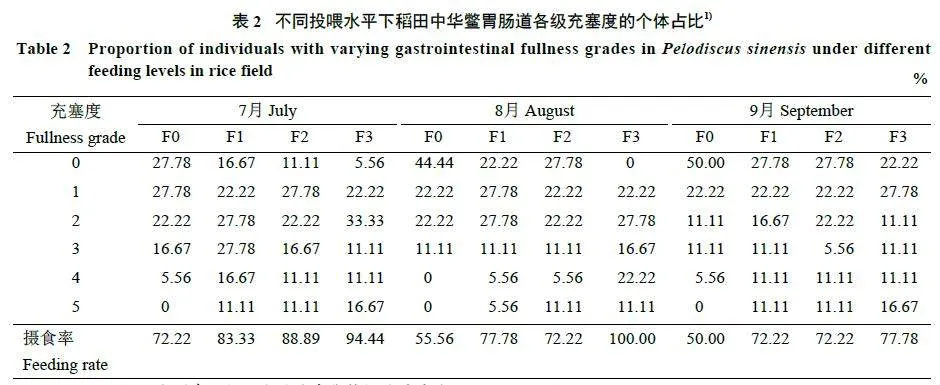
同一采样时期,充塞度为0 级的个体占比随着投喂水平的提升有所下降,摄食率随投喂水平的提升有所上升。无饲料投喂组中华鳖胃肠充塞度整体较低,未见5 级;高投喂水平组充塞度5 级个体占比不高于16.67%,其中,9 月下旬高投喂水平组充塞度0 级个体占比可达到22.22%(表2)。
2.2 环境和胃含物DNA 组成及天然饵料分析
2.2.1 鱼类
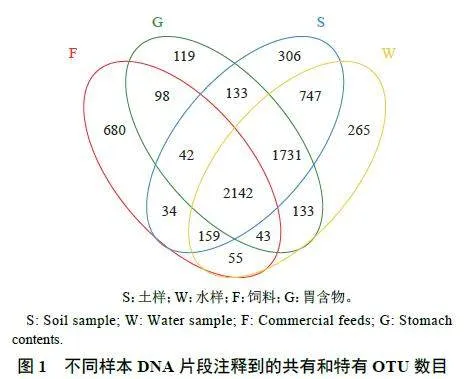
所有样本有效序列计5 519 639 个,对比获得OTU 6 687 种,共有种2 142 种,其中饲料、胃含物、土样和水样的特有OTU 数量分别为680、119、306 和265 种。土样和水样共有OTU 4 798 种,特有OTU 分别为489 和501 种;饲料和胃含物共有OTU 2 324 种,特有OTU 分别为931 和2 137 种(图1)。
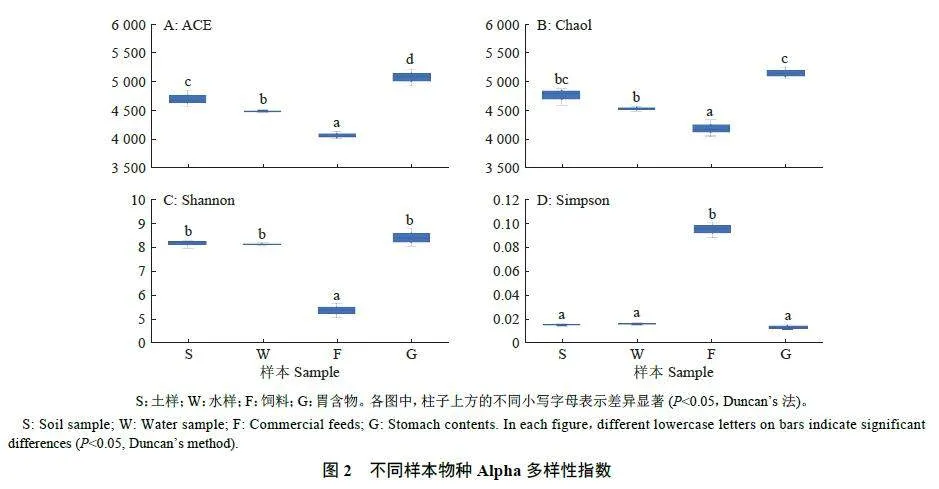
Alpha 多样性指数单因素方差分析和Duncan’s多重比较结果显示,饲料样本ACE、Chao1、Shannon和Simpson 指数与土样、水样和胃含物样本均有显著差异(Plt;0.05),胃含物样本ACE 指数显著高于土样和水样(Plt;0.05),水样、土样和胃含物样本的Shannon 和Simpson 指数无显著差异(图2)。
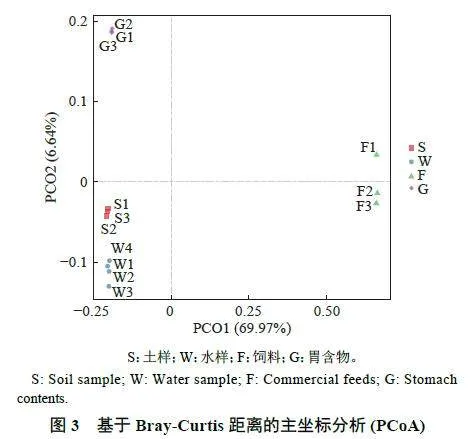
根据主坐标分析结果分析不同样本间的Beta多样性,不同样本间有明显的距离,其中水样和土样间距离较近,表明它们在物种组成上较相似;饲料样本与其他样本距离较远,说明饲料样本中物种组成与其他样本差异较大(图3)。
经过数据比对,合并同物种OTU,去除重复注释物种,共注释鱼类184 种。其中海水或半咸水种类为49 种,在我国未见分布的有23 种,在某一或多个样本中DNA 相对丰度大于0.5% 的鱼类有16 种(图4),其中,棒花鱼、麦穗鱼、中华鳑鲏、张氏䱗、泥鳅、大鳞副泥鳅、鲫和短吻银鱼在胃含物形态学分析中均有发现(表3)。
2.2.2 大型水生无脊椎动物
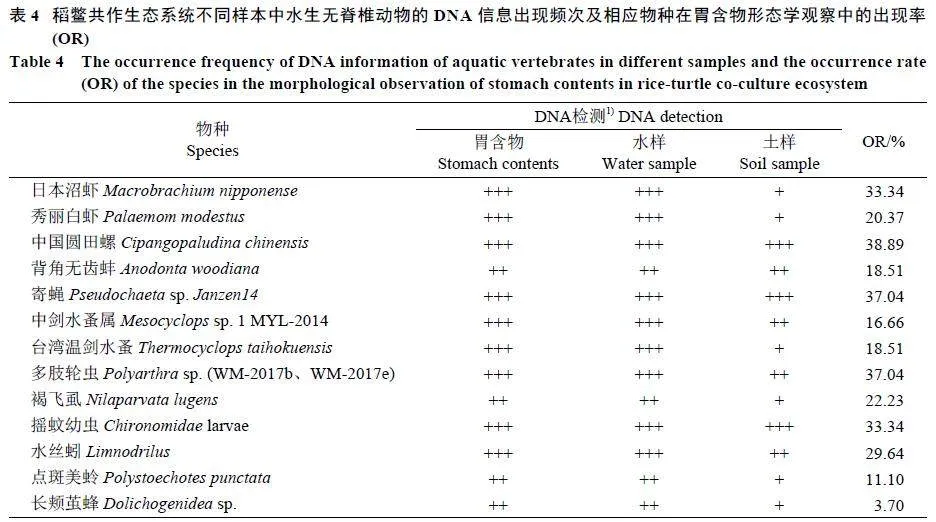
饲料样本未获得有效OTU 序列,其余样本合计有效序列计1 323 473个,对比获得OTU 167 种,注释物种99 个,排除藻类等植物种类。获得大型水生无脊椎动物36 种,隶属5 门、8 纲、14 目、28 属、36 种。其中,胃含物DNA 样本中注释到与胃含物形态学分析吻合的物种共13 种(表4)。胃含物样本中出现率和丰度较高,但环境中出现率和丰度较低的物种,如小头虻、沼蝇、蕈蚊、小潜蛾科、弄蝶科、猎蝽、叶甲虫、石蛛、溞类等可能也会被中华鳖摄食,但活体在环境中残留的DNA 信息较低。
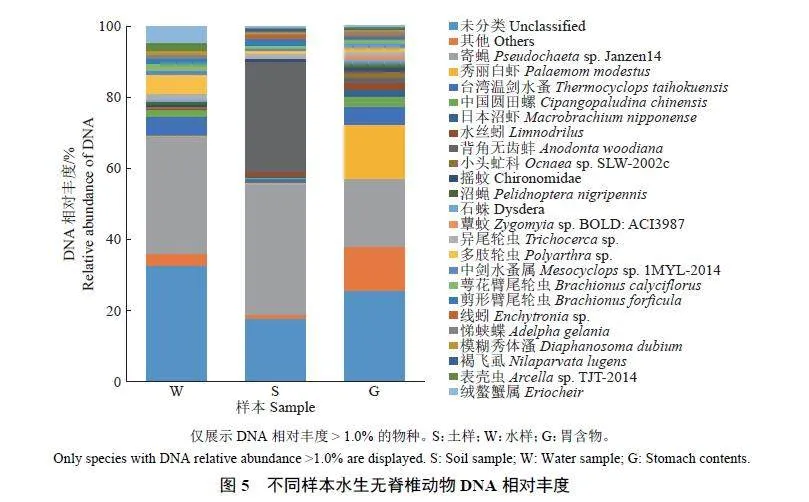
胃含物中DNA 相对丰度较高的物种(gt; 1.0%)主要包括寄蝇、秀丽白虾、台湾温剑水蚤、中国圆田螺、日本沼虾、水丝蚓、背角无齿蚌、小头虻、摇蚊、沼蝇、石蛛、轮虫、蕈蚊等;水样中DNA 相对丰度较高的物种包括寄蝇、轮虫、台湾温剑水蚤、绒螯蟹、表壳虫、中国圆田螺、溞类等; 土壤样本DNA 相对丰度较高的物种包括寄蝇、背角无齿蚌、轮虫、水丝蚓、台湾温剑水蚤、线蚓、摇蚊等(图5)。
3 讨论
3.1 投喂水平对稻田中华鳖摄食生态的影响
稻鳖共作系统是一个相对封闭的小型生态系统,稻田饵料生物丰度与水源资源条件、农田施肥用药管理方式等均密切相关,稻田生态系统可提供的生物资源量虽可满足一定数量的共作生物生存和生长,但天然饵料数量有限,难以获得高产。稻鳖共作生产中,一般将温室培育的较大规格苗种投入到稻田进行生态养殖,常见的稻田养殖主要有两种形式,一种是低密度放养,种养期间不投喂商品饲料或仅补充少量杂鱼、螺蛳等天然饵料的仿野生养殖;另一种是放养一定密度,同时进行外源补充投喂饲料或天然饵料的生态养殖[18-20]。食物是影响动物生存、行为、生长、生理代谢的重要因子,一般饱食条件下可获得机体最大生长[21-22]。投喂水平直接影响动物的生长率和饲料转化效率,过低的投喂水平可能导致营养不良、生长迟缓、免疫力下降,过高的投喂水平可能导致消化压力,饲料转化率下降,从而造成浪费和环境污染[23]。投喂水平还可能影响动物的摄食行为模式,投喂不足可能导致群体内部竞争加剧,而过量投喂可能导致厌食等异常行为,影响群体的活跃程度[24]。
前期研究结果显示,综合生长、饲料效率、生理状态等指标,稻田养殖大规格中华鳖适宜的投喂水平为1.4%,综合种养降低了中华鳖适宜的投喂水平。低投喂水平天然饵料的贡献率较高,随着投喂水平的上升,饲料对中华鳖的摄食贡献显著上升,当投喂水平达到1.4% 以上,饲料的贡献率可达90% 以上。天然饵料贡献率较低,这可能与中华鳖适应投喂方式相关,当配合饲料充足时,中华鳖偏向于摄食易于获得的配合饲料,而减少对天然饵料的捕食,鳖的活动性相对减弱。基于天然饵料丰度优化投喂水平可以提高养殖的经济效益,减少饲料浪费,实现成本节约[25-26]。适当减少投喂可以在保持一定产量的前提下,提高稻田饵料生物及空间资源利用效率,有利于达到生态养殖的目的,稻田鳖从形态、习性和口感上更接近于野生群体,商品性能进一步提高,高投喂水平会削弱综合种养的生态效益,对集约化水产养殖、温室气体排放的缓解作用下降[27]。
3.2 稻田鳖摄食对稻田生物资源及环境的潜在影响
养殖动物在稻田的活动强度影响了稻田环境,综合种养模式更有利于提高稻田生物多样性。鳖在稻田中的捕食活动,促进了稻田生态系统物质间的内在循环,提高了稻田环境的多元化水平,对土壤的松动作用、排泄物等均有利于水稻生长;鳖在稻田活动还可改善田间温度、光照、小气候、土壤肥力状况、氧化还原电位等,减少甲烷、二氧化碳等温室气体的排放,进一步提高生态效益[28-29]。鳖的存在有助于维持稻田生态系统的平衡,通过食物链的营养循环,综合种养延长了能量传递途径,可增强稻田生态系统的稳定性、提高能量利用效率和稻田生态系统服务功能,有助于实现生态平衡和农业可持续发展[30]。
节肢动物是农田中最多的类群,其中步甲、蜘蛛、蝴蝶、蜜蜂、瓢虫和食蚜蝇常被作为生物多样性指示类群[31]。本试验食性分析结果显示,鳖对节肢动物的摄食量以饵料的可获得性决定,以摄食水生幼虫为主,飞虫个体出现率较低。养殖动物对稻田有害生物有一定防控作用,鳖在稻田中摄食可以减少害虫的数量,如稻飞虱,这有助于减少对化学农药的依赖,增加生物多样性,并通过自然捕食者控制害虫数量[32-33]。虫害、草害发生与农药施用次数呈负相关,稻田综合种养在减少农药施用次数的情况下,水稻产量和病害发生频率未受到显著影响,间接说明了综合种养对虫害、草害的控制作用[34]。鳖对天然饵料的摄食未造成稻田生物多样性的下降,甚至可能丰富田间生物多样性,但其对害虫的控制作用及对稻田生物多样性的影响还需结合生物调查进一步量化。
3.3 环境和胃含物DNA 对监测稻鳖共作生态系统生物多样性和中华鳖摄食生态的可行性
环境DNA 高通量测序的方法会导致很多实际不存在于稻鳖共作系统的物种被检出,有些是监测分析方法导致的,比如非特异性的片段被检出,从而被识别为不同物种;另外一些DNA 信息可能是被捕食者带入稻田系统中而被检出;还有一些是可能短暂经过或停留在稻鳖共作系统留下DNA 信息[35-36]。本试验稻鳖共作系统中田面土壤样本、水体样本、鳖胃含物样本和饲料样本被用作环境DNA 分析,在水样、土样和鳖胃含物中广泛存在而在饲料中不存在或丰度较低的物种,可能是本试验稻鳖共作生态系统中客观存在的物种。水样中丰度较高、土样中丰度低的物种,可能是随水源水体流动的物种;土样中丰度高、水中丰度低的物种可能是土壤表层物种或在稻田中长期停留活动的物种;土样和水样中丰度均较高的物种可能普遍存在于稻田生态系统。
本试验土样、水样和胃含物样本高通量测序所获得丰度较高的种类在野外调查中均有发现(排除饲料中检测出的特有种类),但并非所有观测的物种在土样、水样或胃含物样本显示较高丰度,甚至有一些偶然出现的物种,如蛇类,并未检测到有效的DNA 信息,说明稻田中客观存在的生物,复杂的环境样本中未必能采集到有效的DNA 信息,这可能与样本采集尺度、DNA 提取技术及样本自身DNA降解等有关,其他DNA 的干扰也可能会影响分析结果。鳖主要摄食稻田中的鱼类、节肢动物(或幼虫)、环节动物、软体动物、轮虫等,稻田生态系统中鱼类的丰度主要来源于水源地,丰度与来源直接相关。水样和土样中一些物种DNA 丰度较低却在胃含物样本中丰度较高,这可能与个体偶然摄食相关[37-38]。综合看来,稻田捕食性生物胃含物及环境样本高通量测序对稻田生态系统物种组成和多样性评估可起到一定补充作用。
4 结论
稻田的生态容量有限,要在养殖期获得目标产量,仍需补充一定外源饲料。稻田甲鱼的天然饵料主要包括棒花鱼、麦穗鱼、泥鳅等小型鱼类,螺类、蚌类等软体动物,沼虾、白虾、寄蝇、摇蚊等节肢动物,轮虫、水溞等;胃含物形态学分析可大致获得不同饵料的相对重要性指数,高通量测序可相对准确地确定所摄食天然饵料种类。稻田养殖中华鳖投喂水平会影响稻田天然饵料的摄食,投喂水平越高,天然饵料的相对重要性指数越低;但当投喂足够的饲料,鳖会优先选择摄食配合饲料,降低鳖进入稻田捕食天然饵料的积极性,进而可能降低共作的生态效益。
参考文献:
[1]于秀娟, 郝向举, 党子乔, 等. 中国稻渔综合种养产业发展报告(2023)[J]. 中国水产, 2023, 573(8): 19-26.
[2]WANG C, SHI X, QI Z, et al. How does rice-animal coculturesystem affect rice yield and greenhouse gas? Ameta-analysis[J]. Plant and Soil, 2023, 493: 325-340.
[3]何志刚. 稻渔综合种养生态系统中生物多样性, 营养与食物[J]. 湖南饲料, 2018(4): 13-17.
[4]SIG H, PENG C L, YUAN J F, et al. Changes in soil microbialcommunity composition and organic carbon fractionsin an integrated rice–crayfish farming system insubtropical China[J]. Scientific Reports, 2017, 7: 2856.
[5]刘其根, 李丰, 罗衡, 等. 引入养殖鳖对稻田土壤固氮菌的影响[J]. 应用与环境生物学报, 2018, 24: 483-492.
[6]罗衡, 赵良杰, 李丰, 等. 养殖鳖的引入对稻田土壤细菌群落结构的影响[J]. 水产学报, 2018, 42: 720-732.
[7]CAI S M, LV W G, ZHU H T, et al. Effect of nitrogenapplication rate on soil fungi community structure in arice-fish mutualistic system[J]. Scientific Reports, 2019,9: 16188.
[8]HU L L, REN W Z, TANG J J, et al. The productivity oftraditional rice-fish co-culture can be increased withoutincreasing nitrogen loss to the environment[J]. Agriculture,Ecosystems amp; Environment, 2013, 177: 28-34.
[9]KOIZUMI N, MORI A, MINETA T, et al. Plant speciesidentification using fecal DNAs from red-eared slider andReeves’ pond turtle in agricultural canals for rural eco-system conservation[J]. Paddy and Water Environment,2017, 15(4): 723-730. .
[10]盛瀛. 稻鳖共作对稻飞虱的防控效果[J]. 浙江农业科学, 2019, 60(6): 933-934.
[11]WAN N F, LI S X, LI T, et al. Ecological intensificationof rice production through rice-fish co-culture[J]. Journalof Cleaner Production, 2019, 234: 1002-1012.
[12]XIE J, HU L L, TANG J J, et al. Ecological mechanismsunderlying the sustainability of the agricultural heritagerice-fish coculture system[J]. Proceedings of the NationalAcademy of Sciences of the United States of America,2011, 108(50): 1381-1387.
[13]GE L, SUN Y, LI Y, et al. Ecosystem sustainability ofrice and aquatic animal co-culture systems and a synthesisof its underlying mechanisms[J]. Science of the TotalEnvironment, 2023, 880: 163314.
[14]梁玉刚. 垄作稻鱼鸡共生系统水稻产量形成及其生态学效应研究[D]. 长沙: 湖南农业大学, 2020.
[15]SUN C X, ZHANG D D, LIU W B, et al. Growth performance,digestion and metabolism to fish meal replacementby rice protein concentrate in Chinese soft-shelledturtle Pelodiscus sinensis[J]. Aquaculture, 2018, 492:321-326.
[16]ZHANG J, HU L, REN W, et al. Rice-soft shell turtle cocultureeffects on yield and its environment[J]. Agriculture,Ecosystems amp; Environment, 2016, 224: 116-122.
[17]GUO L, ZHAO L F, YE J L, et al. Using aquatic animalsas partners to increase yield and maintain soil nitrogen inthe paddy ecosystems[J]. eLife, 2022, 11: 73869.
[18]ZHAO J, ZOU Y, CHEN H, et al. Effects of stockingdensity of Chinese soft-shelled turtle and interactionsbetween cultivated species on growth performance andthe environment in a turtle-rice coculture system[J].Journal of the World Aquaculture Society, 2020, 51(3):788-803.
[19]WU B L, CHEN J, HUANG L, et al. Dynamics of soilfertility and microbial community response to stockingdensity in rice-turtle co-culture[J]. Aquaculture Reports,2021, 20: 100765.
[20]WU B L, HUANG L, WU C C, et al. Comparative analysisof the growth, physiological responses, and gene expressionof Chinese soft-shelled turtles cultured in differentmodes[J]. Animals, 2024, 14(6): 962.
[21]ASSAN D, HUANG Y, MUSTAPHA U F, et al. Fishfeed intake, feeding behavior, and the physiological responseof apelin to fasting and refeeding[J]. Frontiers inEndocrinology, 2021, 12: 798903.
[22]KAUSSHIK S J. Feed management and on-farm feedingpractices of temperate fish with special reference to salmonids[J]. FAO Fisheries and Aquaculture Technical Paper,2013, 583: 519-551.
[23]LUO L, LI T L, XING W, et al. Effects of feeding ratesand feeding frequency on the growth performances of juvenilehybrid sturgeon, Acipenser schrenckii Brandt♀×A.baeri Brandt♂[J]. Aquaculture, 2015, 448: 229-233.
[24]李笑天, 刘宝良, 费凡, 等. 投喂策略对水产动物生长生理及行为特征影响研究进展[J]. 渔业现代化, 2020,47(2): 7-15.
[25]魏凤. 秸秆还田和投食对稻虾共作系统小龙虾食源和水生生物多样性的影响[D]. 武汉: 华中农业大学, 2023.
[26]PARK J C, KODAMA K, OYAMA M, et al. Changes infeeding habits of the starspotted smooth-hound, Mustelusmanazo, in Tokyo Bay between periods with differentstock size levels[J]. Marine Pollution Bulletin, 2020, 152:110863.
[27]HU Y, YANG T, LIU Y, et al. High fish stocking densityweakens the effects of rice-fish co-culture on watereutrophication and greenhouse gas emissions[J]. Water,Air, amp; Soil Pollution, 2022, 233(6): 222.
[28]周勇, 李皓轩, 董洪瑞, 等. 基于小龙虾田间分布的稻虾共生机制探究[J]. 华中农业大学学报, 2022, 41(4): 202-209.
[29]刘雯, 李娜, 鞠民, 等. 在不同稻渔共作模式下中小型土壤动物群落特征研究[J]. 江西师范大学学报(自然科学版), 2021, 45(2): 188-193.
[30]ZHANG K, PENG H H, XIA Y, et al. Evaluating ecologicalmechanisms and optimization strategy of rice-fishco-culture system by ecosystem approach[J]. Aquaculture,2022, 560: 738561.
[31]DUAN M C, HU W H, LIU Y H, et al. The influence oflandscape alterations on changes in ground beetle (Cara-bidae) and spider (Araneae) functional groups between1995 and 2013 in an urban fringe of China[J]. Science ofthe Total Environment, 2019, 689: 516-525.
[32]申祺, 李蔚然, 于小彭, 等. 稻蟹共作对稻田生物影响的研究进展[J]. 北方水稻, 2021, 51(5): 59-62.
[33]桑海旭, 马晓慧, 王井士, 等. 稻蟹共养对水稻有害生物控制效果评价[J]. 北方水稻, 2021, 51(2): 17-20.
[34]蔡羽娟. 江汉平原稻农施药次数的影响因素及其对稻田节肢动物的影响[D]. 武汉: 华中农业大学, 2023.
[35]陈炼, 吴琳, 刘燕, 等. 环境DNA metabarcoding 及其在生态学研究中的应用[J]. 生态学报, 2016, 36(15): 4573-4582.
[36]ZHANG S, ZHENG Y T, ZHAN A B, et al. EnvironmentalDNA captures native and non-native fish communityvariations across the lentic and lotic systems of amegacity[J]. Science Advances, 2022, 8(6): eabk0097.
[37]MÉHEUST E, ALFONSI E, LE MÉNEC P, et al. DNAbarcodingfor the identification of soft remains of prey inthe stomach contents of grey seals (Halichoerus grypus)and harbour porpoises (Phocoena phocoena)[J]. MarineBiology Research, 2015, 11(4): 385-395.
[38]MORAN Z, ORTH D J, SCHMITT J D, et al. Effectivenessof DNA barcoding for identifying piscine prey itemsin stomach contents of piscivorous catfishes[J]. EnvironmentalBiology of Fishes, 2016, 99(1): 161-167.
【责任编辑 庄 延】
基金项目:国家自然科学基金青年项目(32101305);安徽省农业科学院青年英才计划(QNYC-202215);安徽省水产产业技术体系(皖农科[2021]711 号)
