鹿茸中水溶性成分提取方法研究
2024-01-01周远卓安楠王松涛岳媛媛严立石吴丽娜
周远卓 安楠 王松涛 岳媛媛 严立石 吴丽娜*
(1.南京师范大学& 食品与制药工程学院 江苏南京 210023;2.泸州老窖股份有限公司;3.苏州科技大学化学与生命科学学院)
0 引言
鹿茸是鹿科动物梅花鹿或马鹿的雄鹿未骨化密生茸毛的幼角[1],是一种传统名贵中药材,作为最重要的动物药之一,已被广泛应用于各种功能的保健用品。 鹿茸中含有钾、钙、钠、镁等无机元素[2],蛋白质、氨基酸、多糖、雌激素、磷脂、脂肪酸等有机物质[3-6],以及人体所必需的多种常量和微量元素, 这些物质是鹿茸具有特殊药理作用的主要物质基础。 鹿茸中含有的生物活性成分,具有促进机体新陈代谢、提高免疫力、抗疲劳[7]、抗炎[8]、调节心血管系统、改善人体机能[7-9]等功效。 ZHAO 等[10]通过生物实验证明了酶解鹿茸蛋白得到的多肽活性物质, 能促使骨细胞有丝分裂,进而修复骨组织损伤[9]。 肖响等[11]研究发现鹿茸蛋白可以通过调控凋亡相关蛋白减轻缺血缺氧对心肌细胞造成的损伤, 从而维持细胞线粒体膜电位稳定性,减少细胞凋亡。
鹿茸水溶性成分主要包括蛋白质、氨基酸、多糖等,其中蛋白质和多糖是具有生物功能的活性物质。赵玉红等[4]以梅花鹿鹿茸为原料,采用缓冲溶液提取水溶性蛋白质,设计优化提取条件,并对产物组分进行分级和分子质量分析, 得出鹿茸水溶性蛋白质的最佳提取工艺条件为pH 9.18,料液比1.0 g:60.4 mL,提取时间5.9 h,得到的蛋白提取量为90.84 mg/g。宋佳[12]依据水提醇沉的原理,以水作为提取溶剂进行超声提取, 从而提取出鹿茸粗多糖, 随后用Sevage法纯化去除蛋白质。该方法提取工艺稳定、简单,提取出的多糖含量较高,其多糖含量在18.34~31.74 mg/g范围内。
蛋白酶是一种生物活性物质, 作用于蛋白质或者多肽类,在医药、纺织、食品、有机合成等工业应用方面有着十分广泛的作用。相比于浸提法,蛋白酶水解法能高效分解蛋白质,同时无副产物生成,并且能耗低、绿色环保、操作简便、使用安全。李冰等[13]以碱性蛋白酶和胰蛋白酶为供试酶类, 采用响应面试验设计优化单酶水解条件,并确定双酶复合水解方案,确定了鹿茸胶原多肽碱性蛋白酶和胰蛋白酶复合水解的工艺条件。目前催化蛋白质水解的酶种类很多,重要的有胃蛋白酶、胰蛋白酶、木瓜蛋白酶等。因此,本研究选取胃蛋白酶、胰蛋白酶、菠萝蛋白酶、木瓜蛋白酶以及复合酶(木瓜蛋白酶、菠萝蛋白酶、胰蛋白酶)进行对比鹿茸中有效成分的分解。
本研究以梅花鹿鹿茸为原料, 对比普通浸提法和酶解法,综合传统提取方法,选用木瓜蛋白酶、菠萝蛋白酶、 胃蛋白酶、 胰蛋白酶以及多酶复合条件下,对鹿茸水溶性成分进行提取以及测定,旨在优化鹿茸中总提物的最佳提取工艺条件, 以提高鹿茸成分的利用效率,节约生产成本,为食品行业高效利用鹿茸提取物中活性物质的进一步应用提供依据。
1 材料与方法
1.1 实验材料
梅花鹿鹿茸, 来自吉林省长春市、 吉林省白山市、吉林省吉林市,均为二杠锯茸,具有典型分枝,为带血茸,经粉碎机粉碎过筛后待用。
乙醇(纯度95%)、木瓜蛋白酶(批号:C13585358)、菠萝蛋白酶(批号:C12814383)、胃蛋白酶(批号:C12414891)、胰蛋白酶(批号:C13139644)(上海麦克林生化科技有限公司);苯酚(上海凌峰化学试剂有限公司);FDTMBradford 蛋白定量试剂盒(弗德生物科技有限公司);16 种氨基酸标准品(纯度>99%,北京振翔科技有限公司)。
本实验用水均为超纯水。
1.2 主要仪器
电热恒温鼓风干燥箱(上海精宏实验仪器设备有限公司);多功能微孔板检测仪(基因有限公司);恒温振荡器(上海一恒科学仪器有限公司);pH 计(宝成生物供应商);落地离心机(香港Gene 公司);电子天平(梅特勒—托利多仪器(上海)有限公司);艾科浦超纯水机(重庆颐洋企业发展有限公司);LCMS-8050 三重四极杆液质联用仪(岛津公司);超高效液相色谱-四极杆-静电场轨道阱高分辨质谱联用仪(美国Thermo Fisher 公司)。
1.3 实验方法
1.3.1 冷浸法提取蛋白质、氨基酸
准确称取鹿茸粉末1.00 g,分别放置于含有25 mL水、25 mL 20%乙醇、25 mL 10%乙醇的圆底螺口瓶中,密封振摇6 h,静置18 h 后,于干燥滤器中迅速滤过,滤液备用,每组试验重复3 次。
1.3.2 热浸法提取蛋白质、氨基酸
准确称取鹿茸粉末1.00 g,置于250 mL 圆底烧瓶中,分别准确加入25 mL 水、25 mL 20%乙醇、25 mL 10%乙醇,密封称重后,静置1 h,连接回流冷凝管油浴加热至微沸1 h,冷却后取下,进行密塞称重,用水补足流失的重量摇匀后,干燥器中迅速滤过,滤液备用,每组试验重复3 次。
1.3.3 酶解法提取蛋白质、氨基酸
1.3.3.1 木瓜蛋白酶
准确称取鹿茸粉末1.00 g, 加入8 mL 超纯水,调节溶液pH 值为7, 加入0.05 g 木瓜蛋白酶,50℃酶解11 h 后,于100℃进行灭酶15 min,冷却静置。6 000 r/min 离心10 min。 过滤, 取上清液(即酶解液),放入4℃冰箱保存,备用,每组试验重复3 次。
1.3.3.2 菠萝蛋白酶
准确称取鹿茸粉末1.00 g, 加入8 mL 超纯水,调节溶液pH 值为7, 加入0.05 g 菠萝蛋白酶,50℃酶解11 h 后,于100℃进行灭酶15 min,冷却静置。6 000 r/min 离心10 min。 过滤,取上清液(即酶解液),放入4℃冰箱保存,备用,每组试验重复3 次。
1.3.3.3 胃蛋白酶
准确称取鹿茸粉末1.00 g,加入23 mL 超纯水,调节溶液pH 值为2(1 mol/L CH3COOH),加入0.05 g胃蛋白酶,50℃酶解5 h 后,于100℃进行灭酶15 min,冷却静置。 6 000 r/min 离心10 min。 过滤,取上清液(即酶解液),放入4℃冰箱保存,备用,每组试验重复3 次。
1.3.3.4 胰蛋白酶
准确称取鹿茸粉末1.00 g,加入10 mL 超纯水,调节溶液pH 值为8(1 mol/L NaOH),加入0.05 g 胰蛋白酶,50℃酶解5 h 后,于100℃进行灭酶15 min,冷却静置。 6 000 r/min 离心10 min。 过滤,取上清液(即酶解液),放入4℃冰箱保存,备用,每组试验重复3 次。
1.3.3.5 复合酶
准确称取鹿茸粉末1.00 g,加入10 mL 超纯水,调节溶液pH 值为7.5(1 mol/L NaOH),依次加入木瓜蛋白酶、菠萝蛋白酶、胰蛋白酶各0.016 7 g,50℃酶解10 h 后,于100℃进行灭酶15 min,冷却静置。6 000 r/min 离心10 min。 过滤, 取上清液(即酶解液),放入4℃冰箱保存,备用,每组试验重复3 次。
1.3.4 水提醇沉法提取多糖
准确称定鹿茸粉末1.00 g, 将脱脂鹿茸粉末置于250 mL 圆底烧瓶中按照1∶35 的液料比加入蒸馏水,于80℃水浴中浸提,离心,分离沉淀与上清,将上清液旋蒸浓缩至10 mL,加入4 倍体积95%乙醇,于冰箱中静置12 h,离心取沉淀,60℃烘干得疏松粉末,称重,用5 倍体积的超纯水复溶,复溶后离心取上清液1 mL,稀释100 倍,备用,每组试验重复3次。
1.3.5 方法学考察
1.3.5.1 精密度实验
取冷浸法、热浸法、酶解法得到的滤液各5 份,精密称取滤液2.5 mL,置于已干燥至恒重的蒸发皿中,于水浴锅中蒸干,105℃烘箱干燥3 h 后,放于干燥器中冷却0.5 h 至室温,称重,分别计算水溶性成分提取率及RSD(SD/平均数)值,得出水溶性成分提取率的RSD 分别为1.31%、1.29%、1.21%,说明不同提取方式的精密度均良好。
1.3.5.2 重复性实验
取冷浸法、热浸法、酶解法得到的滤液各2.5 mL,每份样品重复3 次,置于已干燥至恒重的蒸发皿中,于水浴锅中蒸干,105℃烘箱干燥3 h 后, 放于干燥器中冷却0.5 h 至室温,称重,分别计算水溶性成分提取率及RSD 值, 得出水溶性成分提取率的RSD均<3%,说明不同提取方式均具有良好的重现性。
1.3.5.3 稳定性试验
取冷浸法、热浸法、酶解法得到的滤液各2.5 mL,置于已干燥至恒重的蒸发皿中, 于水浴锅中蒸干,105℃烘箱干燥3 h 后, 放于干燥器中冷却0.5 h 至室温后取出,分别于0、2、4、6、8 d 后称重,计算水溶性成分提取率及计算RSD 值,得出水溶性成分提取率的RSD 分别为1.62%、1.29%、1.87%,说明不同提取方式均具有良好的稳定性。
1.3.5.4 准确度试验
利用加样回收法,取冷浸法、热浸法、酶解法得到的滤液各2.5 mL,分别按3 种物质(蛋白质、多糖、核苷酸) 质量百分含量的50%、100%、150%加入3种物质的对照品溶液, 按照优化所得到的最终条件提取样品, 分析并计算3 种物质的加样回收率及RSD 值。加样回收率试验结果显示3 种活性成分的加样回收率分别为100.92%、99.86%、100.37%,均在95%~105%范围内,其RSD 分别为1.82%、1.99%、1.27%,表明该方法回收率高,满足分析测定的要求。
1.3.6 数据处理
试验结果取3 次平行试验的平均值, 数据表示为平均值±标准差(,n=3)。
1.4 检测方法
1.4.1 浸出物得率分析
参照 《中国药典》2015 年版附录2201 测定方法中的操作规程,计算各浸出物得率。 精密称取滤液5 mL,置于已干燥至恒重的蒸发皿中,于水浴锅中蒸干,105℃烘箱干燥3 h 后, 放于干燥器中冷却0.5 h 至室温,称重。 根据公式(Ⅰ):水溶性成分提取率= (提取所得质量/样品总质量)×100%,计算水溶性成分提取率,其中,水溶性成分主要包括鹿茸蛋白质、氨基酸、多糖等成分。
1.4.2 FDTM Bradford 蛋白定量试剂盒测定可溶性蛋白
采用微孔酶标仪法进行蛋白质含量测定。 完全溶解BSA 蛋白标准品(5 mg/mL),用PBS 稀释液进行稀释,使其终浓度为0.2 mg/mL。 用双蒸水将混匀后的5×G250 染色液稀释至1×G250 染色液。将标准品按0、1、2、4、6、8、12、16、20 μL 分别加入到96 孔板的标准品孔中, 加PBS 稀释液补足到20 μL。 同时,加2 μL 离心后样品到96 孔板的样品孔中,并用PBS 稀释液补足至20 μL。 各孔均加入200 μL 1×G250 染色液,于室温放置3~5 min 后,用酶标仪测定595 nm 处的吸光度。最终可根据标准曲线和样品体积计算出样品的蛋白质浓度。
1.4.3 苯酚-硫酸法测定多糖得率
准确称取葡萄糖对照品10.0 mg, 置于100 mL容量瓶中,加水定容至刻度线。准确量取0、0.2、0.4、0.6、0.8、1.0、1.2 mL,分别加入到试管中,依次加入蒸馏水使其终体积为2 mL,各管加入1.0 mL 6%苯酚,混匀,于冰浴中加入5 mL 浓硫酸,摇匀,沸水浴20 min,静置至室温。 在490 nm 处测定吸收度,以多糖浓度为横坐标, 以吸光度为纵坐标, 绘制标准曲线。 同时, 将处理后的鹿茸粗多糖样品置于50 mL容量瓶中,水解并稀释至刻度,得到供试品溶液,准确吸取多糖供试品溶液10 μL,稀释100 倍,按照上述步骤加入苯酚及硫酸,测得吸光度。根据公式(Ⅱ)多糖得率=(烘干后多糖质量/鹿茸粉末质量)×100%,计算多糖得率。
1.4.4 液相色谱-质谱联用测定氨基酸
采用液相色谱-质谱联用技术定量检测鹿茸氨基酸。采用TSKgel Amide-80(2 mm×150 mm,3 μm)分析柱,流动相为0.2%甲酸溶液(A)-乙腈(B),梯度洗脱 (0~3.5 min,60%~80% B;3.5~4.5 min,80%B;4.5~4.6 min,80%~60% B;4.6~6.1 min,60% B);仪器参数为:流速为0.2 mL/ min;柱温为40℃;进样量为2 μL;采用正离子、多反应检测模式;气帘气压力241.32 kPa;离子化温度为550℃;喷雾电压为5 500 V。
1.4.5 高分辨质谱进行提取物中非靶向代谢物质检测
色谱条件:色谱柱为ACQUITY UPLC HSS T3(2.1mm×100mm,1.8μm),柱温为40℃,进样量为3μL。正离子模式:A:0.1%甲酸水、B:0.1%甲酸乙腈;负离子模式:A:水(2 mM 乙酸铵)、B:乙腈。
质谱条件:雾化气压:60 Psi,辅助气压:60 Psi,气帘气压:35 Psi, 温度:650℃, 喷雾电压:5 000 V(正离子模式)或-4 000 V(负离子模式)。
2 结果与分析
2.1 鹿茸中浸出物得率计算
由公式(Ⅰ)计算出不同提取方式下鹿茸中水溶性成分提取率如表1 所示。
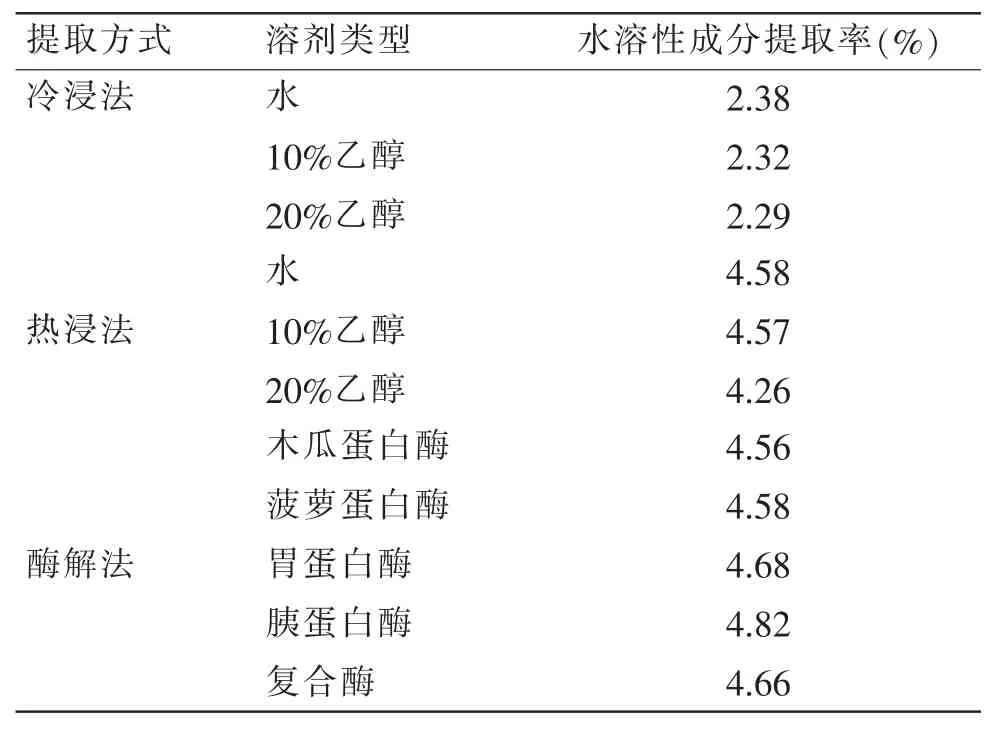
表1 鹿茸中水溶性成分提取率Table 1 Extraction rate of water-soluble components in velvet antler
从表1 可以看出, 热浸法和酶解法得到的鹿茸中水溶性成分提取率均在4%~5%之间,冷浸法得到的提取率较低,约为2%,不高于2.5%。其中,热浸法鹿茸中水溶性提取率明显高于冷浸法, 可能是因为随着温度的提高, 目标化合物的溶解度和传质速率有所增加,有利于萃取。 经对比发现,较高浓度的乙醇不利于鹿茸水溶性多糖和蛋白的溶解, 从而使得提取率降低。 此外,酶解法得到的水溶性成分较高,是由于酶在适宜条件下的分解作用, 使得目标化合物分解在溶液中, 不同酶处理的鹿茸水溶性成分提取率相差不大。
2.2 鹿茸中蛋白质含量测定
采用Bradford 法测定蛋白质含量。 以BSA 浓度(mg/mL)为横坐标,以A595nm吸光度值为纵坐标,得出鹿茸中蛋白质含量测定的标准曲线回归方程为Y= 1.728 9X+0.008 88,R2=0.997 22,线性范围为0~0.18 mg/mL。 不同提取方式下鹿茸中蛋白质含量如图1(a)所示。

图1 不同提取方式蛋白质含量(a)、多糖得率(b)Fig.1 Protein content(a),yield of polysaccharides(b) by different extraction methods
鹿茸水溶性蛋白主要为小分子蛋白。 由图可看出,酶解法提取物中蛋白质含量在80~206 mg/g,其中最低的为胰蛋白酶提取物,蛋白质含量为88.2 mg/g,最高的为木瓜蛋白酶提取物,蛋白质含量为205.9 mg/g。20%乙醇作为溶剂的热浸法得到的蛋白质含量较高,为210 mg/g,冷浸法(20%乙醇作为溶剂)得到的蛋白质为180 mg/g。 对比发现酶解法提取物中蛋白质含量较溶剂浸提法低, 其原因为酶将蛋白质分解为多肽、氨基酸等小分子物质。
2.3 鹿茸中多糖得率的测定
采用苯酚-硫酸法测定多糖得率。 以多糖浓度为横坐标,以A490nm吸光度值为纵坐标。 得出回归方程为Y=0.006 02X-0.025 79,R2=0.990 41。 根据公式(Ⅱ)进行糖得率的计算。由实验结果可知,冷浸法提取工艺未提取出多糖, 可能是由于浸提温度太低未提取到鹿茸的多糖分子。 不同提取方法的的多糖得率如图1(b)所示,热浸法多糖得率为10.56%,木瓜蛋白酶提取法的多糖得率为6.24%, 多酶提取法的多糖得率为9%,胃蛋白酶为5.88%,胰蛋白酶提取法得到的多糖得率最高为11.61%,最低得率为菠萝蛋白酶的3.26%。
2.4 鹿茸中氨基酸含量的测定
采用TSKgel Amide-80 (2 mm×150 mm,3 μm)分析柱, 以0.2%甲酸溶液-乙腈为流动相, 梯度洗脱;流速为0.2 mL/min;检测器为QTRAP 5500 质谱仪; 对鹿茸提取物中16 种氨基酸类成分进行检测。图2 为氨基酸标准溶液(10 μg/mL)的色谱图。

图2 16 种氨基酸标准溶液(10 μg/mL)的色谱图Fig.2 Chromatograms of the 16 amino acids standard solutions (10 μg/mL)
分别取适量16 种氨基酸标准溶液,用超纯水稀释,按1.4.4 条件测定,以各标准物质的质量浓度(x,mg/L)为横坐标,峰面积(y)为纵坐标绘制标准曲线,计算回归方程。 按信噪比(S/N)=3 计算仪器检出限(IDL)。16 种氨基酸的线性范围为10.0~200.0 mg/L,在该范围内相关系数(R2)均≥0.999 0,线性良好。16种氨基酸的保留时间、回归方程、R2、IDL 见表2。

表2 16 种氨基酸的保留时间及线性范围考察Table 2 Retention times and investigation on linearity range of 16 amino acids
将不同提取条件下的氨基酸总量进行对比(见表3),可知不同条件下鹿茸氨基酸总量有较大差异。其中,酶解法,尤其在胰蛋白酶条件下,测得的小分子含量最高,为11.42 mg/g,证明相较于其他酶解条件,胰蛋白酶对于鹿茸蛋白具有更高的分解效率。

表3 鹿茸中浸出物中氨基酸总量Table 3 Total amino acids in antler extract
由于蛋白质为鹿茸中的主要成分, 故根据上述实验中鹿茸水溶性提取物中蛋白质含量结果, 选取冷浸法20%乙醇作为溶剂、热浸法20%乙醇作为溶剂、胰蛋白酶酶解法作为代表性样品,测得16 种氨基酸含量分布如图3 所示。 胰蛋白酶酶解法较20%乙醇作为溶剂的冷浸法和热浸法, 得到了更多的L型氨基酸和芳香族氨基酸。其中,胰蛋白酶酶解法中精氨酸含量为0.983 mg/g,是冷浸法的12 倍,热浸法的7 倍;赖氨酸含量为0.984 mg/g,为热浸法的10倍;酪氨酸和苯丙氨酸含量分别为1.793、1.64 mg/g,均为冷浸法和热浸法的4 倍。 相较于冷浸法和热浸法, 胰蛋白酶酶解法还得到了较高含量的苏氨酸和缬氨酸,分别为1.111、1.092 mg/g。

图3 不同提取方式氨基酸测得值Fig.3 Measured values of amino acids by different extraction methods
2.5 鹿茸中水溶性成分最优工艺
经前期预实验的对比以及对乙醇浓度、 提取时间和料液比3 个因素进行单因素试验优化, 分别建立了浸提法最优提取工艺。 其中热浸法的最优工艺条件为:以20%乙醇作为提取溶剂,采取1∶25 的料液比, 浸提1 h 效果最佳。 冷浸法的最优工艺条件为:以20%乙醇作为提取溶剂,采取1∶25 的料液比,密封振摇6 h 效果最佳。
同时对胰蛋白酶酶解条件进行优化, 由于梅花鹿茸不溶于水, 其在水溶液中的酶催化反应属于非均相催化反应, 非均相催化底物与溶剂体系的固液比一般不宜超过10%,否则会引起传质和传热阻力从而影响目标产物得率, 而固液比太低又容易引起产物浓度过低阻碍后继分离纯化。因此,本研究采用1∶10 的固液比进行反应。 经前期预实验选择2%、5%、10%的酶底物比,结果分析2%酶底物比时得率较低,10%酶底物时得率相较于5%时产物得率没有显著变化,从成本以及得率变化考虑,选择5%的酶与底物之比为最优方案。另外,因为胰蛋白酶适合在碱性的环境进行催化反应, 在pH 为8,50℃左右可维持其最佳活性[14],因此本研究采用此反应条件进行胰蛋白酶对梅花鹿茸的提取。 故得到胰蛋白酶酶解具体工艺参数为:溶液pH 为8,底物固液比1∶10,酶底物比5%,50℃提取5 h。
对比鹿茸中水溶性成分提取率、多糖得率、氨基酸含量以及对水溶性成分进行的定性分析, 发现胰蛋白酶酶解的效果最优。其原因为在适宜的温度、pH条件下,胰蛋白酶将鹿茸蛋白成分进行有效分解,高效的将大分子物质降解为小分子氨基酸等物质。
胰蛋白酶是一种丝氨酸蛋白水解酶, 具有很强的专一性,作用于L 型氨基酸的精氨酸或赖氨酸所形成的肽键、酰胺键或者酯键[15],同时,其对底物的专一性类似于糜胰蛋白酶, 可优先切开羧基侧是芳香族氨基酸如酪氨酸、苯丙氨酸所构成的肽键。鹿茸蛋白为天然蛋白, 因此其氨基酸多为L 型氨基酸,且含有丰富的赖氨酸、 精氨酸、 酪氨酸和苯丙氨酸等,因此胰蛋白酶可以高效水解鹿茸蛋白为小分子,得到最高含量的小分子氨基酸,为11.42 mg/g。而胃蛋白酶、木瓜蛋白酶、菠萝蛋白酶专一性较低,特别是木瓜蛋白酶和菠萝蛋白酶具有广泛的特异性[16-17]。因此,基于上述机理,本实验对比不同种类酶对鹿茸中蛋白质的降解发现胰蛋白酶具有最优的效果。 由图3 所示,可验证胰蛋白酶法得到了更多含量的芳香族氨基酸以及赖氨酸、精氨酸,远高于冷浸法和热浸法。
因此,综合多种因素进行评判,得出鹿茸中水溶性成分最佳提取工艺为胰蛋白酶于pH 值为8 的适宜溶剂中,50℃酶解鹿茸5 h。
2.6 鹿茸提取物中非靶向代谢物质检测分析
通过使用飞行时间高分辨质谱(5600 QTOF)进行对比分析不同提取方式下鹿茸中水溶性提取物成分变化。对比发现,酶解法较其他方法提取出更多的成分,包括脯氨酸、组氨酸、蛋氨酸、鸟氨酸、瓜氨酸、色氨酸、苏氨酸、缬氨酸等氨基酸,鸟苷、肌苷、尿嘧啶等核苷/核苷酸,胆酸、十四烷二酸、2-羟基肉桂酸、肌酸、甘油酸等多种脂肪酸,雌三醇、2-羟基雌二醇等雌激素以及4′-甲基染料木黄酮、7-羟基-6-甲氧基二氢黄酮醇、2-甲基-5,7,8-三甲氧基异黄酮、4,5,7-三羟基异黄酮、 大豆黄酮等多种黄酮类物质。 不同提取方式水溶性成分对比如表4 所示。

表4 不同提取方式鹿茸水溶性成分Table 4 Water-soluble components of velvet antler in different extraction methods
3 结论
本研究对比了冷浸法、 热浸法和酶解法在梅花鹿鹿茸中水溶性成分提取实验的效率, 对提取物成分进行了定性分析,得到蛋白质、氨基酸、多糖等水溶性物质,并对酶解机理进行分析。通过对比不同提取方式下鹿茸中的水溶性成分,分析可知:胰蛋白酶酶解为鹿茸水溶性成分的最佳提取方式, 其具体条件为:pH 8, 底物固液比为1∶10, 酶底物比为5%,50℃提取5 h,得到的水溶性成分提取率为4.8%,氨基酸分子总量为11.42 mg/g,多糖得率为11.61%,均为相应含量的最高值。在此条件下,能得到较高的水溶性成分提取率以及氨基酸分子总量, 可以在较为温和的条件下, 更加高效地对梅花鹿茸中的水溶性成分进行提取。 本研究为鹿茸中水溶性成分的大量综合性提取奠定了基础, 为进一步高效合理利用鹿茸中活性成分提供了一定的依据。
