近红外荧光成像监测ENO1 mAb在宫颈癌荷瘤小鼠体内生物分布的研究
2023-12-30赵调红章婷婷陈圆圆路如霞赵源旭裴亚萍刘会玲祝秉东
赵调红, 章婷婷, 陈圆圆, 路如霞, 赵源旭,裴亚萍, 刘会玲*, 祝秉东
1. 甘肃中医药大学第一临床医学院, 甘肃 兰州 730000; 2. 甘肃省人民医院妇科,甘肃 兰州 730000;3. 兰州大学基础医学院, 甘肃 兰州 730000
烯醇化酶1(enolase 1,ENO1)作为糖酵解途径的关键酶之一,在宫颈癌及多种癌症中过度表达,并且与肿瘤的发生、发展、转移和侵袭密切相关[1]。因此,ENO1有望作为肿瘤诊断和治疗的靶点。近红外荧光成像(Near infrared fluorescence imaging,NIRF)作为一种非侵入性分子成像技术,为监测肿瘤进展和预测药物的治疗反应以及肿瘤靶向性提供依据[2,3]。张胜华等[4]用FITC标记靶向CD20的利妥昔单抗,活体成像分析荷瘤裸鼠体内的动态分布情况,结果显示该技术对监测抗体药物靶向肿瘤作用具有指导意义。
本研究前期利用真核细胞表达ENO1蛋白,并通过杂交瘤技术利用体内诱生腹水法成功制备了烯醇化酶1单克隆抗体(ENO1 monoclonal antibody,ENO1 mAb),采用正辛酸-硫酸铵沉淀法从腹水中进行粗提取,用Protein A亲和层析柱纯化得到纯度较高的ENO1 mAb,并且研究发现能够抑制宫颈癌细胞的侵袭、增殖和克隆形成[5]。本研究通过生物信息学方法分析ENO1在正常宫颈组织及宫颈癌中的表达差异,并分析其表达与宫颈癌分期及免疫浸润的相关性;其次,制备ENO1 mAb,通过NIRF监测其在宫颈癌荷瘤小鼠体内的生物分布、代谢以及肿瘤靶向效率。
1 材料与方法
1.1 一般材料
实验试剂:Cy7-NHS购自富佰科(中国),FITC、DAPI和DMSO购自Solarbio(中国),ENO1 mAb由本实验室制备和纯化,胎牛血清和RPMI-1640 medium购自GIBCO公司,细胞培养瓶和培养皿购自NEST(美国)。
宫颈癌TC-1细胞购买于上海富衡生物科技有限公司,培养于含10%胎牛血清和100 μg/mL青霉素/链霉素的RPMI-1640培养基中,置于37 ℃、5%CO2细胞培养箱中培养。
实验动物:雌性C57BL/6小鼠(6~8周龄)购自兰州大学动物中心,在无特殊病原体条件下饲养。
主要仪器:小动物成像系统[富佰科(中国)]和激光共聚焦显微镜(ZESS)。
1.2 生物信息学分析
从TCGA(portal.gdc.cancer.gov/)数据库中收集有关宫颈癌的临床数据,分析ENO1在正常组织和宫颈癌组织中的表达及其与生存预后的关系;用TIMER2.0(https://cistrome.shinyapps.io/timer/)研究ENO1的表达与不同免疫细胞的浸润水平的相关性;从HPA(https://www.proteinatlas.org/)数据库中下载宫颈癌患者临床标本中ENO1的蛋白表达免疫组织化学染色(immunohistochemistry,IHC)图像;利用GEPIA(http://gepia.cancer-pku.cn/index.html)研究ENO1的表达对肿瘤分期的影响;为了进一步分析ENO1表达与CESC糖酵解的相关性,我们采用R软件包(4.2.1版本)对TCGA CESC数据集糖酵解相关基因表达的相关性进行分析。
1.3 ENO1 mAb的制备和纯化
ENO1 mAb的制备和纯化参照文献[5],简要描述为体内诱生腹水法制备ENO1 mAb,然后用正辛酸-硫酸铵法从腹水中粗提取ENO1 mAb,用蛋白A层析纯化,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)验证。
1.4 Cy7-ENO1 mAb分子探针制备
Cy7-ENO1 mAb的制备参照文献[6]进行了部分改动。DMSO配置Cy7-NHS(MW 765.95)溶液浓度为10 mg/mL,将1 mg Cy7-NHS溶解于250 μL DMSO中,按照抗体与染料的投料比1∶3(摩尔比)加入ENO1 mAb溶液中,锡纸包裹置于摇床反应过夜后将混合物转移至10 kDa超滤管中,在4 ℃下以4000 r/min离心10 min,Cy7-NHS的相对分子量为720.94,而ENO1 mAb相对分子量为25000~50000,因此偶联物为上层溶液,游离的Cy7-NHS则被过滤至下层,取上层溶液用DMSO稀释至5 mL避光保存备用。
1.5 FITC标记ENO1 mAb
将纯化后的ENO1 mAb用PBS调整终浓度为1 mg/mL,调节pH至9.0。将FITC溶解于DMSO中,终浓度为5 mg/mL,避光保存;将1 mL ENO1 mAb和90 μL FITC溶液按照P∶F(蛋白∶FITC)=1 mg∶150 μg比例充分混合均匀,将混合物避光至摇床4 ℃摇晃反应12 h,然后将偶联物在PBS中透析至透析液清亮,将游离的FITC与抗体分离。
从表2可以看出,本同步系统在综合频率为400 MHz时,时间裕度为0.04。本方案采取四字节并行处理实现方案,故平均数据处理速率可达到12.5 Gbyte/s,满足JESD204B协议规范和要求。
1.6 宫颈癌荷瘤小鼠模型建立
待培养TC-1细胞长满培养瓶壁,弃去旧培养基,用PBS轻轻润洗细胞2~3次后,胰酶室温消化2 min,吹打分散后调整细胞悬液浓度为1×106/mL,将混合好的细胞悬液于小鼠左侧腹股沟皮下接种100 μL细胞悬液,待14 d后肿瘤生长至1 cm时备用。
1.7 激光共聚焦显微镜检测
TC-1细胞以2×105cells/孔在24孔板内的盖玻片上贴壁生长,37 ℃、5%CO2细胞培养箱过夜。PBS洗3次,加入500 μL FITC标记的ENO1 mAb(FITC-ENO1 mAb),4 ℃共同孵育2 h后弃去上清,PBS洗3次,4%多聚甲醛固定15 min,再用PBS将4%多聚甲醛冲干净,继续加入500 μL 10 μg/mL DAPI染核10 min,轻轻晃动使染料均匀覆盖所有细胞,PBS洗3次将DAPI冲洗干净,用激光共聚焦显微镜观察。
1.8 荷瘤鼠近红外荧光成像
按随机选取体质量相近的荷瘤鼠,分为6组,每组3只,尾静脉注射200 μL Cy7-ENO1 mAb,成像前每只小鼠腹腔注射1%戊巴比妥(40 mg/kg)进行麻醉,将小鼠仰卧位固定,分别于注射后1、6、24、48、72和120 h进行活体成像。活体成像观察结束后迅速将小鼠处死后解剖,分别取心脏、肺脏、肾脏、肝脏、脾脏、肠管、肌肉和肿瘤组织,用吸水纸擦干表面后对不同器官组织进行体外成像。
2 结果
2.1 ENO1在肿瘤中的表达
根据TIMER2.0数据库分析ENO1在人类癌症中的表达,ENO1在乳腺浸润性癌(BRCA)、宫颈腺癌和鳞癌(CESC)、结肠腺癌(COAD)、食管癌(ESCA)、头颈部鳞状细胞癌(HNSC)、肾嫌色细胞癌(KICH)、肾脏乳头状细胞癌(KIRP)、肺腺癌(LUAD)、肺鳞状细胞癌(LUSC)和胃腺癌(STAD)中的表达高于相应的正常组织(图1a)。在TCGA数据库和UALCAN数据库中,我们同样发现CESC组织中ENO1 mRNA的表达高于正常组织(图1b、c)。
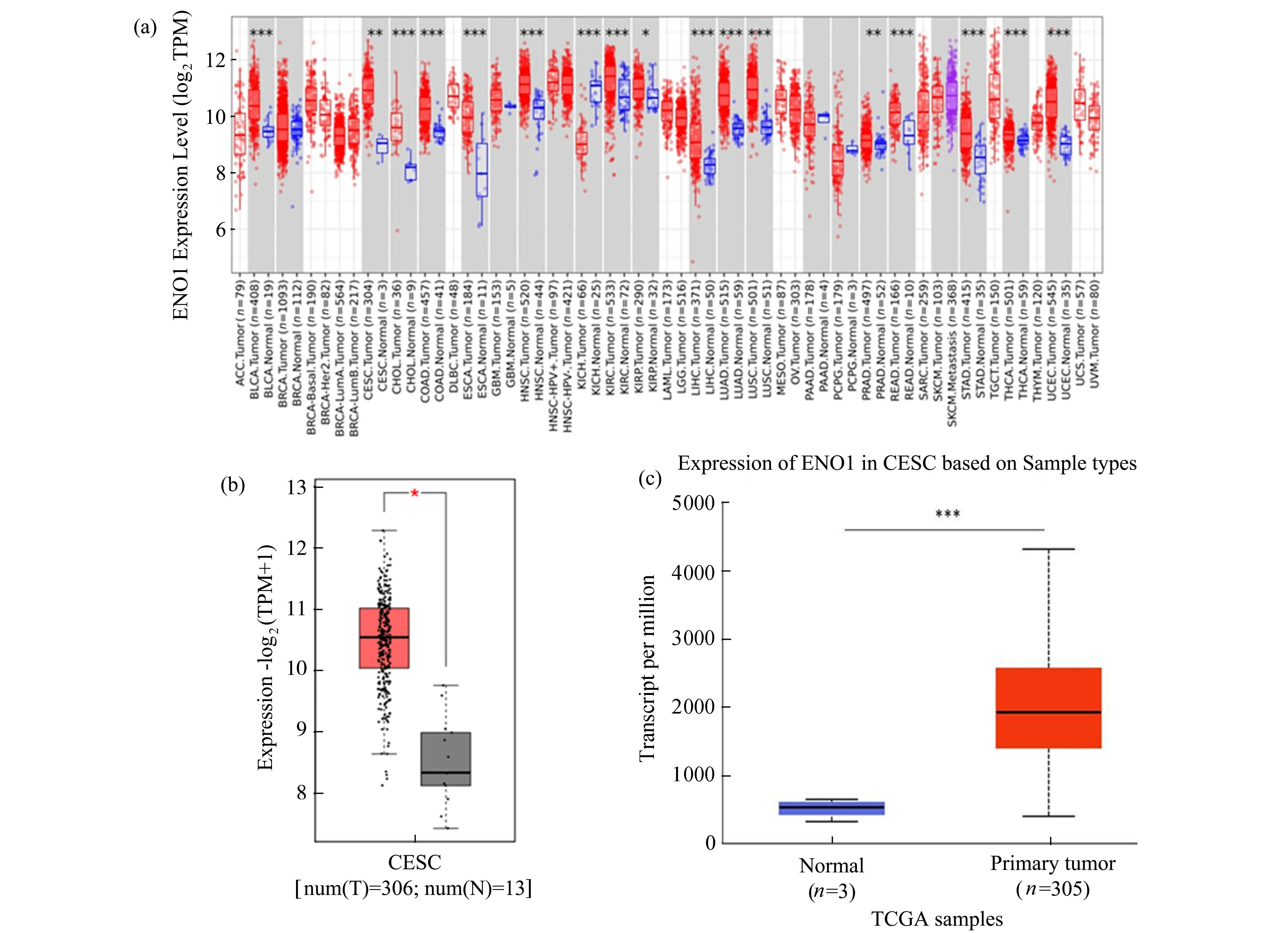
图1 ENO1在CESC中的表达(a)利用TIMER2.0数据库研究不同类型癌症中ENO1的表达差异;(b)正常宫颈组织和宫颈癌组织中ENO1的表达差异;(c)正常宫颈组织和宫颈癌组织中ENO1的表达差异。*表示P<0.05,**表示P<0.01,***表示P<0.001
2.2 ENO1在宫颈癌中蛋白表达情况
为了确定宫颈癌中ENO1的蛋白表达差异,从HPA数据库中获取了正常宫颈组织和宫颈癌组织中ENO1蛋白的IHC染色图像,结果显示宫颈癌组织中有较强的染色,其蛋白表达水平高于正常宫颈组织(图2)。
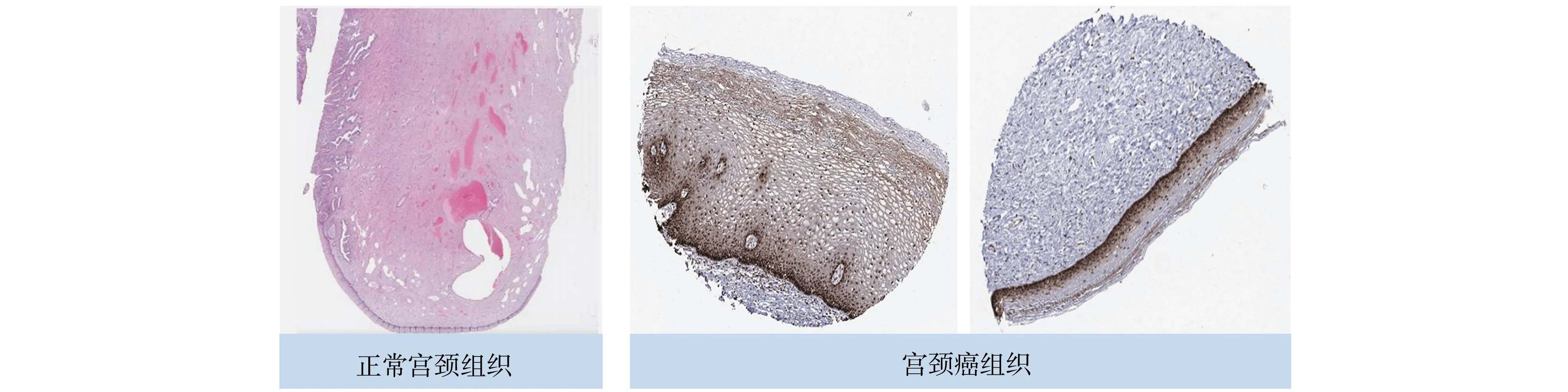
图2 正常宫颈组织(左)和宫颈癌组织(右)之间的ENO1表达差异所有IHC染色图像均来自HPA数据库
2.3 ENO1在宫颈癌中的表达与分期和淋巴结转移的相关性
根据不同的临床参数,研究ENO1在各组患者中的表达,在肿瘤分期方面CESC患者1、2、3、4期ENO1表达显著增加(图3a);根据癌症分期,在N0、N1级CESC患者中ENO1表达较高(图3b)。
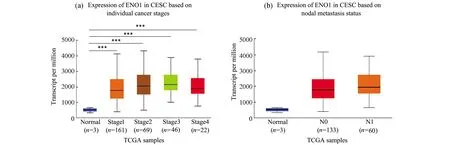
图3 评估不同组患者中ENO1表达的箱线图(a)肿瘤分期;(b)淋巴转移。N0:无区域淋巴结转移;N1:1~3个腋窝淋巴结转移。*表示P<0.05,* *表示P<0.01,* * *表示P<0.001
2.4 ENO1表达与肿瘤细胞免疫浸润的相关性
利用TIMER2.0数据库分析了ENO1表达与免疫浸润细胞的相关性(图4),发现在CESC中,ENO1表达与B细胞(r=-0.166,P=5.56E-3)和巨噬细胞(r=-0.207,P=5.37E-4)的浸润水平呈负相关。然而,ENO1表达与肿瘤纯度,CD4+T细胞(r=-0.061,P= 3.1E-1)、CD8+T细胞(r=-0.104,P= 8.54E-2)、树突状细胞(r=0.107,P=7.50E-2)、中性粒细胞(r=0.09,P=1.37E-1)之间没有观察到显著相关性(图4)。
2.5 ENO1与糖酵解基因共表达之间的相关性
肿瘤细胞的糖酵解增强在CESC的进展中起着重要作用。通过分析TCGA CESC数据集,研究ENO1与CESC中39个糖酵解相关基因表达的相关性。结果显示,ENO1表达与PRKAA2、PGM2L1、ENO3、IL13RA1、BIK、KIF20A、MIOX、EXT1、ARNT、FUT8、PPP2R1B、HK2、PHKA2、NUP155、B4GALT2、PLOD1、PAXIP1、ANG、NDC1、GAPDH、GUSB、PGK1、STMN1显著正相关(P<0.05)(图5),这些结果表明,ENO1的高表达与癌症的发生和不良预后密切相关。
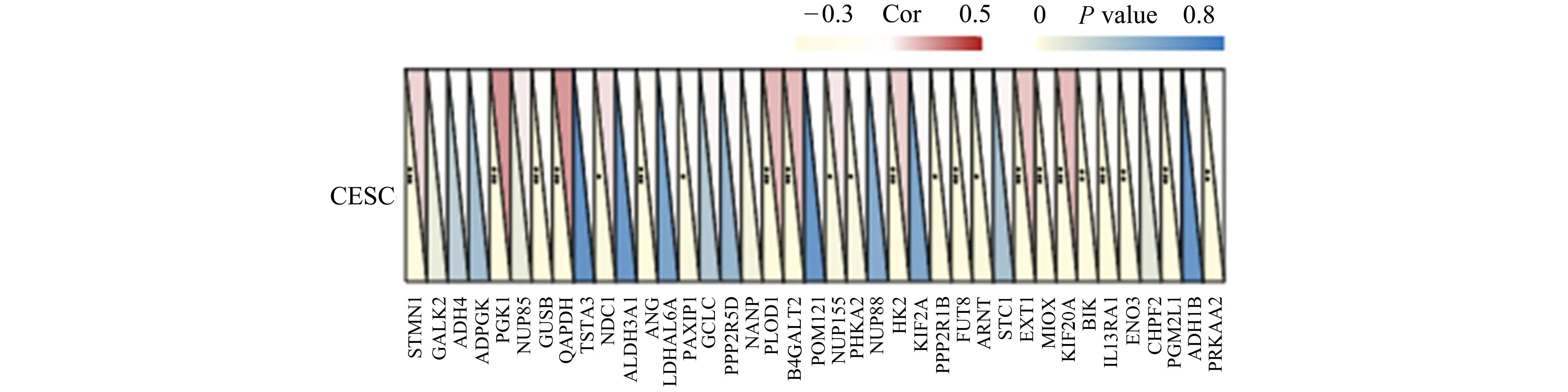
图5 CESC中ENO1表达与糖酵解基因之间关系的热图左下三角形表示P值,右上三角形表示相关系数(*表示P<0.05,**表示P<0.01,***表示P<0.001)
2.6 ENO1 mAb SDS-PAGE电泳结果

图6 ENO1 mAb的SDS-PAGE电泳分析图M. 蛋白marker;1. 粗提后ENO1 mAb;2. 纯化后ENO1 mAb;3. 流穿
2.7 激光共聚焦显微镜观察
激光共聚焦显微镜观察显示,TC-1细胞轮廓清楚(图7a),FITC标记ENO1 mAb呈绿色荧光(图7b);DAPI与细胞共同孵育后可见细胞核发出蓝色的荧光(图7c);两种图像模式融合观察到FITC-ENO1 mAb能特异性与TC-1细胞膜结合,绿色荧光均出现在细胞膜表面,细胞内未见FITC-ENO1 mAb分布(图7d)。
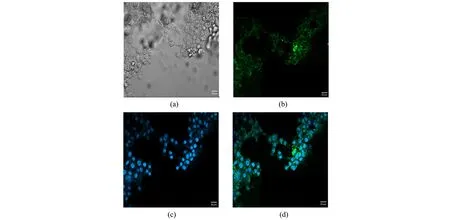
图7 激光共聚焦显微镜观察ENO1 mAb在TC-1细胞中的分布特征(a) 明场; (b) FITC标记的ENO1 mAb;(c) DAPI标记的细胞核;(d) 图b和c的融合图像。荧光成像显示FITC-ENO1 mAb特异性结合在细胞膜水平,未观察到细胞内化;蓝色代表DAPI的荧光,绿色代表FITC的分子荧光
2.8 ENO1 mAb在宫颈癌荷瘤小鼠体内分布
为了评估ENO1 mAb在体内的代谢和靶向肿瘤,我们将宫颈癌荷瘤鼠尾静脉注射Cy7-ENO1 mAb后,活体状态下在不同的时间点监测120 h。结果发现在1 h和6 h时ENO1 mAb主要分布在全身,但也可观察到特异性聚集在肿瘤区域。且随时间推移全身荧光信号逐渐减弱,但肿瘤区信号在24 h时富集最明显,48 h时肿瘤区信号消失(图8a)。为了进一步验证,解剖感兴趣脏器以及肿瘤组织进行体外成像,结果发现荧光信号主要分布在肾脏、肝脏、肿瘤组织中,24 h时肿瘤组织中出现荧光信号,48 h时信号消失,肾脏中荧光信号持续120 h仍未消失,肝脏中荧光信号72 h时消失(图8b)。
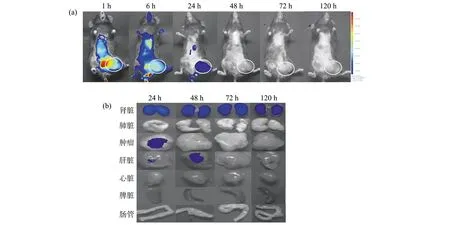
图8 TC-1宫颈癌小鼠体内外荧光图像(a) 体内荧光图像(圆圈区域为肿瘤所在位置); (b) 体外荧光图像
3 讨论
宫颈癌是威胁全球女性健康的恶性肿瘤之一,其死亡病例占7.7%[7]。尽管在早期诊断、靶向和免疫疗法方面取得了进展,但晚期宫颈癌预后较差[8]。探讨宫颈癌的预后生物标志物非常重要。糖酵解的增强与癌症的发生和不良预后密切相关,因此,靶向肿瘤糖酵解代谢是一种新的治疗策略[9]。ENO1作为一种双功能基因,主要编码糖酵解酶和c-myc结合蛋白(MBP-1),其基因产物在葡萄糖代谢和生长调节中具有重要作用[10,11]。ENO1在多种癌症类型中的过表达,包括胰腺癌、结直肠癌、膀胱癌、肺癌、胃癌、食管癌等,表达在细胞质中的ENO1催化2-磷酸甘油酸(2-PGA)转化为磷酸烯醇丙酮酸(PEP),表达在细胞膜表面的ENO1作为激活纤溶酶原的受体,促进肿瘤细胞的迁移和侵袭[12-18]。本研究中,通过生物信息学分析,发现ENO1在包括宫颈癌在内的多种癌症中高表达。
NIRF是一种用蛋白质或染料标记细胞的光学成像方法,因其灵敏度高、特异性强、成本低而成为首选的成像方法[19]。近红外荧光染料,如吲哚氰绿(ICG)、荧光素(FITC)、irdy700/800和菁染料5/7(Cy5/7),在人体中具有良好的耐受性,并已广泛应用于临床研究中,本研究采用的NIRF染料Cy7具有较高的荧光强度,且稳定性好,在活体成像研究中已代替放射性元素。
单克隆抗体靶向成像不仅用于监测疾病进展、预测治疗药物的效果,还可以递送抗肿瘤药物从而发挥有效的抗肿瘤作用[20]。Zhang等[6]研究发现将近红外染料与CC188 mAb偶联作为分子成像探针监测其在荷瘤鼠体内分布,结果发现CC188单抗的成像在卵巢癌早发现早治疗方面具有可行性。因此,本研究制备了针对ENO1的单克隆抗体(ENO1 mAb),通过近红外荧光染料Cy7-NHS标记ENO1 mAb用于宫颈癌的非侵入性显像,结果显示ENO1 mAb主要分布在肝脏、肾脏和肿瘤组织中,并且证实ENO1 mAb具有靶向宫颈癌细胞作用,这些结果证实了ENO1可能是宫颈癌预后的生物标志物,并可能促进靶向肿瘤治疗的进展。
研究表明荧光染料与抗体蛋白分子的游离氨基结合而不丧失抗体的免疫活性,由于研究经费有限,本研究使用了两种不同的荧光染料Cy7-NHS和FITC标记ENO1 mAb,由于ENO1 mAb分子量较大,激光共聚焦显微镜观察其主要定位在TC-1的细胞膜上,认为TC-1细胞膜表达的ENO1参与肿瘤的迁移和侵袭。抗肿瘤药物的生物安全性一直是肿瘤治疗关注的重点,在本研究中ENO1 mAb在肾脏富集120 h仍未代谢完全,因此,ENO1 mAb是否对肾脏产生毒性作用,有待进一步研究。此外,靶向基团和载体修饰的抗肿瘤药会改变其生物分布和靶向肿瘤效率,为抗肿瘤药物的发展提供依据,示踪剂具有早期发现转移淋巴结的潜力,下一步研究有希望将分子探针Cy7-ENO1 mAb应用于宫颈癌转移灶及转移性淋巴结的显像,为宫颈癌的早期发现和诊断提供新方法。
