基于骨髓间充质干细胞分离培养的原代细胞培养技术在细胞生物学实验课程中的应用和思考
2023-12-30吕欢欢刘悦彤王建萍
吕欢欢,刘悦彤,王建萍,吕 毅
西北工业大学生命学院,陕西 西安 710072
细胞生物学既是生命科学的基础学科,也是其前沿学科;对细胞的研究既是生命科学的出发点,又是生命科学的汇聚点[1]。细胞是生命活动的基本结构和功能单位。通过细胞培养可以获得大量细胞,并且生物学、药学、医学等诸多领域也都涉及细胞的研究,所以都离不开细胞培养技术的应用,这也进一步凸显了细胞培养技术在生物技术专业本科生实验技能培养过程中的重要性[2]。
细胞培养是开展细胞生物学研究的基础,也是生物学最基本的实验操作技术之一[3]。细胞培养可分为原代细胞培养和继代细胞培养。本文所研究的原代细胞培养是指直接从生物体内获取组织或者器官的一部分细胞进行培养,是获取细胞的主要手段,是建立各种细胞体系的第一步,也是从事组织或细胞培养相关研究工作必须掌握的一项基本技术[4]。
间充质干细胞是中胚层来源的成体干细胞,具有多向分化和自我更新能力[5-8]。骨髓中间充质干细胞的含量最为丰富,是最先被分离出来的成体干细胞。骨髓中的间充质干细胞在不同条件下可以诱导分化为成骨细胞、脂肪细胞、软骨细胞等,因此被广泛应用于骨相关疾病的治疗[9-10]。掌握骨髓间充质干细胞的分离和培养方法,了解骨髓间充质干细胞的定向诱导分化,有助于为后期利用骨组织工程技术治疗临床疾病提供理论依据。
1 教学设计
1.1 实验原理
原代细胞培养是指直接从动物体内获取所需组织(或器官)的一部分细胞,经分离或消化分散成单个游离细胞,在体外通过人工培养使其不断生长繁殖,直到第一次传代为止。但原代培养的组织由多种成分组成,比较复杂,一般需要对原代培养细胞进行传代,然后再开展后续实验。骨髓间充质干细胞的分离方法包括密度梯度离心法、全骨髓贴壁法、骨片消化爬片法等[11-13]。本实验将运用全骨髓法,根据干细胞在低血清培养基中具有贴壁优势的特性,从小鼠股骨和胫骨中获得全骨髓,通过多次换液得到较纯的骨髓间充质干细胞。
1.2 实验材料与设备
实验动物:8 周龄C57BL/6J 小鼠。
实验试剂:DMEM 高糖完全培养基(含10%胎牛血清和1%霉素/链霉素混合液),75%酒精。
实验耗材和设备:倒置显微镜、离心机、水浴锅、CO2培养箱、超净工作台、无菌眼科剪刀、眼科镊子、离心管、纱布、注射器、9 cm 细胞培养皿和6 cm 细胞培养皿。
1.3 实验步骤
1.3.1 实验小鼠骨头的取材
将小鼠用异氟烷麻醉后,予以颈椎脱臼处死,然后用75%酒精浸泡消毒10 min。将无菌的眼科剪刀、镊子、纱布、离心管、注射器、培养皿等器材放入超净工作台中。在超净工作台中,将小鼠平放在9 cm 细胞培养皿中,腹部朝上,取出小鼠双侧长骨包括股骨和胫骨,并剥离附着在长骨上的毛发和皮肤等(见图1)。

图1 实验小鼠骨头的取材
1.3.2 制备骨髓收集管
准备1.5 mL 和0.5 mL 的无菌离心管。将0.1 mL 预热的DMEM 完全培养基置于1.5 mL 离心管中,用注射器针头在0.5 mL 离心管底部扎几个小孔。将打孔的0.5 mL 离心管放入1.5 mL 离心管中(见图2)。

图2 制备骨髓收集管
1.3.3 股骨和胫骨的清理
去除掉附着在长骨上的肌肉组织,用纱布将残留在长骨上的肌肉擦拭干净,剪断长骨,分离股骨和胫骨,并从骨头中间剪断,将断口朝下放在0.5 mL离心管中,将1.5 mL 离心管管盖剪断,盖上0.5 mL离心管的盖子,用封口膜密封离心管(见图3)。

图3 股骨和胫骨的清理
1.3.4 离心收集骨髓
在4 000 r/min 的转速下离心5 min,离心完成后取出0.5 mL 离心管,可以看到股骨和胫骨已经泛白,表明股骨和胫骨中的骨髓已经离心到了1.5 mL离心管中。取出1.5 mL 离心管中的样品加入含有完全培养基的新的1.5 mL 离心管中。再将该新的1.5 mL 离心管在1 000 r/min 的条件下离心10 min。离心过程中,准备好培养皿,并做好标记(见图4)。
1.3.5 培养细胞
向细胞培养皿中加入DMEM 完全培养基。弃去第二次离心后离心管中的上清液,得到培养基重悬细胞沉淀。将细胞悬液转移至细胞培养皿中,轻轻摇匀,使细胞在培养皿中均匀分布(见图5)。在37℃、5% CO2培养箱中静置培养,培养期间不得晃动培养皿,以使细胞充分贴壁。
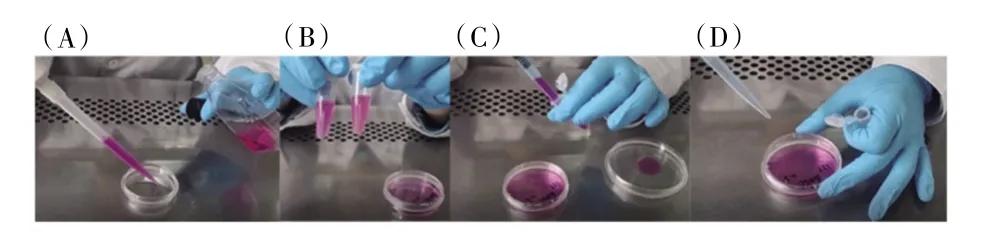
图5 细胞培养
1.3.6 实验结果观察
培养48 h 后,弃去原培养基,加入新鲜的DMEM 完全培养基,之后每隔48 h 换液1 次(见图6A)。培养至70%~80%融合时(约6~7 d),即可进行细胞传代培养(见图6B)。

图6 小鼠骨髓间充质干细胞分离培养在不同时间点的形态图
2 利用小鼠骨髓间充质干细胞可开展的实验
2.1 利用小鼠骨髓间充质肝细胞进行成脂分化
小鼠骨髓间充质干细胞传代后,当细胞融合到80%以上时,弃去原培养基,向其中添加成脂诱导培养基。成脂诱导培养基为向DMEM 基础培养基中添加10%胎牛血清、1%双抗、10 ng/mL 胰岛素、1 μM地塞米松、0.5 mM 3-异丁基-1-甲基黄嘌呤和0.1 mM 吲哚美辛所得。每隔48 h 换液1 次,分化10 d后,在显微镜下可以看到较为明显的脂滴,用油红O染液对其进行染色。
2.2 利用小鼠骨髓间充质肝细胞进行成骨分化实验
小鼠骨髓间充质干细胞传代后,在细胞融合到80%以上时,弃去原培养基,向其中添加成骨诱导培养基。成骨诱导培养基为向DMEM 基础培养基中添加10%胎牛血清、1%双抗、50 μg/mL 维生素和10 mM β-甘油磷酸钠所得。每隔48 h 换液1 次,分化10 d 后,在显微镜下可以看到较为明显的矿化结节,用5%的茜素红染液对其进行染色。
2.3 利用小鼠骨髓间充质肝细胞进行成软骨分化实验
小鼠骨髓间充质干细胞传代后,在细胞融合到80%以上时,弃去原培养基,向其中添加成软骨诱导培养基。成软骨诱导培养基为向DMEM 基础培养基中添加10%胎牛血清、1%双抗、0.2 mM 维生素和10 mM β-甘油磷酸钠所得。每3 d 换液1 次,分化10 d,用甲苯胺蓝染液对其进行染色。
3 教学设计
3.1 教学目的
了解原代细胞培养原理;熟悉原代细胞的培养方法与过程;掌握骨髓间充质干细胞的分离与培养方式;掌握无菌操作;了解骨髓间充质干细胞的应用情况。
3.2 教学重点
在本次实验教学过程中,采用离心法从股骨和胫骨中获得骨髓间充质干细胞;同时,也可以采用使用针管冲洗股骨和胫骨骨髓以获得骨髓间充质干细胞的方法。无论采用哪一种方法,都要注意不能破坏细胞的完整性。获得细胞后,基于先前在实验课学得的细胞培养技术,对骨髓间充质干细胞进行继代培养,从而使同学进一步掌握并巩固细胞培养技术。细胞培养工作最关键的环节就是注意无菌操作,防止细胞在培养过程中受到污染。原代细胞培养要从器官或者组织中直接获取细胞,因此,材料的消毒要非常严格;而且,在整个取材过程和骨髓间充质干细胞的分离过程中都要注意无菌操作。
3.3 教学安排
开课前,授课教师准备实验耗材试剂和实验小鼠。
本实验共安排4 课时,学生在实验课堂上需要完成实验小鼠股骨和胫骨的取材、骨髓收集管的制备、骨头附属物的剥离、离心收集骨髓、培养细胞等步骤。实验课结束之后,学生可自行观察细胞的生长情况。
另外,学生可根据自己的兴趣偏好,利用培养得到的骨髓间充质干细胞进行细胞传代、冻存等细胞培养基本实验技术的练习,以巩固细胞培养操作;或者利用培养的骨髓间充质干细胞进行成骨、成脂、成软骨分化实验;还可以设计并开展化学或者物理刺激对骨髓间充质干细胞分化影响的研究等综合实验。
3.4 教学意义
细胞生物学是生命科学相关专业的实践类专业基础课,是一门研究和解释细胞基本生命活动规律的学科。本实验在进行细胞培养的基础上进行,通过骨髓间充质干细胞的分离和培养,不仅能够使同学们掌握原代细胞培养的基本原理和方法,也能够让学生更加深刻地认识到骨髓间充质干细胞的多潜能性分化。并且,在达到原代细胞培养基本实验教学目的的基础上,将科研内容引入实验教学中,鼓励学生开展以“骨髓间充质干细胞分化研究”为主题的设计性实验,还能够激发学生的多元实验设计思维和开展综合性创新实验的动力。
