去甲斑蝥素通过诱导自噬体聚集促使乳腺癌MDA-MB-231细胞凋亡
2023-12-30姜庆玲王晓婷李敏敬郑秋生1李德芳1
夏 源,姜庆玲,王晓婷,李敏敬,郑秋生1,2,*,李德芳1,2,**
(1石河子大学药学院新疆植物药物资源与利用教育部重点实验室,石河子 832061;2滨州医学院中西医结合学院山东省高等学校-中药活性成分生物合成与靶点发现特色实验室,烟台 264003;3滨州医学院中西医结合学院烟台市肿瘤代谢中药药理重点实验室,烟台 264003)
乳腺癌是全球女性发病率较高的恶性肿瘤之一,年增长幅度约为3.1%[1]。三阴性乳腺癌(triple negative breast cancer,TNBC)是最严重的一种乳腺癌亚型,在乳腺癌患者中占15% ~ 20%[2]。与其他乳腺癌相比,TNBC 患者发病年龄较小,且恶性程度高、侵袭性强,容易出现局部复发和远处转移,具有预后差、易复发、患者总体生存期短等特点,常见的内分泌治疗及针对HER2 的分子靶向药物治疗对TNBC 患者无效,并且患者也易对化疗耐受[3-4]。因此寻找能有效治疗三阴性乳腺癌的药物是十分必要的。
细胞凋亡是机体发育过程中在某些因素的作用下通过基因调控而发生的一种程序性细胞死亡过程,旨在维持机体内环境稳定。细胞凋亡受多种蛋白调节,其中Bcl-2 家族和半胱氨酸天冬氨酸特异性蛋白酶家族(caspases)最受关注。众所周知,Bcl-2家族包含两种类型的凋亡调节蛋白,即促凋亡蛋白(Bax、Bak、Bid 或Bad)和抗凋亡蛋白(Mcl-1、Bcl-2 和Bcl-xl)。其中,线粒体相关蛋白Bcl-2蛋白家族和半胱氨酸天冬氨酸特异性蛋白酶(caspase)家族在众多凋亡调控基因中最受关注。其中,Bax 是细胞对死亡信号反应所必需的,通过转位到线粒体形成同源二聚体或多聚体,引起线粒体膜通透性增加及促凋亡因子释放,并最终启动凋亡级联反应。相反,Bcl-2 通过与其形成更稳定的Bcl-2和Bax异源二聚体来抑制细胞凋亡[5]。
线粒体在细胞存亡机制中起着至关重要的作用。线粒体是细胞的动力源,参与细胞的基本功能,包括ATP 的产生、Ca2+的调节、ROS 的产生和清除,此外,还参与了caspase 蛋白家族的激活。因此,线粒体功能障碍和氧化应激在很大程度上也与肿瘤的发生发展有关[6-7]。例如,erastin样化合物X1 可通过诱导ROS 增加,线粒体膜电位下降从而诱导肝癌细胞凋亡[8];此外,pPolyHb 通过调节PINK1-Parkin 介导的线粒体自噬途径保护心肌H9C2 细胞免受缺血再灌注损伤[9];亦有报道称酮康唑可通过下调COX-2,诱导PINK1 积累和Parkin的线粒体易位,最终激活肝癌细胞中的线粒体自噬[10]。到目前为止,有越来越多的证据表明PINK1/Parkin 可以通过调节线粒体自噬来清除受损或功能障碍的线粒体[11-12]。因此,线粒体自噬是移除受损线粒体的质量控制方式。
Meta 分析证实中医药治疗可有效提高TNBC患者5 年生存率降低TNBC 的复发转移率[13]。NCTD 是疱状甲虫中分离出的斑蝥素的合成去甲基类似物[14]。与斑蝥素相比,NCTD 降低了原有的毒性,基本消除了不良反应,抗肿瘤作用增强;此外,NCTD 对癌肿瘤细胞的毒性明显高于正常细胞;因此,NCTD 在肿瘤治疗中更具吸引力,目前已用于肝癌、食管癌、胃癌以及白血病的临床治疗[15];此外,NCTD 也可以通过靶向miR-873/CDK3 调节ERα 信号抑制肿瘤细胞的增殖、侵袭及转移达到治疗的目的[16],然而NCTD 在治疗乳腺癌方面鲜有报道。
本研究旨在证明NCTD 通过PINK1/Parkin 信号通路诱导线粒体自噬,引起自噬小体蓄积,最终导致MDA-MB-231 细胞的凋亡的机制,以期为NCTD在治疗TNBC的应用中提供理论依据。
1 材 料
1.1 试 剂
NCTD(北京百灵威科技有限公司);磷酸化MEK1/2 抗体(美国Cell Signaling Technology 公司);cyclin B1、p-21、CDK1、磷酸化乙酰辅酶A 羧化酶、磷酸化CDK1(英国Abcam 公司);Jun、p-53、JNK、磷酸化JNK、GAPDH、CDC25C、山羊抗兔IgG抗体(武汉三鹰生物技术有限公司);磷酸化AMPKa1-T183/AMPKa2-T1728(武汉爱博泰克生物公司);抗p-ERK1/2 抗体,LC3α/β 抗体(沈阳万类生物科技有限公司);Annexin V FITC/PI 试剂盒、JC-1检测试剂盒、ROS 检测试剂盒,RIPA 高效裂解液、蛋白酶抑制剂PMSF、1 × 蛋白磷酸酶抑制剂、BCA蛋白分析试剂盒(北京索莱宝科技有限公司);Lipofectamine 3000(美国Invitrogen 公司);细胞线粒体提取试剂盒(中国碧云天生物技术有限公司)。
1.2 仪 器
酶标仪(奥地利Tecan Austria GmbH 公司);光学显微镜(意大利Optika 公司);荧光显微镜(德国Leica Microsystems CMS GmbH 公司);FACSCanto II 流式细胞仪(美国Becton Dickinson 公司);共聚焦显微镜(德国Zeiss公司);透射电子显微镜(日本Jeol公司);凝胶成像分析系统(德国Jena公司)。
1.3 细 胞
三阴性乳腺癌MDA-MB-231 细胞来源于(江苏凯基生物科技有限公司)。
2 方 法
2.1 细胞培养
三阴性乳腺癌MDA-MB-231 细胞在含有10%血清以及1%双抗(最终浓度为青霉素100 U/mL,链霉素100 µg/mL)的L-15 完全培养基中,置5%CO2的37 ℃培养箱中培养,当细胞密度达到70% ~80%时即可进行实验。
2.2 CCK-8法检测细胞增殖
将处于对数生长期的MDA-MB-231细胞消化、离心重悬后进行细胞计数。用L-15完全培养基将细胞密度调整至每毫升7.5 × 104个。取96 孔板,设置只有培养基的空白对照组、对照组和处理组,每组3 个复孔,每孔加入细胞悬液200 µL,培养箱中培养24 h至细胞完全贴壁。吸除培养基,处理组细胞加入NCTD 的终浓度为10,20,30,40,50,60,70,80,90,100 µmol/L,空白对照组和对照组分别加入新鲜的L-15完全培养基,各孔均加入200 µL,培养48 h 后吸除培养基,每孔加入含10% CCK-8 试剂的完全培养基100 µL,37 ℃,5% CO2条件下继续孵育2 h。使用酶标仪检测细胞在450 nm 波长处的吸收度。计算去甲斑蝥素作用于细胞48 h 后的各组的抑制率。抑制率=[1-(Atest-Ablank)/(Acontrol-Ablank)] × 100%。
2.3 平板克隆实验检测细胞集落形成能力
将处于对数生长期的MDA-MB-231细胞消化、离心重悬后进行细胞计数。用L-15 完全培养基将细胞密度调整至每毫升100 个。取6 孔板,设置对照组和处理组,每孔加入细胞悬液2 mL,培养箱中培养3 ~ 4 d,每2天换液1次。吸除培养基,处理组细胞加入NCTD 的终浓度为20、50、80 µmol/L,对照组则加入新鲜的L-15 完全培养基,各孔均加入2 mL,培养48 h 后吸除培养基,每孔加入新鲜培养基2 mL,37 ℃,5% CO2条件下培养15 d 左右,每2 天换液1 次。待细胞形成肉眼可见群落时,吸弃培养基,PBS 清洗2 次,加入组织固定液,每孔700 µL,室温静置15 min;吸弃固定液,PBS 清洗2 次,加入1%结晶紫染色溶液,每孔1 mL,室温静置15 min;PBS 清洗至孔中无多余结晶紫染色液残留,将6 孔板置于阴凉通风处使之挥发多余水分,待板底彻底干燥后即可拍照。进行3次平行实验。
2.4 Hoechst 33258 荧光染色观察细胞凋亡形态变化
将处于对数生长期的MDA-MB-231细胞消化、离心重悬后进行细胞计数。用L-15 完全培养基将细胞密度调整至每毫升1.0 × 104个。取6孔板,设置对照组和处理组,每孔加入细胞悬液2 mL,培养箱中培养24 h至细胞完全贴壁。吸除培养基,处理组细胞加入NCTD 的终浓度为20、50、80 µmol/L,对照组加入新鲜的L-15 完全培养基,各孔均加入2 mL,培养48 h 后吸除培养基。PBS 清洗3 次,固定液(甲醇-乙酸,3∶1)固定15 min;吸弃固定液,于避光条件下用Hoechst 33258(10 µg/mL)染色10 min;吸除染液,PBS 清洗3 次。最后用PBS 1mL浸润细胞,于荧光显微镜下观察细胞染色情况。独立进行3次实验。
2.5 流式细胞仪检测细胞凋亡
将处于对数生长期的MDA-MB-231 细胞消化、离心重悬后进行细胞计数。用L-15 完全培养基将细胞密度调整至每毫升2.5 × 105个。取6 孔板,设置对照组和处理组,每孔加入细胞悬液2 mL,培养箱中培养24 h 至细胞完全贴壁。吸除培养基,处理组细胞加入NCTD 的终浓度为20、50、80 µmol/L,对照组加入新鲜的L-15 完全培养基,各孔均加入2 mL,培养48 h 后吸除培养基。胰酶消化,离心收集细胞沉淀,结合缓冲液重悬,每孔500 µL。根据Annexin V-FITC/PI 试剂盒说明书指示,各管先加入FITC(5 µL)孵育10 min,再加入PI(5 µL)孵育5 min。染色结束,立即上机进行流式检测。独立进行3次实验。
当用该试剂盒检测自噬抑制剂对凋亡的影响时,将细胞分为对照组、50 µmol/L NCTD 处理组、50 µmol/L NCTD + 抑制剂组,其余操作步骤与上述相同。
2.6 流式细胞仪检测线粒体膜电位变化
将处于对数生长期的MDA-MB-231 细胞消化、离心重悬后进行细胞计数。用L-15 完全培养基将细胞密度调整至每毫升2.5 × 105个。取6 孔板,设置对照组和处理组,每孔加入细胞悬液2 mL,培养箱中培养24 h 至细胞完全贴壁。吸除培养基,处理组细胞加入NCTD的终浓度为20、50、80 µmol/L,对照组加入新鲜的L-15完全培养基,各孔均加入2 mL,培养48 h 后吸除培养基。胰酶消化,离心收集细胞沉淀,染料(完全培养基:1 × JC-1染料缓冲液=1∶1)重悬,每管500 µL,37 ℃避光孵育20 min。离心沉淀细胞,JC-1 染色缓冲液洗涤2 次,完全培养基500 µL 重悬,流式细胞仪检测线粒体膜电位的变化。每个样本中均收集10 000个细胞用于检测分析,红色/绿色荧光强度之比用于表示线粒体膜电位变化。
2.7 透射电子显微镜检测细胞自噬体变化
将处于对数生长期的MDA-MB-231 细胞消化、离心重悬后进行细胞计数。
于100 mm培养皿中接种细胞,密度为每皿6 ×105个,设置对照组和处理组,培养箱中培养24 h至细胞完全贴壁。吸除培养基,处理组细胞用NCTD(终浓度为50 µmol/L)处理6 h,12 h;对照组加入新鲜L-15 完全培养基,各皿均加入5 mL。培养48 h 后吸除液体,细胞刮刮取细胞,保证收集细胞数量为每组1 × 105~ 1 × 106个。离心收集细胞沉淀,沿管壁缓慢加入固定液(注意防止将细胞团块吹散)1 mL,4 ℃冰箱过夜。取出细胞,吸弃固定液,0.1 mol/L PBS 清洗两遍,第1 遍约15 min,第2遍于4 ℃冰箱过夜。再次取出细胞,0.1 mol/L PBS清洗1遍,约15 min,吸弃PBS,加入适宜体积的1%锇酸,置4 ℃冰箱固定90 min,每隔20 min 晃动容器,使细胞充分接触细胞团块。固定完毕后,弃去固定液,0.1 mol/L PBS 清洗3 次,每次15 min。接着用50%乙醇脱水,4 ℃处理15 min;70%乙醇脱水,4 ℃处理3 h;80%乙醇脱水,室温处理15 min;95%乙醇脱水,室温处理15 min;无水乙醇脱水,室温处理15 min,重复3 次。丙酮置换2 次,共计15 min,注意避免组织暴露在空气中;丙酮-浸透剂(2∶1),室温1 h;丙酮-浸透剂(1∶2),室温2 h;纯浸透剂,35 ℃恒温箱内开盖浸透(防止细胞团块漂浮在液面)。包埋样品;梯度升温37 ℃,12 h;45 ℃,12 h;60 ℃,24 h。样品准备完毕后用透射电镜拍摄自噬小体即可。
2.8 转染mCherry-EGFP-LC3检测细胞自噬流变化
将处于对数生长期的MDA-MB-231 细胞消化、离心重悬后进行细胞计数。
于40 mm 培养皿中接种细胞,密度为每皿6 ×105个,培养箱中培养24 h 至细胞完全贴壁,转染mCherry-EGFP-LC3质粒。具体操作如下。
准备转染混合液,A 液:Opti-MEM 125 µL,Lipofectamine 3000 转染试剂7 µL;B 液:Opti-MEM 125 µL,DNA 4 µg,P3000 试剂8 µL。配制好A,B液以后,等体积混匀,室温静置15 min。将培养皿中的培养基吸除,加入无双抗培养基1.5 mL,再加入AB 混合液,轻轻混匀,于培养箱(37 ℃,CO2)中培养12 h。转染完成后,将MDA-MB-231 细胞消化、离心重悬后进行细胞计数。用L-15 完全培养基将细胞密度调整至每毫升1.0 × 105个,接种到共聚焦小皿上(每皿1 mL),培养箱中培养24 h至细胞完全贴壁。吸除培养基,加入终浓度为50 µmol/L NCTD,给药6 h 或12 h 后移除药液。PBS 清洗2 遍,加入适量4%细胞固定液,固定15 min。吸除固定液,PBS 清洗2 遍,加入DAPI 染液,室温孵育6 min。吸除DAPI 染液,PBS 洗涤3次,每次5 min。最后加入刚好没过细胞的少量PBS,置于激光共聚焦下拍片即可。
2.9 Western blot 检测凋亡相关蛋白和自噬相关蛋白的表达
将处于对数生长期的MDA-MB-231 细胞消化、离心重悬后进行细胞计数。于100 mm 培养皿中接种细胞,密度为每皿6 × 105个,设置对照组和处理组,培养箱中培养24 h至细胞完全贴壁。
提取细胞总蛋白:吸除培养基,处理组细胞加入NCTD(终浓度为20、50、80 µmol/L),对照组加入新鲜L-15 完全培养基,各皿均加入5 mL。培养48 h 后吸除液体,加入蛋白裂解液,冰上裂解30 min;细胞刮刮取细胞,4 ℃,12 000 r/min离心10 min,收集上清液。
提取线粒体蛋白及胞浆蛋白:吸除培养基,处理组细胞加入NCTD(终浓度50 µmol/L),对照组加入新鲜L-15 完全培养基,各皿均加入5 mL。培养48 h 后吸除液体,消化、离心重悬后进行细胞计数。按照细胞线粒体提取试剂盒指示提取线粒体蛋白和胞浆蛋白。
根据BCA 蛋白分析试剂盒检测蛋白浓度,将各组蛋白浓度调节一致,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳90 V,30 min;120 V,1 h。电转210 mA,120 min。电转结束后,5%脱脂奶粉封闭2 h。TBST 清洗2 遍,4 ℃一抗孵育过夜;一抗孵育结束后,TBST 洗膜3 次,二抗室温孵育40 min;结束后,TBST 洗膜3 次,使用凝胶成像分析系统对蛋白条带进行显影。
2.10 统计学分析
本研究实验数据以来表示。使用SPSS 25.0 统计软件进行分析,采用了单因素方差分析(One-Way ANOVA)或T 检验来计算统计差异,并在采用单因素方差分析后,进行Tukey 事后检验,P< 0.05被认为具有统计学意义。
3 结 果
3.1 NCTD 对人MDA-MB-231 细胞存在细胞毒性作用
为评估NCTD 是否具有抗乳腺癌的作用,用不同浓度NCTD (10 ~ 100 µmol/L)处理MDA-MB-231 细胞,检测NCTD 对MDA-MB-231 细胞毒性作用。如图1-A 所示,NCTD 处理后MDA-MB-231 细胞的存活率降低。此外,克隆形成减少也证实NCTD 显著抑制MDA-MB-231 细胞的增殖(图1-B),提示NCTD 对MDA-MB-231细胞的生长有抑制作用。为进一步检测NCTD 诱导MDA-MB-231 细胞生长抑制作用的机制,用Hoechst 33258 染色分析NCTD 是否诱导MDA-MB-231 细胞凋亡。如图1-C所示,细胞经NCTD处理后,均出现典型的凋亡小体、染色质浓缩、核膜溶解、细胞质皱缩等特征,这一现象初步表明NCTD 可以诱导MDA-MB-231细胞凋亡。随后,使用流式细胞术进一步分析了NCTD 对MDA-MB-231 细胞凋亡的影响。如图1-D所示:不同浓度NCTD 处理后,MDA-MB-231 细胞总凋亡比例分别为:8.2%、18.1%以及22.7%。综上所述,NCTD 对MDA-MB-231 细胞存在生长抑制作用,且可诱导其凋亡。
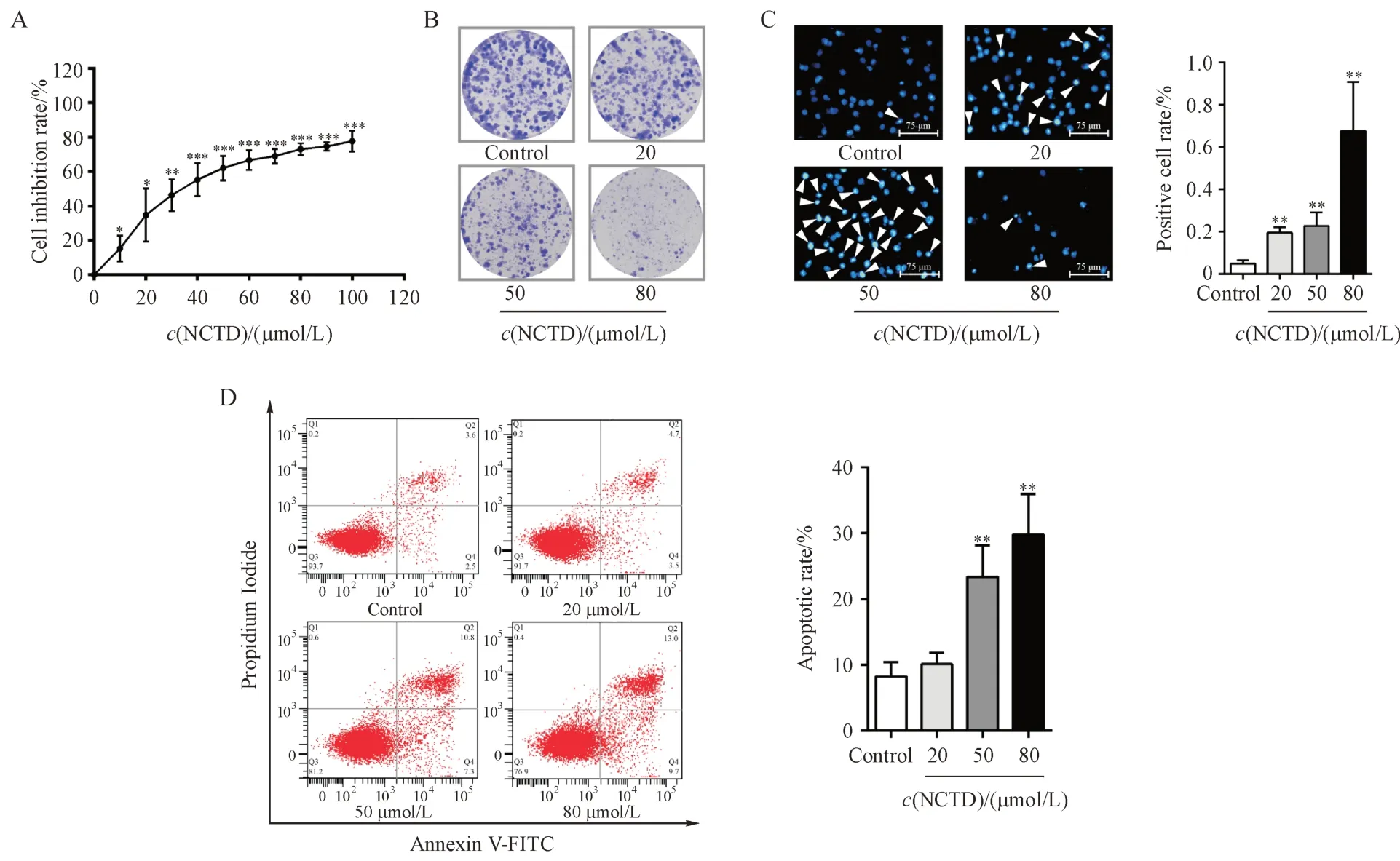
Figure1 Toxicity of norcantharidin (NCTD) on MDA-MB-231 cells
3.2 NCTD 诱导MDA-MB-231 细胞凋亡相关蛋白表达改变
为了探究NCTD 诱导MDA-MB-231 细胞凋亡的分子机制,本实验进一步分析了凋亡途径相关蛋白的表达情况。如图2-A 所示,MDA-MB-231 细胞在用NCTD 处理48 h 以后,Bcl-2,MCL-1 表达降低,促凋亡蛋白Bax 表达升高,且呈剂量依赖性。此外,经NCTD 处理以后,凋亡相关蛋白cleavedcaspase-9,cleaved-caspase-3 以及cleaved-PARP/PARP 表达水平升高(图2-B)。蛋白免疫印迹法证明NCTD 通过改变凋亡相关蛋白的表达,促进MDA-MB-231细胞凋亡。
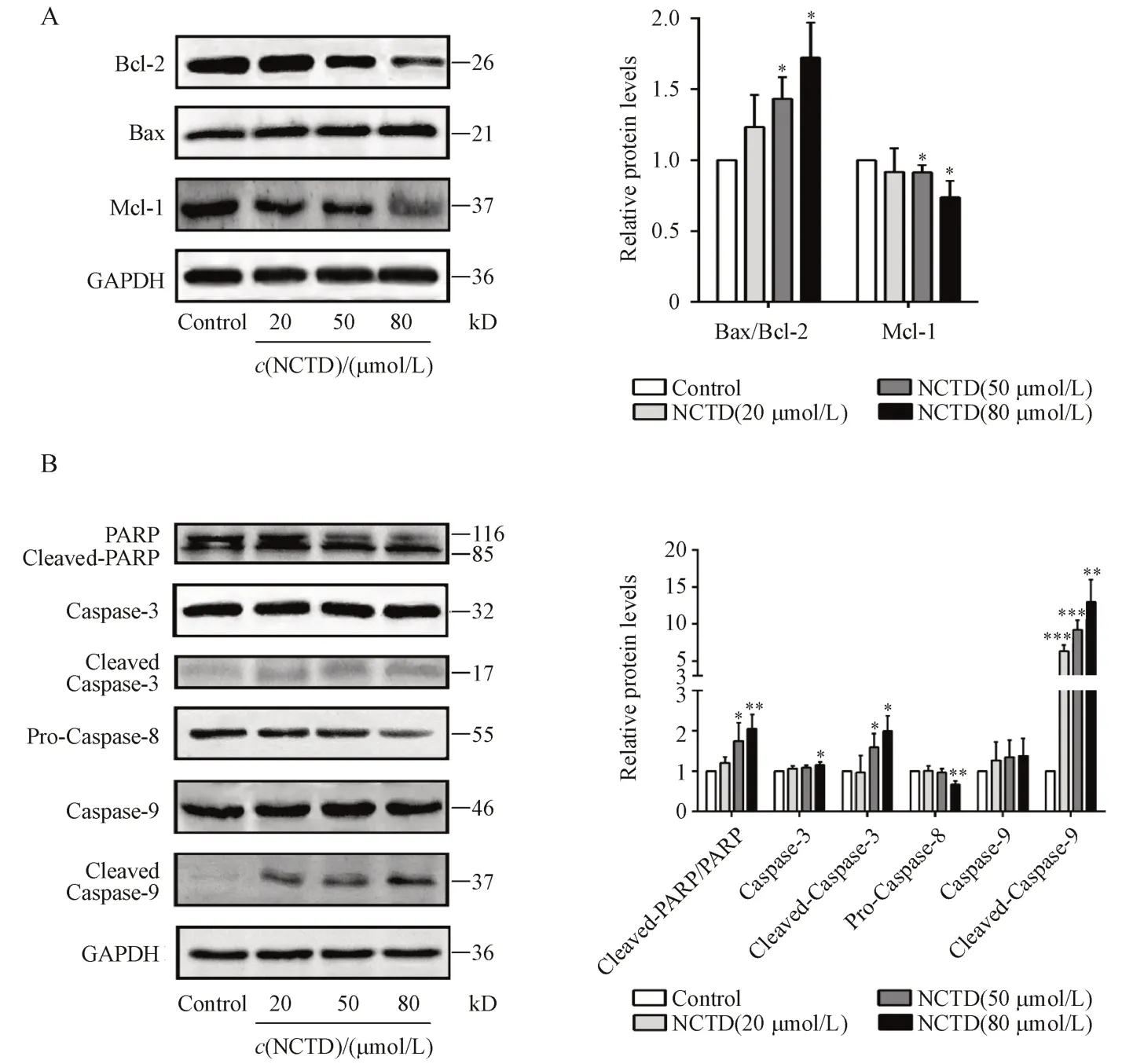
Figure2 Effects of NCTD on the expression of apoptosis-related proteins
3.3 NCTD 诱导MDA-MB-231 细胞线粒体功能障碍
线粒体膜电位丢失是细胞死亡过程中的关键步骤,本实验通过JC-1 染色和流式细胞术检测了不同浓度NCTD 对MDA-MB-231 细胞线粒体膜电位的影响。
凋亡引发的线粒体膜电位的降低表现为红色/绿色荧光强度的降低。如图3-A所示:与对照组相比,MDA-MB-231 细胞经不同浓度NCTD 处理48 h后,细胞出现高绿色和低橙色的荧光,初步表明NCTD 可以降低MDA-MB-231 细胞的线粒体膜电位。此外,如图3-B 所示,流式细胞术进一步证明NCTD 诱导MDA-MB-231 细胞线粒体膜电位降低,且呈剂量依赖性。NCTD 引起线粒体膜电位的去极化,提示其可能与MDA-MB-231 细胞凋亡有关。为了探究NCTD 对MDA-MB-231 细胞线粒体功能的影响,本研究进一步测量了NCTD 处理的MDAMB-231 细胞的线粒体ROS 水平。结果显示,与对照组相比, NCTD处理组细胞的线粒体产生更多的ROS(图3-C)。综上所述,该实验证明NCTD 能够引发MDA-MB-231细胞的线粒体功能损害。
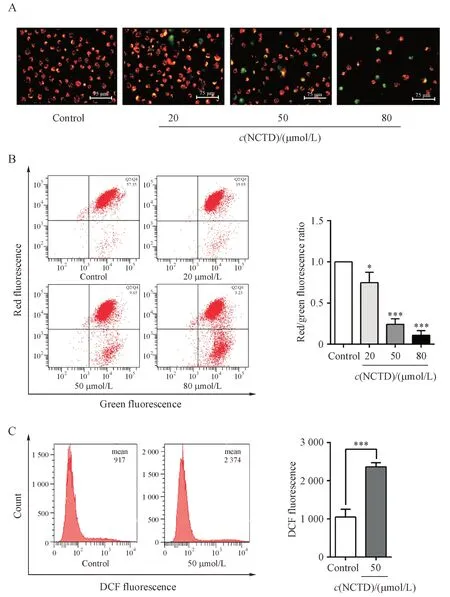
Figure3 Effects of NCTD on mitochondrial dysfunction
3.4 NCTD 通过PINK1/Parkin 信号通路诱导线粒体自噬
本研究通过透射电镜观察各组细胞中自噬特异性结构的数量及超微结构,发现MDA-MB-231细胞经50 µmol/L NCTD分别处理12 h后,与对照组相比,细胞质中可以观察到清晰的自噬泡(图4-A)。随后,本研究分析了自噬相关蛋白的表达情况,发现NCTD显著促进LC3-I转化为LC3-II,同时自噬体形成相关蛋白Atg5 的表达也升高(图4-B),提示NCTD处理后的细胞可能发生自噬。已有研究表明Parkin 的线粒体易位是线粒体自噬的标志[17],因此本研究检测了NCTD处理的细胞中Parkin的线粒体易位情况,观察到NCTD 处理的MDA-MB-231 细胞的线粒体富含Parkin 蛋白(图4-C)。鉴于PINK1/Parkin信号通路在哺乳动物细胞线粒体自噬中的关键调控作用[18],本研究进一步检测了NCTD 处理对MDA-MB-231 细胞中PINK1 表达的影响,如图4-D所示,NCTD 处理增加了MDA-MB-231 细胞中PINK1 的表达。综上所述,本研究提出NCTD 增强线粒体Parkin 募集,通过PINK1/Parkin 信号通路促进线粒体自噬诱导MDA-MB-231凋亡。
3.5 NCTD诱导MDA-MB-231细胞自噬流阻滞
NCTD 已被证明能诱导MDA-MB-231 细胞发生自噬,本研究旨在通过mCherry-EGFP-LC3 报告质粒进一步观察NCTD 处理的MDA-MB-231 细胞中自噬流的状态。该融合蛋白在自噬小体阶段呈mCherry+EGFP+,在自噬溶酶体阶段中呈mCherry+EGFP-。如图5-A 所示,随着NCTD 处理时间的延长,细胞中自噬小体数量明显增加,而自噬溶酶体数量逐渐减少,表明NCTD 可能通过促进自噬小体的形成调控MDA-MB-231 细胞自噬。考虑到与自噬特异性底物p62 结合的泛素化蛋白可通过自噬小体-自噬溶酶体途径降解[19-21],因此,本研究检测了p62 和泛素化蛋白的表达水平。结果发现与LC3-II 表达积累相一致,p62 表达水平和线粒体蛋白的泛素化水平在NCTD 处理的MDA-MB-231 细胞中升高(图5-B,图5-C),进一步证明自噬溶酶体数量减少,MDA-MB-231细胞自噬通量受损。综合以上实验结果,本研究提出NCTD 通过促进自噬小体的形成和抑制自噬溶酶体形成的来调控MDAMB-231细胞自噬。
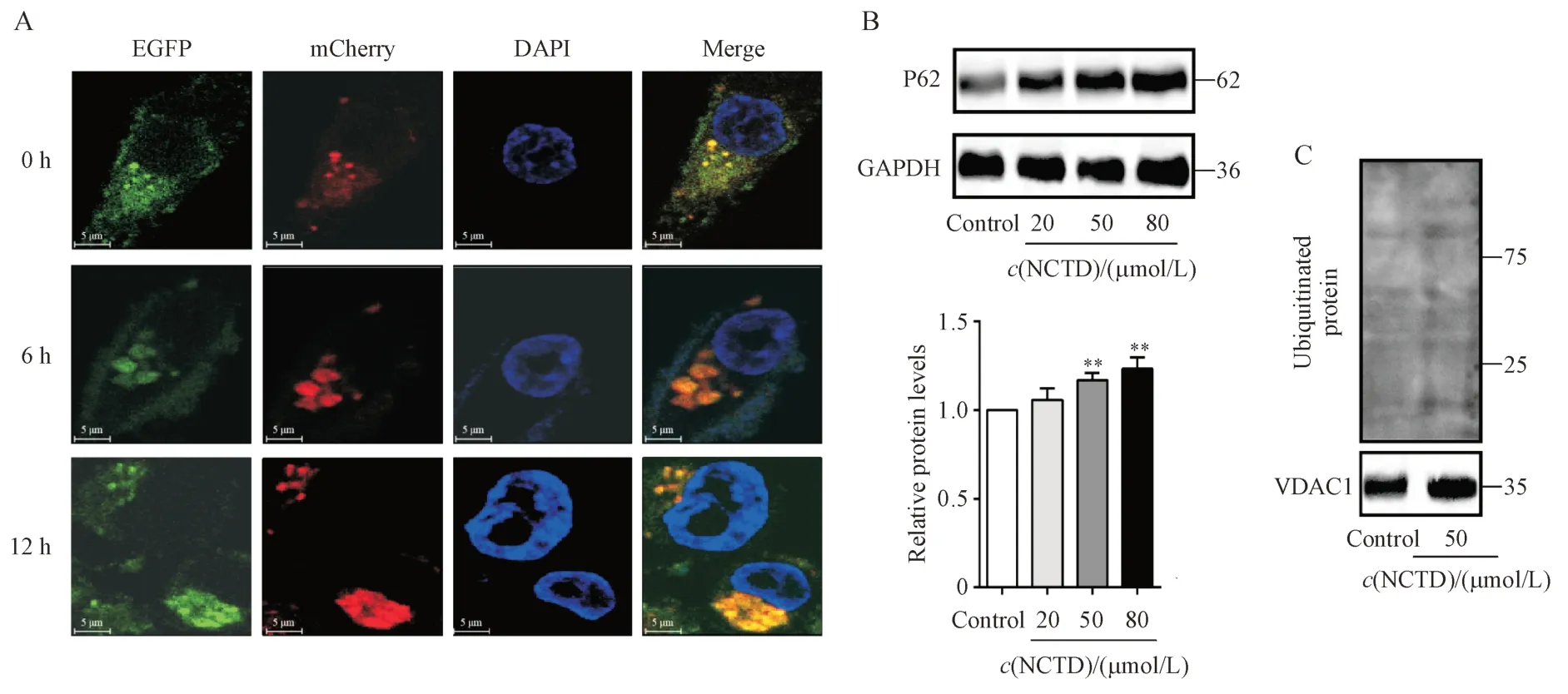
Figure5 Effect of NCTD on autophagy flow in MDA-MB-231cells
3.6 NCTD 引发自噬小体积累导致MDA-MB-231细胞凋亡
为了进一步探究NCTD 诱导MDA-MB-231 细胞凋亡的自噬调控机制,本研究选取自噬抑制剂CQ 和3-MA,联合应用NCTD,检测它们对细胞凋亡的影响。CQ 能够破坏自噬小体与溶酶体融合并导致自噬小体积累,而3-MA 主要抑制自噬启动和自噬小体形成。MDA-MB-231 细胞凋亡的流式分析结果显示NCTD 联合使用CQ 可以显著加重NCTD 诱导的细胞凋亡(图6-A);相反,NCTD 联合使用3-MA 显著降低了NCTD 处理后MDA-MB-231细胞的凋亡(图6-B);该结果进一步证明了自噬小体的积累在NCTD 诱导MDA-MB-231 细胞凋亡过程中的调控作用。综上所述,NCTD 通过启动线粒体自噬和阻止自噬小体-溶酶体融合诱导自噬小体积累,导致MDA-MB-231细胞凋亡。

Figure6 NCTD leads to apoptosis by inducing the accumulation of autophagosomes
4 讨 论
本研究证实NCTD 可诱导MDA-MB-231 细胞自噬小体蓄积,并最终诱导其凋亡。本研究首次分析了NCTD 处理后细胞自噬依赖性凋亡的分子机制,为MDA-MB-231 细胞的治疗提供了理论依据。
以往研究发现,NCTD 可抑制人肾小球系膜细胞、人肝癌细胞和人口腔鳞状癌细胞等多种肿瘤细胞的增殖和生长[22-24]。为评价NCTD 是否具有抗乳腺癌的作用,本实验首先分析了NCTD 对MDAMB-231 细胞生长的影响。本研究发现NCTD 处理后MDA-MB-231 细胞的存活率降低,克隆形成减少,证实NCTD 可以显著抑制MDA-MB-231 细胞的增殖。诱导细胞凋亡是抗肿瘤药物抑制细胞生长的潜在因素之一[25]。在本研究中,MDA-MB-231 细胞经NCTD 处理后凋亡细胞比例增加,并且凋亡相关蛋白表达水平变化明显,提示NCTD 可以诱导MDA-MB-231细胞凋亡。
线粒体是细胞的动力源,参与细胞的基本功能,包括ROS的产生和清除、细胞凋亡以及caspase家族的激活等,对细胞的存活起着至关重要的作用。因此,线粒体功能障碍在很大程度上与衰老、肿瘤、年龄相关的神经退行性和代谢综合征的发生发展有关[26]。同时研究表明,ROS的增加会导致线粒体的破坏,线粒体膜电位降低,最终导致细胞凋亡[27-28]。在本实验中,NCTD 处理的MDA-MB-231 细胞中线粒体膜电位下降,并伴有线粒体ROS生成增加,该结果提示NCTD 诱导MDA-MB-231 细胞凋亡与线粒体功能障碍密切相关。
线粒体自噬是线粒体质量控制的一种形式,用于去除功能不佳的线粒体[29]。有研究发现,PINK1/Parkin 信号通路是介导哺乳动物细胞线粒体自噬的关键信号通路[18]。其中,活化的Parkin 作为线粒体自噬信号的“增强子”,扩大自噬信号,促进受损线粒体的降解;PINK1作为受损线粒体的分子传感器,触发线粒体自噬的起始信号,并将Parkin 向受损的线粒体募集[17]。本研究发现MDAMB-231 细胞经NCTD 处理后,细胞质中出现大量自噬特异性结构;此外,高表达的自噬相关标志物(LC3-II/LC3-I,Atg5 和PINK1)以及Parkin 的线粒体易位进一步证实了NCTD 诱导MDA-MB-231 细胞的线粒体自噬。
自噬的诱导通常被认为是营养物再循环和细胞毒性物质清除的适应性和细胞保护性机制,在不同生理状态下可以抑制或刺激细胞凋亡[[30]。通常情况下,自噬通量的形成是实现自噬的必要前提[31-32]。而自噬通量阻断诱导的自噬小体蓄积可作为一种新的调节方式参与细胞凋亡,其典型特征是P62和泛素化蛋白表达增加[33-35]。本研究发现MDA-MB-231 细胞经NCTD 处理后,自噬通量阻断,自噬小体蓄积,并且出现较高的凋亡率。此外,P62的表达水平和线粒体蛋白的泛素化水平也升高。结合上述结果说明NCTD 可以抑制MDAMB-231 细胞中自噬小体与溶酶体的融合,并最终导致自噬小体蓄积。
然而,本研究还存在一定的研究局限性。本研究所使用的mCherry-GFP-LC3 报告质粒不能指示线粒体自噬流水平,故无法明确NCTD 诱导的线粒体自噬与自噬体累积之间的联系。此外,对于NCTD 在三阴性乳腺癌中的抗肿瘤作用,仅在一种人TNBC 细胞MDA-MB-231 中进行了评价;同时,该研究缺少NCTD 的动物体内抗肿瘤活性评价,因此,本课题组将在后续同类型研究中进一步完善实验方案。基于上述发现,本研究认为NCTD 是通过引起细胞中自噬小体积累从而诱导MDA-MB-231 细胞凋亡。随后,通过联合使用自噬抑制剂来验证假设。3-MA 能抑制自噬启动和自噬小体形成,而CQ 能够破坏自噬小体与溶酶体融合并导致自噬小体积累。在本研究中,3-MA 降低了NCTD诱导的凋亡,而CQ 的联合使用显著促进了NCTD诱导的凋亡,该结果进一步说明了NCTD 诱导MDA-MB-231 细胞凋亡与自噬小体的积累相关。该研究结果为NCTD 在TNBC 治疗中的应用提供了理论依据。
