天然产物去氢骆驼蓬碱糖基偶联物的合成及抗肿瘤活性评价
2023-12-30刘晓涵谭云鹰傅俊杰
刘晓涵,谭云鹰,李 强,陈 旭,傅俊杰*,尹 健,2**
(1江南大学生物工程学院糖化学与生物技术教育部重点实验室,无锡 214122;2江南大学生命科学与健康工程学院,无锡 214122)
恶性肿瘤是全球第二大致命疾病,其发病率和病死率持续上升,严重威胁人类生命安全[1]。不断寻找并开发有效、安全的抗肿瘤新药十分重要。天然产物因结构多样、生物活性优良,成为抗肿瘤药物的重要来源[2]。紫杉醇、喜树碱、长春碱等都是活性优异的抗肿瘤天然产物,已广泛应用于临床治疗[3-4]。
去氢骆驼蓬碱(harmine)是天然的三环β-咔啉类生物碱,可于骆驼蓬种子中提取获得,具有镇痛、抗菌、抗寄生虫、降血糖、抗肿瘤等多种生物活性[5-6]。去氢骆驼蓬碱可通过与DNA 结合、抑制拓扑异构酶Ⅰ活性、改变细胞周期、抑制肿瘤血管生成等多种作用机制发挥抗肿瘤作用[7-8]。上皮-间充质转化(EMT)是上皮细胞转化为拥有侵袭转移能力的间充质细胞的过程,可促进肿瘤细胞的迁移和侵袭[9]。研究表明,去氢骆驼蓬碱可以抑制肿瘤细胞的EMT 进程[10-11]。例如,去氢骆驼蓬碱可以以剂量依赖的方式诱导EMT 转录因子Twist1 的降解,抑制人和小鼠乳腺癌细胞的迁移和侵袭[12]。但是,由于去氢骆驼蓬碱神经毒性强,生物利用度低,其临床应用受到了一定限制,需要对其进行进一步优化。Lu 等[13]在去氢骆驼蓬碱的N9位偶联组蛋白去乙酰化酶(HDAC)抑制剂,得到HDAC 和DNA 双靶向抑制剂N-羟基-2-(4-((去氢骆驼蓬碱-9-基)甲基)哌啶-1-基)嘧啶-5-甲酰胺(1)(图1),其对HCT-116 细胞的IC50由20 µmol/L 低到1.41 µmol/L。Du 等[14]在去氢骆驼蓬碱的N9位引出不同长度(4 ~ 6 个直链碳原子)的溴代烷链,发现所得9-溴代烷基去氢骆驼蓬碱衍生物2 的抗肿瘤活性随烷基链长度增加而增加。Tang 等[15]合成了去氢骆驼蓬碱N9位肉桂酸衍生物4-(去氢骆驼蓬碱-9-基)丁基(E)-3-(4-甲氧基苯基)丙烯酸酯(3),其对MDAMB-231 细胞抑制活性是去氢骆驼蓬碱的4.5 倍,而对正常细胞的毒性低于去氢骆驼蓬碱。Filali等[16]在去氢骆驼蓬碱的N9位引入异唑得到5-((去氢骆驼蓬碱-9-基)甲基)-3-苯基-4,5-二氢异唑(4),其对MCF-7 细胞的毒性比去氢骆驼蓬碱提高了4 倍。此外,研究表明,将去氢骆驼蓬碱C7位氧原子上的甲基替换为异戊基、环己基甲基、苄基、苯丙基等也可提高其抗肿瘤活性[17]。综上,去氢骆驼蓬碱的C7和N9位是其结构改造的主要位点。
与正常细胞相比,肿瘤细胞主要依靠糖酵解获取能量,对葡萄糖的需求增加,这一现象被称为Warburg 效应[18]。葡萄糖转运蛋白1(GLUT1)是细胞摄取葡萄糖的主要通道,在肿瘤细胞表面过表达,已成为肿瘤治疗的重要靶点。半乳糖、甘露糖、2-氨基-2-脱氧-D-葡萄糖(2-DG)等也可被GLUT1 识别并运输至细胞内,其中2-DG 磷酸化生成的产物无法继续参与糖酵解中的异构化反应,不能为肿瘤细胞提供能量,具有独特的优势[19]。因此,可利用2-DG 或其类似物与药物偶联,提高肿瘤细胞对偶联药物的摄取效率,增加药物的肿瘤细胞选择性[20-21]。例如,通过丁二酸连接2-DG 和阿霉素的氨基得到2-DG 阿霉素偶联物5,利用依他尼酸的羧基与2-DG 的氨基成酰胺得到2-DG 依他尼酸偶联物6(图1),两者均可通过靶向GLUT1显著提高药物对肿瘤细胞的选择性[22-23]。此外,2-DG 偶联策略在临床成像、肿瘤诊断、治疗效果监测等方面也有广泛应用[19],并且糖基的引入还能有效改善药物的水溶性和成药性[24-25]。
基于上述背景,本研究在前期研究中选用甲基、异戊基、环己基甲基和苄基作为去氢骆驼蓬碱C7位氧上的修饰基团,并通过3 个和5 个直链碳原子在去氢骆驼蓬碱N9位上偶联甲基2-氨基-2-脱氧-β-D-葡萄糖苷,合成了一系列去氢骆驼蓬碱糖基偶联物。抗肿瘤活性筛选发现,去氢骆驼蓬碱C7位氧上为环己基甲基时抗肿瘤活性最佳,且N9位连接臂长度也显著影响抗肿瘤活性(未发表数据)。因此,本研究将去氢骆驼蓬碱C7位氧上的取代基固定为环己基甲基,通过1 ~ 9 个直链碳原子在去氢骆驼蓬碱N9位上引出羧基并偶联甲基2-氨基-2-脱氧-β-D-葡萄糖苷,进一步系统考察连接臂长度对抗肿瘤活性的影响,并对优选出的化合物的作用机制进行初步探究(图1)。

Figure1 Design of glycoconjugates from harmine and 2-amino-2-deoxy-β-D-glucoside
1 合成路线
如路线1 所示,以2-氨基-1, 2, 3, 4, 6-O-五-乙酰基-β-D-葡萄糖为起始原料,在Lewis酸三氟化硼乙醚(BF3·Et2O)的催化下与甲醇发生糖苷化反应得到相应的甲基糖苷7,依次用甲醇钠和氢氧化钠脱除氧和氮原子上的乙酰基,得甲基2-氨基-2-脱氧-β-D-葡萄糖苷9。另一方面,以去氢骆驼蓬碱为原料,在氢溴酸和乙酸中回流脱除C7位氧上的甲基得化合物10。在碳酸铯条件下,化合物10 的羟基经溴甲基环己烷亲电取代得中间体11。中间体11 的NH 经钠氢或碳酸钾活化后与长度各异的ω-溴代羧酸叔丁酯或丙烯酸叔丁酯反应得化合物12a ~ 12h,经三氟乙酸脱除叔丁酯保护基后得相应的酸13a ~ 13h。最后,化合物13a ~ 13h 在苯并三氮唑-N,N,N',N'-四甲基脲六氟磷酸盐(HBTU)条件下与氨基葡萄糖9 缩合得目标分子14a ~14h。目标分子结构经1H NMR、13C NMR 和HRMS确认,纯度均在95%以上。
2 实验部分
2.1 试剂、仪器及细胞
本研究所用化学品及试剂均为市售分析纯,使用前无须进一步纯化;Annexin V-FITC 细胞凋亡检测试剂盒、细胞周期检测试剂盒、RIPA细胞裂解液、ECL 化学发光试剂盒(上海碧云天生物技术有限公司);抗E-cadherin抗体、抗N-cadherin抗体、抗Twist1 抗体、抗Bcl-2 抗体(英国Abcam 公司);抗GADPH 抗体及兔、鼠二抗(江苏凯基生物技术股份有限公司)。
Avance Ⅲ 400 MHz 或Avance Ⅲ 600 MHz 核磁共振仪(德国Bruker 公司);Agilent 6220 高分辨质谱仪、紫外分光光度计(美国Agilent 公司);酶标仪(美国Thermo Fisher公司);流式细胞仪(美国BD公司);化学发光成像系统(美国Bio-Rad公司)。
本研究所用的人乳腺癌细胞MDA-MB-231、人宫颈癌细胞HeLa、人卵巢癌细胞OVCAR-3、人结肠癌细胞HCT-116、人正常乳腺上皮细胞MCF-10A 均由江南大学糖化学与生物技术教育部重点实验室提供。

Scheme 1 Synthetic route of harmine derivatives 14a-14h
2.2 化学合成
2.2.1 中间体7 的合成[26]在氩气保护下,向2-氨基-1, 2, 3, 4, 6-O-五-乙酰基-β-D-葡萄糖(2.50 g,6.43 mmol)和活化好的4 Å 分子筛中依次加入无水二氯甲烷(30 mL)和无水甲醇(2.6 mL, 64.3 mmol)。在0 ℃下逐滴加入BF3·Et2O(7.9 mL,64.3 mmol),搅拌30 min 后升温至50 ℃继续反应48 h。用饱和碳酸氢钠溶液淬灭反应。溶液经硅藻土过滤,以二氯甲烷稀释,依次用水和饱和氯化钠溶液洗涤。收集有机相经无水硫酸钠干燥,减压浓缩得到粗品。粗品经硅胶柱纯化(乙醇-二氯甲烷,1∶50)得白色固体7(1.34 g, 3.73 mmol),收率58.2%。
2.2.2 中间体8 的合成[26]将中间体7(160 mg,0.44 mmol)溶于无水甲醇(3 mL)中,加入甲醇钠(9.6 mg, 0.18 mmol),于室温下反应2 h。用氢离子交换树脂中和并过滤后,浓缩得到白色固体8(101.2 mg, 0.43 mmol)。不经纯化直接用于下一步。
2.2.3 中间体9 的合成[26]将中间体8(101.2 mg,0.43 mmol)溶于氢氧化钠水溶液(1 mol/L, 2 mL),120 ℃下回流反应12 h。反应液恢复至室温后,逐滴加入盐酸(1 mol/L)中和,减压浓缩得白色固体9(140.3 mg),收率定量。不经纯化直接用于下一步。
2.2.4 中间体10 的合成[17]将去氢骆驼蓬碱(1.54 g, 7.27 mmol)溶于48% 氢溴酸水溶液(30 mL)及乙酸中(25 mL),120 ℃下回流反应12 h。反应液减压浓缩,加入15 mL 水,并逐滴加入饱和碳酸氢钠溶液至pH 为8,生成大量沉淀。过滤,用水洗涤滤饼,干燥得到棕红色固体10(1.41 g, 7.12 mmol),收率97.9%。
2.2.5 中间体11 的合成[17]取中间体10(1.00 g,5.05 mmol)溶解于DMF(14 mL)中,加入碳酸铯(2.46 g, 7.56 mmol),于室温下搅拌30 min,随后逐滴加入溴甲基环己烷(0.86 mL, 6.06 mmol)。升温至40 ℃反应12 h。反应液经硅藻土过滤,加乙酸乙酯稀释并用水洗涤。有机相经无水硫酸钠干燥,减压浓缩得到粗品。粗品经硅胶柱纯化(甲醇-二氯甲烷,1∶25)得到淡黄色固体11(1.16 g,3.94 mmol),收率78.5%。
2.2.6 中间体12 的合成 对于中间体12a 及12c ~ 12h:将中间体11(294 mg, 1 mmol)溶解于DMF(6 mL)中,在0 ℃条件下加入钠氢(36 mg, 1.5 mmol),恢复至室温搅拌30 min。加入对应的溴代羧酸叔丁酯(1.2 mmol)并于室温下反应12 h。用乙酸乙酯稀释反应液,有机相用水洗涤并经无水硫酸钠干燥,减压浓缩得到粗品。粗品经硅胶柱纯化(甲醇-二氯甲烷,1∶50→1∶25)得到目标中间体。
中间体12b:将中间体11(294 mg, 1 mmol)溶解于DMF(6 mL)中,在0 ℃条件下加入碳酸钾(207 mg, 1.5 mmol),恢复至室温搅拌30 min。加入丙烯酸叔丁酯(174 µL, 1.2 mmol)并于80 ℃下反应12 h。用乙酸乙酯稀释反应液,有机相用水洗涤并经无水硫酸钠干燥,减压浓缩得到粗品。粗品经硅胶柱纯化(甲醇-二氯甲烷,1∶25)得淡黄色固体12b(190.3 mg, 0.45 mmol),收率45.6%。
中间体12a 淡黄色固体,收率52.2%,mp:182.2 ~ 183.0 ℃。1H NMR(400 MHz, CDCl3)δ:8.28(1H, d,J= 5.3 Hz, Har-3), 7.95(1H, d,J= 8.6 Hz, Har-5), 7.73(1H, d,J= 5.3 Hz, Har-4), 6.89(1H, dd,J= 8.6, 2.1 Hz, Har-6), 6.76(1H, d,J=2.1 Hz, Har-8), 5.08(2H, s, NCH2), 3.86(2H, d,J=6.3 Hz, OCH2), 2.95(3H, s, CH3), 1.97 ~ 1.70(6H,m, cyclohexyl), 1.43(9H, s, CH3× 3), 1.30 ~ 1.17(5H, m, cyclohexyl)。13C NMR(150 MHz, CDCl3)δ:168.01, 161.08, 143.85, 140.46, 138.62, 135.84,130.15, 122.59, 115.27, 112.54, 109.96, 93.88,83.03, 74.12, 47.64, 37.95, 30.11(2C), 28.10(3C),26.65, 25.96(2C), 22.88。MS(ESI)m/zCalcd. for C25H32N2O3[M + H]+409.241 3, Found 409.053 8。
中间体12b 淡黄色固体,收率45.4%,mp:159.5 ~ 160.2 ℃。1H NMR(400 MHz, CDCl3)δ:8.31(1H, d,J= 5.2 Hz, Har-3), 7.97(1H, d,J= 8.5 Hz, Har-5), 7.74(1H, d,J= 5.2 Hz, Har-4), 6.97 ~6.89(2H, m, Har-6 和Har-8), 4.85 ~ 4.77(2H, m,NCH2), 3.92(2H, d,J= 6.2 Hz, OCH2), 3.06(3H, s,CH3), 2.77 ~ 2.69(2H, m, COCH2), 1.99 ~ 1.68(6H,m, cyclohexyl), 1.43(9H, s, CH3× 3), 1.38 ~ 1.09(5H, m, cyclohexyl)。13C NMR(100 MHz, CDCl3)δ:170.34, 160.96, 142.98, 140.69, 138.71, 135.20,129.99, 122.48, 115.29, 112.41, 109.81, 94.27,81.64, 74.17, 40.77, 38.00, 36.42, 30.14(2C),28.17(2C), 28.11, 26.67, 25.99(2C), 23.48。HRMS(ESI)m/zCalcd. for C26H34N2O3[M + H]+423.256 9,Found 423.270 7。
中间体12c 白色固体,收率79.6%,mp:127.7 ~ 128.7 ℃。1H NMR(600 MHz, CDCl3)δ:8.27(1H, d,J= 5.2 Hz, Har-3), 7.94(1H, d,J= 8.6 Hz, Har-5), 7.72(1H, d,J= 5.2 Hz, Har-4), 7.01(1H, d,J= 2.1 Hz, Har-8), 6.88(1H, dd,J= 8.6,2.1 Hz, Har-6), 4.54 ~ 4.48(2H, m, NCH2), 3.91(2H,d,J= 6.4 Hz, OCH2), 3.03(3H, s, CH3), 2.33(2H, t,J=6.8 Hz, COCH2), 2.11 ~ 2.03(2H, m, CH2), 1.95 ~1.69(6H, m, cyclohexyl), 1.47(9H, s, CH3× 3), 1.36 ~1.06(5H, m, cyclohexyl)。13C NMR(150 MHz, CDCl3)δ:172.16, 160.98, 143.44, 140.39, 138.10, 135.25,129.79, 122.39, 114.96, 112.37, 109.78, 94.20,80.98, 74.08, 44.11, 37.95, 32.32, 30.12(2C),28.25(3C), 26.68, 25.97(2C), 25.85, 23.32。HRMS(ESI)m/zCalcd. for C27H36N2O3[M + H]+437.272 6,Found 437.285 9。
中间体12d 淡黄色固体,收率91.5%,mp:112.2 ~ 113.0 ℃。1H NMR(400 MHz, CDCl3)δ:8.27(1H, d,J= 5.3 Hz, Har-3), 7.95(1H, d,J= 8.5 Hz, Har-5), 7.73(1H, d,J= 5.2 Hz, Har-4), 6.91 ~6.83(2H, m, Har-6 和Har-8), 4.52 ~ 4.43(2H, m,NCH2), 3.89(2H, d,J= 6.2 Hz, OCH2), 3.02(3H, s,CH3), 2.28(2H, t,J= 7.1 Hz, COCH2), 1.97 ~ 1.69(10H, m, cyclohexyl 和CH2× 2), 1.41(9H, s, CH3× 3),1.26 ~ 1.08(5H, m, cyclohexyl)。13C NMR(100 MHz,CDCl3)δ:172.56, 160.92, 143.32, 140.44, 138.15,135.34, 129.76, 122.50, 115.11, 112.41, 109.52,94.21, 80.61, 74.14, 44.76, 38.04, 35.17, 30.13(2C), 29.56, 28.26(2C), 28.18, 26.68, 26.00(2C),23.37, 22.52。HRMS(ESI)m/zCalcd. for C28H38N2O3[M + H]+451.288 2, Found 451.301 1。
中间体12e 淡黄色固体,收率71.3%,mp:99.8 ~ 100.5 ℃。1H NMR(400 MHz, CDCl3)δ:8.27(1H, d,J= 5.2 Hz, Har-3), 7.95(1H,d,J= 8.5 Hz,Har-5), 7.72(1H, d,J= 5.2 Hz, Har-4), 6.87(1H,dd,J= 8.6, 2.1 Hz, Har-6), 6.83(1H, d,J= 2.0 Hz,Har-8), 4.49 ~ 4.41(2H, m, NCH2), 3.89(2H, d,J=6.2 Hz, OCH2), 3.01(3H, s, CH3), 2.22(2H, t,J=7.3 Hz, COCH2), 1.98 ~ 1.61(10H, m, cyclohexyl 和CH2× 2), 1.48 ~ 1.40(11H, m, CH2和CH3× 3), 1.38 ~1.05(5H, m, cyclohexyl)。13C NMR(100 MHz, CDCl3)δ:172.91, 160.79, 143.25, 140.52, 138.26, 135.38,129.63, 122.44, 115.15, 112.37, 109.26, 94.19,80.35, 74.13, 44.86, 38.02, 35.40, 30.54, 30.15(2C), 28.23(3C), 26.67, 26.48, 26.00(2C), 24.95,23.50。HRMS(ESI)m/zCalcd. for C29H40N2O3[M +H]+465.303 9, Found 465.317 9。
中间体12f 白色固体,收率74.2%,mp:76.8 ~77.9 ℃。1H NMR(400 MHz, CDCl3)δ:8.27(1H, d,J= 5.2 Hz, Har-3), 7.95(1H, d,J= 8.6 Hz, Har-5),7.72(1H, d,J= 5.2 Hz, Har-4), 6.91 ~ 6.82(2H, m,Har-6 和Har-8), 4.48 ~ 4.40(2H, m, NCH2), 3.89(2H, d,J= 6.2 Hz, OCH2), 3.01(3H, s, CH3), 2.20(2H, t,J= 7.4 Hz, COCH2), 1.98 ~ 1.69(8H, m,cyclohexyl 和CH2), 1.59 ~ 1.53(2H, m, CH2), 1.48 ~1.38(11H, m, CH2和CH3× 3), 1.36 ~ 1.08(7H, m,cyclohexyl 和CH2)。13C NMR(100 MHz, CDCl3)δ:173.15, 160.77, 143.26, 140.58, 138.30, 135.43,129.60, 122.41, 115.18, 112.37, 109.26, 94.30,80.25, 74.15, 44.97, 38.02, 35.49, 30.65, 30.16(2C), 29.01, 28.30, 28.23(2C), 26.82, 26.67, 26.00(2C), 25.06, 23.52。 HRMS(ESI)m/zCalcd. for C30H42N2O3[M + H]+479.319 5, Found 479.333 7。
化合物12g 白色固体,收率82.5%,mp:55.5 ~ 56.4 ℃。1H NMR(400 MHz, CDCl3)δ:8.26(1H, d,J= 5.2 Hz, Har-3), 7.95(1H, d,J= 8.5 Hz,Har-5), 7.72(1H, d,J= 5.2 Hz, Har-4), 6.91 ~ 6.80(2H, m, Har-6 和Har-8), 4.48 ~ 4.39(2H, m, NCH2),3.89(2H, d,J= 6.2 Hz, OCH2), 3.01(3H, s, CH3),2.19(2H, t,J= 7.4 Hz, COCH2), 1.98 ~ 1.70(8H,m, cyclohexyl 和CH2), 1.57 ~ 1.49(2H, m, CH2),1.45 ~ 1.39(11H, m, CH2和CH3× 3), 1.34 ~ 1.06(9H, m, cyclohexyl 和CH2× 2)。13C NMR(100 MHz,CDCl3)δ:173.29, 160.75, 143.27, 140.59, 138.25,135.44, 129.59, 122.43, 115.18, 112.36, 109.18,94.28, 80.16, 74.15, 45.02, 38.02, 35.60, 30.75,30.16(2C), 29.26, 29.14, 28.28, 28.23(2C), 26.92,26.67, 25.99(2C), 25.09, 23.49。HRMS(ESI)m/zCalcd. for C31H44N2O3[M + H]+493.335 2, Found 493.348 7。
中间体12h 淡黄色固体,收率72.6%,mp:42.0 ~ 42.8 ℃。1H NMR(400 MHz, CDCl3)δ:8.27(1H, d,J= 5.2 Hz, Har-3), 7.95(1H, d,J= 8.5 Hz,Har-5), 7.72(1H, d,J= 5.2 Hz, Har-4), 6.87(1H,dd,J= 8.6, 2.0 Hz, Har-6), 6.83(1H, d,J= 2.0 Hz,Har-8), 4.43(2H, t,J= 7.9 Hz, NCH2), 3.89(2H, d,J= 6.2 Hz, OCH2), 3.01(3H, s, CH3), 2.19(2H, t,J=7.5 Hz, COCH2), 1.95 ~ 1.70(8H, m, cyclohexyl 和CH2), 1.56 ~ 1.47(2H, m, CH2), 1.43 ~ 1.39(11H,m, CH2和CH3× 3), 1.34 ~ 1.08(13H, m, cyclohexyl和CH2× 4)。13C NMR(100 MHz, CDCl3)δ:173.40,160.74, 143.29, 140.58, 138.20, 135.43, 129.60,122.44, 115.16, 112.37, 109.25, 94.31, 80.06,74.14, 45.04, 38.00, 35.70, 30.76, 30.16(2C),29.49, 29.35(2C), 29.16, 28.29, 28.22(2C), 27.04,26.67, 25.99(2C), 25.19, 23.37。HRMS(ESI)m/zCalcd. for C33H48N2O3[M + H]+521.366 5, Found 521.380 2。
2.2.7 中间体13 的合成[5]将中间体12(0.45 mmol)溶解于无水二氯甲烷(5 mL)中,在0 ℃下逐滴加入三氟乙酸(5 mL),恢复至室温反应24 h。反应液减压浓缩得中间体13。不经纯化直接用于下一步。
2.2.8 目标化合物14的合成 将中间体13(0.53 mmol, 1.2 eq.)溶解于DMF(5 mL)中,逐滴加入N,N-二异丙基乙胺DIPEA(290 µL, 1.76 mmol)和HBTU(217 mg, 0.57 mmol),搅拌15 min 后加入中间体9(100 mg, 0.44 mmol),室温下继续搅拌2 h。反应液减压浓缩得到粗品,粗品经硅胶柱纯化(甲醇-二氯甲烷,1∶10→1∶5)得目标化合物14。
化合物14a 白色固体,收率35.7%,mp:247.6 ~ 248.6 ℃。1H NMR(400 MHz, DMSO-d6)δ:8.22(1H, d,J= 8.9 Hz, NH), 8.16(1H, d,J= 5.2 Hz, Har-3), 8.08(1H, d,J= 8.6 Hz, Har-5), 7.90(1H, d,J= 5.2 Hz, Har-4), 7.09(1H, d,J= 2.1 Hz,Har-8), 6.88(1H, dd,J= 8.6, 2.1 Hz, Har-6), 5.25~ 5.10(2H, m, NCH2), 5.04 ~ 5.01(1H, m, 4-OH),4.98(1H, d,J= 5.1 Hz, 3-OH), 4.56(1H, t,J= 5.9 Hz, 6-OH), 4.25(1H, d,J= 8.3 Hz, 1-H), 3.91(2H,dd,J= 6.3, 1.9 Hz, OCH2), 3.68(1H, dd,J= 11.7,5.8 Hz, 6-H), 3.53 ~ 3.42(3H, m, 6'-H, 2-H和3-H),3.30(3H, s, OCH3), 3.10 ~ 3.07(2H, m, 4-H 和5-H),2.90(3H, s, CH3), 1.91 ~ 1.63(6H, m, cyclohexyl),1.22 ~ 1.02(5H, m, cyclohexyl)。13C NMR(150 MHz,DMSO-d6)δ:167.91, 160.21, 143.90, 141.01,137.55, 135.53, 128.85, 122.29, 114.20, 112.23,109.58, 101.85, 94.42, 77.04, 74.00, 73.19, 70.54,60.97, 55.85, 55.53, 47.64, 37.29, 29.37(2C),26.06, 25.30(2C), 22.14。HRMS(ESI)m/zCalcd.for C28H37N3O7[M + H]+528.263 2, Found 528.293 7。
化合物14b 白色固体,收率39.1%,mp:224.0 ~ 224.6 ℃。1H NMR(600 MHz, DMSO-d6)δ:8.17(1H, d,J= 5.2 Hz, Har-3), 8.08(1H, d,J= 8.6 Hz, Har-5), 7.90(1H, d,J= 5.2 Hz, Har-4), 7.87(1H, d,J= 8.9 Hz, NH), 7.20(1H, d,J= 2.1 Hz,Har-8), 6.88(1H, dd,J= 8.6, 2.0 Hz, Har-6), 5.01(1H, d,J= 4.0 Hz, 4-OH), 4.94(1H, d,J= 5.1 Hz, 3-OH), 4.77(2H, t,J= 8.0 Hz, NCH2), 4.54(1H, t,J=5.9 Hz, 6-OH), 4.16(1H, d,J= 8.4 Hz, 1-H), 3.95(2H, d,J= 6.3 Hz, OCH2), 3.68(1H, dd,J= 11.6, 5.5 Hz, 6-H), 3.48 ~ 3.37(2H, m, 6'-H 和2-H), 3.29 ~3.26(1H, m, 3-H), 3.20(3H, s, OCH3), 3.11 ~ 3.04(2H, m, 4-H 和5-H), 2.99(3H, s, CH3), 2.65 ~ 2.53(2H, m, COCH2), 1.90 ~ 1.64(6H, m, cyclohexyl),1.35 ~ 1.08(5H, m, cyclohexyl)。13C NMR(150 MHz,DMSO-d6)δ:169.53, 160.27, 142.73, 140.49,137.59, 134.39, 128.87, 122.42, 114.16, 112.31,109.65, 101.73, 94.50, 77.00, 74.07, 73.16,70.51, 61.01, 55.59, 55.48, 40.76, 37.22, 36.35,29.37(2C), 26.06, 25.29(2C), 22.70。HRMS(ESI)m/zCalcd. for C29H39N3O7[M + H]+542.278 8, Found 542.292 0。
化合物14c 白色固体,收率47.3%,mp:195.4 ~ 196.2 ℃。1H NMR(400 MHz, DMSO-d6)δ:8.28 ~ 8.19(3H, m, Har-3, Har-5 和Har-4), 7.90(1H, d,J= 9.1 Hz, NH), 7.34(1H, d,J= 2.1 Hz,Har-8), 6.96(1H, dd,J= 8.7, 2.0 Hz, Har-6), 5.10(1H, s, 4-OH), 5.04(1H, s, 3-OH), 4.64 ~ 4.52(3H,m, 6-OH 和NCH2), 4.23(1H, d,J= 8.4 Hz, 1-H),4.00(2H, d,J= 6.3 Hz, OCH2), 3.69(1H, d,J= 11.8 Hz, 6-H), 3.58 ~ 3.45(2H, m, 6'-H 和2-H), 3.34 ~3.28(4H, m, OCH3和3-H), 3.12 ~ 3.06(5H, m, 4-H,5-H 和CH3), 2.25(2H, t,J= 6.9 Hz, COCH2), 2.04 ~1.63(8H, m, cyclohexyl 和CH2), 1.36 ~ 1.06(5H, m,cyclohexyl)。13C NMR(150 MHz, DMSO-d6)δ:171.44, 161.67, 144.73, 138.52, 133.74, 132.41,131.08, 123.53, 113.40, 113.32, 111.57, 101.84,94.18, 77.07, 74.20, 73.38, 70.71, 61.07, 55.59,55.10, 43.67, 37.17, 32.33, 29.35(2C), 26.08,26.05, 25.30(2C), 19.69。HRMS(ESI)m/zCalcd.for C30H41N3O7[M + H]+556.294 5, Found 556.308 8。
化合物14d 黄色固体,收率52.5%,mp:188.2 ~ 189.4 ℃。1H NMR(400 MHz, DMSO-d6)δ:8.17(1H, d,J= 5.3 Hz, Har-3), 8.08(1H, d,J= 8.6 Hz, Har-5), 7.93(1H, d,J= 5.3 Hz, Har-4), 7.65(1H, d,J= 9.0 Hz, NH), 7.22(1H, d,J= 2.1 Hz,Har-8), 6.86(1H, dd,J= 8.6, 2.0 Hz, Har-6), 4.99(1H, s, 4-OH), 4.87(1H, s, 3-OH), 4.54(3H, t,J= 7.7 Hz, 6-OH 和NCH2), 4.13(1H, d,J= 8.4 Hz, 1-H),3.95(2H, d,J= 6.3 Hz, OCH2), 3.66(1H, d,J= 11.7 Hz, 6-H), 3.51 ~ 3.41(2H, m, 6'-H 和2-H), 3.31 ~3.24(1H, m, 3-H), 3.10(3H, s, OCH3), 3.07 ~ 2.99(2H, m, 4-H 和5-H), 2.97(3H, s, CH3), 2.13(2H, t,J=6.9 Hz, COCH2), 1.92 ~ 1.56(10H, m, cyclohexyl 和CH2× 2), 1.37 ~ 1.03(5H, m, cyclohexyl)。13C NMR(100 MHz, DMSO-d6)δ:171.79, 160.46, 143.23,140.06, 136.51, 134.35, 129.05, 122.55, 113.89,112.44, 109.88, 102.80, 94.30, 76.46, 74.98,73.23, 70.71, 61.08, 56.30, 54.54, 43.94, 37.32,35.41, 30.05, 29.60, 29.40, 26.09(2C), 25.35(2C),22.53。HRMS(ESI)m/zCalcd. for C31H43N3O7[M +H]+570.310 1, Found 570.324 8。
化合物14e 白色固体,收率43.6%,mp:172.7 ~ 174.0 ℃。1H NMR(400 MHz, DMSO-d6)δ:8.18(1H, d,J= 5.3 Hz, Har-3), 8.09(1H, d,J= 8.6 Hz, Har-5), 7.94(1H, d,J= 5.3 Hz, Har-4), 7.64(1H, d,J= 9.0 Hz, NH), 7.16(1H, d,J= 2.3 Hz,Har-8), 6.87(1H, dd,J= 8.6, 2.0 Hz, Har-6), 5.04(1H, s, 4-OH), 4.91(1H, s, 3-OH), 4.52(3H, t,J=7.9 Hz, 6-OH 和NCH2), 4.18(1H, d,J= 8.4 Hz, 1-H), 3.94(2H, d,J= 6.2 Hz, OCH2), 3.68(1H, d,J=11.7 Hz, 6-H), 3.49 ~ 3.38(2H, m, 6'-H 和2-H),3.33 ~ 3.25(4H, m, OCH3和3-H), 3.13 ~ 3.01(2H,m, 4-H 和5-H), 2.97(3H, s, CH3), 2.06(2H, t,J=7.2 Hz, COCH2), 1.91 ~ 1.62(8H, m, cyclohexyl 和CH2), 1.60 ~ 1.52(2H, m, CH2), 1.44 ~ 1.03(7H, m,CH2和cyclohexyl)。13C NMR(150 MHz, DMSO-d6)δ:171.87, 160.40, 143.12, 139.95, 136.46, 134.35,129.00, 122.53, 113.93, 112.37, 109.77, 101.92,94.23, 76.96, 74.25, 73.17, 70.72, 61.02, 55.53,55.00, 44.03, 37.24, 35.59, 29.95, 29.32(2C),26.02, 25.51, 25.29(2C), 24.99, 22.25。 HRMS(ESI)m/zCalcd. for C32H45N3O7[M + H]+584.325 8,Found 584.340 7。
化合物14f 黄色固体,收率41.1%,mp:130.0 ~ 130.7 ℃。1H NMR(400 MHz, DMSO-d6)δ:8.17(1H, d,J= 5.3 Hz, Har-3), 8.08(1H, d,J= 8.6 Hz, Har-5), 7.91(1H, d,J= 5.3 Hz, Har-4), 7.61(1H, d,J= 9.0 Hz, NH), 7.17(1H, d,J= 2.1 Hz,Har-8), 6.86(1H, dd,J= 8.6, 2.0 Hz, Har-6), 5.00(1H, s, 4-OH), 4.87(1H, s, 3-OH), 4.52(3H, t,J=7.7 Hz, 6-OH 和NCH2), 4.17(1H, d,J= 8.4 Hz, 1-H), 3.93(2H, d,J= 6.2 Hz, OCH2), 3.68(1H, d,J=11.7 Hz, 6-H), 3.50 ~ 3.44(2H, m, 6'-H 和2-H),3.29 ~ 3.23(4H, m, OCH3和3-H), 3.11 ~ 3.01(2H,m, 4-H 和5-H), 2.95(3H, s, CH3), 2.04(2H, t,J=7.2 Hz, COCH2), 1.93 ~ 1.62(8H, m, cyclohexyl 和CH2), 1.51 ~ 1.43(2H, m, CH2), 1.42 ~ 1.03(9H, m,CH2× 2 和cyclohexyl)。13C NMR(100 MHz, DMSOd6)δ:172.04, 160.36, 143.12, 140.08, 136.71,134.42, 128.93, 122.61, 113.98, 112.42, 109.75,102.00, 94.33, 77.00, 74.28, 73.20, 70.72,61.04, 55.64, 55.01, 44.02, 37.28, 35.74, 30.22,29.38(2C), 28.19, 26.08, 25.97, 25.36(2C), 25.22,22.48。HRMS(ESI)m/zCalcd. for C33H47N3O7[M +H]+598.341 4, Found 598.356 3。
化合物14g 黄色油状物,收率35.8%。1H NMR(400 MHz, DMSO-d6)δ:8.17(1H, d,J= 5.4 Hz, Har-3), 8.09(1H, d,J= 8.6 Hz, Har-5), 7.93(1H, d,J= 5.3 Hz, Har-4), 7.58(1H, d,J= 8.9 Hz,NH), 7.17(1H, d,J= 2.1 Hz, Har-8), 6.87(1H, dd,J= 8.7, 2.0 Hz, Har-6), 5.00(1H, s, 4-OH), 4.86(1H, s, 3-OH), 4.53(3H, t,J= 7.6 Hz, 6-OH 和NCH2), 4.15(1H, d,J= 8.4 Hz, 1-H), 3.93(2H, d,J= 6.2 Hz, OCH2), 3.68(1H. d,J= 11.7 Hz, 6-H),3.46 ~ 3.38(2H, m, 6'-H 和2-H), 3.29 ~ 3.20(4H,m, OCH3和3-H), 3.06(2H, d,J= 5.1 Hz, 4-H 和5-H), 2.96(3H, s, CH3), 2.02(2H, t,J= 7.2 Hz,COCH2), 1.91 ~ 1.64(8H, m, cyclohexyl 和CH2),1.50 ~ 1.41(2H, m, CH2), 1.35 ~ 1.04(11H, m,CH2× 3 和cyclohexyl)。13C NMR(100 MHz, DMSOd6)δ:172.05, 160.39, 143.23, 140.01, 136.46,134.39, 129.05, 122.61, 113.94, 112.47, 109.79,102.09, 94.34, 76.99, 74.28, 73.19, 70.71, 61.04,55.62, 55.01, 44.02, 37.27, 35.76, 30.36, 29.38(2C), 28.69, 28.43, 26.15(2C), 25.34(3C), 22.41。HRMS(ESI)m/zCalcd. for C34H49N3O7[M + H]+612.357 1, Found 612.372 1。
化合物14h 黄色油状物,收率44.3%。1H NMR(400 MHz, DMSO-d6)δ:8.16(1H, d,J= 5.2 Hz, Har-3), 8.06(1H, d,J= 8.6 Hz, Har-5), 7.88(1H, d,J= 5.2 Hz, Har-4), 7.57(1H, d,J= 9.0 Hz,NH), 7.14(1H, d,J= 2.1 Hz, Har-8), 6.85(1H, dd,J= 8.6, 2.0 Hz, Har-6), 4.98(1H, d,J= 5.8 Hz, 4-OH), 4.86(1H, s, 3-OH), 4.51(3H, t,J= 7.6 Hz, 6-OH 和NCH2), 4.18(1H, d,J= 8.4 Hz, 1-H), 3.92(2H, d,J= 6.2 Hz, OCH2), 3.69(1H, d,J= 11.7 Hz,6-H), 3.49 ~ 3.43(2H, m, 6'-H和2-H), 3.29 ~ 3.25(4H, m, OCH3和3-H), 3.10 ~ 3.03(2H, m, 4-H 和5-H), 2.93(3H, s, CH3), 2.06 ~ 1.96(2H, m, COCH2),1.93 ~ 1.62(8H, m, cyclohexyl 和CH2), 1.49 ~ 1.40(2H, m, CH2), 1.38 ~ 1.02 (15H, m, CH2× 5和cyclohexyl)。13C NMR(100 MHz, DMSO-d6)δ:172.11,160.17, 142.97, 140.29, 137.30, 134.50, 128.70,122.47, 114.06, 112.30, 109.62, 102.07, 94.33,77.01, 74.33, 73.16, 70.72, 61.08, 55.66, 55.05,43.96, 37.26, 35.86, 30.28, 29.40(2C), 28.98,28.82, 28.81, 28.50, 26.11(2C), 25.34(3C), 22.80。HRMS(ESI)m/zCalcd. for C36H53N3O7[M + H]+640.388 4, Found 640.403 4。
2.3 MTT测试
以去氢骆驼蓬碱为阳性对照,采用MTT 比色法测试目标化合物对MDA-MB-231、HeLa、OVCAR-3、HCT-116、MCF-10A 细胞的增殖抑制活性。将细胞以每孔5 000 个细胞的密度接种于96孔板中,在37 ℃,5% CO2的加湿培养箱中培养12 h。受试化合物用DMSO 溶解配制母液,使用前用新鲜培养基稀释至所需浓度,DMSO 的最终含量为0.1%。去除培养基,每孔加入含不同浓度药物的新鲜培养基100 µL,继续孵育48 h。随后,向每孔加入5 mg/mL MTT 溶液20 µL,37 ℃条件下避光培养4 h。小心去除上清液,并向每孔加入DMSO 100 µL ,振摇10 min。最后,用酶标仪测试其在570 nm处的吸收度,计算相应的细胞存活率及IC50。
2.4 水溶性测试
采用紫外光谱法测试化合物14h 的水溶性。配制0, 2, 4, 6, 8, 10 µg/mL 的化合物14h 和去氢骆驼蓬碱的标准甲醇溶液,绘制标准曲线。配制化合物14h 及去氢骆驼蓬碱过饱和的水溶液及pH 7.4 的磷酸盐缓冲溶液(PBS),室温下摇晃过夜后离心取上清液,用甲醇稀释后根据标准曲线测得其中化合物14h 或去氢骆驼蓬碱的浓度,计算溶解度。
2.5 细胞凋亡实验
MDA-MB-231 细胞以每孔2 × 105个细胞的密度接种于6 孔板中,培养12 h。随后,加入浓度为10、15、20 µmol/L 的化合物14h 及20 µmol/L 的去氢骆驼蓬碱处理24 h。收集细胞并用PBS 清洗细胞3 次,离心、去除上清液。加入Annexin V-FITC 5 µL 及PI 染色液 10 µL,缓慢混匀。最后,在室温下避光孵育20 min,用BD流式细胞仪检测。
2.6 细胞周期分布实验
MDA-MB-231 细胞以每孔2 × 105个细胞的密度接种于6 孔板中,培养12 h。随后,加入浓度为10、15、20 µmol/L 的化合物14h 和20 µmol/L 的去氢骆驼蓬碱处理24 h。收集细胞并用预冷的PBS清洗,离心弃去上清液,向细胞沉淀中加入70%乙醇,4 ℃过夜固定。PBS清洗细胞3次后,加入事先配制好的PI 染色液,轻轻混匀。最后,细胞在37 ℃条件下避光温浴30 min,并通过流式细胞仪检测细胞DNA含量。
2.7 Western blot实验检测EMT相关蛋白的表达
用不同浓度的化合物14h 和去氢骆驼蓬碱孵育MDA-MB-231细胞24 h。通过RIPA 裂解缓冲液(含1 mmol/L PMSF)处理细胞获取细胞总蛋白。随后,利用SDS-PAGE 将蛋白进行分离并转移至PVDF 膜上。将膜用5%脱脂牛奶在室温下封闭2 h,并使用相应的一抗(抗E-cadherin 抗体、抗Ncadherin 抗体、抗Twist1 抗体、抗Bcl-2 抗体、抗GADPH 抗体)4 ℃孵育过夜。在室温下用辣根过氧化物酶标记的二抗处理PVDF 膜2 h。最后,向膜上滴加ECL 发光液,利用成像系统进行发光成像。
2.8 划痕实验
MDA-MB-231 细胞以每孔5 × 105个细胞的密度接种于6 孔板中,培养12 h,形成融合的单层细胞。用10 µL无菌枪头的尖端轻轻划伤细胞,并用PBS 小心清洗。随后,用含2% FBS 的新鲜培养基配制10、15、20 µmol/L 的化合物14h 和20 µmol/L的去氢骆驼蓬碱并加入到细胞中,共同培养12 h。在0 h 和12 h 通过显微镜拍照记录创面的生长情况。
3 结果与讨论
3.1 体外抗肿瘤活性筛选
通过MTT 比色法测定合成的8 个目标化合物14a ~ 14h 对4 种人肿瘤细胞(乳腺癌细胞MDAMB-231、宫颈癌细胞HeLa、卵巢癌细胞OVCAR-3、结肠癌细胞HCT-116)的增殖抑制活性,计算IC50。如表1 所示,化合物14a ~ 14h 中连接臂长度(n)对其抗肿瘤活性有显著影响。整体而言,IC50随n增大呈下降趋势。连接臂长度最短的化合物14a(n= 1)对4 种细胞均无明显抑制作用(IC50> 100µmol/L),化合物14b和14c(n= 2, 3)的抗肿瘤活性有所提高但仍劣于去氢骆驼蓬碱。随着连接臂长度继续增加,化合物14d ~ 14g(n= 4 ~ 7)的IC50进一步降低,特别是对MDA-MB-231 和HeLa 细胞的IC50分别达到14.02 ~ 35.30 µmol/L 和17.40 ~23.50 µmol/L,绝大部分优于去氢骆驼蓬碱。所有偶联物中,连接臂长度最大的化合物14h(n= 9)对肿瘤细胞的增殖抑制活性最强,其对OVCAR-3 和HCT-116 的活性与去氢骆驼蓬碱相当,而对MDAMB-231 和HeLa 的抑制活性(IC50= 12.79 µmol/L和14.36 µmol/L)显著优于去氢骆驼蓬碱(IC50=28.30 µmol/L 和34.38 µmol/L)。不同肿瘤细胞对化合物14h 的敏感性不同可能与肿瘤细胞表面GLUT1 的表达量有关。综合上述结果,选择化合物14h,进一步在乳腺癌细胞中考察其抗肿瘤活性和作用机制。
Table1 IC50 of compounds 14a-14h against cancer cells (, n = 3)

Table1 IC50 of compounds 14a-14h against cancer cells (, n = 3)
?
MTT 试验发现,化合物14h 对MDA-MB-231细胞的增殖抑制作用呈时间(24, 48, 72 h)和浓度(10, 15, 20 µmol/L)依赖性(图2-A)。为考察化合物14h 中各部分结构对其抗肿瘤活性的贡献,在3 种浓度下(10, 15, 20 µmol/L)测定了片段化合物12h 和8 对MDA-MB-231 细胞的抑制活性,并与化合物14h 和去氢骆驼蓬碱比较(图2-B)。结果显示,化合物12h 和8 均无显著细胞毒性,而化合物14h 的增殖抑制活性显著优于去氢骆驼蓬碱。这提示,化合物14h 的抗肿瘤活性是其结构中去氢骆驼蓬碱、连接臂、糖基片段协同作用的结果。

Figure2 Cytotoxicity of compound 14h in MDA-MB-231 cells (, n = 3)
3.2 化合物14h中糖基的作用考察
3.2.1 水溶性测试 糖基的引入往往可以增加偶联药物的水溶性,因此对化合物14h 在纯水和PBS(pH 7.4)中的溶解度进行了测定。结果显示,化合物14h 在水和PBS 中溶解度分别为42.56 µg/mL 和32.31 µg/mL,分别是去氢骆驼蓬碱的4.5 倍和3.8倍(图3-A)。
3.2.2 抑制剂对化合物14h 抗肿瘤活性的影响为探究化合物14h 的抗肿瘤活性是否依赖于糖基转运蛋白GLUT,用GLUT 抑制剂根皮苷(phlorizin)预处理MDA-MB-231 细胞,考察其对化合物14h 和去氢骆驼蓬碱细胞毒性的影响。结果显示,加入根皮苷(1 mmol/L)后,去氢骆驼蓬碱的IC50提高了0.4 倍,而化合物14h 的IC50提高了1.4 倍(图3-B)。显然,与去氢骆驼蓬碱相比,糖基偶联物14h的抗肿瘤活性更依赖于GLUT,提示GLUT 在肿瘤细胞对化合物14h的摄取中发挥重要作用。
3.2.3 化合物14h的肿瘤细胞选择性 为考察糖基的引入是否提高了化合物14h 的肿瘤细胞选择性,分别在肿瘤细胞MDA-MB-231 和正常细胞MCF-10A 中测定化合物14h 的增殖抑制活性。结果显示,化合物14h 对正常细胞MCF-10A 的毒性显著低于对MDA-MB-231 的毒性(图3-C)。经15µmol/L 和20 µmol/L 的化合物14h 处理后,MCF-10A细胞的存活率分别是MDA-MB-231细胞的2.2倍和6.1 倍。相反,在相同的试验中,去氢骆驼蓬碱未显示出对肿瘤细胞和正常细胞的区分能力(图3-D)。
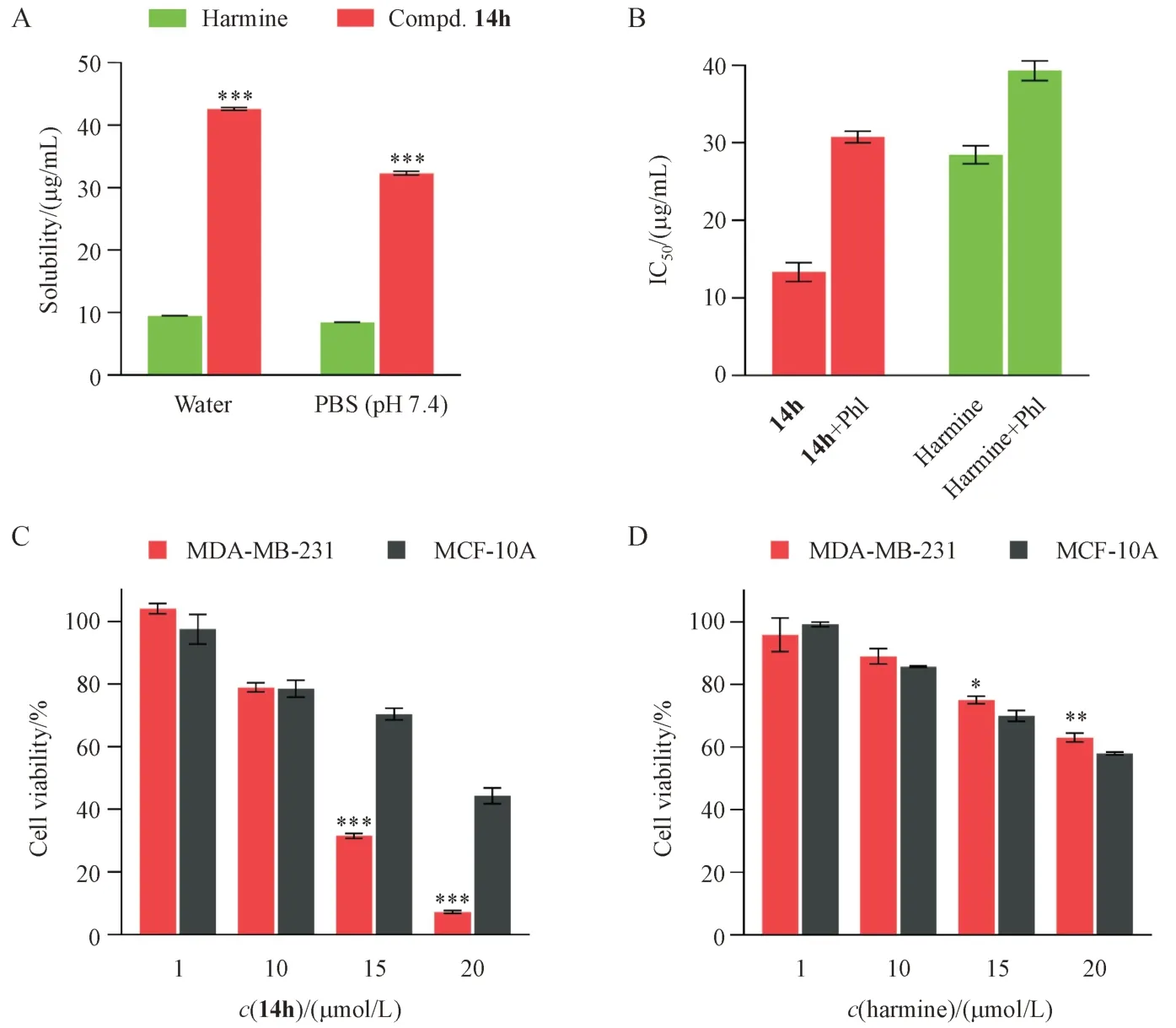
Figure3 Roles of the carbohydrate moiety in compound 14h (, n = 3)
综上,糖基的引入改善了药物的水溶性,并利用Warburg 效应显著提高了化合物14h 对肿瘤细胞的选择性。
3.3 化合物14h 诱导MDA-MB-231 细胞凋亡能力考察
诱导肿瘤细胞凋亡是抗肿瘤药物的经典作用机制。通过Annexin V-FITC/PI 双染色法和流式细胞术评价化合物14h 诱导MDA-MB-231 细胞凋亡的能力。结果显示,与空白组的凋亡率(12.1%)相比,10 µmol/L 和15 µmol/L 的化合物14h 处理过的细胞的凋亡率分别增长至20.0%和29.9%。用20µmol/L 的化合物14h 处理后,细胞凋亡率达到37.4%,显著高于相同浓度去氢骆驼蓬碱的凋亡诱导率(23.9%)(图4)。这表明,化合物14h 可浓度依赖性地诱导肿瘤细胞凋亡,活性优于去氢骆驼蓬碱。

Figure4 Apoptosis-inducing effects of compound 14h in MDA-MB-231 cell lines (, n = 3)
3.4 化合物14h 对MDA-MB-231 细胞周期分布的影响
抗肿瘤药物通常可以通过诱导细胞周期阻滞来发挥作用。通过PI染色法和流式细胞术测试化合物14h 和去氢骆驼蓬碱对MDA-MB-231 细胞周期分布的影响。结果显示,与空白组相比,20µmol/L 的去氢骆驼蓬碱处理细胞后,S期的细胞比例由46.0%上升至59.8%(图5),说明去氢骆驼蓬碱可将细胞周期阻滞在S 期。与去氢骆驼蓬碱不同,10 µmol/L、15 µmol/L 和20 µmol/L 的化合物14h 处理细胞后,G0/G1期的细胞比例明显增加,分别上升至38.3%、52.3%和67.1%。因此,化合MB-231 细胞阻滞在G0/G1期。
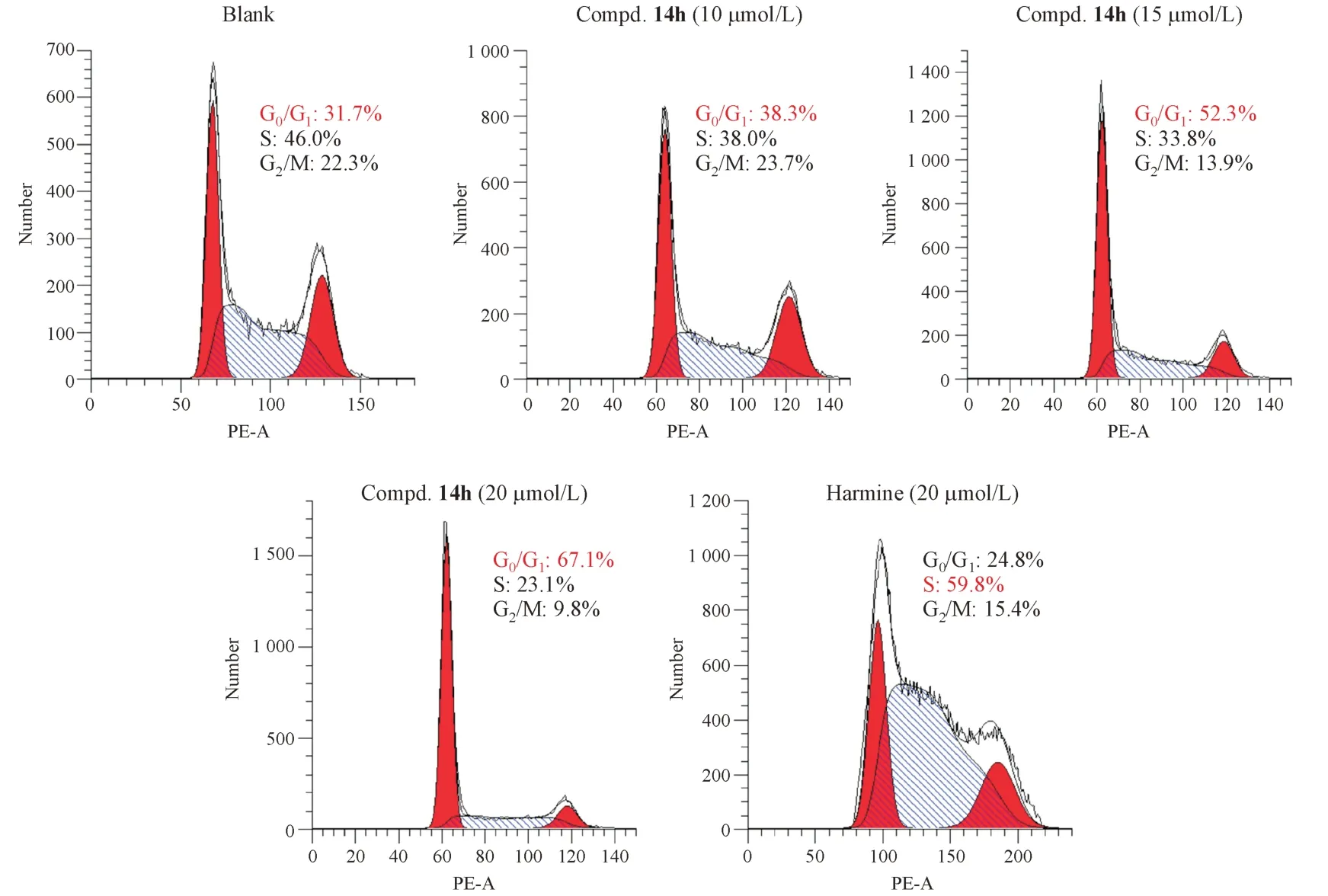
Figure5 Effects of compound 14h on the cell cycle distribution of MDA-MB-231 cell lines
3.5 化合物14h 对MDA-MB-231 细胞EMT 的影响
上皮-间充质转化(EMT)是肿瘤细胞侵袭和转移的重要原因。EMT 发生时,上皮细胞表型标志物E-cadherin 表达下调,而介导细胞黏附功能的N-cadherin、核转录因子Twist1 以及与Twist1 发挥协同效应的Bcl-2表达上调。为考察化合物14h 对肿瘤细胞EMT 的影响,采用Western blot 测定相关蛋白的表达。结果显示,化合物14h浓度依赖性地增加了MDA-MB-231 细胞中E-cadherin 的表达,同时降低了N-cadherin、Twist1 和Bcl-2 的表达(图6-A)。相同浓度(20 µmol/L)下,化合物14h 对EMT相关蛋白表达的影响大于去氢骆驼蓬碱。
3.6 化合物14h 对MDA-MB-231 细胞迁移能力的影响
肿瘤细胞的迁移能力与肿瘤侵袭和转移密切相关。通过划痕试验进一步评估了化合物14h 对MDA-MB-231 细胞迁移能力的影响。在创面形成12 h 后,空白组随着细胞迁移创面面积减少25.9%。化合物14h 浓度依赖性地减缓MDA-MB-231 细胞的创面愈合速度(图6-B)。经20 µmol/L化合物14h处理后,单层细胞的创面面积在12 h内无明显变化(0.32%),而相同浓度下去氢骆驼蓬碱组的创面面积减少17.7%。以上结果提示,化合物14h 对MDA-MB-231 细胞迁移的抑制能力优于去氢骆驼蓬碱。

Figure6 Effects of compound 14h on epithelial-mesenchymal transition (EMT) and migration of MDA-MB-231 cells
4 结 论
本研究设计并合成了天然产物去氢骆驼蓬碱的N9位糖基偶联物并重点考察连接臂长度对偶联物抗肿瘤活性的影响。MTT 筛选发现,偶联物的抗肿瘤活性随连接臂中烷基链长度的增加而提高。化合物14h 的抗肿瘤活性最佳,对MDA-MB-231 细胞的增殖抑制活性显著优于去氢骆驼蓬碱。进一步研究发现,与去氢骆驼蓬碱相比,糖基的引入改善了化合物14h 的水溶性,并提高了化合物14h 对肿瘤细胞的选择性,提示糖基偶联物14h 可利用Warburg 效应更好地靶向肿瘤细胞。机制研究发现,化合物14h 可诱导MDA-MB-231 细胞凋亡,阻滞细胞周期于G0/G1期,并通过抑制EMT 信号通路抑制肿瘤细胞的迁移。后续将围绕化合物14h 开展进一步的结构优化以期获得成药性更佳的去氢骆驼蓬碱衍生物用于肿瘤治疗。
