微流控芯片技术及质谱技术用于细菌耐药性检测及耐药机制研究
2023-12-30张冬雪
张冬雪,乔 亮
(复旦大学化学系,复旦大学生物医学研究院,上海 200433)
细菌是最常见的病原微生物之一,是引起大部分感染性疾病的重要原因。1928 年,Alexander Fleming 发现了第1 种抗生素——青霉素,使得医生们拥有了完全治愈感染性疾病的方法。抗生素的出现,无疑是人类历史上一个重要的转折点,开启了人类历史的新纪元。然而,细菌却对抗生素产生了耐药性,导致抗生素杀菌效率降低,致使细菌感染性疾病的治疗又出现了困难。20世纪30年代末至40 年代,首次出现了抗生素耐药的问题。就在当时第一批抗菌药物磺胺类药物和青霉素刚刚问世不久,普通细菌如金黄色葡萄球菌(Staphylococcus aureus,S.aureus)对这类抗生素产生耐药性的速度达到了创纪录的水平[1]。20 世纪60 年代,半合成青霉素被生产、开发以及使用,然而不到一年,就出现了耐甲氧西林S.aureus(MRSA)的报道[2]。
细菌耐药性对人类和动物健康、粮食安全和经济发展构成重大威胁[3]。耐药菌在医院环境中导致医院获得性感染[4],提高了控制成本,同时无效的治疗延长了疾病治疗的时间,增加发病率和死亡率,并且增加了住院的费用[5]。除造成医院感染以外,耐药菌在人群尤其是易感人群中传播,侵袭感染人体的不同组织和器官,严重危害公众健康。根据The Review on Antimicrobial Resistance的报道,从2014 年到2050 年,由微生物耐药性影响的全球国内生产总值损失高达100.2万亿美元,并且每年导致1 000 万人口死亡[6]。根据美国疾病控制与预防中心的Antibiotic Resistance Threats in the United States,2019报告预测,每年在美国会有超过280 万的抗生素耐药性引起的感染病例,并且会有超过35 000人死亡[7]。
1 细菌耐药性与SOS反应
致病菌通过两种不同的遗传机制获得耐药性[8]。(1)在细菌染色体复制过程中发生的自发突变可以使细菌对抗生素产生耐药性。(2)可移动的遗传元素,如质粒和噬菌体(细菌病毒),通过水平基因转移过程在细菌种群之间转移耐药基因,如结合和转导,从而使细菌获得耐药基因。在大多数情况下,抗生素形成的压力环境是引起大部分病原菌耐药性产生的最常见的原因[9]。而抗生素的滥用,无疑加速了细菌耐药性的产生和耐药菌的传播。
当处于抗生素造成的压力环境中时,细菌会发生DNA 损伤修复反应(SOS 反应),抵抗压力以进行自救。这种反应机制潜在地加速了细菌进化和耐药性的产生。LexA(阻遏因子)和RecA(诱导因子)在调节SOS 反应中起关键作用,控制SOS 基因的表达[10]。在DNA 修复的情况下,RecA 在诱导SOS 反应中起到主要作用,以表达与DNA 修复有关的各种SOS 基因[11]。通过激活RecA,使LexA 抑制因子失活并诱导SOS 反应响应基因,最终激活SOS 反应通路[12]。RecA 介导的SOS 反应进而影响细菌持留性、生物被膜形成和宿主反应[11]。很多种类的抗生素如环丙沙星[13],阿奇霉素[14],β-内酰胺类抗生素[15]都可以诱导细菌发生SOS反应。
细菌形态成丝状是SOS 反应在表型上的一种体现。SOS 反应通过在DNA 损伤修复过程中抑制细胞分裂,当细菌细胞分裂受到抑制但还在继续生长的时候,丝状就会产生。例如,使用β-内酰胺类抗生素去刺激细菌、干扰细菌细胞分裂时,细胞会呈现丝状;当抗生素浓度稀释或抗生素失活时,细菌又会存活下来[16]。Braga 等[17]研究了不同亚抑菌浓度的β-内酰胺类抗生素头孢布烯诱导大肠埃希菌(Escherichia coli,E.coli)不同时间的丝状形成动力学,发现细菌细胞的形态变化受暴露时间和抗生素浓度的影响。Yao 等[18]发现β-内酰胺类抗生素杀死E.coli细胞经历4 个阶段:细胞变长、肿胀形成、肿胀停滞、细胞裂解。而发生肿胀的细胞处于亚稳态,可能裂解,也可能在抗生素撤除后恢复到正常状态。此外,多核的丝状细菌细胞可以在丝状体尖端发生不对称的分裂,产生更加耐药的非丝状的子代细胞[19]。而且,细菌的形态变化能够降低细菌对抗生素的摄取,是一种帮助细菌恢复到快速生长状态的反馈策略[20]。
2 质谱在细菌检测方面的应用
质谱是一种分析技术,根据化学物质的质荷比将离子进行区分。质谱有灵敏度高、检测限低、检测速度快等优点,在生物化学领域被广泛应用在蛋白质组学、代谢组学、高通量药物筛选等方面,是环境监测、食品质控、临床诊断等领域的重要手段工具。常用于细菌分析研究的质谱包括基质辅助激光解吸离子化飞行时间(matrix assisted laser desorption/ionization time-of-flight,MALDITOF)质谱、电喷雾离子化(electrospray spray ionization,ESI)质谱、敞开式质谱(ambient mass spectrometry)等。利用质谱技术分析细菌可以实现细菌鉴定、耐药菌株与敏感菌株区分、细菌耐药性检测等(图1)。
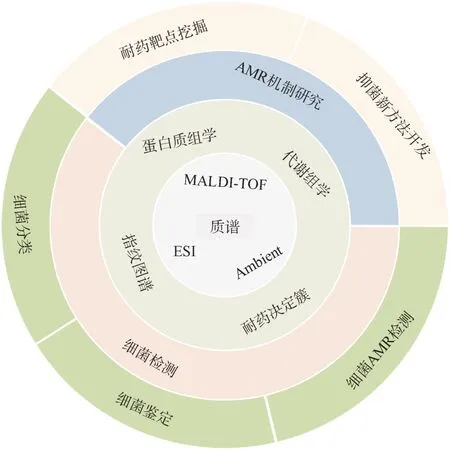
图1 基于质谱的细菌检测及耐药机制研究
2.1 MALDI-TOF质谱检测细菌
MALDI 作为一种基于细菌蛋白质量分布鉴定细菌的方法,具有检测快速、方便、准确等优点,已经应用于临床微生物鉴定、核酸检测等方面,同时可应用于细菌药物敏感性分析。
在微生物鉴定方面,Bruker 推出了Biotyper CA system 商品化仪器,包含MALDI-TOF 质谱仪、软件、数据库[21]。MALDI-TOF 质谱主要检测的是细菌的核糖体蛋白,而不同属、种细菌具有特定的指纹图谱,由此可以实现细菌的区分和鉴定。利用Bruker 的Biotyper 对革兰氏阴性杆菌进行鉴定,与BD 的BD Pheoenix 自动微生物系统相比较结果更加准确[22]。BD Phoenix 系统鉴定准确率在菌属水平和菌种水平分别为83%和75%,而Biotyper 鉴定准确率分别为93%和82%。与分离富集方法联用,MALDI-TOF 质谱还可对复杂体系中的微生物进行鉴定。Zhu 等[23]利用基于免疫亲和磁珠捕获的MALDI-TOF 质谱检测法,直接从血培养瓶中捕获目标细菌,然后利用质谱进行检测,检测限低至8 000 CFU/mL。他们团队后续开发了基于MALDITOF 质谱区分耐药菌和敏感菌的新方法[24]。TiO2修饰的靶板可以在光催化下破坏细菌的膜结构,提高细菌胞内组分的电离效率,从而能检测到更多的胞内物质,提高了MALDI-TOF 质谱的检测灵敏度。使用这种方法,可以通过相对峰强度快速测量细菌胞内耐药蛋白表达水平的变化。这种通过利用质谱直接从完整细菌中检测耐药蛋白的方法可用于快速区分耐药细菌和非耐药细菌,同时实现物种鉴定。此外,该方法还可以用于初步分析潜在耐药机制。
2.2 ESI质谱检测细菌
使用ESI 质谱可以直接对细菌细胞进行检测分析。直接检测细菌细胞时,质谱的主要信号来源于小分子代谢物和一些脂质分子[25]。早在1999年,Goodacre 等[26]首次报道了应用ESI 质谱对革兰氏阴性菌和革兰氏阳性菌完整细胞的重复性鉴定。Vaidyanathan等[27]用ESI质谱直接分析36株包括芽孢杆菌属(Bacillus)在内的需氧有内生孢子的细菌水悬液。使用聚类分析方法,成功证明该技术能够实现对枯草芽孢杆菌(Bacillus subtilis)的鉴定,并实现了在亚种水平上的区分。
对细菌样品进行预处理不仅可以获得纯化的生物分子样品,而且可以避免因直接引入细菌导致电喷雾喷针堵塞的问题。可使用超声波和裂解液裂解细菌细胞,离心分离提取出细菌的蛋白[28]。再将提取的蛋白依次还原、烷基化、酶解成肽段[29],进行蛋白质组分析,从而获得丰富的细菌蛋白信息。利用基于ESI 质谱的蛋白质组学方法检测细菌对抗生素的抗性决定簇,可以实现对耐药菌的鉴定。Chen 等[30]使用蛋白质组学技术检测了4 株空肠弯曲杆菌(Campylobacter jejuni,C.jejuni)分离菌株对四环素、环丙沙星、β-内酰胺类抗生素的耐药决定簇,都与耐药性表型检测结果一致。Blumenscheit 等[31]利用组学技术分析了7 种耐药程度不同的29 株分离株,包括E.coli,肺炎克雷伯氏菌(Klebsiella pneumoniae,K.pneumoniae),屎肠球菌(Enterococcus faecium)等,共鉴定到代表13 种蛋白亚型的11种耐药决定簇。这种耐药性检测方法的灵敏度和特异性分别高达98%和100%。ESI 质谱还可以通过检测细菌的代谢物[32]、脂质[33]和细胞壁磷壁酸[34]等其他的生物分子对细菌进行分析检测。
2.3 敞开式质谱检测细菌
敞开式离子化质谱(ambient ionization mass spectrometry,AMS)通过检测细菌样品挥发出的气态代谢物、或者固态样品本身,实现对细菌样品的检测,可应用于病原菌的早期检测和快速分类。利用AMS,样品可不经预处理直接从其原生环境中进行分析[35]。常用于微生物分析检测的AMS 包括二次电喷雾电离(secondary electrospray ionization,SESI)质谱、解吸附电喷雾离子化(desorption electrospray ionization,DESI)质谱、实时直接分析(direct analysis in real time,DART)质谱、激光烧蚀电喷雾离子化(laser ablation electrospray ionization,LAESI)质谱等[36-39]。细菌悬液与四甲基氢氧化铵(tetramethyl ammonium hydroxide,TMAH)混合时会产生细菌脂质的热水解和甲基化。根据这一原理,Pierce等[40]将从经TMAH处理的细菌中提取的少量溶液放置在玻璃毛细管上进行电离,利用DART质谱检测全细菌悬浮液中细菌脂质热水解和甲基化产生的脂肪酸甲酯(fatty acid methyl esters,FAME)。通过对来自E.coli、伯纳特柯克斯体(Coxiella burnetii)和链球菌(streptococcus)的FAME 的谱图观测,实现在菌种、菌株水平上的区分。So 等[41]发展了一种采用固体底物针尖的高通量的针尖解吸电喷雾离子化技术(tip-DESI),与离子迁移串级质谱结合,用于从临床样品中快速筛选产碳青霉烯酶的细菌。将培养在平板上的细菌菌落直接悬浮在含有指示剂(如碳青霉烯类抗生素美罗培南)的溶液中,再将其直接负载在高压连接的一次性底物尖端上,用DESI 进行解吸和电离。通过监测特征离子迁移时间以及碳青霉烯类的水解和脱羧MS/MS 谱图,实现了对产碳青霉烯酶的细菌的模糊鉴定。Dean 等[42]使用LASEI 快速、直接地分析S.aureus和铜绿假单胞菌(Pseudomonas aeruginosa,P.aeruginosa)混合菌的生物被膜,分析两种菌在混合生物被膜中共定位或自分离的情况,并提供关于生物被膜成分和抗生素治疗效果的信息。
3 基于组学技术的耐药机制研究
基于质谱的蛋白质组学和代谢组学分析技术可以提供丰富的蛋白和代谢分子信息,是阐述生物体代谢途径的重要技术。组学技术是指导耐药性分析的重要手段,对细菌耐药性发生机制的研究、药物靶点的筛选以及新药开发具有积极意义(图1)。
3.1 蛋白质组学技术研究细菌耐药机制
检测耐药相关蛋白及其丰度的变化可以实现对细菌耐药性的解析。对耐药相关蛋白的研究往往是通过比较敏感菌株和耐药菌株的蛋白种类和丰度的差异;或利用抗生素刺激细菌,并与未受抗生素刺激的细菌进行蛋白质种类和丰度比较,分析差异蛋白的功能归属,从而实现相关机制的研究。早期的蛋白质组学是利用基于固定pH 梯度的二维凝胶电泳技术的方法来检测不同样品蛋白丰度的差异。现在广泛应用的是基于液相色谱串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)的蛋白质组学来鉴定、定量蛋白[43]。常用的蛋白定量方法包括标记定量和非标记定量。标记定量方法包括细胞培养中的氨基酸稳定同位素标记(stable isotope labeling with amino acids in cell culture,SILAC)的生物标记法,以及用于标记母离子的同位素编码亲和标记(isotope-coded affinity tag,ICAT)和用于标记子离子的串联质量标签(tandem mass tags,TMT)的化学标记法。
Chua等[44]使用脉冲SILAC定量蛋白质组学,定量出耐黏菌素P.aeruginosa的生物被膜亚群中新表达的蛋白。耐黏菌素细菌通过利用type IV pili迁移到黏菌素杀死的生物被膜顶端,再通过群体感应形成新的耐药亚群。他们发现在耐黏菌素亚群中,与type IV pili 组装相关的蛋白PilF 和群体感应相关的蛋白LasB 都高表达。Hao 等[45]利用TMT标记定量蛋白质组学方法,比较分析了药物敏感、多重耐药与广泛耐药的K.pneumoniae菌株的蛋白质组,共鉴定到了3 531 个蛋白质。与药物敏感菌株相比,在多重耐药株和广泛耐药株中分别有247个和346个表达不同的蛋白。基因本体论GO和京都基因与基因组百科全书KEGG 富集分析揭示了大部分的差异蛋白参与很多促进K.pneumoniae耐药性进化的过程。
另一种为非标记定量,不需要稳定的同位素标签作内部标准。Sharma 等[46]使用LC-MS/MS 分析在美罗培南刺激下耐碳青霉烯K.pneumoniae的蛋白质组。将得到的显著差异蛋白进行功能归属,发现在DNA/RNA 修饰酶或蛋白、碳青霉烯类裂解等方面的蛋白都有过表达的现象。Monteiro等[47]使用二维凝胶电泳与质谱相结合的经典蛋白质组学方法,研究发现受抗生素刺激的产超广谱β-内酰胺酶E.coli(ESBL-E.coli)与未受刺激的ESBL-E.coli之间,以及耐药的E.coli菌株与敏感的E.coli菌株之间,细胞质蛋白都有很大的差异。一些抗性蛋白如β-内酰胺酶CTX-M-1 和TEM,以及与氧化应激相关的蛋白高水平表达。Balboa等[48]使用定量蛋白质组学技术比较耐药菌和敏感菌在抗菌肽作用下的蛋白差异,揭示新型抗菌肽的作用机制。此外,不同浓度的抗生素所引起的耐药菌蛋白水平变化也不尽相同。受低浓度环丙沙星刺激的P.aeruginosa主要体现在铁和多胺摄取以及DNA 修复相关蛋白的上调,而使用高浓度环丙沙星刺激的P.aeruginosa主要体现在mexCDoprJ外排泵的过表达[49]。
3.2 代谢组学技术研究细菌耐药机制
蛋白驱动着代谢过程,而代谢反映了蛋白调节的全局情况。因此,相对于蛋白质组学,代谢组学更能反映微生物细胞动态的、实时的状态。了解细菌应对抗生素药物的动态变化可以解释耐药发生机制。Zampieri 等[50]利用非靶向代谢组学方法监测了E.coli在多种抗生素扰动下的即时代谢响应,揭示了氨失衡在加重氯霉素毒性及脱氧胸苷-5'-二磷酸-鼠李糖合成在应对喹诺酮类抗生素反应中gyrA即时转录上调的重要功能。Liu等[51]利用非靶向代谢组学技术分析了基因同源的甲氧西林敏感S.aureus(MSSA)和MRSA 的代谢区别。通路富集分析结果表明DNA 修复和黄素生物合成是抗生素压力环境中MSSA 和MRSA 菌株中普遍的代谢通路。MRSA 系统通过精准地控制能量产生,青霉素结合蛋白PBP2a 底物生物合成和抗氧化功能,有效地对抗苯甲异唑青霉素。Aros-Calt等[52]将亲水性相互作用液相色谱与高分辨质谱相结合,比较在无抗生素作用时10株MRSA和MSSA在不同生长时期的代谢,发现耐药菌株相较于敏感菌株生长缓慢,而且在肽聚糖和荚膜多糖的生物合成上与敏感菌株也不相同。Li 等[53]利用基于液相色谱质谱(liquid chromatography-mass spectrometry, LC-MS)的非靶向代谢组学方法分析C.jejuni的耐药机制,同时结合靶向定量分析多反应监测(multiple reaction monitoring,MRM)模式定量分析特征代谢物。在一株耐氯霉素的C.jejuni中,发现了多达41 种涉及甘油磷脂代谢、鞘脂代谢和脂肪酸代谢的差异代谢物。
使用二氧化钛辅助激光解吸离子化(TiO2assisted desorption/ionization)质谱检测细菌胞内代谢物也可以区分不同细菌菌株,检测细菌耐药性[54]。一些氨基酸的代谢通路如半胱氨酸和甲硫氨酸代谢、精氨酸和脯氨酸代谢、以及嘌呤代谢在ESBL-E.coli和敏感的E.coli之间表现出很大的差异。气相色谱质谱联用(gas chromatography-mass spectrometry,GC-MS)也可用来分析同基因型不同菌株之间的代谢差异,从而实现耐药相关代谢通路的分析。Liu 等[55]利用基于GC-MS 的代谢组学技术分析敏感和头孢他啶耐药的溶藻弧菌(Vibrio alginolyticus,V.alginolyticus),发现耐药菌株的特点为呼吸效率低下,丙酮酸循环(P 循环)效率低下,脂肪酸生物合成增加,膜质子动力降低。
3.3 多组学技术研究细菌耐药机制
很多时候可以将多种组学分析方法相结合来综合研究细菌耐药问题。多种组学可以互相验证,更全面准确地分析细菌耐药性机制。Wright等[56]将基因测序和转录分析相结合,发现了9 株临床耐黏菌素K.pneumoniae的遗传机制。在全部耐药菌株中,涉及阳离子运输和膜完整性维护的基因全部上调,以保护细菌细胞抵抗抗生素造成的压力环境。Cai等[57]结合蛋白质组学和基因组学技术比较研究耐药P.aeruginosa及其敏感菌株。在耐药菌株中共发现41 个差异蛋白和42 个突变位点,可能是控制P.aeruginosa耐药的关键。Foudraine 等[58]将全基因组测序(whole genome sequencing, WGS)、高分辨LC-MS/MS和梯度稀释的细菌药物敏感性分析法相结合,分析187 株临床分离E.coli和K.pneumoniae菌株。使用抗性基因数据库CARD 鉴定耐药基因和蛋白。所有的蛋白使用NCBI RefSeq 数据库和Prokka 进行注释。在大多数分离株中,检测到的机制与表型相匹配。Cheng等[59]使用同位素标记的蛋白质组定量方法,同位素标记相对和绝对定量(isobaric tag for relative and absolute quantitation,iTRAQ),分析耐左氧氟沙星V.alginolyticus的蛋白质组,发现三羧酸循环(tricarboxylic acid cycle,TCA cycle)代谢通路显著下调,并使用转录组分析方法定量逆转录聚合酶链反应(quantitative reverse transcriptase polymerase chain reaction,qRT-PCR)分析验证参与TCA 循环的基因表达情况。Li 等[60]分析比较E.coli在环丙沙星胁迫下与未处理情况下的蛋白质组和代谢组,总结得出环丙沙星能抑制DNA复制,增加DNA回旋酶和DNA拓扑异构酶的表达。
4 微流控技术在细菌检测及细菌耐药性研究中的应用
如今,病原菌检测方法以高灵敏、准确、快速地鉴定多种微生物为发展目标。然而,从高度复杂背景的样品中提取病原微生物的过程至关重要,而这一步骤往往耗费很长时间。发展能极大地缩短并简化样品预处理过程的新方法,是众望所归。微流控技术是从20 世纪80 年代至90 年代初快速发展的多学科技术[61]。微流控芯片是大小为数厘米的便捷式设备,通常包含阀、微通道、反应腔、压力系统和检测系统。微流控技术通过控制流体的流动,将样品处理、反应、分离和检测整合到微流控芯片上,并可与聚合酶链反应(polymerase chain reaction,PCR)、环介导等温扩增(loop-mediated isothermal amplification,LAMP)、质谱、荧光、电化学等检测技术联用。
4.1 基于微流控芯片的细菌样品纯化
微生物的纯化和富集是实现准确鉴定的关键。传统的细菌纯化方法依赖于细菌培养,耗时长且只能应用于可培养的物种。而且,从单菌落中纯化的细菌不能完全代表原始的样品成分,尤其是当原始的样品中有很多种微生物。为克服培养中的偏差问题,实现快速原位鉴定,不同的微流控芯片被设计出来,从空气、水、食品、临床等样品中,通过物理、化学或生物化学等方法富集和纯化细菌。微生物提取的物理方法主要依赖于惯性差异、大小差异、过滤、声波分离和特殊的微通道结构设计[62-65]。基于特异性识别的化学和生物化学的方法也能实现微生物的提取分离,如磁珠修饰抗体产生免疫亲和作用[66],以及甘露糖结合凝集素与甘露糖在细菌细胞膜上的亲和力[67]。与物理方法相比,生化方法能从大小和密度相同的微粒中提取目标病原微生物。
4.2 微流控芯片检测细菌
Homann等[68]设计制作一种微流控墨盒以快速准确诊断结核杆菌(Mycobacterium tuberculosis,M.tuberculosis)感染。该微流控系统包含一个微流控墨盒,一个实验室标准离心机和一个标准的PCR扩增仪。该墨盒包含所有所需的试剂,并自动搜集滤膜上的细菌、裂解细菌、提取核酸和等分DNA提取物以进行PCR 反应。使用该方法,可以在痰液样本中检测到浓度低至10 CFU/mL 的添加的M.tuberculosis。Jin 等[69]将微流控芯片与LAMP 相结合,实现沿海水域中10 种水生致病菌的同时快速检测。Krafft等[70]将微流控技术与表面增强拉曼光谱(surface enhanced Raman spectroscopy, SERS)相结合,富集和检测饮用水中的细菌。该微流控装置包含两个垂直堆叠的微流控通道,中间由一张聚碳酸酯纳米多孔膜分隔开。一条通道通入样品,另一条通道利用驱动力使流体通过多孔膜,将微生物捕获在多孔膜上,再利用SERS 实现对微生物的检测。Li 等[71]设计了一个微通道硅纳米线(microchannel silicon nanowires,McSiNW)微流控芯片来捕获尿液中的细菌,并结合MALDI-TOF 质谱进行分析检测。微流控通道是由McSiNW 基底和上面覆盖的聚二甲基硅氧烷(polydimethylsiloxane,PDMS)片组成,上下两侧还有两片聚甲基丙烯酸甲酯片进行固定。石英毛细管插在McSiNW 基底和PDMS 片之间作为样品的入口和出口。细菌会被捕获到McSiNM 基底上,然后用MALDI-TOF质谱进行分析。在最优的条件下,从尿液样本中可以直接检测到浓度为1 × 106CFU/mL 的细菌,无需培养。Bian 等[72]设计了一种可以高效捕捉富集空气中细菌的微流控芯片。他们使用基于LC-MS/MS的蛋白质组学方法鉴定出多种收集在芯片上的细菌,包括副溶血性弧菌(Vibrio parahaemolyticus,V.parahemolyticus)、单核细胞增多性李斯特氏菌(Listeria monocytogenes)和E.coli。电化学方法也可以与微流控技术联用检测细菌。Srikanth 等[73]设计制作了一种结合丝网印刷电极的微流控腔室实现对细菌的电化学检测。使用该三电极系统,无需对电极进行任何生物修饰,可以在2 × 104到1.1 × 109CFU/mL浓度范围内准确定量细菌。
4.3 微流控芯片检测细菌耐药性
微流控芯片也可以用于实现细菌药物敏感性的分析检测。Xu 等[74]设计了一种含纸基底微腔阵列的微流控芯片培养细菌,利用多重显色法,成功实现多种细菌的耐药性检测。Lee等[75]设计了一个包含细菌分配、培养基运输和抗生素稀释的多功能微流控芯片,通过使用最低浓度的抗生素抑制显色反应来实现细菌药物敏感性测试。Ma 等[76]设计制作了一种基于聚合物的微流控设备实现食源性病原菌弯曲杆菌属(Campylobacter)的鉴定和药物敏感性分析。该芯片包含一列的细菌培养腔室,可以用来装载显色培养基及抗生素。利用显色反应观察Campylobacter的生长情况,从而判断其药物敏感性。Ma 等[77]进一步展示了一种物联网,包括基于比色学的微流体传感器、定制的便携式培养箱和机器学习算法,以实时监测耐药性趋势。在比色传感器上使用卷积神经网络ResNet50进行图像分类,对细菌生长/抑制模式进行分类的准确率达到99.5%。
除了根据上述显色反应实现耐药性检测,还可以通过观察微流控芯片内细菌的生长状况完成细菌药物敏感性分析。Choi 等[78]设计了一个类似于96 孔板的微流控芯片,通过观察在抗生素存在下单个细菌的形态以及生长状况,实现了对细菌耐药性的快速检测。该方法检测了包含ESBL-E.coli在内的4 株临床和标准菌株,以及189 个临床样品,检测时间在4 h 以内,与“黄金标准”微量稀释法比较,结果一致率高达91.5%。Song等[79]设计了一个具有16 个独立通道的微流控芯片,可以同时实现细菌对16种药物的敏感性检测。利用显微镜跟踪拍摄细菌,并通过Matlab 中的自定义代码快速报告细菌生长曲线,从而判断细菌的耐药性。该方法检测时间为30 min 至2 h,显著短于基于浊度分析的传统方法。
微流控芯片技术还能在单细菌水平上实现耐药性的分析检测。Kandavalli 等[80]介绍了一种基于微流控芯片的在单细胞水平完成表型药物敏感性测试的方法。首先利用微流控芯片从复杂的样品中捕获单个细菌,并且用光学监测抗生素存在与不存在下的细菌生长状态。然后,利用荧光原位杂交(fluorescencein situhybridization,FISH)和靶向16s/23 rRNA 序列的菌种特异性的ssDNA 探针鉴定菌种。一旦获得芯片内每种细菌的菌种和药敏性测试响应,就可以基于菌种对药敏性测试响应进行分层,最终可以在2 h 内确定混合样本中每个菌种的药敏信息。
5 微流控芯片与质谱联用研究耐药菌
微流控芯片与质谱联用可以极大地提高质谱方法的整体分析性能,并拓展其潜在的应用前景[81]。微流控芯片通过各种接口与质谱仪联用,如基于芯片的ESI[82],或将微芯片产生的液滴收集在MALDI靶板上[83]。Dai等[84]设计搭建了一种液滴微流控装置,与MALDI-TOF质谱联用,用于检测单细菌的耐药性。ESBL-E.coli被捕获在含有氨苄西林环境的等离子体胶体内,在微区室中的快速反应下,抗生素可以快速被耐药菌水解,在40 min 内便可由MALDI-TOF 质谱检测到水解信号。同时,该方法也能说明细菌的耐药异质性,该菌株中20%的单个细菌具有极强的水解氨苄西林的能力。Zhang 等[85]设计了具有过滤功能的三明治结构微流控芯片,发展了其与ESI 质谱相结合的方法,实现了在线快速检测产ESBL 细菌。细菌首先被负载在三明治结构的微流控芯片内,然后通入抗生素药物与细菌进行反应。通过检测抗生素及其相应水解产物的质谱信号,可以在30 min 内完成细菌药物敏感性分析。使用两株ESBL-E.coli菌株和两株不产ESBL的E.coli菌株作为模型验证该方法的可行性。在两种β-内酰胺类抗生素氨苄西林和头孢曲松的作用下,ESBL-E.coli菌株同不产ESBL 的E.coli菌株得到区分。Zhang 等[86]还发展了使用微流控技术和MALDI-TOF质谱来研究耐药菌在抗生素刺激下产生形变时的蛋白表达变化的方法。使用“圣诞树”型的微流控芯片产生梯度浓度的抗生素,来研究在不同浓度抗生素刺激下的细菌形态变化。蛋白表达差异研究集中于能够被MALDI-TOF 质谱检测到的较低分子量的蛋白。通过比较不同形态的细菌细胞的MALDI-TOF 质谱图,判定出形变状态下的差异峰,然后在UniProt数据库中进行检索并根据分子量进行鉴定。鉴定的结果由高分辨质谱和非标记定量蛋白质组学进一步验证。耐碳青霉烯K.pneumoniae、ESBL-E.coli、南美洲虾中的V.parahemolyticus和耐碳青霉烯P.aeruginosa作为实验菌株对该方法的可行性进行验证。使用LC-MS/MS 对MALDI-TOF 质谱的蛋白鉴定结果进行验证,得到8 个与耐碳青霉烯K.pneumoniae形态变化过程紧密相关的蛋白质。在这8 个蛋白中,菌毛亚基3 型(fimbrial subunit type 3)、青霉素结合蛋白激活剂LpoB(penicillin-binding protein activator LpoB)和30S 核糖体蛋白S14(30S ribosomal protein S14)在转录水平上得到进一步验证。Zhang 等[87]进一步设计、构建了微流控电喷雾质谱平台,对抗生素刺激下耐药菌胞内代谢物进行实时表征。结合蛋白质组学技术,综合分析耐药菌的耐药机制,并开发了一种细菌耐药相关酶化学抑制剂联合抗生素的协同抑菌新方法。
6 总结与展望
细菌耐药性是在全球范围内危害人类生命健康的重大公共安全问题。一些“超级细菌”,如碳青霉烯耐药肠杆菌、碳青霉烯耐药不动杆菌等对大多数的抗生素都具有耐药性,极大地增加了临床治疗的难度。抗生素的过量使用和滥用不仅加速了细菌耐药性的产生和进化,同时也促进了耐药菌的传播。因此,发展快速、准确检测耐药菌的方法和开展耐药机制的研究尤为重要。一方面,快速的检测方法可以为后续治疗节省大量的时间;另一方面,准确的检测结果可以为后续治疗选择最合适的药物提供理论基础。抗生素新药研发的速度已经追赶不上细菌耐药性的进化速度,单纯依靠现有的抗生素很难满足细菌感染性疾病的治疗,因此需要发展新的抑菌杀菌方法来弥补这方面的不足。在分子水平上对细菌耐药性的机制进行研究,可以为新药的开发奠定基础。
各种各样的微流控芯片被设计用以从复杂样本中提取细菌,并与多种分析方法联用检测环境、食品和人体液中的病原微生物。用于临床检测病原菌的微流控芯片朝着及时、快速分析、自动化、高通量、高特异性、高准确度、无损害、便捷、低成本和方便的方向发展。微流控芯片用于临床的关键性要求是稳定、重现性好和能大量生产,这就要求发展新的微流控芯片制造技术和新型材料。微流控技术可以实现各类功能的整合,避免了很多繁琐的操作。质谱作为一种分析检测技术手段,广泛应用于细菌鉴定和耐药性机制的研究。MALDI-TOF 质谱已经进入到各大医院,广泛应用于微生物鉴定、核酸检测等方面,而且在细菌药敏试验方面也极具潜力。LC-MS/MS 是研究代谢组学和蛋白质组学的重要工具。完整全面的组学鉴定信息和定量信息无疑为机制的研究带来了源源不断的动力,而新型质谱仪器的开发则为这些研究提供了坚实的基础。
微流控质谱联用技术具有快速、简便获得微生物丰富的蛋白、代谢物信息的能力。一方面,该技术既保证了对微生物细胞的精准控制,使目标微生物能在芯片中富集、纯化,又可获得大量的生物分子信息。因此,该技术可以更加快速和高效地获取细菌菌种信息及药物敏感性信息。另外,微流控芯片为细菌提供了反应平台,如药物刺激、与宿主细胞相互作用、微生物间相互作用等,可用于模拟各种生理、病理微环境,研究细菌感染性疾病机制、宿主免疫、靶点挖掘、药物筛选等。而与质谱的在线联用确保了质谱技术能够实时检测到各种反应状态下的微生物代谢状态,获得更准确的微生物细胞生理状态信息,避免了繁琐预处理步骤中代谢状态变化的问题。然而,微流控芯片的微腔室体积较小,可容纳的微生物的含量可能不足以完成高度覆盖的代谢组学和蛋白质组学分析。这就需要高灵敏的质谱检测技术,以及在芯片上或者芯片后方增加样品分离步骤,提高覆盖度。微流控芯片与质谱的接口也需要进行设计优化,确保不同制作批次的相同芯片中的样品的离子化效率一致,以提高检测重现性和不同组别之间的可比较性。此外,盐类化合物进入质谱会极大降低分析灵敏度,这就需要在微流控芯片内或后端增加除盐的步骤。未来,微流控质谱技术可朝着原位化、集成化、自动化发展,在食品安全、临床、环境监测等各个领域的细菌分析中将会有巨大的潜力和广阔的前景。
