基于超高效液相色谱-四级杆/静电场轨道阱高分辨质谱非靶向筛查分析烤牛肉在不同温度下的差异标记物
2023-12-29李波孙世琨苏阿龙禹洁师希雄
李波,孙世琨,苏阿龙,禹洁,师希雄
1(甘肃农业大学 食品科学与工程学院,甘肃 兰州,730070)2(甘肃省食品检验研究院,甘肃 兰州,730000)
国际相关调查和移民研究表示,饮食与结直肠息肉密切相关。有研究表明息肉组患者食用红肉频次相对较高且经常吃红肉的人患结肠直肠癌的风险更高,还可能增加患乳腺癌、胃癌、胰腺癌、肺癌、食道癌和膀胱癌的风险[1-3]。但是,因为加工方式、添加的调料等复杂的饮食因素,并没有足够的证据直接证明食用未经加工的红肉和致癌之间存在显著关联,但可以明确的是,烹饪加工提高了肉类的消化率和适口性的同时,也会产生致癌物质,并且多存在于煎炸、烧烤或干制的高温烹饪方式过程中[4]。
牛肉及牦牛肉的加工制品,是甘肃省的特色肉品加工业,它们的肉质和滋味都得到了国内外消费者的一致认可,但如果加工过程不规范或者控制条件不严格,会导致产品可能会含有对人体产生危害的组分,比如极高的加工温度可导致致癌和致突变化合物的形成,包括已知的杂环胺、多环芳烃化合物、亚硝胺、脂质过氧化物和自由基[5-7]。TENG等[8]采用高效液相色谱并荧光检测器对猪肉烹饪过程中的杂环胺进行检测,钟华珍[9]采用高效液相色谱并紫外检测器对3种畜禽肉中的多环芳烃进行了测定,YAN等[10]采用超高效液相色谱-四级杆/静电场轨道阱高分辨质谱(ultra performance liquid chromatography-quadrupole-exactive-mass-spectrometry,UPLC-Q-Exactive-MS)研究了不同温度下烤猪肉的代谢物差异以选择指示肉类加热终点温度的标记物。其中UPLC-Q-Exactive-MS利用数据库检索方便,不需要使用标准物质定性就可采集全面的目标物信息,因此在食品非靶向筛查中应用十分广泛[11]。然而,非靶向筛选技术的瓶颈是会产生大量过于复杂和难以管理的数据集,无法进行人工分析,因此需要化学计量学的帮助。赵萍等[12]采用液相色谱-质谱联用非靶向代谢组学方法对冷藏大鲵肉进行研究,并利用偏最小二乘法判别分析(partial least squares-discriminant analysis, PLS-DA)模型筛选共得到125种差异代谢物,获得了7种潜在的生物标志物。孙斌等[13]利用GC-MS研究了延边黄牛臀肉与眼肉组织的代谢物,并用主成分分析(principal components analysis, PCA)、正交偏最小二乘法判别分析(orthogonal partial least squares-discriminant analysis, OPLS-DA)等统计方式对数据进行分析,揭示出油酸等差异代谢物作为风味化合物的前体物质。结合先进的仪器,化学计量学能够增强研究者对复杂系统的理解,并可以从海量数据中提取有价值的信息。该方法已用于区域分析、类型分类和食品鉴定中[14-15]。
目前,UPLC-Q-Exactive-MS非靶向代谢组学技术多数应用在医药学研究中。在食品领域,其主要应用于食品中的非法添加、外源性添加剂筛查、农兽药残留及内源性代谢产物的变化[16-20],鲜少有研究追踪食品在加工过程中产生的风险代谢组分。本研究以甘肃省甘南地区牛肉为研究对象,采用UPLC-Q-Exactive-MS技术,结合PCA、PLS-DA、OPLS-DA及层次聚类分析(hierarchical clustering analysis, HCA)等多元统计方法,挖掘了在不同高温条件下烤制牛肉的化学差异,筛查其风险与标志组分的内在关联规律,转变被动过程追溯为主动识别,能够快速精准地识别潜在风险以期为烤牛肉制品加工生产企业的生产条件进行一定意义上的指导。
1 材料与方法
1.1 试剂
乙腈、己烷、乙酸乙酯、乙酸铵,色谱纯;氢氧化钠、盐酸,分析纯。
1.2 仪器与设备
T25 d匀浆机、Vorex 3涡旋混合器,艾卡公司;SiO-6512均质离心机,本立科技公司;P300H超声波清洗器,德国艾尔玛公司;UNIVERSAL320R高速离心机,德国海蒂诗公司;mv5氮吹仪,北京莱伯泰科公司;ME403T千分之一电子天平,梅特勒-托利多公司;Simplicity uv超纯水机,默克公司;含Compound Discoverer(CD)分析软件Q-Exactive-MS四极杆轨道阱质谱、Ultimate 3000高效液相色谱系统,赛默飞世尔科技公司;Kinetex C18(2.1 mm×100 mm, 1.7 μm粒径)色谱柱,美国Phenomenex公司;KWS2060LQ-D1N电烤箱,格兰仕公司。
1.3 实验方法
1.3.1 样本收集
从本地批发具有代表性的地理区域(甘南)的鲜瘦牛肉。进行市场调查,以避免与牛肉来源相关的潜在关键标记的差异。牛肉贮藏在-20 ℃条件下。
1.3.2 样本制备
同一来源的牛肉,使用电烤箱在130、160、200、220 ℃下烘烤牛肉片[4 cm×4 cm×3 mm,(5±0.1) g],双面各涂抹大豆油2 mL分别烘烤5 min,不添加盐和香料。烤好的牛肉在室温下冷却,然后切成小块后匀浆。分析前,将处理好的牛肉末置于-20 ℃保藏。
1.3.3 代谢物提取
样品代谢物的提取参考文献[10]并做修改。采用连续两步法从烤牛肉中提取尽可能多不同理化性质的化合物。将匀浆后的烤牛肉放入50 mL的Eppendorf试管中,加入5 mL 1 mol/L NaOH和7 mL乙酸乙酯,将上清液在室温下以6 000 r/min均质1 min,然后涡旋振荡2 min后置于超声波清洗器中提取30 min。随后,将提取液在4 ℃、9 000 r/min离心10 min,收集上清液。在剩余的组织中加入10 mL 1 mol/L HCl和5 mL己烷,然后按如上步骤所述进行同样的处理,并保留上清液。将两步的上清液合并在40 ℃的氮气流下蒸吹至近干,用1 mL乙腈溶解,在4 ℃下13 000 r/min离心10 min,上清液通过0.22 μm尼龙滤膜过滤,待测。
1.3.4 空白和质量控制(quality control,QC)样品
混合所有样品的等量上清液制备QC样品。根据质控样品的重叠总离子流图(total ion flow diagram,TIC)评估数据的重复性和仪器的稳定性;用空白样品的TIC图测定仪器和色谱柱的清洁度。
1.3.5 色谱参数
使用Kinetex C18 (2.1 mm×100 mm, 1.7 μm粒径)色谱柱;色谱柱温度:40 ℃;进样量为5 μL;流动相:10 mmol/L的乙酸铵溶液(A)、乙腈(B);流动相流速:0.3 mL/min;梯度洗脱程序:0~1 min(0~30% B),1~9 min(30%~65% B),9~10 min(65%~95% B),10~17 min(95%~95% B),17~19 min(95%~30% B),19~20 min(30~30% B)。
1.3.6 高分辨质谱参数
1.3.6.1 离子源参数
离子源:加热电喷雾电离源;样品质谱信号采集分别采用正负离子扫描模式;全扫描采集范围:m/z100~1 000;分辨率:全扫描70 000FWHM、对窄范围母离子碎裂17 500 FWHM;电喷雾电压:+3.6 kV的HESI+和-3.6 kV的HESI-;加热器温度:320 ℃;毛细管温度:350 ℃;鞘气流速:40;辅助气流速:10;离子传输透镜电压:55 V。
1.3.6.2 扫描参数
自动增益控制目标离子数:1e6,最大注入时间:100 ms。归一化碰撞能量:40、50、60的阶梯式碰撞能量。为了提高精密度和准确度,在分析前分别用正负标定溶液对仪器进行校准。
1.4 数据分析
原始数据使用Compound Discoverer软件(3.3.1)进行峰检测、保留时间对齐等预处理。在Excel 2010中将数据整理为二维矩阵形式,保留了包含m/z值、保留时间、分子式、峰面积等信息,导入SIMCA 14.1软件(Umetrics, Sweden)进行统计分析。采用PCA初步观察样品根据烤制温度不同各组分间存在差异的情况。采用PLS-DA进一步进行分类并评价模型有效率,进行置换检验。在Compound Discoverer软件中进行热图聚类分析并根据P值和单变量分析差异倍数FC值(fold-change)过滤掉统计上不显著的特征。将化合物的峰面积定义为变量,序号作为观测ID,采用OPLS-DA对130 ℃和220 ℃下处理过的牛肉样品进行分析,根据变量投影重要度(variable importance in projection, VIP)(VIP>1),将实验图谱、化学式等与mzCloud、ChemSpider等线上数据库比对寻找样品潜在的特征化合物。
采用Excel 2010和Origin(8 Pro)进行数据统计和绘图。
2 结果与分析
2.1 QC和空白
基于正离子模式和负离子模式得到TIC图,结果如图1-a、图1-b所示。图中不同的颜色表示5个质控样品重叠的总离子流图。横坐标表示保留时间,重叠峰表明代谢产物的提取和检测具有良好的重复性和检测系统的高稳定性[21]。分析空白样品的正负离子TIC图,如图1-c、图1-d所示,没有检测到明显的峰,说明样品中没有残留物质或交叉污染。
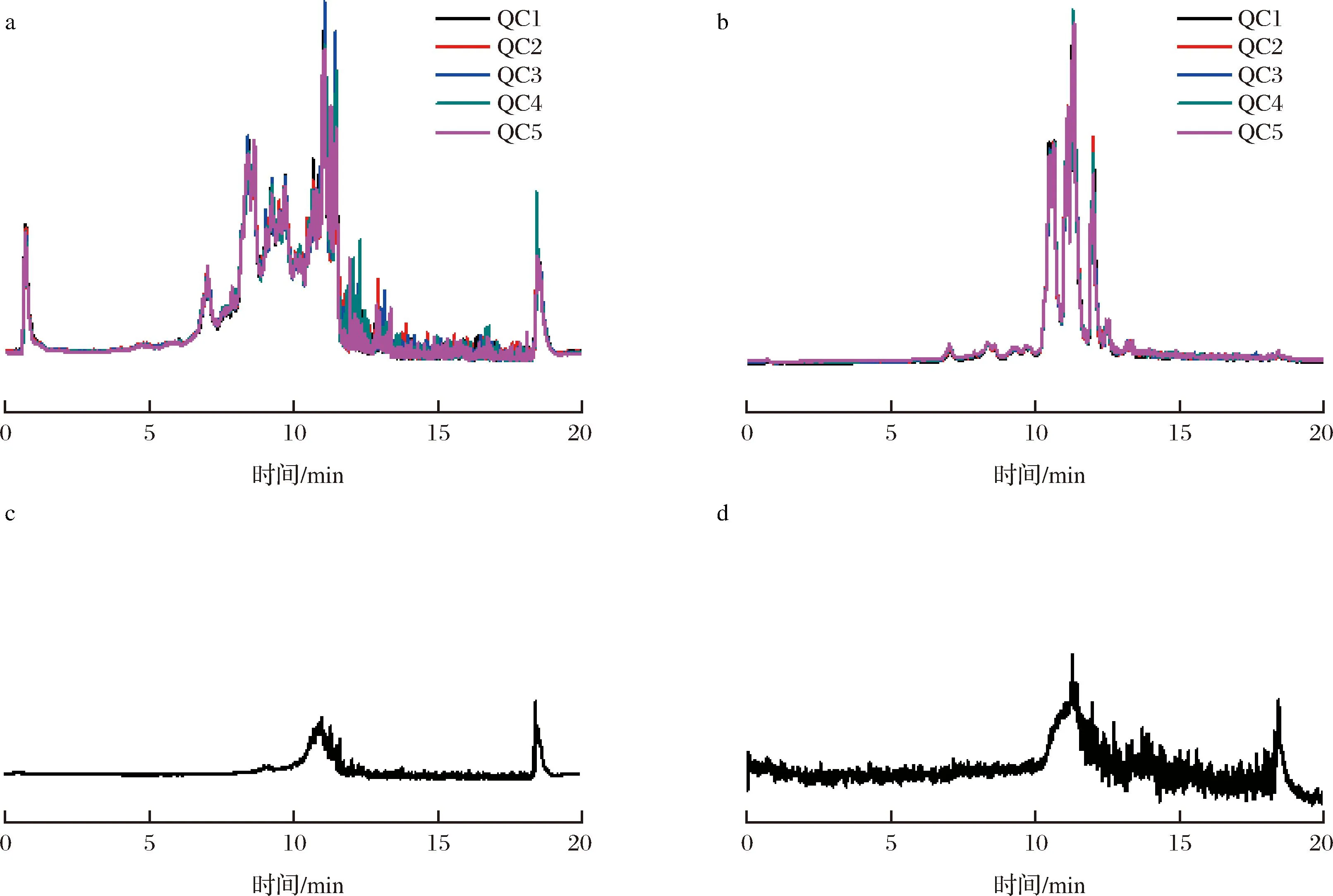
a-5个质控样品正离子模式TIC图;b-5个质控样品负离子模式TIC图;c-空白样品正离子模式TIC图;d-空白样品负离子模式TIC图图1 总离子流图Fig.1 Total ion flow diagram
2.2 基于温度变化的牛肉代谢产物分析
2.2.1 PCA和聚类热图分析
本研究使用Compound Discoverer软件从Q-Exactive-MS正离子模式和负离子模式的总离子色谱图中共提取了7 068个化合物。
利用代谢组学方法对牛肉在高温过程中的分子代谢物进行表征,可以更好地控制、评价和理解肉类的品质。本研究的目的是利用UPLC-Q-Exactive-MS非靶向代谢组学方法分析不同的高温加工温度对牛肉代谢的影响。如图2所示,不同烤制温度的样品具有明显的层次聚类。采用PCA方法对不同温度下烘烤的牛肉样品进行分析,由图3-a和图3-b可见,生成的PCA得分图显示出明显的分离。
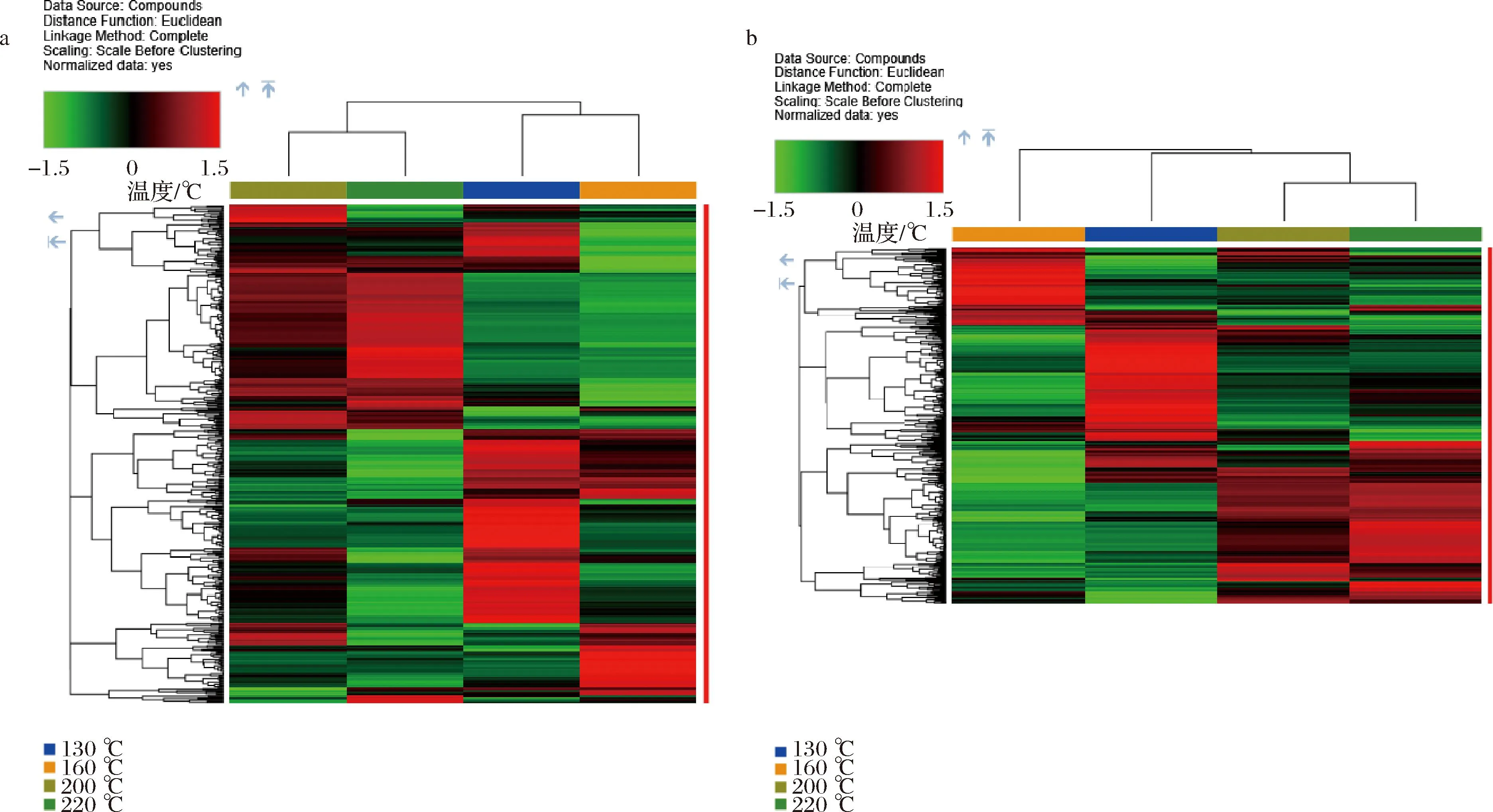
a-正离子模式聚类热图;b-负离子模式聚类热图图2 不同温度牛肉样品间显著性差异离子层次聚类分析Fig.2 Hierarchical clustering significant differentially metabolites among different varieties of samples of beef
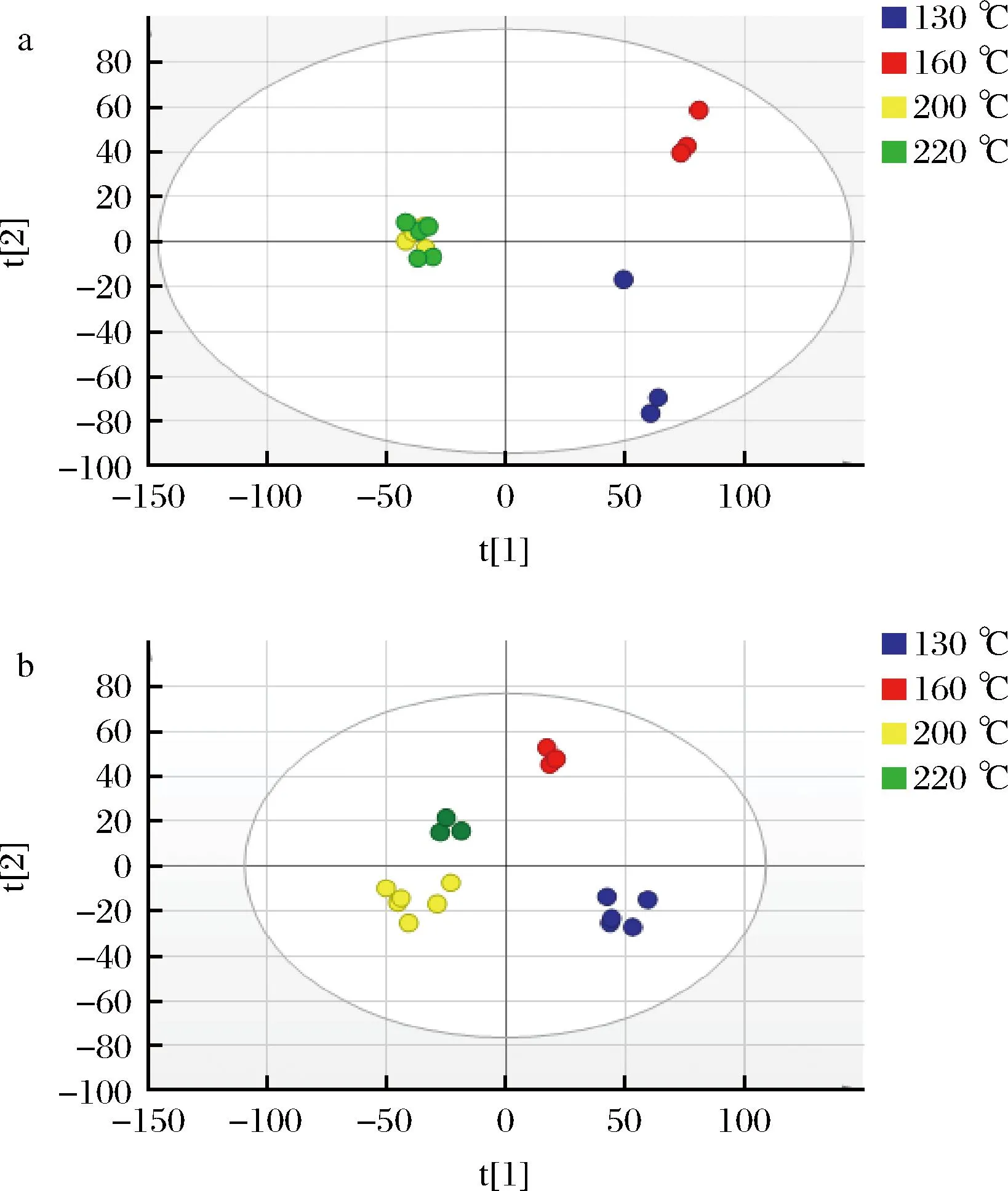
a-正离子模式PCA得分图;b-负离子模式PCA得分图图3 PCA得分散点图Fig.3 Scatter plot of PCA
2.2.2 PLS-DA
使用SIMCA软件进行PLS-DA,可以处理PCA无法忽略的组内误差和随机误差[22],并对该模型参数R2和Q2进行200次置换检验,判别模型是否发生过度拟合。如图4所示,各组是明显分开的,说明各组的代谢物具有显著性差异。同时,本次分析中正离子模式下自变量拟合指数(R2X)为0.699,因变量拟合指数(R2Y)为0.967,模型预测指数(Q2)为0.525,负离子模式下自变量拟合指数(R2X)为0.56,因变量拟合指数(R2Y)为0.998,模型预测指数(Q2)为0.807,表明当前PLS-DA模型稳定可靠,具有良好的预测性。经过200次置换检验,Q2点的蓝色回归线与纵轴相交于负坐标轴,所有左侧的蓝色Q2值都低于右侧的原始点,说明模型不存在过拟合,模型验证有效,认为该结果可用于牛肉样品的温度差异分析。
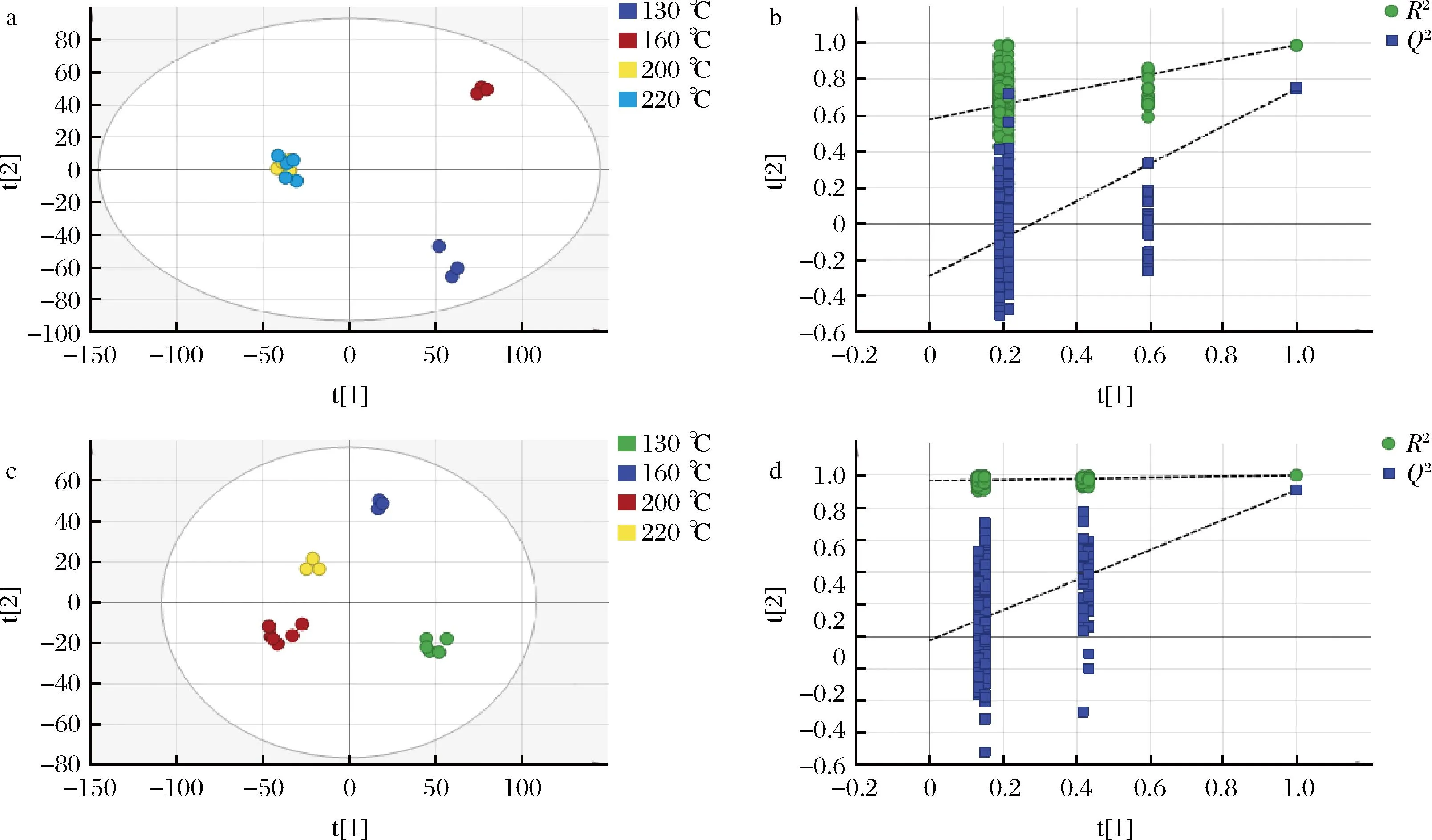
a-正离子模式PLS-DA得分散点图;b-正离子模式200个排列模型验证;c-负离子模式PLS-DA得分散点图;d-负离子模式200个排列模型验证图4 PLS-DA得分散点图和200个排列模型验证Fig.4 Scatter plot of PLS-DA and 200 permutation test model validation plot
2.3 潜在的标志物
2.3.1 OPLS-DA
由于共检测到7 068个化合物,因此有必要降低数据维数。首先应注意在高温烤制过程中,代谢产物含量的增加或减少是否具有统计学意义。利用方差分析(analysis of variance,ANOVA)的P值和FC值对从原始数据中提取的化合物在Compound Discoverer软件中进行过滤。以log2(FC)>1或<-1;P值<0.05筛选化合物构建OPLS-DA模型以便快速定位潜在标记物,共筛选出正离子模式下差异上调化合物16个,差异下调化合物2 669个;负离子模式下差异上调化合物4个,差异下调化合物22个。OPLS-DA是建立在通过验证的PLS模型的基础上寻找差异化学物质的有监督的分析方法[23]。如图5所示,正负离子模式下130 ℃和220 ℃处理的烤牛肉代谢产物显著分开。在本研究中,正离子模式下OPLS-DA模型数值为R2X为0.905,R2Y为1,Q2为0.999,负离子模式下,R2X为0.899,R2Y为1,Q2为0.99,R2Y和Q2的高值表明模型解释Y的高变化和OPLS-DA模型的预测优势。
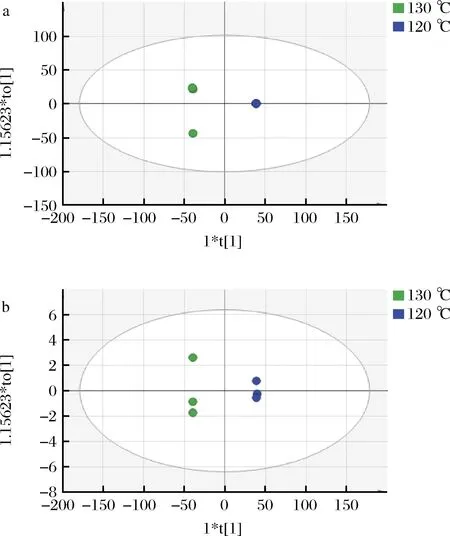
a-正离子模式OPLS-DA得分图;b-负离子模式OPLS-DA得分图图5 OPLS-DA得分散点图Fig.5 Scatter plot of OPLS-DA
2.3.2 差异化合物的鉴定
利用OPLS-DA模型生成的VIP值来选择差异性表达代谢物。在本研究中,VIP>1的化合物被定义为潜在候选差异标记物,在正离子模式下共筛选出1 447个化合物,负离子模式下筛选出14个化合物。然而,这些化合物是由Compound Discoverer软件自动从原始文件中提取的,需要进一步的人工检查,去除同位素、等价物、重复物并且需要一个可接受的峰形以确保这些化合物的真实性。更重要的是检查这些化合物是否是在130~220 ℃的牛肉加工过程中影响牛肉品质的重要因素,最后在正离子模式下筛选出4个潜在标记物,用Compound Discoverer软件对这4种物质进行了化学方程式假设。化学结构的预测基于同位素模式和ChemSpider数据库,在m/zCloud数据库的帮助下,对理论碎片和检测到的碎片进行了比较。经过这个过程后,化合物被确定。上述4个选定标志物的参数如表1所示。
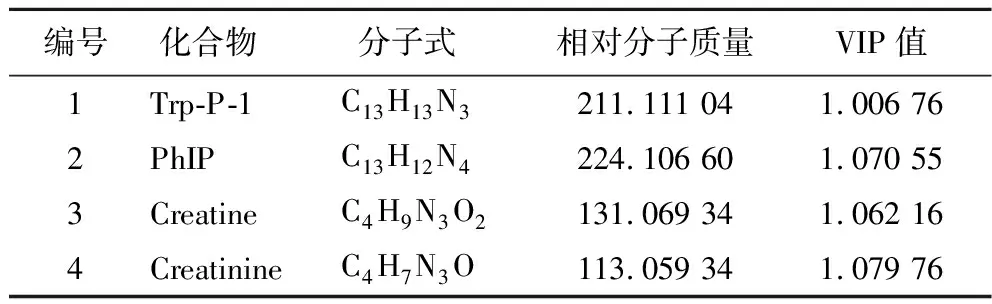
表1 四个选定差异标记物的化合物信息Table 1 Components identified with significant differences from the four selected markers
2.3.3 差异化合物的相对含量分析
查阅文献可知,在高温热加工过程中,杂环胺的形成与肌酸、肌酐等前体物质密不可分[24]。3-氨基-1,4-二甲基-5H-吡啶[4,3-b]吲哚(3-amino-1,4-dimethyl-5H-pyrido[4,3-b]indol, Trp-P-1)是γ-咔啉类热裂解杂环胺,为2B级潜在致癌物,可通过180 ℃的加热条件下在含氨基酸、肌酸、还原糖的混合体系下生成[25-26];2-氨基-1-甲基-6-苯基咪唑[4,5-b]吡啶(2-amino-1-methyl-phenylimidazo[4,3-b]pyridine, PhIP)为热生成型杂环胺,由前体物葡萄糖、氨基酸、肌酸等物质在热反应环境中最终反应生成[27-28]。因此有必要探究烤牛肉中肌酸和肌酐在不同烤制温度下的相对含量变化规律,以进一步了解前体物质与杂环胺生成的关系。肌酸是一种非蛋白质性氨基酸,存在于脊椎动物体内为机体提供能量,肌酸酐是在热处理过程中形成的,它是一种生理惰性的肌酸酐环化产物[29]。图6结果表明,在牛肉烤制过程中,随着加热温度升高,杂环胺的含量越来越高,转化为肌酐的肌酸越多,且极性杂环胺相对含量高于非极性杂环胺。此外,氨基酸的相对含量变化并不显著,差异化合物鉴定研究中未筛查到,原因可能与脂肪流失、水解有关[30]。在Compound Discoverer软件中共人工筛查到赖氨酸、缬氨酸、脯氨酸、亮氨酸、苯丙氨酸、甲硫氨酸、组氨酸、异亮氨酸、色氨酸等9种氨基酸,本研究不进行进一步分析。
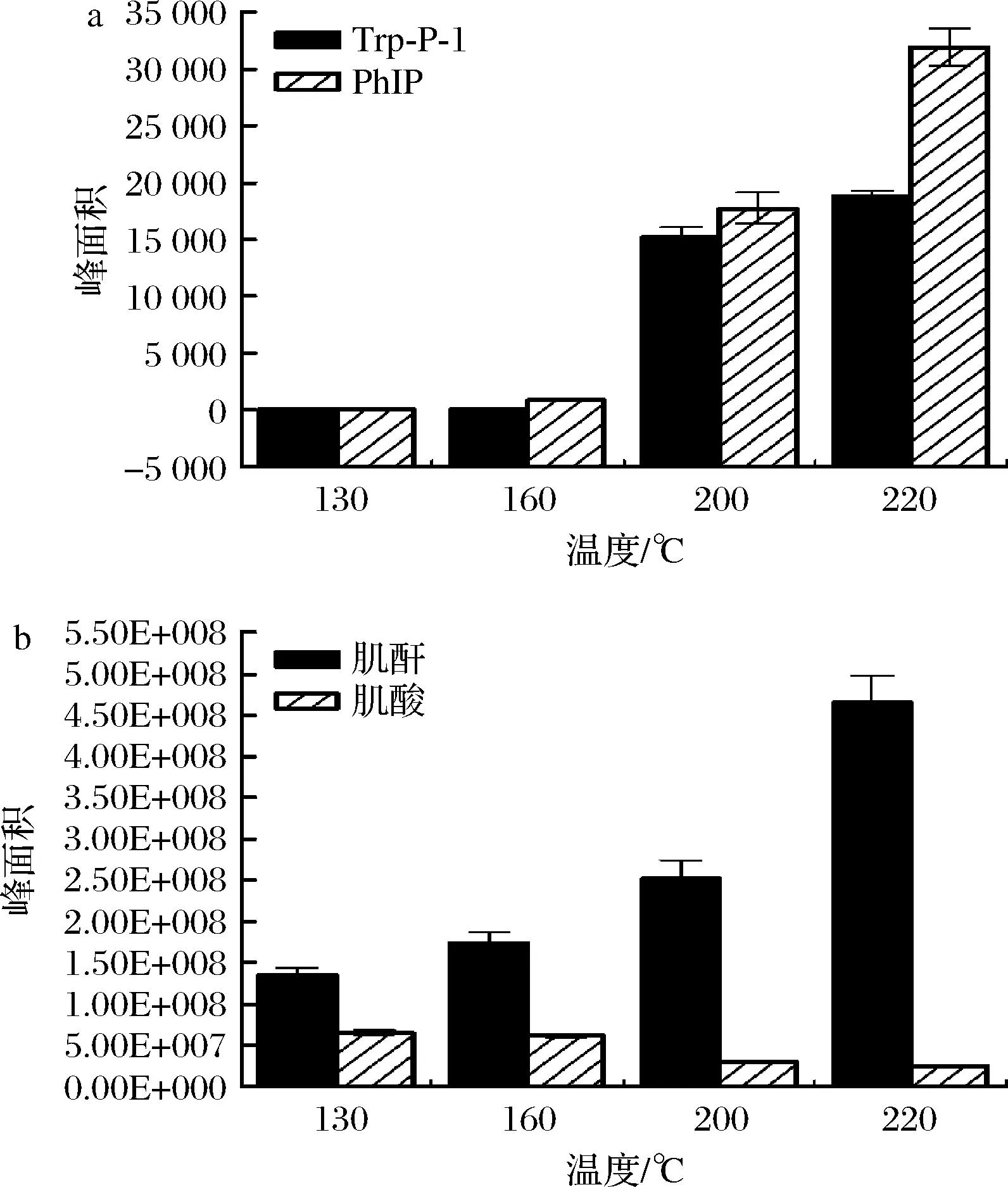
a-Trp-P-1和PhIP的含量变化趋势; b-肌酐和肌酸的含量变化趋势图6 130~220 ℃下牛肉选定标记物的含量变化趋势Fig.6 Trend of selected marker abundance in beef treated with temperature from 130 ℃ to 220 ℃
3 结论与讨论
本实验采用了基于UPLC-Q-Exactive-MS的非靶向代谢组学方法结合化学计量学优秀的分析能力,为牛肉热加工过程中标记物的选择和探索产生的有毒物质变化规律提供了有效的方法。实验结果表明,不同温度热加工下的牛肉样品中化学成分存在明显差异。PCA可以在得分图中显示不同的分离组,所建PLS-DA模型具有良好的预测能力。用P值和FC值来筛选具有统计学差异的化合物,根据OPLS-DA模型,结合Compound Discoverer等分析软件、线上数据库和相关文献来选择对分类有显著贡献的特征化合物,结果在正、负离子模式下分别找到1 447个和14个差异化学成分,最终筛选出了4个特征标记。热裂解杂环胺通常在高于300 ℃的加工条件下热解产生,而其中的Trp-P-1却可在180 ℃的加热条件下生成,本研究验证了这一点。由于本研究样本数量较多,显然需要进一步的实证工作来验证此标记的有效性,但是研究强调了方法提供标记的潜力,可用于有针对性的分析以确证有害物质含量的变化规律。
高分辨质谱与化学计量学相结合可以用来研究在食品加工、贮存和运输过程中复杂体系的样品分析和差异代谢物的鉴定。本研究的方法在很大程度上依赖于在线数据库,并且高分辨质谱价格昂贵也是阻碍该方法广泛应用的重要原因。
