ZBD-2改善创伤后应激障碍模型小鼠恐惧焦虑和抑郁样行为的作用
2023-12-29李旭波靳雨晨王欣赏姜永莉颜雨暄宋大可刘水冰
李旭波,靳雨晨,王欣赏,姜永莉,颜雨暄,宋大可,刘水冰
空军军医大学药学系药理学教研室,陕西 西安 710032)
创伤后应激障碍(posttraumatic stress disorder,PTSD)是患者在亲身经历或目击重大创伤性事件后如战争、地震等延迟出现的一种精神心理障碍[1-3]。肩负着依法维护国土和国家安全的军队作战人员,长期暴露于高强度的心理生理应激条件下,PTSD亦成为他们最常见的精神疾病[4]。
PTSD主要临床症状包括:重复性出现以往的创伤性体验、持续性地逃避引起创伤性事件的相关刺激、保持高度易激惹警觉状态,与创伤性事件相关的认知和情绪方面的负性改变,创伤性记忆增强的同时伴有正常学习记忆功能的下降[5]。PTSD的发病机制尚未阐明,缺乏有效治疗药物,目前临床上采用选择性血清素再摄取抑制剂舍曲林和帕罗西汀治疗PTSD[6]。然而,其起效缓慢,长期服用会出现认知功能障碍、性功能障碍、睡眠障碍、依赖和戒断综合征等不良反应,限制了它们在临床上的广泛应用[6-7]。因此,寻找抗PTSD的潜在药物靶点并开发新药具有重要的研究意义。
转位蛋白18 kDa(translocator protein 18 kDa,TSPO)是一种主要表达于类固醇合成组织线粒体外膜的蛋白,广泛分布于中枢神经系统和外周组织,参与介导胆固醇进入线粒体内,是脑内合成神经类固醇并发挥神经保护作用的关键蛋白[8]。已有研究报道,TSPO与许多神经精神疾病、神经退行性疾病和多种应激相关障碍的发病机制和进展有关,包括阿尔茨海默病、肌萎缩侧索硬化症、帕金森病、多发性硬化症、重度抑郁障碍、强迫症、PTSD和焦虑症等[9-10]。TSPO配体XBD173在动物模型和临床治疗上具有抗焦虑、抗抑郁作用[10],没有肌松、镇静、戒断、耐受、损伤认知等苯二氮样副反应。其作用机制是TSPO与配体结合可促进胆固醇跨膜并转运进入磷脂膜,增加孕烯醇酮及下游神经类固醇的合成[10-11]。ZBD-2是本实验室自主研发合成的2-芳基咪唑并[1,2-α]吡啶-3-乙酰胺衍生物(图1),是一种新型TSPO配体(中国专利号:201210047188.6)。我们的前期研究发现ZBD-2对NMDA引起的神经元兴奋性毒性损伤具有保护作用,具有改善脑缺血再灌注的作用[12],可以显著缓解神经病理性疼痛引起的动物焦虑样行为[13],改善PPD小鼠抑郁样行为[14]。但是,ZBD-2是否能够改善PTSD的症状尚不清楚。

图1 ZBD-2化学结构式
前期研究中,条件性恐惧(conditioned fear,CF)和单一的长期压力被广泛用于建立PTSD的动物模型研究[15]。为了最大限度模拟PTSD患者的病理生理学改变,本研究采用CF联合单一连续应激(single-prolonged stress,SPS)的双重应激(CF+SPS)建立小鼠PTSD模型[16],诱导小鼠情绪障碍和过度恐惧反应,旨在探讨自主研发的新型TSPO配体ZBD-2对小鼠PTSD行为的影响,为发现抗PTSD潜在新靶标和新药物提供前期研究基础。
1 材料与方法
1.1 材料
48只成年(6~7周龄)C57BL/6健康雄性小鼠,体质量(20.0±2.0)g,由空军军医大学实验动物中心提供。实验前在实验室进行1周适应性饲养,室温22~25 ℃,湿度55%~60%,12 h∶12 h光照黑暗循环饲养,并给予足量的水与食物。所有动物实验均经空军军医大学实验动物福利与伦理委员会批准(许可证号:IACUC-20230064)。
1.2 方法
1.2.1 实验分组 将48只小鼠随机分为正常对照(Control)组、PTSD模型(Model)组、PTSD模型+ZBD-2组[ZBD-2低剂量(Model+L-ZBD)组、ZBD-2中剂量(Model+M-ZBD)组、ZBD-2高剂量(Model+H-ZBD)组]、PTSD模型+帕罗西汀阳性对照(Model+Paro)组,每组8只。
1.2.2 PTSD模型的建立 在制备模型前,连续1周每日抚摸小鼠2次以减少应激反应。采用CF+SPS双重应激方法建立小鼠PTSD模型[16]。实验前1 d,将小鼠放置在行为学室适应环境。恐惧记忆箱放置在配备有照明灯、小风扇、声音发生器以及与声音发生器相联的扩音器和摄像头的隔音箱中,风扇用于通风和产生背景噪音,这对于以声音作为条件刺激尤其重要。小鼠所有运动轨迹由视频跟踪和自动分析系统记录(DigBehv-LR4,吉良软件科技有限公司,中国上海)。CF实验开始,将小鼠放进恐惧记忆箱(30 cm×30 cm×60 cm)中自由探索180 s,然后给予蜂鸣(15 s,1 kHz,75 dB),蜂鸣的最后5 s同时给予足部电击(电流强度2 mA)。间隔60 s后再开始第二轮蜂鸣和电击。小鼠在被电击时发生惊叫、惊跳、逃避等,听到声音提示时出现慌张、逃避或者僵立行为(除呼吸外无其他运动行为)。重复5个循环,持续5 d,每日在同一个时间段进行上述操作。第6日进行单一连续应激实验:先将小鼠束缚固定2 h(8∶00~10∶00),接着立即将小鼠放入装满20~24 ℃水的玻璃圆柱形水箱(直径24 cm,高度50 cm)强迫游泳20 min,待小鼠恢复15 min后,用乙醚麻醉至意识模糊(夹脚趾和夹尾巴没有反应),每只小鼠麻醉2次,结束后将小鼠放回笼中(图2)。
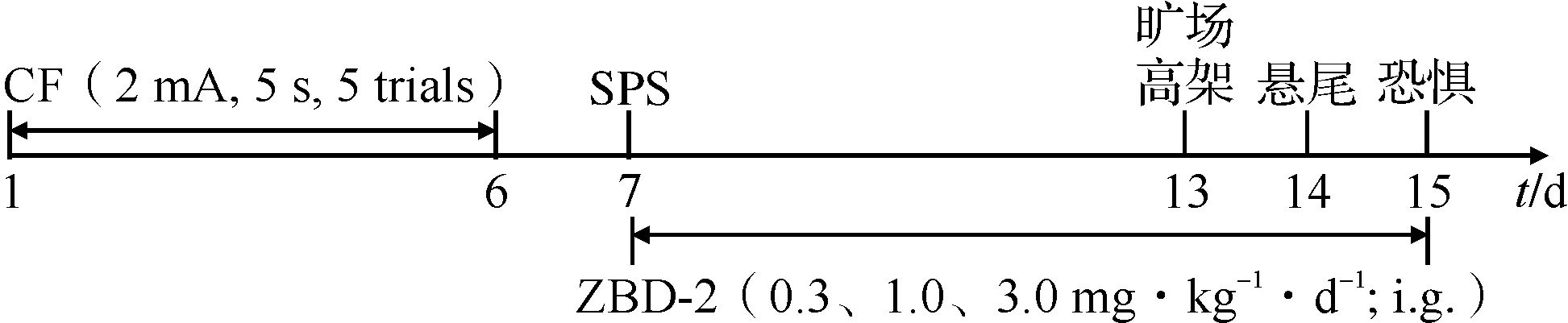
CF:条件性恐惧;SPS:单一连续应激。图2 实验方案时间轴
1.2.3 药物干预 PTSD模型+ZBD-2(低、中、高剂量)组小鼠分别给予ZBD-2灌胃(0.3、1.0、3.0 mg/kg)。Model+Paro组小鼠给予帕罗西汀灌胃(10 mg/kg)[17],Control组和Model组小鼠灌胃注射生理盐水,各组连续给药7 d。
1.2.4 旷场实验 旷场实验是检测动物焦虑水平的经典行为学方法,用来评价动物的警觉反应、焦虑状态和环境适应能力[18]。参照前期研究[19],实验装置为单独配有弱光和换气系统的隔音箱,内装有玻璃树脂做成的30 cm×30 cm×30 cm的盒子。盒子底面被分割为16个等大的方格。实验第13日,灌胃给药后2 h开始实验,将小鼠头朝开场箱的某个固定角落放入,自由活动15 min,应用JLCY-3小鼠自发活动视频跟踪分析系统记录实验小鼠15 min内的自发活动。记录各组小鼠之间的中央区域运动时间、中央区域运动路程与运动总路程,中央区域是盒子底面积中心9个方格区域。中央区域运动时间百分比=中央区域运动时间/自由活动总时间,中央区域运动路程百分比=中央区域运动路程/总活动路程。表现焦虑样行为的小鼠喜欢靠近墙壁并更多地在四周活动,焦虑程度较低的老鼠在盒子的中央开放区域会活动更多的时间[18]。每只小鼠完成实验后均用乙醇棉球擦拭敞箱,以除去前一只小鼠余留的气味,避免影响下次测试结果。
1.2.5 高架十字迷宫实验 旷场实验结束后4 h,进行高架十字迷宫实验,用来检测动物焦虑和恐惧水平。装置包括两个25 cm×8 cm×0.5 cm相对开臂和两个25 cm×8 cm×12 cm相对闭臂,距离地面50 cm高,迷宫中央交叉区域8 cm×8 cm,上方安装录像监控器,以录制动物在迷宫中的活动情况。实验开始,将小鼠头朝开臂放入迷宫中央区,摄像监控记录5 min内实验小鼠进入开臂和闭臂的次数和时间。开臂进入次数百分比=开臂进入次数/(开臂进入次数+闭臂进入次数),开臂进入时间百分比=开臂进入时间/(开臂进入时间+闭臂进入时间)。记录结束后将小鼠放回饲养笼,用乙醇擦拭迷宫,消除气味对后继实验小鼠的影响。
1.2.6 悬尾实验 悬尾实验利用小鼠悬尾后企图逃脱但又无法逃脱,从而放弃挣扎,进入特有不动状态来评价小鼠的抑郁行为。实验第14日,将实验小鼠尾部远端1.5 cm处固定悬挂于40 cm×40 cm的白色树脂玻璃盒内,小鼠头部距地面15 cm。摄像记录6 min,统计后5 min小鼠不动时间总和。
1.2.7 僵住时间测定 实验第15日进行情境和线索CF测试[20]。在情境条件性恐惧测试中,将小鼠置于相同的恐惧记忆箱(30 cm×30 cm×60 cm)中不给予蜂鸣和电击自发活动5 min,记录小鼠的僵住时间。僵住行为是小鼠表达恐惧的方式,行为学表现为除呼吸运动外全身其余的肌肉运动均消失。小鼠的僵住时间百分比=僵住时间/总时间。每只小鼠实验间隔需用乙醇擦拭箱体以消除气味的影响。4 h后进行线索CF测试。首先改变测试箱体,将导电格栅地板替换为网格薄板,黑白格图案贴到测试箱的内壁上,用10 mL/L的醋酸溶液来遮掩之前的清洁溶液,为线索CF测试提供新环境。让小鼠在这样一个新的测试箱内自发活动3 min,然后连续3次循环蜂鸣刺激(在每分钟的前15 s蜂鸣,180 s,2 kHz,75 dB),没有电击刺激。记录3 min内小鼠的僵住时间,计算小鼠的僵住时间百分比,以反映小鼠的恐惧行为。
2 结果
2.1 ZBD-2能够改善PTSD模型小鼠焦虑样行为
采用旷场实验和高架十字迷宫实验检测小鼠焦虑样行为。与Control组相比,Model组小鼠旷场总路程缩短(P<0.05),反映遭受刺激后小鼠对新环境的好奇感减弱、探索兴趣下降;中央区域运动路程百分比和中央区域运动时间百分比显著降低(P<0.01,图3A~D),反映小鼠的焦虑状态和对旷场环境保持警觉。Model组小鼠相较与Control组小鼠,进入高架十字迷宫开臂滞留时间百分比、开臂进入次数百分比和总进臂次数显著减少(P<0.01,图3E~H),小鼠倾向进入闭臂内,停留在闭臂角落处,回避进入开臂(开臂代表危险),提示模型小鼠恐惧水平较高,有明显的焦虑样行为,与PTSD患者警觉性增高和易激惹症状相符。ZBD-2治疗后,小鼠旷场总路程无明显差异(P>0.05);Model+L-ZBD组小鼠的中央区域运动路程百分比和中央区域运动时间百分比明显升高(P<0.01,图3A~D)。同时,PTSD模型+ZBD-2各组小鼠进入高架十字迷宫开臂的滞留时间百分比、开臂进入次数百分比和总进臂次数与Model组相比均有增加,其中Model+L-ZBD组和Model+M-ZBD组具有显著性差异(P<0.05,P<0.01,图3E~H),表明灌胃给药7 d后ZBD-2能够有效改善PTSD模型小鼠的焦虑样行为。

A:旷场试验中小鼠的运动轨迹;B:运动总路程比较;C:各组小鼠在中央区域运动路程百分比;D:各组小鼠在中央区域运动时间百分比;E:高架十字迷宫实验中小鼠的运动轨迹;F:各组小鼠开臂滞留时间百分比;G:开臂进入次数百分比;H:总进臂次数。Control:正常对照;Model:PTSD模型;Model+L-ZBD:ZBD-2低剂量;Model+M-ZBD:ZBD-2中剂量;Model+H-ZBD:ZBD-2高剂量;Model+Paro:PTSD模型+帕罗西汀阳性对照。n=8,aP<0.05,bP<0.01。图3 旷场和高架十字迷宫实验评估小鼠焦虑样行为
2.2 ZBD-2能够减轻PTSD模型小鼠抑郁样行为
在悬尾实验中,Model组小鼠不动时间比Control组显著延长,反映小鼠出现明显的抑郁样行为。PTSD模型+ZBD-2的各组小鼠不动时间均比Model组减少,其中Model+M-ZBD和Model+H-ZBD组具有显著性差异(P<0.01),效果与Model+Paro组相似(图4)。结果表明ZBD-2能够有效减轻PTSD模型小鼠的抑郁样行为。

A:悬尾试验中小鼠的运动轨迹;B:各组小鼠不动时间百分比。Control:正常对照;Model:PTSD模型;Model+L-ZBD:ZBD-2低剂量;Model+M-ZBD:ZBD-2中剂量;Model+H-ZBD:ZBD-2高剂量;Model+Paro:PTSD模型+帕罗西汀阳性对照。n=8,aP<0.05,bP<0.01。图4 悬尾实验评估小鼠抑郁样行为
2.3 ZBD-2能够缓解PTSD模型小鼠恐惧样行为
重新回到情景和线索CF环境中,模型小鼠呈现PTSD的核心行为表型,即再次暴露于创伤环境时呈现以僵住时间延长为指征的恐惧行为。在情景CF和线索CF测试中,Model组小鼠与Control组小鼠相比,在试验箱中的僵住时间显著延长(P<0.01,图5A~C),提示PTSD模型小鼠恐惧水平增加。与Model组小鼠相比,PTSD模型+ZBD-2各组小鼠的僵住时间显著缩短,其中Model+H-ZBD组和Model+Paro组小鼠的僵住时间显著降低(P<0.05,P<0.01,图5B~C),提示ZBD-2能够缓解PTSD模型小鼠的恐惧样行为,其中以中剂量的ZBD-2治疗效果为最佳。

A:情景和线索CF实验中小鼠的运动轨迹;B:各组小鼠情景CF僵住时间百分比;C:各组小鼠线索CF僵住时间百分比。Control:正常对照;Model:PTSD模型;Model+L-ZBD:ZBD-2低剂量;Model+M-ZBD:ZBD-2中剂量;Model+H-ZBD:ZBD-2高剂量;Model+Paro:PTSD模型+帕罗西汀阳性对照;CF:条件性恐惧。n=8,aP<0.05,bP<0.01。图5 情景和线索CF实验评估小鼠恐惧样行为
3 讨论
50%以上的PTSD患者共病有抑郁症、酒精滥用或成瘾、焦虑性障碍等[21-22]。选择性5-羟色胺(5-hydroxytryptamine,5-HT)再摄取抑制剂是美国FDA批准的PTSD一线治疗药物。然而,有数据表明40%~60%的患者对此类药物没有反应[23]。因此,亟需新的药物用于PTST治疗。ZBD-2是一种新型的小分子TSPO配体,在多种动物模型中具有显著的抗焦虑和抑郁作用[13-14]。然而,ZBD-2是否对PTSD引起的恐惧焦虑和抑郁样行为有作用尚不清楚。在本研究中,我们从行为学上首次验证了ZBD-2改善PTSD模型小鼠恐惧焦虑和抑郁样行为。我们首先建立CF+SPS模型模拟PTSD患者的病理生理学改变,进而观察到ZBD-2治疗7 d就可以发挥快速起效的抗PTSD样作用,且有效用药剂量低于帕罗西汀。但其作用机制及副作用评价将是我们下一步的重点研发的方向,这将对自主产权的新药研发产生积极的借鉴意义。
我们在本次实验中仅选择了成年雄性小鼠,是为了避免雌性动情周期引起的情绪变化。有研究报道5-HT再摄取抑制剂舍曲林抗PTSD作用在TSPO敲除小鼠中被消除,提示TSPO可能介导了5-HT再摄取抑制剂发挥抗PTSD作用[24]。此外,5-HT再摄取抑制剂可显著升高PTSD模型大鼠脑内四氢孕酮含量,这类药物亦被称为选择性促脑类固醇生成剂,而激活TSPO同样可产生类似改变[24],提示TSPO激活与5-HT再摄取抑制剂抗PTSD作用机制可能具有密切关系。本实验室前期经评筛发现化合物ZBD-2与TSPO的高亲和力结合,基于前期的研究基础,提示TSPO介导了ZBD-2的抗PTSD作用,可能是抗PTSD的潜在治疗药物。
大量研究表明,海马体和杏仁核这两个区域都参与了PTSD的发生发展[25]。海马体调控了情境性恐惧,杏仁核调控了CF[26],本实验发现模型小鼠在情景和线索条件恐惧环境中都出现僵住时间延长现象。给予ZBD-2治疗后,在情景和线索CF中小鼠僵住时间均缩短,提示激活TSPO与海马体和杏仁核脑区均相关。前期文献报道,在海马齿状回激活TSPO具有抗焦虑和抑郁的作用[27];在海马齿状回过表达TSPO可以减轻PTSD模型小鼠的焦虑样反应[28];在杏仁核中检测TSPO与配体结合后可以减轻产后抑郁模型小鼠的抑郁样行为[14],这些报道与我们的研究结果一致,已有研究者提出海马体和杏仁核作为治疗PTSD的共同靶向[25],但是我们也不能完全排除其他脑区可能的作用。不同脑区TSPO扮演的作用有待我们进一步的深入研究。
本研究中,0.3 mg/kg的ZBD-2能有效地缓解PTSD模型小鼠的焦虑样行为,同时,1.0 mg/kg的ZBD-2能有效地缓解PTSD模型小鼠的抑郁样行为,效果与帕罗西汀效果接近,证实小鼠灌胃ZBD-2具有显著的抗抑郁、抗焦虑作用,但药效并非随剂量增大而增加,表明ZBD-2存在剂量效应曲线变化,一开始剂量低时,药物效应小;随着剂量的增加,药物效应也随之增加,到达最大效应;此时ZBD-2效应不再随剂量的增加而增强。本实验中低剂量ZBD-2具有抗焦虑作用,中剂量ZBD-2具有抗抑郁作用,提示抗焦虑和抑郁的有效治疗剂量会有差别,符合药物剂量效应关系。
综上所述,TSPO选择性配体ZBD-2能有效改善PTSD小鼠焦虑和抑郁样行为,发挥抗PTSD作用,提示ZBD-2有可能成为预防PTSD的潜在药物,但调节机制尚有待进一步深入研究,我们的研究为筛选抗PTSD候选新药提供了重要的实验依据。
