黄绿卷毛菇中原伊鲁烷型倍半萜芳基酯提取工艺优化及活性研究
2023-12-29张鑫朱青永徐慧敏吴梦园陈小娥陈启和刘政捷
张鑫,朱青永,徐慧敏,吴梦园,陈小娥,陈启和,刘政捷,*
(1.浙江海洋大学食品与药学学院,浙江 舟山 316022;2.浙江大学生物系统工程与食品科学学院,浙江 杭州 310058)
黄绿卷毛菇(Floccularia luteovirens)又称黄蘑菇、黄金菇、黄绿蜜环菌,属于担子菌门、伞菌纲、伞菌目、伞菌科、卷毛菇属,是一种珍贵的食药两用菌[1]。黄绿卷毛菇主要分布在西藏、青海等地的草原或者高山草甸上[2],在我国著名医学著作《四部医典》中就有明确记载,外敷或者内服黄绿卷毛菇可以治疗寒性和不发热的肿胀[3]。至今,祁连地区的牧民还有通过食用黄绿卷毛菇治疗感冒的习俗。有研究发现,黄绿卷毛菇干制子实体中含有大量粗蛋白、粗脂肪、脂肪酸和氨基酸等营养成分[4-6]。研究人员在黄绿卷毛菇子实体提取物中发现了多糖、甾醇、核黄素、凝集素等多种单体化合物,其表现出良好的抗氧化、抗炎、抗肿瘤等生理活性[7-9]。LIU 等[10]首次报道了黄绿卷毛菇的完整基因组序列,并对预测到的基因进行分析,发现了原伊鲁烷型倍半萜芳基酯生物合成基因簇。但是到目前为止,还鲜见关于黄绿卷毛菇子实体中此类化合物提取工艺优化及活性研究的报道。
按照碳骨架类型分类,原伊鲁烷型倍半萜芳基酯属于三环倍半萜,这类化合物主要从高等真菌中分离得到,也有少部分来源于海洋动植物[11]。据前人报道,其酯类衍生物对莴苣的生长具有明显的抑制作用并存在剂量效应关系[12],在慢性不可预知轻度应激诱导的抑郁小鼠模型中表现出显著的抗抑郁活性[13]。从蜜环菌中提取出的原伊鲁烷型倍半萜芳基酯可以通过分子靶向方式,抑制5-脂氧合酶的合成,从而降低哮喘、类风湿性关节炎、过敏性鼻炎等疾病的发病风险[14]。MISIEK 等[15]在蜜环菌中分离出7 种原伊鲁烷型倍半萜芳基酯,并结合液相色谱/质谱(liquid chromatography/mass spectrometry, LC/MS)与核磁共振(nuclear magnetic resonance, NMR)分析分子量与分子结构,发现其在体外表现出良好的抗真菌活性。BOHNERT等[16]同样从蜜环菌中分离出原伊鲁烷型倍半萜芳基酯,并对其抗真菌活性进行分析,发现该化合物的抗真菌能力取决于部分双键的位置。LI等[17]在蜜环菌与附球菌共同培养的发酵液内分离纯化出新型原伊鲁烷型倍半萜芳基酯结构类似物,其在体外表现出较好的细胞毒性与乙酰胆碱酯酶抑制活性。原伊鲁烷型倍半萜芳基酯来源丰富、结构多样,近年来已经成为食品及药品领域的研究热点。
本研究以黄绿卷毛菇子实体为原料,以原伊鲁烷型倍半萜芳基酯提取量为指标,研究不同溶剂对提取量的影响;并通过超声波辅助提取法,在单因素实验的基础上采用响应面法分析,优化原伊鲁烷型倍半萜芳基酯的提取工艺。同时,采用体外抗氧化实验及抑菌实验探究黄绿卷毛菇中原伊鲁烷型倍半萜芳基酯的生物活性,以期为后续黄绿卷毛菇相关产品的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
黄绿卷毛菇购自青海省海北藏族自治州祁连县;2,4-二羟基苯甲酸甲酯(分析纯)、2,2-联苯基-1-苦基肼基(2, 2-diphenyl-1-picrylhydrazyl,DPPH)均购自上海麦克林生化科技有限公司;抗坏血酸(质量分数>99.7%)、水杨酸、30%过氧化氢(H2O2)、乙酸乙酯、环己烷、石油醚、氯仿均为分析纯,购自国药集团化学试剂有限公司;大肠埃希菌、金黄色葡萄球菌、蜡样芽孢杆菌由浙江大学陈启和教授赠予。
1.2 仪器与设备
BSA224S-CW 电子天平购自赛多利斯科学仪器(北京)有限公司;UV-5900紫外可见分光光度计购自上海元析仪器有限公司;SK5210HP 超声波清洗机购自上海科导超声仪器有限公司;N-1100旋转蒸发仪购自上海爱朗仪器有限公司;5804R 台式高速冷冻离心机购自德国Eppendorf公司。
1.3 实验方法
1.3.1 原料预处理
将黄绿卷毛菇子实体冻干,经粉碎机粉碎后,过80目网筛,密封、避光保存于4 ℃冰箱中,备用。
1.3.2 原伊鲁烷型倍半萜芳基酯提取工艺流程
称取一定量的黄绿卷毛菇子实体粉末并加入有机溶剂,用保鲜膜封口防止溶剂挥发,放入超声波清洗机中,在不同的料液比、超声时间、超声功率、超声温度下进行提取,超声结束后以8 000 r/min离心10 min,上清液即为黄绿卷毛菇中原伊鲁烷型倍半萜芳基酯提取液。
1.3.3 原伊鲁烷型倍半萜芳基酯的纯化
采用硅胶柱层析法,样品与硅胶(100~200目)按质量比1∶1 吸附上样,用20 倍体积硅胶(200~300目)装柱,用石油醚-乙酸乙酯(按体积比50∶1→20∶1→10∶1→5∶1→2∶1→1∶1→0∶1)梯度洗脱,得到7 个流分(Fr.1~Fr.7)。将流分Fr.3 经Sephadex LH-20凝胶柱色谱进一步分离,用氯仿-甲醇(体积比1∶1)洗脱,流速为1 mL/min,共得到4 个流分(Fr.3-1~Fr.3-4),合并Fr.3-2 后旋干溶剂,得到黄绿卷毛菇中纯化的原伊鲁烷型倍半萜芳基酯。
1.3.4 原伊鲁烷型倍半萜芳基酯含量的测定
精确称取0.001 g 2,4-二羟基苯甲酸甲酯标准品置于100 mL容量瓶中,加入乙酸乙酯定容至刻度线,得到0.1 mg/mL 标准品母液。分别移取母液100、200、400、600、800、1 000 μL,并用乙酸乙酯补充至5 mL。充分摇匀后,以乙酸乙酯为空白对照,于260 nm波长处测定吸光度值,以2,4-二羟基苯甲酸甲酯标准品质量浓度为横坐标,吸光度值为纵坐标,绘制原伊鲁烷型倍半萜芳基酯提取量标准曲线,得到线性回归方程:Y=52.532X+0.007 8,R2=0.999 6。取原伊鲁烷型倍半萜芳基酯提取液于260 nm 波长处测定吸光度值,按公式(1)计算黄绿卷毛菇中原伊鲁烷型倍半萜芳基酯提取量[C/(μmol/g)][18]。
C=(c×V×N)/m.(1)
式中:c为根据标准曲线计算出的黄绿卷毛菇中原伊鲁烷型倍半萜芳基酯提取液浓度,μmol/L;V为提取液总体积,mL;N为稀释倍数;m为黄绿卷毛菇子实体粉末质量,g。
1.4 不同溶剂对提取量的影响
为探究不同有机溶剂对原伊鲁烷型倍半萜芳基酯提取量的影响,采用石油醚、环己烷-乙酸乙酯(体积比3∶1)、乙酸乙酯3 种溶剂各40 mL,采用
1.3.2 节中的方法对黄绿卷毛菇子实体粉末进行超声波辅助提取(超声时间30 min、超声温度25 ℃、超声功率270 W)。
1.5 单因素实验
精确称取1.000 g黄绿卷毛菇子实体粉末,以原伊鲁烷型倍半萜芳基酯提取量为指标,参考SHAHIDI[19]的报道,选取超声时间10、20、30、40、50 min,超声功率108、135、162、189、216 W,超声温度20、30、40、50、60 ℃,以及料液比1∶20、1∶30、1∶40、1∶50、1∶60(质量体积比)进行提取,考察不同因素在不同水平下对原伊鲁烷型倍半萜芳基酯提取量的影响。
1.6 响应面实验设计
根据单因素实验结果,选取料液比(A)、超声时间(B)、超声功率(C)3 个因素为自变量,以原伊鲁烷型倍半萜芳基酯提取量(Y)作为响应值,使用Design-Expert 11 软件,依据Box-Benhnken 中心组合实验设计原理设计响应面实验,以优化原伊鲁烷型倍半萜芳基酯提取工艺条件。响应面实验各因素与水平见表1。
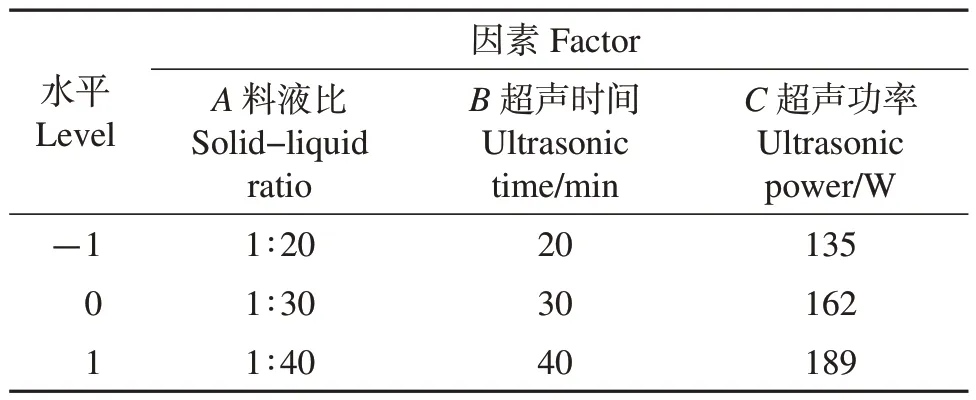
表1 响应面实验因素和水平Table 1 Factors and levels of response surface experiments
1.7 体外抗氧化实验
1.7.1 DPPH 自由基清除率测定
精确称取DPPH 0.001 0 g,加入24 mL 无水乙醇,超声5 min 使其充分溶解,配制成DPPH 工作液。在预实验的基础上,取5 支试管加入浓度为4.00 mmol/L的原伊鲁烷型倍半萜芳基酯提取液(样品),体积分别为200、400、600、800、1 000 μL,每管再分别加入2 mL DPPH 工作液与1 mL 无水乙醇,在黑暗条件下反应30 min,反应结束后在517 nm波长处测定溶液吸光度值,参比溶液为无水乙醇。以同浓度抗坏血酸为阳性对照,以乙酸乙酯为空白对照,每个浓度样品平行测定3 次,根据公式(2)计算DPPH自由基清除率[20]。
式中:D1表示样品中加入DPPH 工作液反应后的溶液吸光度值;D2表示以无水乙醇代替DPPH 工作液反应后的溶液吸光度值;D0表示以乙酸乙酯代替样品时空白对照的吸光度值。
1.7.2 羟自由基清除率测定
在比色管中依次加入9 mmol/L FeSO4溶液1 mL、9 mmol/L水杨酸-乙醇溶液1 mL和去离子水12 mL,最后加入8.8 mmol/L H2O2溶液1 mL,充分摇匀后置于37 ℃水浴中反应30 min,反应结束后在510 nm波长处测定溶液吸光度值,参比溶液为不加H2O2体系。按上述方法用浓度为0.25、0.50、1.00、2.00、4.00 mmol/L的原伊鲁烷型倍半萜芳基酯(样品)代替去离子水,参比溶液为去离子水。以同浓度抗坏血酸为阳性对照,以乙酸乙酯为空白对照。每个浓度样品平行测定3次,根据公式(3)计算羟自由基清除率[21]。
对比两组患者临床疗效和治疗前后银屑病严重程度以及血清干扰素-γ(IFN-γ)、白细胞介素-2(IL-2)水平。(1)临床疗效:无效:疗效指数<30%;一般:疗效指数30%~59%;有效:疗效指数>60%[7];(2)银屑病严重程度:采用银屑病面积和严重程度指数(PASI)评价,得分越低表示银屑病严重程度越低[8]。
式中:D3表示加入FeSO4溶液、水杨酸-乙醇溶液、H2O2溶液、样品和去离子水反应后的溶液吸光度值;D4表示加入FeSO4溶液、水杨酸-乙醇溶液、样品反应后的溶液吸光度值;D′0表示以乙酸乙酯代替样品时空白对照的吸光度值。
1.8 体外抑菌活性实验
采用打孔法测定原伊鲁烷型倍半萜芳基酯的抑菌活性[22],以大肠埃希菌、金黄色葡萄球菌、蜡样芽孢杆菌为指示菌。将冻存的上述3种菌株接种至Luria-Bertani(LB)固体培养基上进行活化,随后置于37 ℃培养箱中培养12 h,用接种环挑取活化后的单菌落接种至LB 液体培养基中,调整菌液浓度为1×106CFU/mL,备用。3种菌液分别与LB固体培养基混合后倒入平板中,待凝固后用灭菌的牛津杯(内径6 mm、外径8 mm、高10 mm)在平板上打孔,每个平板打3个孔,每孔中加入100 μL 0.40 mmol/L原伊鲁烷型倍半萜芳基酯,用封口膜封好后置于37 ℃培养箱中恒温培养24 h,以加入乙酸乙酯为阴性对照,以加入同浓度的硫酸庆大霉素为阳性对照,测定抑菌圈直径以评估原伊鲁烷型倍半萜芳基酯的抑菌活性。
1.9 数据处理与分析
实验均重复3次,结果取平均值,采用Microsoft Excel 2019、Design-Expert 11和Origin 8.5软件对数据进行处理和绘图。
2 结果与分析
2.1 不同溶剂对原伊鲁烷型倍半萜芳基酯提取量的影响
提取溶剂的极性影响着提取物的产率,根据相似相溶的原则,可以通过改变溶剂的极性来影响倍半萜化合物的溶解度,这对提取工艺的优化影响显著[23]。对比3种不同极性溶剂中原伊鲁烷型倍半萜芳基酯提取量,结果(图1)表明,提取量排序为乙酸乙酯>环己烷-乙酸乙酯(体积比3∶1)>石油醚,采用乙酸乙酯提取的原伊鲁烷型倍半萜芳基酯含量最高,故后续实验选择乙酸乙酯作为提取溶剂。
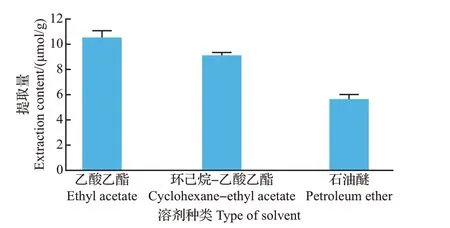
图1 不同溶剂对原伊鲁烷型倍半萜芳基酯提取量的影响Fig.1 Effects of different solvents on extraction contents of protoilludane sesquiterpene aryl esters
2.2 单因素实验结果分析
2.2.1 料液比对提取量的影响
如图2A所示,料液比在1∶20~1∶60(质量体积比)范围内时,原伊鲁烷型倍半萜芳基酯提取量在料液比1∶30时达到最大,这可能是由于溶剂与黄绿卷毛菇子实体粉末在此比例下接触面积最大,原伊鲁烷型倍半萜芳基酯溶出率高。随着溶剂比例的不断增加,提取量呈下降趋势,原因可能是大部分原伊鲁烷型倍半萜芳基酯成分已经溶出,溶剂比例不断增加导致其他化合物溶出增多,从而抑制了倍半萜类成分析出,使其含量降低[24]。
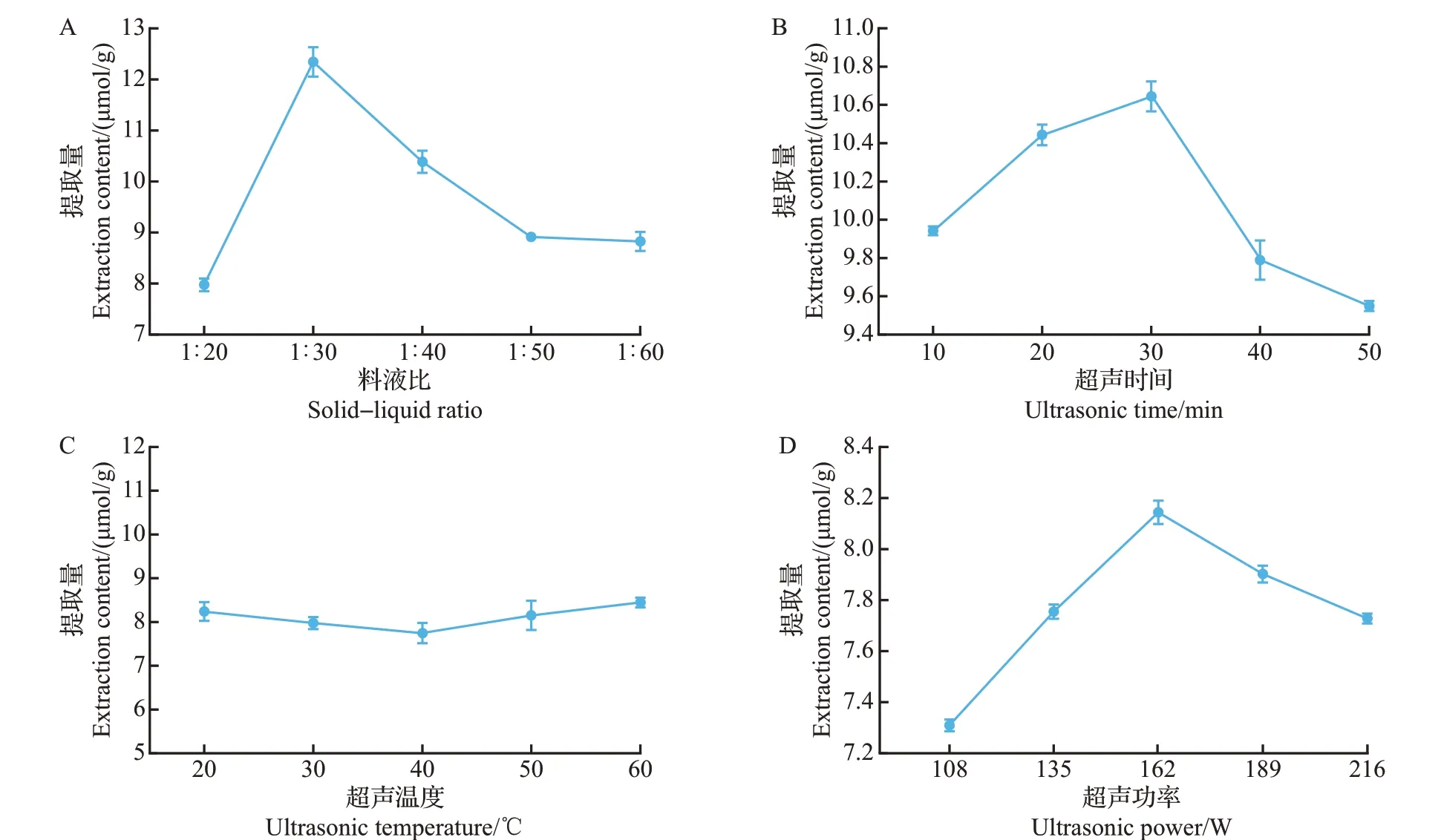
图2 不同因素对黄绿卷毛菇中原伊鲁烷型倍半萜芳基酯提取量的影响Fig.2 Effects of different factors on the extraction contents of protoilludane sesquiterpene aryl esters from F. luteovirens
2.2.2 超声时间对提取量的影响
如图2B 所示,超声时间设定在10~50 min 范围内时,原伊鲁烷型倍半萜芳基酯提取量呈先升高后降低的趋势,并在30 min时达到最大。随着超声时间的延长提取量下降,原因可能是刚开始超声时,溶剂还未渗透进黄绿卷毛菇子实体组织内,后续随着超声时间延长,超声波的机械振动导致黄绿卷毛菇细胞壁被破坏,原伊鲁烷型倍半萜芳基酯与其他杂质一同被提取出来,从而导致该倍半萜类成分提取量降低[25]。
2.2.3 超声温度对提取量的影响
温度是影响生物活性成分提取的一个重要因素,温度的升高可以导致细胞壁软化,增加物质的溶解度和扩散系数,从而改变提取效率[19]。如图2C所示,超声温度设定在20~60 ℃范围内时,随着超声温度的升高,原伊鲁烷型倍半萜芳基酯提取量呈先降低后升高的趋势,并在40 ℃时提取量最低,60 ℃时提取量最高,但与20 ℃时相差不大。从节约能源的角度考虑,后续实验选择在20 ℃条件下进行。
2.2.4 超声功率对提取量的影响
如图2D 所示,超声功率设定在108~216 W 范围内时,原伊鲁烷型倍半萜芳基酯提取量随着超声功率的增大呈现先升高后降低的趋势,并在162 W时达到最大。推测原因是超声功率的不断增大会导致提取液温度升高,在超声功率高于162 W 时可造成部分乙酸乙酯挥发,影响了原伊鲁烷型倍半萜芳基酯的溶出[26]。因此,选择超声功率162 W 进行后续实验。
2.3 响应面优化结果分析
2.3.1 实验设计与结果
根据Box-Behnken 中心组合实验设计原理,综合单因素实验结果,选取料液比、超声时间、超声功率进行3因素3水平共17个实验分析。利用Design-Expert 11 软件进行数据处理,得到的二次多项回归方 程 为:Y=10.09+0.434 1A+0.198 1B+0.200 5C-0.701 3A2-0.297 8B2-0.559 5C2+0.076 2AB+0.063 5AC-0.134 5BC(R2=0.988 6),实验设计及结果见表2。
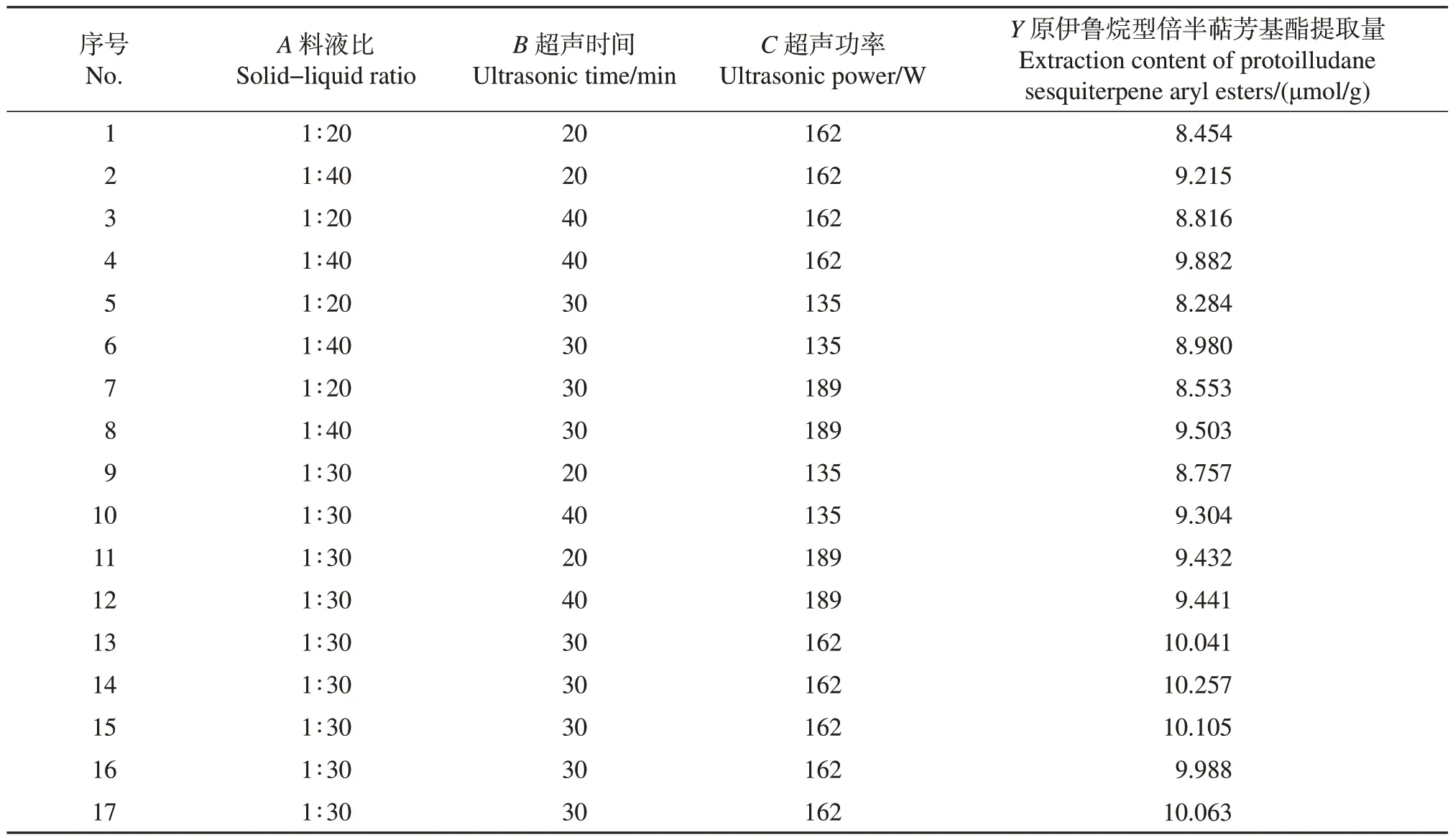
表2 Box-Behnken中心组合实验设计与结果Table 2 Box-Behnken center combination experiment design and results
2.3.2 方差分析结果
由表3 可以看出,该回归模型p<0.000 1,说明该模型具有统计学意义,可以用作提取工艺实验的优化。失拟项p>0.05,说明该模型拟合程度较好,实验误差小。决定系数R2=0.988 6,表明自变量(料液比、超声时间、超声功率)与因变量(原伊鲁烷型倍半萜芳基酯提取量)的关系显著。校正系数Radj=0.974 0,说明该模型可以解释97.40%的响应值变化。一次项A、B、C和二次项A2、B2、C2对因变量影响极显著(P<0.01),交互项AB、AC对因变量无显著影响(P>0.05)。根据F值[27]可知,各因素对原伊鲁烷型倍半萜芳基酯提取量的影响排序为A(料液比)>C(超声功率)>B(超声时间)。

表3 响应面实验的方差分析结果Table 3 Results of variance analysis of response surface experiments
2.3.3 响应面分析结果
通过Design-Expert 11 软件分析,得到黄绿卷毛菇中原伊鲁烷型倍半萜芳基酯提取量和各因素交互作用的响应面。如图3 所示,可以清晰地看到A(料液比)、B(超声时间)、C(超声功率)3因素两两之间的响应面均为开口向下的上凸曲面,说明在曲面上存在极大值。随着料液比、超声功率的增加和超声时间的延长,原伊鲁烷型倍半萜芳基酯提取量均呈现先增加后减小的趋势。响应面的平缓或陡峭程度可以反映各实验因素对响应值影响的强弱程度,响应面坡度越陡峭,则该因素值的改变对响应值的影响越大[28]。从图3 可知,料液比、超声时间、超声功率的交互曲面陡峭,且等高线呈椭圆形,表明各因素两两间相互作用明显,对原伊鲁烷型倍半萜芳基酯提取量有积极影响。
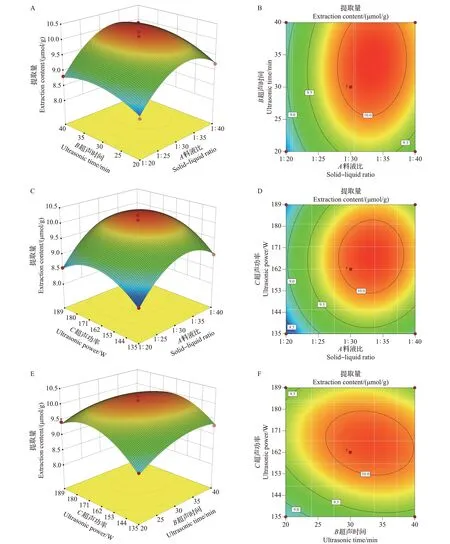
图3 原伊鲁烷型倍半萜芳基酯提取量与各因素(超声时间、超声功率和料液比)交互作用的响应面与等高线Fig.3 Response surfaces and contours of interactions between the extraction contents of protoilludane sesquiterpene aryl esters and factors (ultrasonic time, ultrasonic power and solid-liquid ratio)
2.3.4 最佳提取工艺实验验证
根据回归方程求解,得出原伊鲁烷型倍半萜芳基酯最佳提取工艺为:料液比1∶33.355(质量体积比)、超声时间33.408 min、超声功率166.250 W。根据实际情况,调整实验条件为料液比1∶33(质量体积比)、超声时间33 min、超声功率166 W。在此条件下测定原伊鲁烷型倍半萜芳基酯提取量,平行测定3次,实验结果显示其提取量为10.107 μmol/g,与预测值接近,证明此模型可以用于黄绿卷毛菇中原伊鲁烷型倍半萜芳基酯提取工艺的优化。
2.4 抗氧化活性分析
2.4.1 DPPH 自由基清除作用
DPPH 是一种稳定的氮中心自由基,它在乙醇溶液中呈现深紫色,在517 nm 波长处有吸收峰,并且在加入抗氧化剂后会变成无色或者淡黄色[29]。如图4A 所示,原伊鲁烷型倍半萜芳基酯(样品)与抗坏血酸均可清除DPPH自由基。随着样品添加量的增加,DPPH自由基的清除率逐渐增加,最大添加量下清除率达到(62.60±1.88)%,而抗坏血酸(阳性对照)的最大清除率为(99.64±0.91)%。结果表明,原伊鲁烷型倍半萜芳基酯具有较好的DPPH自由基清除能力。与李雷等[30]从红花中提取出的倍半萜对映异构体相比,本实验结果中DPPH 自由基清除率更高,说明倍半萜化合物有较好的抗氧化能力。
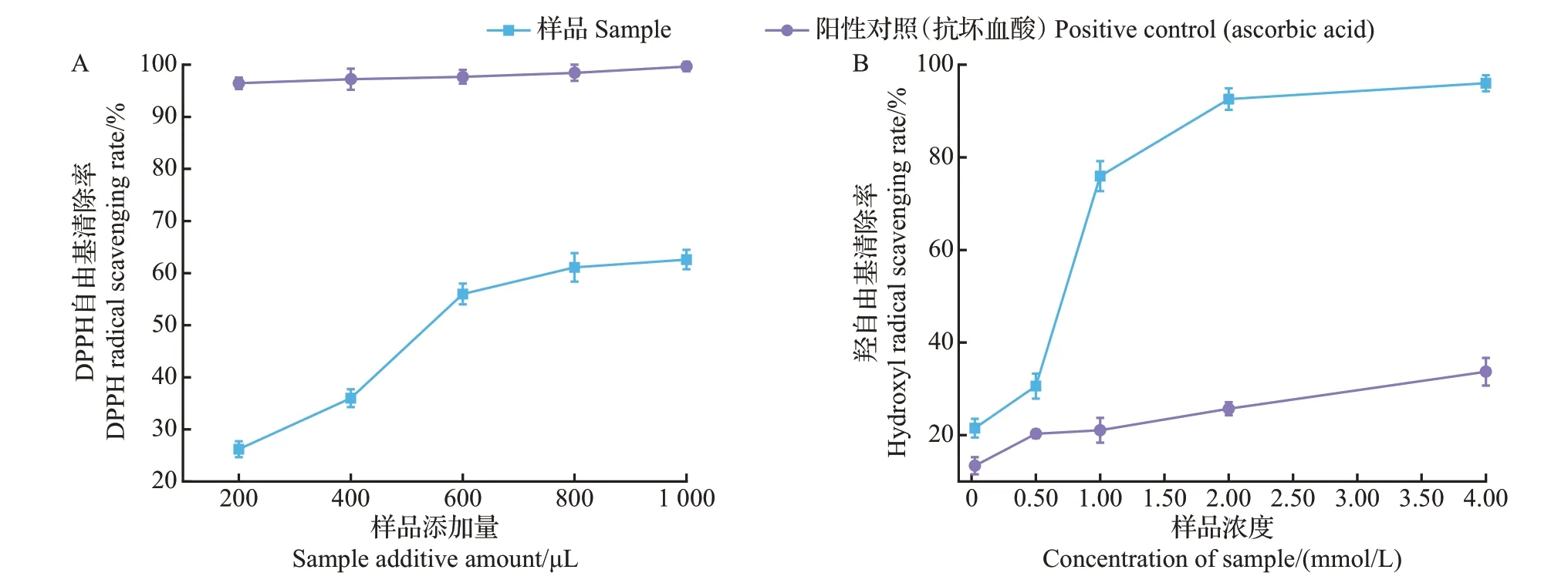
图4 黄绿卷毛菇中原伊鲁烷型倍半萜芳基酯(样品)对自由基的清除作用Fig.4 Scavenging effects on radicals of protoilludane sesquiterpene aryl esters (samples) from F. luteovirens
2.4.2 羟自由基清除作用
羟自由基是一种比较活泼的自由基,利用H2O2与Fe2+反应生成具有高反应活性的羟自由基,加入水杨酸后在510 nm波长处测定溶液吸光度值,若实验样品具有清除羟自由基的能力,则吸光度值会逐渐降低[31]。由图4B所示,羟自由基清除率随样品浓度的增加而增大,最大清除率达到(95.99±1.74)%,清除效果明显优于抗坏血酸(阳性对照),说明原伊鲁烷型倍半萜芳基酯可有效减少羟自由基的产生。推测原因可能是原伊鲁烷型倍半萜芳基酯与水杨酸相比竞争羟自由基的能力更强,而抗坏血酸自身氧化生成的H2O2反而使溶液显色程度增加,导致羟自由基的数量增加。
2.5 抑菌活性分析结果
体外抑菌实验结果(表4)表明,原伊鲁烷型倍半萜芳基酯对大肠埃希菌、金黄色葡萄球菌和蜡样芽孢杆菌均有抑制作用。参考李宇等[32]研究中对抗生素抑菌活性的界定:高度敏感,抑菌圈直径>20 mm;中度敏感,抑菌圈直径10~20 mm;轻度敏感或耐药,抑菌圈直径<10 mm。根据抑菌圈直径分析,硫酸庆大霉素溶液(阳性对照)对3种供试菌株的抑制效果均为高度敏感。原伊鲁烷型倍半萜芳基酯对金黄色葡萄球菌、蜡样芽孢杆菌的抑制效果为中度敏感,抑菌圈直径分别为15.7、16.1 mm,对大肠埃希菌的抑制能力相对较弱,抑菌圈直径为9.4 mm。此结果与文献[33]中所报道的原伊鲁烷型倍半萜芳基酯对革兰氏阳性菌活性抑制能力更强的结果一致,原因可能是分子构型上羟基或双键的位置不同,导致该倍半萜化合物对不同菌种的抑菌能力产生差异。
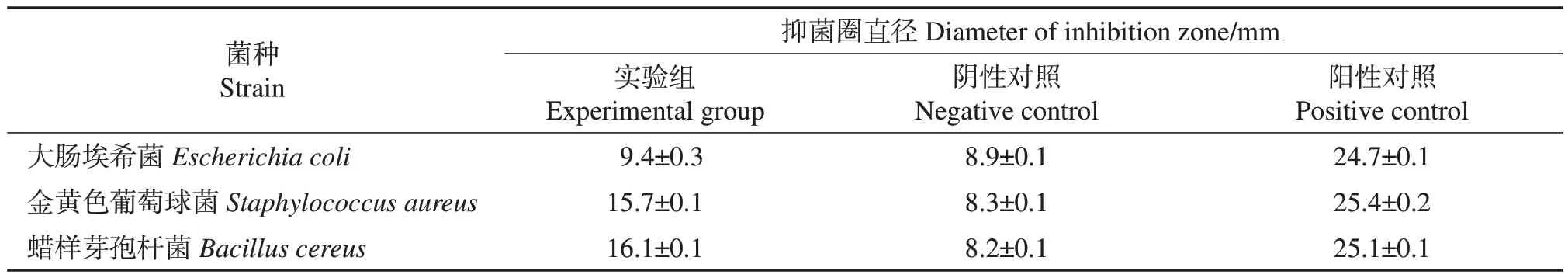
表4 黄绿卷毛菇中原伊鲁烷型倍半萜芳基酯的抑菌活性Table 4 Antibacterial activity of protoilludane sesquiterpene aryl esters from F. luteovirens
3 讨论
黄绿卷毛菇是一种珍稀的食药两用菌,其子实体中的活性成分具有很高的研究价值,不同的提取工艺对活性成分的提取效率有明显影响。本研究发现,原伊鲁烷型倍半萜芳基酯提取量随着溶剂极性的增大而升高。出现这种情况的原因可能是倍半萜内酯中带有卤素原子和极性官能团,其在乙酸乙酯中的溶解度要比在石油醚中高,所以使用极性较高的溶剂更有利于此类化合物的溶出。SIDDIQUI等[34]在尝试了几种溶剂组合后,选择用正己烷-乙酸乙酯(体积比3∶1)对香樟叶中的倍半萜内酯进行提取,优化提取率为1.01%(质量分数)。TRENDAFILOVA等[35]对土木香中2种倍半萜内酯的提取工艺进行优化,通过不断改变溶剂的极性,发现70%乙醇溶液为最佳提取溶剂。对比前人的研究,鲜见有人使用极性较低的溶剂进行提取,本研究的结果与之一致。与SIDDIQUI 等[34]和TRENDAFILOVA 等[35]研究不同的是,本研究所选用的材料为菌类而非植物,但本研究的实验结果与之基本一致,说明不同物种间的倍半萜内酯具有一定的相似性。同样的,李英迪等[36]从猴头菇中提取三萜类化合物时发现,通过增加溶剂的极性可以提高三萜类化合物的提取效率。综上所述,本研究最终选用乙酸乙酯作为黄绿卷毛菇中原伊鲁烷型倍半萜芳基酯的提取溶剂。
目前对黄绿卷毛菇子实体的研究多集中在多糖、蛋白质和核黄素的提取方法优化及活性分析等方面,而在萜类化合物方面鲜有报道。本研究首次利用超声波辅助法提取黄绿卷毛菇中原伊鲁烷型倍半萜芳基酯,并进行响应面实验以优化提取工艺,发现原伊鲁烷型倍半萜芳基酯提取量在超声波的辅助下得到显著提升。TIAN 等[37]利用超声波辅助法提取双孢蘑菇中的多糖,得到了相同的结论,即在超声波的物理力作用下可加剧蘑菇子实体细胞的破坏程度,促使子实体内物质的溶出,从而提升物质提取效率。SANTOS等[38]利用超声波辅助法提取巴西烛树中倍半萜时,发现当超声功率和超声温度一定时,倍半萜含量随着料液比的增加表现出先增大后减小的趋势,在料液比为1∶15(质量体积比)时提取量达到最大,与之相比本研究的最佳料液比为1∶33(质量体积比),所需溶剂更多。出现这种差异的原因可能是菌类细胞壁中的木质素含量远高于植物,木质素可阻碍活性物质的渗出[39]。调整料液比可以给材料和溶剂提供更大的接触面积,材料溶胀程度增加有利于提取物的溶出。本研究中原伊鲁烷型倍半萜芳基酯提取量的影响因素与ABOUHEIF 等[40]使用超声波辅助法提取银杏叶中的萜内酯时基本相同,在超声时间为36.63 min时萜内酯的提取量达到最大,本研究结果与之基本一致,不同的是银杏叶中萜内酯的最佳提取温度为57.58 ℃。造成差异的因素可能是在提取过程中各类组织细胞中成分不同,温度会使萜类化合物发生分解或聚合,进而影响提取效率。本研究中,在最优提取工艺下原伊鲁烷型倍半萜芳基酯提取量可达到10.107 μmol/g,与优化前相比有较大提升,表明超声波辅助提取法可有效提高原伊鲁烷型倍半萜芳基酯的提取量,且兼具快捷、高效和低成本等优点,具有良好的应用前景。
有研究从荔枝果皮中分离纯化出2种倍半萜类化合物[41],并且发现其铁离子还原能力(FRAP)、DPPH 自由基清除能力明显优于果皮中其他成分。本研究结果表明,原伊鲁烷型倍半萜芳基酯具有一定的抗氧化能力。原伊鲁烷型倍半萜芳基酯的DPPH自由基清除率最高可达(62.60±1.88)%,羟自由基清除率最高可达(95.99±1.74)%,与AIT OUAHIOUNE等[42]从长角豆中提取得到的倍半萜化合物的抗氧化性相似。这可能是由于原伊鲁烷型倍半萜芳基酯具有较好的提供氢离子的能力,其与自由基上的不成对电子结合后展现出抗氧化性,这一发现也为未来食品天然抗氧化剂的开发提供了新思路。
原伊鲁烷型倍半萜芳基酯对3种供试菌株均有抑制效果,对大肠埃希菌轻度敏感,对金黄色葡萄球菌和蜡样芽孢杆菌中度敏感。对比实验结果发现,原伊鲁烷型倍半萜芳基酯对革兰氏阳性菌的抑菌能力更强,革兰氏阴性菌与革兰氏阳性菌细胞壁含有的化学物质不同可能是造成这一差异的因素。原伊鲁烷型倍半萜芳基酯对革兰氏阳性菌细胞壁的破坏程度更大,可导致其内容物外泄进而致其死亡。对比DUAN等[43]从毛韧革菌中提取出的倍半萜类化合物的抑菌效果,本研究中原伊鲁烷型倍半萜芳基酯的抑菌效果更好。据MASYITA等[44]报道,植物精油中含有丰富的单帖和倍半萜等活性成分,对大肠埃希菌、金黄色葡萄球菌和铜绿假单胞菌等具有明显抑制效果。结合KUDUMELA等[45]的研究结果,说明从菌类和植物中提取的倍半萜类化合物可以作为未来抗生素的重要来源,但其具体的抑菌机制还有待进一步研究。
4 结论
本研究通过对比3种溶剂对黄绿卷毛菇中原伊鲁烷型倍半萜芳基酯的提取结果,发现乙酸乙酯为佳提取溶剂。随后采用响应面法对超声波辅助提取原伊鲁烷型倍半萜芳基酯的工艺进行优化,得到最佳提取工艺为料液比1∶33(质量体积比)、超声时间33 min、超声功率166 W,在此条件下提取量达到10.107 μmol/g,表明超声波辅助法对原伊鲁烷型倍半萜芳基酯的提取具有显著的提升效果。抗氧化活性分析发现,原伊鲁烷型倍半萜芳基酯对DPPH自由基和羟自由基有较好的清除能力,最大清除率分别为(62.60±1.88)%和(95.99±1.74)%。本研究还发现原伊鲁烷型倍半萜芳基酯对大肠埃希菌、金黄色葡萄球菌和蜡样芽孢杆菌均有抑制作用,表明其有作为食品工业中的天然抗氧化剂和防腐剂的潜力。本研究为黄绿卷毛菇中原伊鲁烷型倍半萜芳香酯用于实际生产提供了理论支撑,拓展了黄绿卷毛菇的应用范围。
