迷宫栓孔菌热激蛋白基因的生物信息学与表达分析
2023-12-29杨旭欣冯连荣池玉杰韩树英
杨旭欣,冯连荣,池玉杰,韩树英
(1.东北林业大学林学院,黑龙江 哈尔滨 150040;2.辽宁省杨树研究所,辽宁 营口 115000;3.周口师范学院生命科学与农学学院,河南 周口 466001)
热激蛋白(heat shock proteins, HSPs)在广义上被称为应激蛋白,是有机体在高温、干旱、自由基损伤等逆境胁迫因子的刺激下[1],正常蛋白受到抑制而诱导细胞合成新的或数量增加的一类应激蛋白。它们是一类在系统发育上高度保守的蛋白质,广泛存在于原核细胞和真核细胞中[2]。迄今为止,在植物、动物和微生物中都发现存在热激反应。热激蛋白种类繁多,目前尚无明确的分类标准[3-4],多数依据蛋白质分子量大小将其分为HSP100、HSP90、HSP70、HSP60和小分子HSPs[small HSPs(sHSPs),15~42 kDa]5个亚类[5-6],其中HSP100家族承担了重要的蛋白质解聚功能。HSP104/ClpB 为HSP100 家族成员,其同系物在真核生物中称为HSP104,在细菌中称为ClpB。相较于经典分子伴侣HSP70 阻止蛋白质聚集的功能,HSP104/ClpB 可以逆转蛋白质聚集[7]。HSP104/ClpB属于AAA+超家族,是依赖于腺苷三磷酸(adenosine triphosphate, ATP)的分子伴侣[8-9]。核苷酸结合域(nucleotide-binding domains,NBDs)为Clp 家族分类的主要判别标准,HSP100/Clp家族主要分为2类:Ⅰ类中含有2个NBDs,Ⅱ类中只含有1 个NBD。HSP104/ClpB 属于Ⅰ类,其单体主要由4 部分构成:N-端、NBD1、NBD2 及2 个NBDs 间的接头(linker)。相较于同类别的ClpA、ClpC、ClpD,HSP104/ClpB 的特点为2 个NBDs 间的接头长度最长[7,10-12]。现阶段对HSP104/ClpB 的研究主要集中在嗜热细菌和大肠埃希菌(Escherichia coli)等模式菌种上,而在真菌细胞及其他高等真核细胞中对HSP104的研究较薄弱。
迷宫栓孔菌(Trametes gibbosa),又称偏肿栓菌、偏肿革裥菌(Lenzites gibbosa)[13],是我国东北林区常见的一种白腐菌,在栎、榆、椴等阔叶树的倒木、枯木、木桩或活立木上生长(一年生),引起木材呈白色海绵状腐朽[14]。本研究构建了迷宫栓孔菌在木屑处理下不同时间点的转录组文库,通过对转录组的分析筛选出迷宫栓孔菌中所有的HSPs,对其进行鉴定分类和相关的生物信息学分析,并针对HSP100 家族的基因序列和蛋白结构进行深入研究。本研究结果可为HSPs 在真菌中的研究提供参考,也为迷宫栓孔菌在胁迫应激方面的研究提供数据支持与理论依据。
1 材料与方法
1.1 试验材料
供试菌株迷宫栓孔菌(T.gibbosa)CB1 从采于长白山的野生迷宫栓孔菌子实体中通过组织分离法分离得到,试验菌种保存于马铃薯葡萄糖琼脂(potato dextrose agar, PDA)培养基上及4 ℃冰箱中。小黑杨(Populus simoniiCarr.×P.nigraL.)木段由黑龙江省齐齐哈尔市林业和草原局提供,试验前去皮,制成碎木屑,备用。低氮天冬酰胺-琥珀酸(low nitrogen asparagine-succinic acid, LNAS)培养基在实验室自配[15]。
RNAprep_Pure多糖多酚植物总RNA提取试剂盒购自天根生化科技(北京)有限公司;第1 链cDNA 合成试剂盒(PrimeScriptTM1st Strand cDNA Synthesis Kit)、定量用反转录试剂盒[PrimeScriptTMRT Reagent Kit with gDNA Eraser (Perfect Real Time)]、ExTaq酶、DL15000 DNA标志物购自宝生物工程(大连)有限公司;2×实时定量聚合酶链反应(polymerase chain reaction, PCR)扩增预混液[2×SYBR Green qPCR Master Mix (Low Rox)]试剂盒购自美国Bimake生物科技有限公司。引物合成及测序均由生工生物工程(上海)股份有限公司完成。
1.2 转录组文库构建及热激蛋白基因家族分析
1.2.1 转录组文库构建
将保存的菌株在PDA 培养基平板上于26 ℃培养7~10 d以进行活化,然后用直径5 mm的打孔器取菌落边缘的菌饼并接种于含有1%葡萄糖的75 mL LNAS液体培养基的锥形瓶中,每瓶接种5个菌饼,在26 ℃培养箱中静置预培养10 d,然后将培养菌丝的锥形瓶分别于0、3、5、7、11 d进行随机取样(以0 d 为对照组,在木屑处理组中每瓶添加2 g 灭菌木屑),每个时间点选取5瓶菌丝混合为1个样品,每个样品进行3组生物学重复。将干燥的菌丝样品收集至冻存管中,在液氮中速冻,然后于-80 ℃冰箱中保存。将冷冻的菌丝样品送至北京百迈客生物科技有限公司进行转录组文库构建,并利用相关软件将测序得到的待分析数据的高质量读长(clean reads)与JGI数据库中迷宫栓孔菌参考基因组(http://genome.jgi.doe.gov/Tragib1/Tragib1.home.html)进行序列比对,得到一整套转录本信息和每个基因的表达量。转录组文库构建方法及基因表达的基本信息详见文献[16]。
1.2.2 热激蛋白基因家族分析
在转录组文库中进行所有热激蛋白基因检索,根据蛋白质直系同源簇(clusters of orthologous groups of proteins, COG)、基因本体(gene ontology,GO)、京都基因和基因组数据库(Kyoto Encyclopedia of Genes and Genomes, KEGG)、基因的进化谱系-非监督直系群数据库(evolutionary genealogy of genes with non-supervised orthologous groups database,eggNOG)、Swiss-Prot、蛋白质家族(protein family,Pfam)数据库基因注释的结果,依据分子量进行分类,并参照NCBI Blast(https://blast.ncbi.nlm.nih.gov/Blast.cgi)及Swiss-Model(https://swissmodel.expasy.org/)比对结果,对每个检索到的基因进行再次确认。基于所有的HSPs 氨基酸序列,利用MEGA_X 软件构建系统发育树:首先用MUSCLE软件进行同源比对,然后采用邻接(neighbor joining, NJ)法构建系统发育树,并利用iTOL 在线工具(https://itol.embl.de/itol.cgi)进行美化。对所有热激蛋白基因在COG、GO、KEGG中进行功能注释与分析。通过系统发育树构建及迷宫栓孔菌热激蛋白基因家族分析,筛选得到2个HSP100家族基因gene_2622和gene_6466,并对它们进行生物信息学与表达量分析。
1.2.3 热激蛋白基因的理化性质及结构分析
分别利用ProtParam(https://web.expasy.org/protparam/)、SignalP-5.0(https://services.healthtech.dtu.dk/service.php?SignalP-5.0)及TMHMM-2.0(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)等工具对迷宫栓孔菌中所有的HSPs氨基酸序列进行理化性质分析、信号肽及跨膜区预测,并利用Swiss-Model对其三级结构进行预测。
1.3 HSP100 家族基因分析
1.3.1 2 个HSP100 基因克隆及生物信息学分析
对筛选出的2 个HSP100 家族基因gene_2622和gene_6466进一步进行分析,分别将其命名为Tg-hsp104-1和Tg-hsp104-2。克隆这2个基因全长序列的引物信息如下:Tg-hsp104-1-F,5´-TCTCTTG TCTGCCCTCTTG-3´;Tg-hsp104-1-R,5´-GCGGT GAGTTGGGTAGAA-3´。Tg-hsp104-2-F,5´-ATG GCTTCCTCTATGA-3´;Tg-hsp104-2-R,5´-GCCG ATTCGCTCTACACT-3´。以反转录cDNA为模板,利用ExTaq酶,在退火温度为45 ℃的条件下对Tg-hsp104-1和Tg-hsp104-2进行PCR 扩增,然后将扩增产物送至生工生物工程(上海)股份有限公司进行测序。综合测序结果、转录组文库及JGI 数据库中的参考基因组进行核苷酸及氨基酸序列分析。利用GSDS 2.0 软件(http://gsds.gao-lab.org/)对Tghsp104-1和Tg-hsp104-2核苷酸序列进行可视化。利 用NCBI 的CD-Search(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)对Tg-HSP104-1 和Tg-HSP104-2 进行氨基酸序列和保守结构域预测,并利用GraphPad Prism 8.4.0软件进行可视化分析;利用Swiss-Model进行三级结构建模,结合序列分析,利用PyMol软件对蛋白结构进行标注。
1.3.2 2 个HSP100 基因表达量分析
依照1.2.1节的方法进行菌丝培养和收集,提取在木屑处理下不同时间点的RNA并反转录成cDNA。以三磷酸甘油醛脱氢酶基因(gpd,GenBank登录号为JN564734)作为内参基因,在退火温度为56 ℃的条件下以两步法对Tg-hsp104-1和Tg-hsp104-2进行实时荧光定量PCR(real-time fluorescent quantitative PCR,qRT-PCR)扩增。引物信息如下:Tg-hsp104-1-F,5´-AAGGCGAGCGGGAGAA-3´;Tg-hsp104-1-R,5´-GATGCGACTGGGCGATT-3´。Tg-hsp104-2-F,5´-GTTGGCCCGTGGAAAGC-3´;Tg-hsp104-2-R,5´-GCGGAGGATGGAGATGGTT-3´。gpd-F,5´-AA CGGTTTCGGTCGTATCGG-3´;gpd-R,5´-CTTGCC CTCGACCCAGAGCT-3´。采用Microsoft Excel 2013和GraphPad Prism 8.4.0软件对数据进行处理,并利用SPSS 24.0 软件对数据进行差异显著性检验(邓肯法)。
2 结果与分析
2.1 迷宫栓孔菌的HSPs 家族分析
2.1.1 迷宫栓孔菌的HSPs 基因分类
在转录组文库中对迷宫栓孔菌所有热激蛋白基因进行检索,结果共检索到32 个热激蛋白基因,根据编码蛋白的分子量分别归属于HSP100(2 个)、HSP90(2 个)、HSP70(7 个)、HSP60(1 个)、sHSPs(20 个,其中,4 个HSP40,2 个HSP31,10 个HSP20,2 个HSP12,2 个HSP10)(附 表1,http://www.zjujournals.com/agr/CN/10.3785/j.issn.1008-9209.2022.10.261)。迷宫栓孔菌热激蛋白基因系统发育树如图1 所示,同类别HSPs 基因聚类在一起,但2个HSP31 基因(gene_5587和gene_6895)亲缘关系较远。
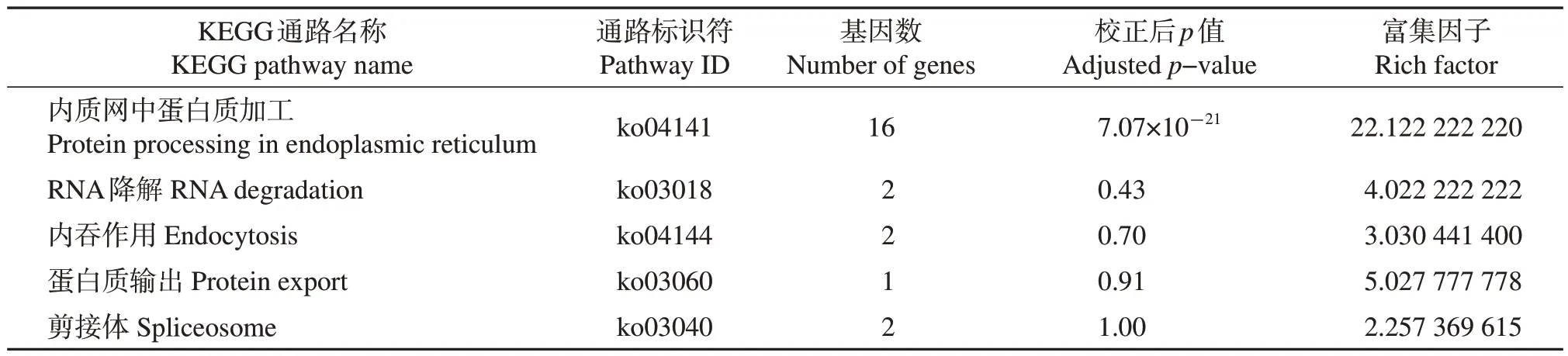
表1 迷宫栓孔菌热激蛋白基因的KEGG通路富集Table 1 KEGG pathway enrichment of HSP genes in T. gibbosa
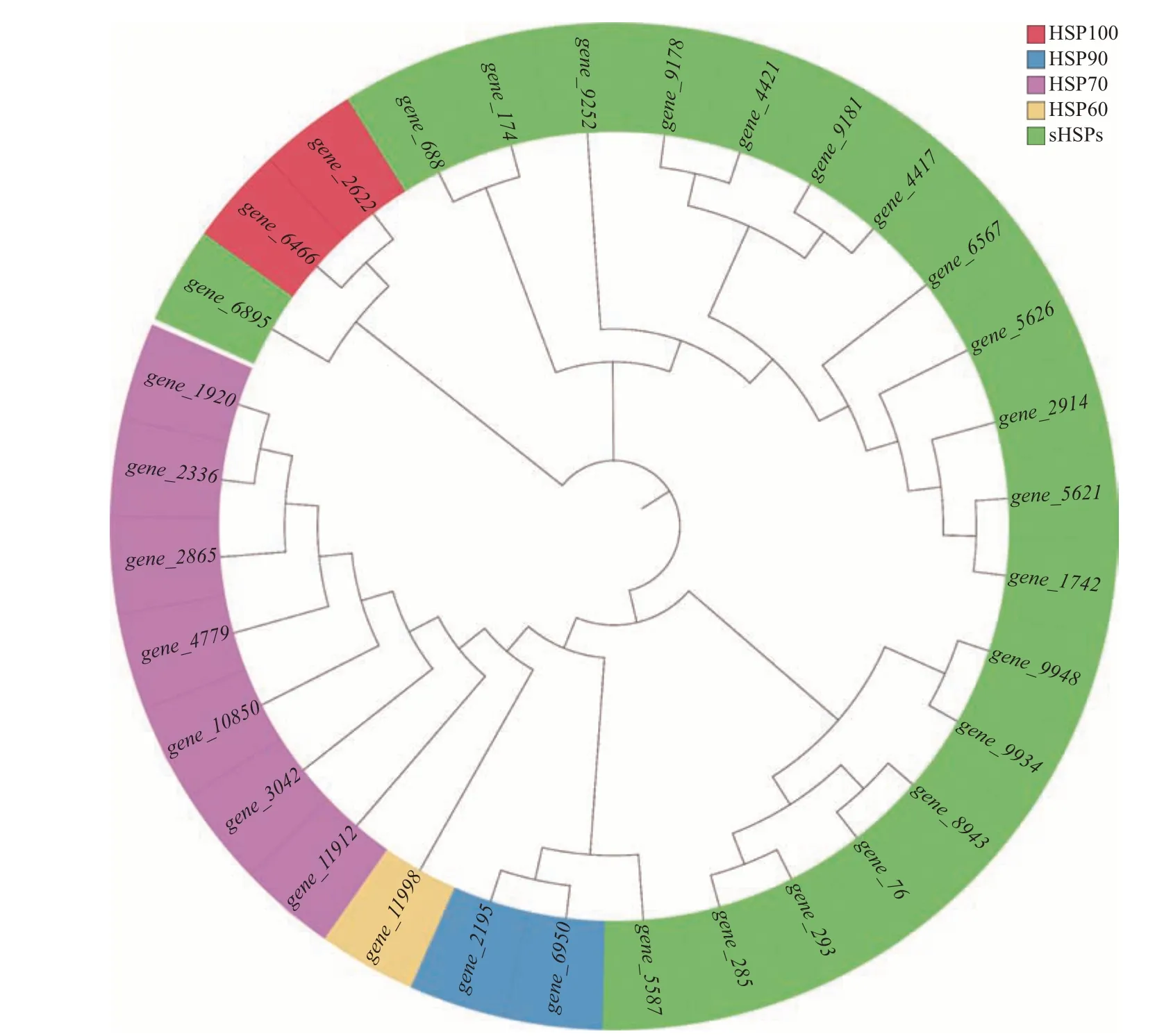
图1 迷宫栓孔菌热激蛋白基因系统发育树(NJ法)Fig.1 Phylogenetic tree of HSP genes in T. gibbosa (NJ method)
2.1.2 迷宫栓孔菌HSPs 家族功能注释
迷宫栓孔菌的32个HSPs基因在COG数据库中被注释的有27个,属于2个功能类目,其中,有25个属于O 类(蛋白翻译后修饰、蛋白质折叠、伴侣蛋白),占比92.59%,有2个属于R类(一般功能预测),占比7.41%;而未被注释的5个基因都为sHSPs基因。可见,在迷宫栓孔菌中热激蛋白的主要功能为蛋白翻译后修饰、蛋白质折叠和伴侣蛋白;而sHSPs种类繁多,在细胞内分布广泛,其功能更待深入研究。
对HSPs基因进行GO注释和富集分析,结果如图2 所示。HSPs 基因被显著富集到“生物过程”的20 个二级类目、“细胞组分”的14 个二级类目及“分子功能”的11 个二级类目中。根据GO 分类和富集分析可知,HSPs 广泛分布于细胞中,发挥多种重要功能,在应激条件下对蛋白质的折叠有重要意义,参与热激反应,具有分子伴侣特性、与ATP 结合的特性和ATP酶活性,在其发挥功能过程中存在能量依赖性。
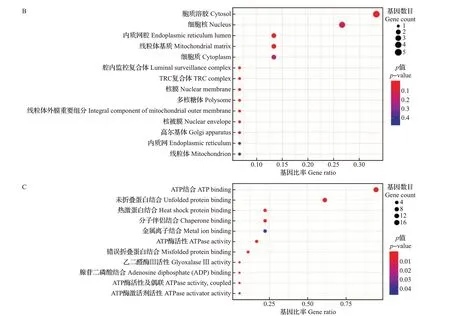
图2 迷宫栓孔菌热激蛋白基因的GO富集Fig.2 GO enrichment of HSP genes in T. gibbosa
KEGG通过分子网络路径图体现大分子功能与代谢通路的关系。在本研究的32个HSPs基因中有18个被注释,分布在5条通路中(表1),其中只有内质网中蛋白质加工通路的校正后p值小于0.05,为显著富集的通路。HSPs 基因在KEGG 中的分类注释与通路富集结果表明,迷宫栓孔菌的热激蛋白还参与了RNA降解、内吞作用、蛋白质输出等通路,但以内质网中蛋白质加工通路最重要。
2.2 迷宫栓孔菌HSPs 理化性质和结构分析
2.2.1 理化性质分析
对所有HSPs的理化性质进行分析(附表2,http://www.zjujournals.com/agr/CN/10.3785/j.issn.1008-9209.2022.10.261),发现迷宫栓孔菌HSPs 家族成员的氨基酸数量及分子量与其对应的HSPs 亚类有直接关系,其理论等电点为4.81~9.10,均为疏水蛋白。在32个HSPs成员中,有10个HSPs的不稳定系数小于40,稳定性较好;另外22个HSPs的不稳定系数大于40,其中sHSPs 亚类成员中有18 个为不稳定蛋白,占sHSPs亚类成员的90%。可见,迷宫栓孔菌HSPs的稳定性因亚类的不同而有所差异,且sHSPs 在体外测试中稳定性普遍较差。
2.2.2 蛋白质三级结构预测
对迷宫栓孔菌HSPs 的三级结构进行预测,结果发现不同类别的HSPs 结构截然不同,各类别代表性结构如图3所示。HSP100为六聚体环状结构,通过构象延展和封闭的相互转换,提供了“棘轮式”(ratchet-like)结构[17-18];HSP90 为同源二聚体结构,与ADP 结合时呈“V 型”(V-shape),通过与ATP 结合,其构象以“钳形运动”(pincer-like motion)实现从开放到闭合的转换[19];HSP70的功能与其辅助分子伴侣HSP40 有紧密联系,在HSP40 和底物的刺激下,HSP70 将ATP 水解为ADP,并捕获底物[20-21];HSP60为蛋白质折叠所必需的蛋白,为七聚体环状结构,在HSP10 的协作下,构成“安芬森笼”(Anfinsen cages)结构[22],促进错误折叠的多肽链的展开。

图3 迷宫栓孔菌不同类别热激蛋白的三级结构Fig.3 Tertiary structures of different classes of HSPs in T. gibbosa
2.3 迷宫栓孔菌HSP100 家族基因分析
Tg-hsp104-1和Tg-hsp104-2为 迷宫 栓 孔菌HSP100 家族基因,编码的产物蛋白具有重要的解聚功能。HSP100 家族中的HSP104 虽为分子伴侣,但其与经典的分子伴侣HSP70的功能有所不同,故筛选出HSP100家族基因予以进一步分析。
2.3.1 基因克隆及序列分析
根据转录组文库分析和JGI 数据库中参考基因组可知,基因Tg-hsp104-1长度为2 663 bp,Tg-hsp104-2长度为2 789 bp。以45 ℃退火温度进行PCR扩增,2个基因都扩增得到单一且明亮的条带(图4),并与预计长度一致,测序结果与转录组序列和基因组序列比对成功。以测序结果为主,结合转录组分析和JGI数据库中参考基因组数据,对上述2个HSP100基因进行分析,其内含子与外显子分布情况如图5所示,其保守结构域都比对到了ClpB结构域上。
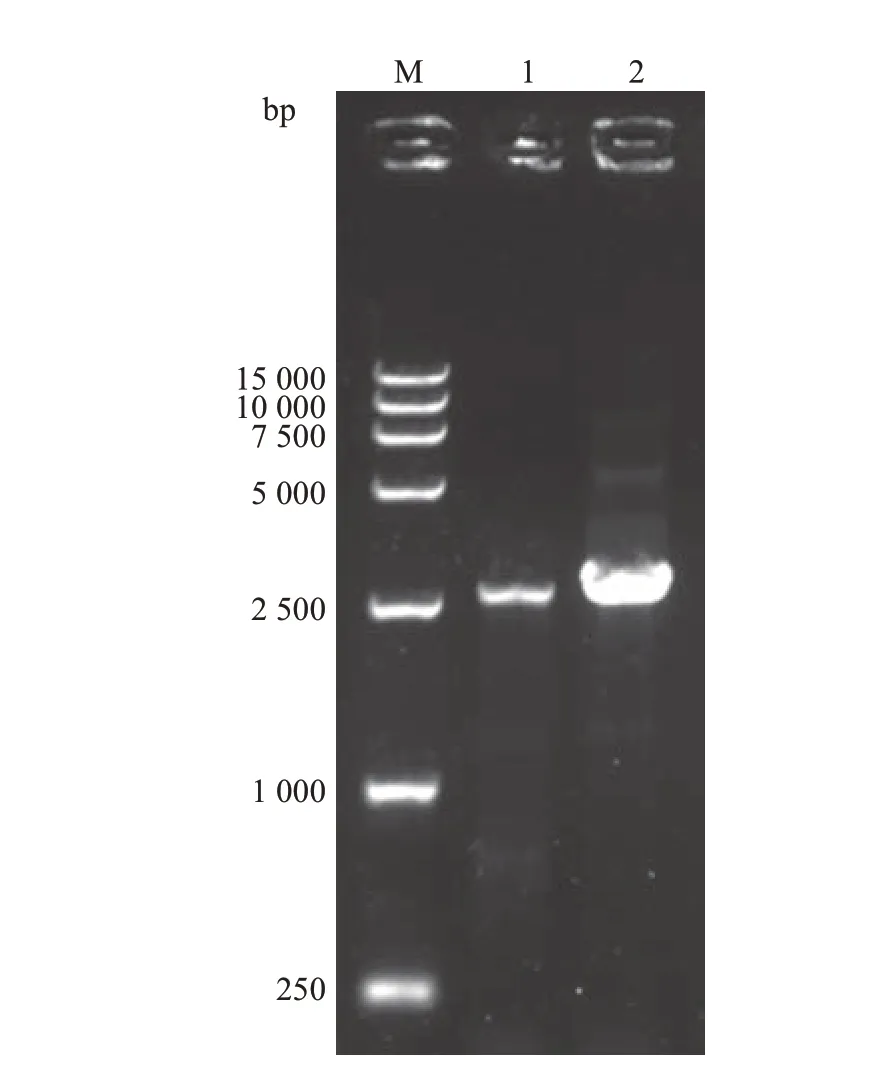
图4 HSP100基因PCR扩增电泳图Fig.4 Electrophoretogram of HSP100 genes by PCR amplification
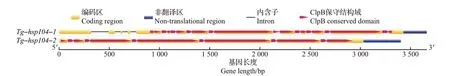
图5 迷宫栓孔菌HSP100基因序列结构Fig.5 Sequence structures of HSP100 genes in T. gibbosa
2.3.2 氨基酸序列分析
HSP104/ClpB属于Clp家族,是AAA+超家族的一员。HSP104/ClpB包含6个结构域:1个不固定的N-端结构域、2 个AAA+模块(NBD1 和NBD2,其中,NBD1 由AAA 结构域和AAA 盖结构域组成,NBD2 由AAA 结构域和C-端结构域组成),以及插入在NBD1 和NBD2 之间的连接结构域(接头)[7,11]。在NBDs 中有十分保守的Walker A、Walker B 基序和一个重要的精氨酸指保守残基[11,23]。
Tg-HSP104-1 和Tg-HSP104-2 的 氨 基 酸 序列结构如图6A~B所示。Tg-HSP104-1共有819个氨基酸(amino acid, aa),通过NCBI 的CD-Search 预测,第80—789 aa 比对到了ClpB 上,2 个AAA 结构域分别在第127 aa处和第532 aa处有Walker A保守基序,在第194 aa 处与第600 aa 处有Walker B 保守基序,在第322个精氨酸(arginine, Arg)处与第772个Arg 处分别为NBD1 和NBD2 精氨酸指结构的保守残基。Tg-HSP104-2共有899 aa,第7—865 aa比对到了ClpB上,2个AAA结构域分别在第215 aa处和第620 aa 处有Walker A 保守基序,在第285 aa 处与第688 aa 处有Walker B 保守基序,在第414 个Arg与第804 个Arg 处分别为NBD1 和NBD2 精氨酸指结构的保守残基。
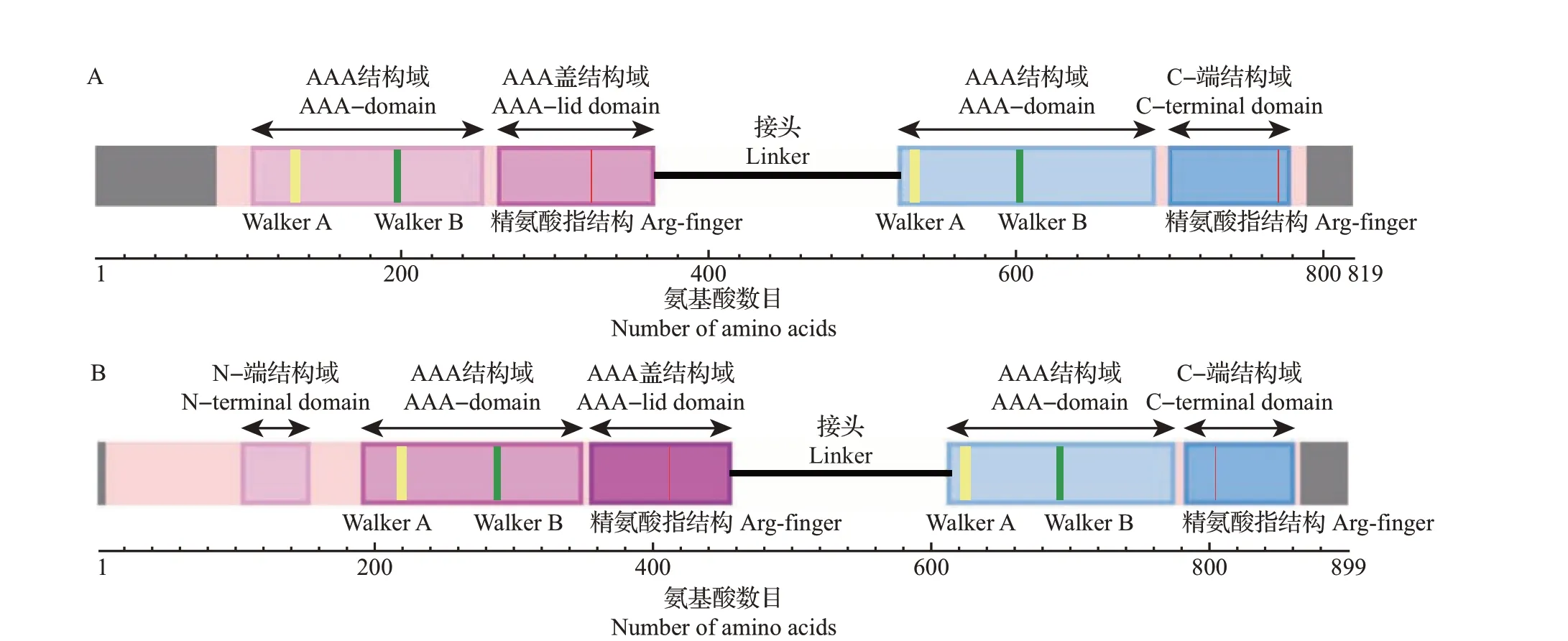
图6 迷宫栓孔菌HSP100氨基酸序列结构Fig.6 Amino acid sequence structures of HSP100 in T. gibbosa
Walker A 和Walker B 保守基序为NBDs 重要的识别序列。精氨酸指结构与相邻亚基结合的核苷酸相互作用,被认为在ATP 水解酶和细胞通信中发挥重要作用[11]。Walker A 基序的序列特点为Gx2GxGK(S/T),其中,G是甘氨酸,K是赖氨酸,S是丝氨酸,T是苏氨酸,x是任何残基;Walker B基序的序列特点为hhhhDE,其中,h 是疏水残基,D 是天冬氨酸,E是谷氨酸[24];精氨酸指结构位于β链之后,其前后序列具有hxxxhxxhxxxxRxxxxxxxxh的特点,其中R是精氨酸。精氨酸指保守残基的详细信息仍然较少,相比于序列保守,其更倾向于结构保守[8,25-26]。
2.3.3 三级结构分析
从图6A~B中可以看出,Tg-HSP104-2蛋白序列更为完整,Tg-HSP104-1 较之缺少了N-端结构域,故以Tg-HSP104-2 为例进行三级结构建模。Tg-HSP104-2为六聚体结构(图7A~B),呈棘轮状,每个单体都相同,共同通过螺旋嵌套形成六聚体构象来发挥功能。每个单体由N-端、NBD1、NBD2、接头构成[10](图7C)。如图7D~E 所示,Tg-HSP104-2单体的NBD1 和NBD2 上半部分由α螺旋-β折叠-无规卷曲组成较大的αβα-核苷酸结合结构,下半部分由α螺旋-β折叠-无规卷曲组成较小的α-螺旋结构。NBD1 和NBD2 在结构上有一定的差异,两者的AAA保守结构域都为一个较大的αβα-核苷酸结合结构,但NBD1的AAA盖保守结构域是一个较小的α-螺旋结构,而NBD2的C-端保守结构域是一个αβ结构[8]。
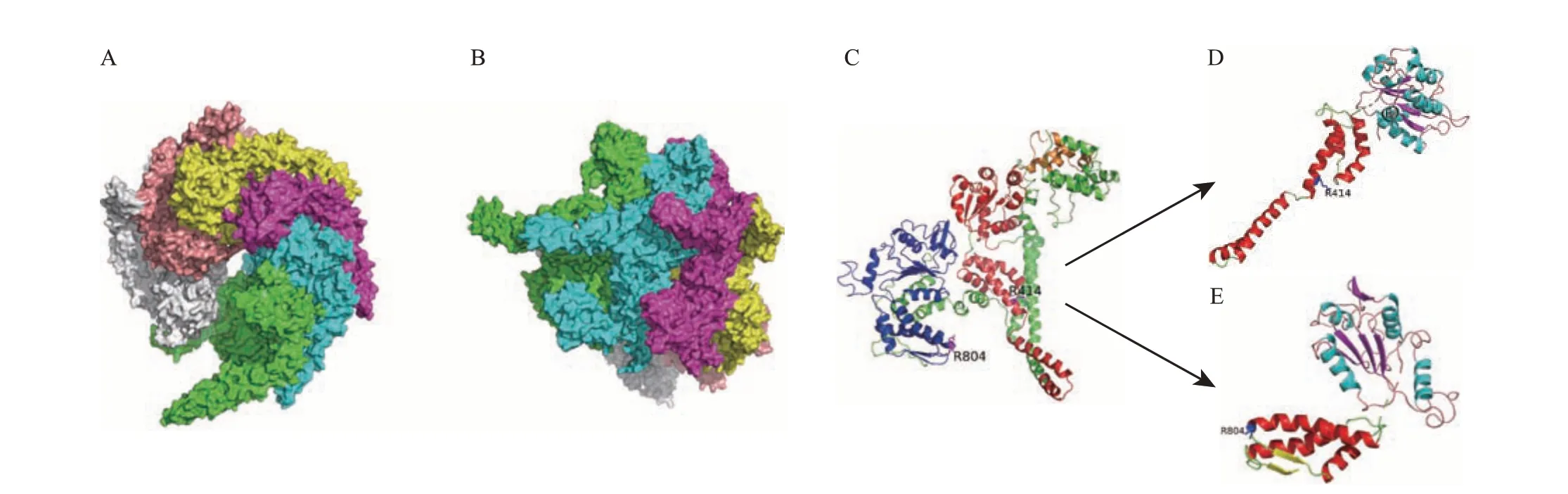
图7 迷宫栓孔菌Tg-HSP104-2的三级结构分析Fig.7 Tertiary structure analysis of Tg-HSP104-2 in T. gibbosa
2.3.4 表达情况分析
对Tg-hsp104-1和Tg-hsp104-2进行qRT-PCR分析,结果如图8所示。添加木屑处理组的表达量相较于对照组明显上升,2个基因的表达量在木屑处理第3天时即呈现显著上调趋势,生长后期表达量均有所回落,但都比对照组高。这说明在木屑处理下迷宫栓孔菌HSP100基因表达量有明显上调趋势。

图8 木屑处理不同时间的基因表达情况Fig.8 Gene expression levels at different time under the sawdust treatment
3 讨论与结论
本文探究了迷宫栓孔菌HSPs 家族的分类、功能及结构。HSPs 家族的功能预测结果及HSP100结构分析结果与现有研究[17-18,24-26]较为一致。但通过理化性质分析发现,相较于其他亚类,sHSPs 的稳定性较差。本研究对HSP100 的分类、所属蛋白家族及超家族关系进行了系统阐述,并通过木屑处理下HSP100 基因的表达量分析,推测其与木屑中的次生代谢物质有关,可能参与对有害物质的适应过程。
在大肠埃希菌的ClpB 中,Walker A 基序负责与ATP 结合,而Walker B 基序负责ATP 的水解;Walker A 位于核心β-折叠的第一链和随后的α-螺旋之间,在核苷酸结合和金属离子配位方面发挥重要作用;Walker B 与核心β-折叠的第三链相关,包含参与ATP 水解和金属离子配位的残基[27]。ClpB存在ClpB95 和ClpB80 这2 种亚型,两者为同一个转录本合成的不同亚型,其不同之处在于ClpB95含有一个高度可移动的N-端结构域[28]。在迷宫栓孔菌中,Tg-HSP104-2 具有完整的6 个结构域,而Tg-HSP104-1 不含N-端结构域,与Tg-HSP104-2也不为同一个转录本。
qRT-PCR验证结果表明,2个HSP104基因在木屑处理下表达量都明显上调。这种上调表达可能的原因是白腐菌在利用营养物质时优先利用单糖,之后才利用木质纤维素。木屑中的木质素含有松柏醇、芥子醇和对香豆醇3 种不同类型的苯基丙烷单体,这3 类醇通过共聚化产生了高度抗生物降解的芳香高聚物,因而对绝大多数微生物的攻击均有抗性[29]。在试验初期,迷宫栓孔菌主要利用LNAS培养基中的葡萄糖,加入木屑后,由于木屑中含有抗性代谢物,在用木屑处理初始阶段,处理组相较于对照组可视为胁迫环境,有可能存在一些蛋白聚集情况,而2个HSP104基因与产物的上调表达更有利于对蛋白的解聚,以维持蛋白的功能。热激蛋白对抗性代谢物质刺激作出反应,表达量上升,说明HSP104 在有害物质的胁迫方面可能发挥作用,并在胁迫消除后一段时间内保持一定的含量。
前期研究发现,迷宫栓孔菌在化学染料降解方面有显著作用[30],通过探究其HSPs 家族分类、理化性质及结构,并对筛选出的HSP100 基因进行分析验证,为后续有针对性地构建功能性菌株提供了依据,有助于提高迷宫栓孔菌在染料胁迫环境下的适应能力和降解能力,进而在环境保护与生态修复中发挥作用。此外,通过对迷宫栓孔菌HSPs 家族基因研究,有助于探索白腐菌菌株对逆境的适应机制,提高其在不同环境条件下对木质素的降解能力,从而在能源利用方面发挥作用。
