常山胡柚果实不同部位中主要功能性成分分析
2023-12-29余丹丹吴家雄刘英汪丽霞杨兴良叶兴乾陈士国陈健乐
余丹丹,吴家雄,2,刘英,汪丽霞,杨兴良,叶兴乾,2,陈士国,2,陈健乐,2*
(1.浙江大学生物系统工程与食品科学学院,智能食品加工技术与装备国家地方联合工程实验室/浙江省农产品加工技术研究重点实验室/馥莉食品研究院,浙江 杭州 310058;2.浙江大学宁波科创中心,浙江 宁波 315100;3.杭州职业技术学院生态健康学院,浙江 杭州 310018;4.常山县农业农村局,浙江 衢州 324299)
常山胡柚(Citrus×aurantiumL.Changshanhuyou)作为浙江省的地方优势特色柑橘品种,主产于浙江省衢州市常山、龙游等地,以常山为重点产区。常山胡柚又名常山柚橙,是芸香科植物酸橙的栽培变种[1],具有独特的风味,且含有丰富的生理活性成分,是较适合精深加工与深度挖掘开发的柑橘品种之一。目前,常山胡柚深加工产品种类主要包括胡柚汁胞饮料、糖水胡柚罐头、胡柚囊胞罐头、胡柚皮蜜饯等[2]。其非可食部位(白皮层和油胞层)约占全果质量的1/3,榨汁后又会产生1/3 左右的加工副产物(果渣和籽),它们大部分被当作垃圾丢弃,造成生态资源浪费[3]。
柑橘类果实的主要功能性成分包括多酚类物质(黄酮类化合物和酚酸类)、果胶类物质、类柠檬苦素等。随着常山胡柚皮、胡柚青果的功效成分及药用价值相继被发现,赵雪梅等[4-5]对常山胡柚成熟果皮中的挥发性成分、黄酮类成分进行了分离提取,并对相关成分的抗氧化活性、免疫生物活性做了大量的研究工作。对常山胡柚果实不同部位中总黄酮、总酚、柠檬苦素的含量,以及不同发育阶段胡柚小青果和枳壳中黄酮类化合物含量变化的相关研究也有报道[3,6-7]。以往的研究多关注于胡柚皮或者皮渣中主要的黄酮类化合物如柚皮苷、圣草次苷和新橙皮苷等,且检测到的种类较少,而对于胡柚果实5个不同部位(果实油胞层、白皮层、囊衣、汁胞和籽)中多酚类物质的全面分析及比较鲜见报道。柑橘果皮或皮渣作为果胶多糖的主要加工来源,其传统提取方法包括热水煮提、酸碱提取和酶法提取等,但传统提取方法提取率低,且提取过程中pH值等剧烈变化会导致多糖结构发生改变。果胶多糖的新兴提取方法包括超声波辅助提取、微波提取、亚临界水萃取和高压提取等,这些方法的作用原理是通过电磁、声波或高压等造成细胞壁结构破坏,从而促进多糖释放,但相关设备价格昂贵,且高压或声波处理会造成多糖中性侧链降解,导致天然多糖靶向提取过程中提取方式对多糖结构产生较大影响[8-10]。作为研究植物细胞壁结构的常用方法,顺序提取技术将热水提取、螯合剂提取、弱酸/碱提取等方法组合,分步提取出不同结构的植物多糖,具有提取率较高、对多糖结构破坏小等优势[11-12]。在该提取技术中,主要步骤螯合剂提取常采用1,2-环己二胺四乙酸[(1, 2-cyclohexylenedinitrilo)-tetraacetic acid, CDTA]或乙二胺四乙酸(ethylenediamine tetraacetic acid, EDTA)螯合钙、镁等金属离子,将以钙盐或镁盐等形式存在的原果胶有效转化为水溶性果胶并浸提出来;弱碱提取常采用低浓度碳酸钠(Na2CO3)或氢氧化钠(NaOH)处理上一步的残渣,可提取细胞壁中与半纤维素结合的果胶多糖,从而充分提取剩余的果胶多糖。淀粉由α-1,4 糖苷键连接葡萄糖而成,为避免样品中残余的淀粉干扰后续多糖结构的测定,通常采用淀粉酶水解法去除样品中的淀粉[13]。因此,本研究采用淀粉酶辅助EDTA 溶液-NaOH 溶液顺序提取法提取胡柚果实不同部位中的果胶多糖,并通过比较果实不同部位中21 种柑橘黄酮类化合物成分、9 种酚酸类成分和果胶多糖的含量,探索胡柚(果实油胞层、白皮层、囊衣、汁胞和籽)中功能性成分的分离和纯化方法,拓展其利用途径,以期提高胡柚的附加值,促进常山胡柚产业的健康发展。
1 材料与方法
1.1 材料与试剂
原料:选用充分成熟、新鲜采摘、无腐烂变质的常山胡柚鲜果为实验原料,所有原料均于2021年12月采摘于常山胡柚的原产地浙江省衢州市常山县。
标准品:圣草次苷、柚皮芸香苷、柚皮苷、橙皮苷、新橙皮苷、野漆树苷、地奥司明、槲皮苷、香蜂草苷、枸橘苷、槲皮素、柚皮素、橙皮素、山柰酚、香叶木素、甜橙黄酮、川陈皮素、橘皮素、去甲基川陈皮素、阿魏酸、咖啡酸、绿原酸、没食子酸、芦丁、新北美圣草苷,均购自上海安谱实验科技股份有限公司;原儿茶酸、香草酸、对羟基苯甲酸、对香豆酸、芥子酸,均购自上海源叶生物科技有限公司;岩藻糖(fucose, Fuc)、鼠李糖(rhamnose, Rha)、阿拉伯糖(arabinose, Ara)、半乳糖(galactose, Gal)、葡萄糖(glucose, Glu)、甘露糖(mannose, Man)、木糖(xylose,Xyl)、半乳糖醛酸(galacturonic acid, GalA)、葡糖醛酸(glucuronic acid, GlcA),均购自西格玛-奥德里奇(上海)贸易有限公司。
试剂:三氟乙酸、耐高温α-淀粉酶、EDTA,均购自阿拉丁试剂(上海)有限公司;甲醇、甲酸(色谱纯),均购自德国Merck公司;NaOH、盐酸(HCl),均购自国药集团化学试剂有限公司。
1.2 仪器与设备
超高效液相色谱仪(Waters ACQUITY UPLC,美国Waters公司)、串联四极杆质谱仪(Waters Xevo TQ-XS,美国Waters 公司)、去离子水发生器(Mili-Q,美国Millipore 公司)、离子色谱仪(ICS-5000,美国Thermo Fisher Scientific 公司)、高效液相色谱仪(Waters e2695,美国Waters 公司)、多角度光散射仪(DAWN HELEOS Ⅱ,美国Wyatt 技术公司)、示差检测器(RID-20A,日本岛津公司)、旋涡混合器(MS3,德国IKA公司)、可视孔氮吹仪(NK200-1B,杭州米欧仪器有限公司)、全自动样品快速研磨仪(JXFSTPRP-24L,上海净信实业发展有限公司)。
1.3 实验方法
1.3.1 原料前处理
1.3.1.1 预处理
取新鲜的常山胡柚鲜果30只,将其洗净、擦干,削皮机处理得到油胞层,再剥皮得到白皮层,剥去囊衣、取籽,得到囊衣、汁胞和籽,分别称量各部位质量,并计算各部位在鲜果中的占比(图1)。随后,取常山胡柚果实不同部位进行冻干,其中汁胞先粉碎均匀后再冻干,其余样品冻干后各自粉碎混匀,再取样采用快速研磨仪充分研磨混合,备用。

图1 常山胡柚果实不同部位的视图及其在鲜果中的占比Fig.1 Views of different parts of Citrus×aurantium L.Changshanhuyou and their proportions of fresh fruits
1.3.1.2 多酚类物质提取
参照ZHANG等[14]的多酚类物质提取方法,精确称取100.0 mg 样品粉末置于10 mL 离心管中,加入80%甲醇溶液3 mL,再加入3粒钢珠,以60 Hz振荡60 s破坏细胞壁;再避光振荡浸泡1 h后,取出钢珠,加入100 μL 80%甲醇溶液冲洗2 次,以8 000 r/min离心5 min,收集上清液;沉淀中加入无水甲醇3 mL,避光振荡浸泡1 h后,以8 000 r/min离心5 min,收集上清液;沉淀中加入无水甲醇3 mL 并重复上述操作;合并3次上清液,即为待测样品。
1.3.1.3 果胶多糖提取
参照YU等[15]的果胶多糖提取方法,收集1.3.1.2节中沉淀后于45 ℃下减压干燥,先采用淀粉酶辅助EDTA 溶液提取法(amylase-assisted EDTA solution extraction, AESE),向干燥样品加入2.0 mL 0.05 mol/L EDTA溶液(用氨水调节溶液pH值至6.5),加入2粒钢珠,以60 Hz振荡混合60 s;再加入200 μL耐高温α-淀粉酶溶液,在90 ℃水浴中振荡提取2 h,然后以60 Hz振荡混合60 s。将混合液冷却至室温,取出钢珠,加入1 mol/L HCl 溶液调节pH 值至3.0 并维持5 min灭酶,再用3 mol/L NaOH溶液调节pH值至6.0~7.0,以10 000 r/min离心10 min,收集上清液作为淀粉酶辅助EDTA溶液提取物。采用NaOH溶液提取法(NaOH solution extraction, NSE),向去除上清液后的沉淀加入0.05 mol/L NaOH 溶液(含20 mmol/L NaBH4)2 mL,在25 ℃下提取1 h 后,用0.3 mol/L HCl溶液调整pH值至6.0~7.0,以10 000 r/min离心10 min,收集上清液作为NaOH溶液提取物。
按体积比1∶2分别向上述淀粉酶辅助EDTA溶液提取物、NaOH溶液提取物中加入无水乙醇,混匀后在4 ℃下静置2 h,以10 000 r/min离心10 min,弃上清液;再向沉淀中加入无水乙醇,重复上述操作,以10 000 r/min 离心10 min,弃上清液,将沉淀置于通风橱过夜,并于80 ℃下干燥至恒量,分别得到果胶多糖AESE样品和NSE样品。
1.3.2 多酚类物质含量测定
参照雷美康等[16]的方法,采用超高效液相色谱-串联质谱法对多酚类物质含量进行测定。
色谱条件:使用Waters CORTECS UPLC C18柱(100 mm×2.1 mm,1.6 µm)。流动相A 相为0.1%甲酸溶液,B 相为甲醇。梯度洗脱程序为0~7.0 min,10%~50% B;7.0~10.0 min,50%~80% B;10.0~10.1 min,80%~100% B;10.1~12.0 min,100% B;12.0~12.1 min,100%~10% B;12.1~15.0 min,10% B。柱温为40 ℃,流速为0.3 mL/min,进样量为1 µL,运行时间为15 min。
离子源条件:采用电喷雾离子源(electrospray ionization, ESI),多 反 应 监 测(multiple reaction monitoring, MRM)模式,毛细管电压为0.5 kV,锥孔电压为20 V,脱溶剂气流速为1 000 L/h,脱溶剂气温度为600 ℃,锥孔气流速为150 L/h。校准方法为质量轴自动调谐校正。
1.3.3 果胶多糖的组成及分子量测定
1.3.3.1 单糖组成测定
果胶多糖的单糖组成采用高效阴离子交换色谱-脉冲安培检测法(high-performance anion-exchange chromatography with pulsed amperometric detection,HPAEC-PAD)[17]进行测定。
样品制备:将2 mg 左右果胶多糖样品溶于2 mol/L三氟乙酸水溶液中,并于110 ℃下水解8 h,冷却至室温后,加入甲醇进行氮吹以获得干燥样品,加入6 mL 去离子水溶解样品。样品溶液经0.22 μm水系滤膜过滤后进样。
离子色谱条件:色谱系统配备脉冲安培检测器。分析柱为CarboPac-PA10(4 mm×250 mm)。洗脱条件为18 mmol/L NaOH 溶液洗脱15 min,含有18 mmol/L NaOH 的CH3COONa 溶液(100 mmol/L)洗脱35 min;流速为1 mL/min,柱温为30 ℃,进样量为25 μL。
1.3.3.2 分子量测定
果胶分子量的测定参照CHEN等[18]的方法。
通过尺寸排阻色谱-多角度激光光散射-示差折光检测器联用(size-exclusion chromatography-multiangle laser light scattering-differential refractive index,SEC-MALLS-RI)系统测定果胶的摩尔质量分布等指标。SEC-MALLS-RI系统包括LC-20高效液相色谱仪,Shodex OH SB-G、SB-804 HQ(8.0 mm×300 mm,10 μm;排 阻 限1×106)和SB-806 HQ(8.0 mm×300 mm,13 μm;排阻限2×107)色谱柱联用,DAWN HELEOS Ⅱ多角度光散射仪(λ0=660 nm)以及RID-20A示差检测器。
样品前处理:将果胶多糖样品溶于0.15 mol/L NaCl中制成3 mg/mL溶液,磁力搅拌溶解过夜。用0.22 μm水系滤膜过滤后进样。
色谱条件:流动相为0.15 mol/L NaCl 溶液(含抑菌剂Proclin 300,pH 7.0),进样量为100 μL,运行时间为60 min,温度为40 ℃,流速为0.5 mL/min。
使用Astra 7.3.2 软件采集和处理数据。所有样品的绝对折射率增量(specific refractive index increment, dn/dc)值定义为0.138 mL/g[19]。
1.4 数据处理与分析
每组实验重复3 次,数据以平均值±标准差表示。采用SPSS 22.0 软件进行单因素方差分析,以评估数据间的差异显著性,以P<0.05 表示差异有统计学意义。采用Origin Pro 7.5软件作图。
2 结果与分析
2.1 常山胡柚果实不同部位的黄酮类化合物组成
一些研究结果显示,柚皮苷和新橙皮苷是常山胡柚中含量最高的成分,也可作为胡柚皮药材指纹图谱中已鉴别的特征指纹峰成分[14,20]。本研究发现,胡柚油胞层和白皮层中另外一种成分新北美圣草苷的质量分数较高,分别可达3 741.45 μg/g(按干质量计,下同)和6 270.24 μg/g(表1)。已有文献报道新北美圣草苷是枳壳、骨碎补中的主要药效成分[21-22],郑雪良等[7]发现胡柚小青果中新北美圣草苷的质量分数为3.32~17.65 mg/g,均显著高于枳壳。与柚皮苷相比,新北美圣草苷对小鼠成骨细胞株MC3T3-E1细胞的体外增殖和成骨分化具有更显著的促进作用,具有治疗骨质疏松症的潜力[23-24]。另外,胡柚油胞层中的柚皮芸香苷、圣草次苷、槲皮苷含量均高于柚皮苷,白皮层和囊衣中的柚皮芸香苷含量也高于柚皮苷(表1)。由此可见胡柚果皮层(包括油胞层和白皮层)、囊衣不仅是柚皮苷和新橙皮苷的重要来源,也可作为新北美圣草苷、柚皮芸香苷、圣草次苷、槲皮苷的加工原料。尤其是胡柚果皮层和囊衣中含有丰富的新北美圣草苷,可作为治疗骨质疏松症活性成分新的加工来源,具有极大的开发价值。

表1 常山胡柚果实不同部位的黄酮类化合物含量(按干质量计)Table 1 Flavonoid contents in different parts of Citrus×aurantium L. Changshanhuyou fruits (by dry mass)μg/g
由表1 可知,常山胡柚果实不同部位的黄酮类化合物以黄烷酮类为主,其中,比较5个部位中含量较高的7种成分(新北美圣草苷、新橙皮苷、柚皮芸香苷、圣草次苷、柚皮苷、橙皮苷、枸橘苷),发现白皮层中各成分含量均最高。胡柚白皮层和囊衣中质量分数最高的均为新橙皮苷,分别为13 700.72 μg/g 和4 186.94 μg/g;油胞层中含量最高的是新北美圣草苷,其次是新橙皮苷和柚皮芸香苷;汁胞中柚皮芸香苷的质量分数最高,为1 894.80 μg/g,其次是柚皮苷;籽中质量分数最高的是柚皮芸香苷(160.85 μg/g),但是与其他部位相比,籽中以上7种成分含量均最低。由此可知,胡柚不同部位的优势成分不同。过去对胡柚各部位黄酮类化合物组成的研究主要集中在黄烷酮类上,且检测到的种类较少。ZHANG 等[25]发现柚皮苷和新橙皮苷在胡柚白皮层中含量最高,其次是在囊衣、油胞层、汁胞中。赵四清等[26]比较了胡柚果实不同部位中的柚皮苷、新橙皮苷、橙皮苷含量,发现各成分含量在不同部位的排序为果皮>囊衣>果肉。本研究发现,黄烷酮类成分更多集中在胡柚白皮层中,而油胞层中黄酮和多甲氧基黄酮类含量总体上比其他部位更高,尤其是油胞层中的川陈皮素、橘皮素、地奥司明、去甲基川陈皮素含量较高,此与上述研究结果基本一致。
2.2 常山胡柚果实不同部位的酚酸类物质组成
由表2 可知,胡柚油胞层、白皮层、囊衣、汁胞中肉桂酸类含量均高于苯甲酸类。油胞层中肉桂酸类含量最高,其中芥子酸和阿魏酸质量分数分别为55.49 μg/g 和46.54 μg/g;苯甲酸类以香草酸和对羟基苯甲酸为主,2 种成分在油胞层中含量最高,其次是在白皮层中。江萍等[27]比较了5 大类(宽皮橘类、甜橙类、柠檬、柚类、葡萄柚类)共15 种柑橘果皮中主要的酚酸类组成,得出各大类柑橘果皮中肉桂酸类的含量显著高于苯甲酸类,且胡柚果皮中阿魏酸含量最高。SUN 等[28]发现胡柚果肉中对羟基苯甲酸、咖啡酸含量较高,而芥子酸、阿魏酸、香草酸含量较低。聂嘉琳等[29]分析了6 种柚果实中的酚酸类组分与含量差异,发现果皮中酚酸含量总体上高于果肉,且油胞层和白皮层中均以对香豆酸、阿魏酸和芥子酸为主,白皮层中酚酸含量更低,而果肉中则以芥子酸、阿魏酸和香草酸为主;与其他品种柚果实不同的是,胡柚中对香豆酸含量偏低。关于胡柚各部位中酚酸含量的研究不多,且研究结果差异较大,这可能与各研究使用的提取方法不同有关,也可能与胡柚的品种、产地或成熟度不同有关。
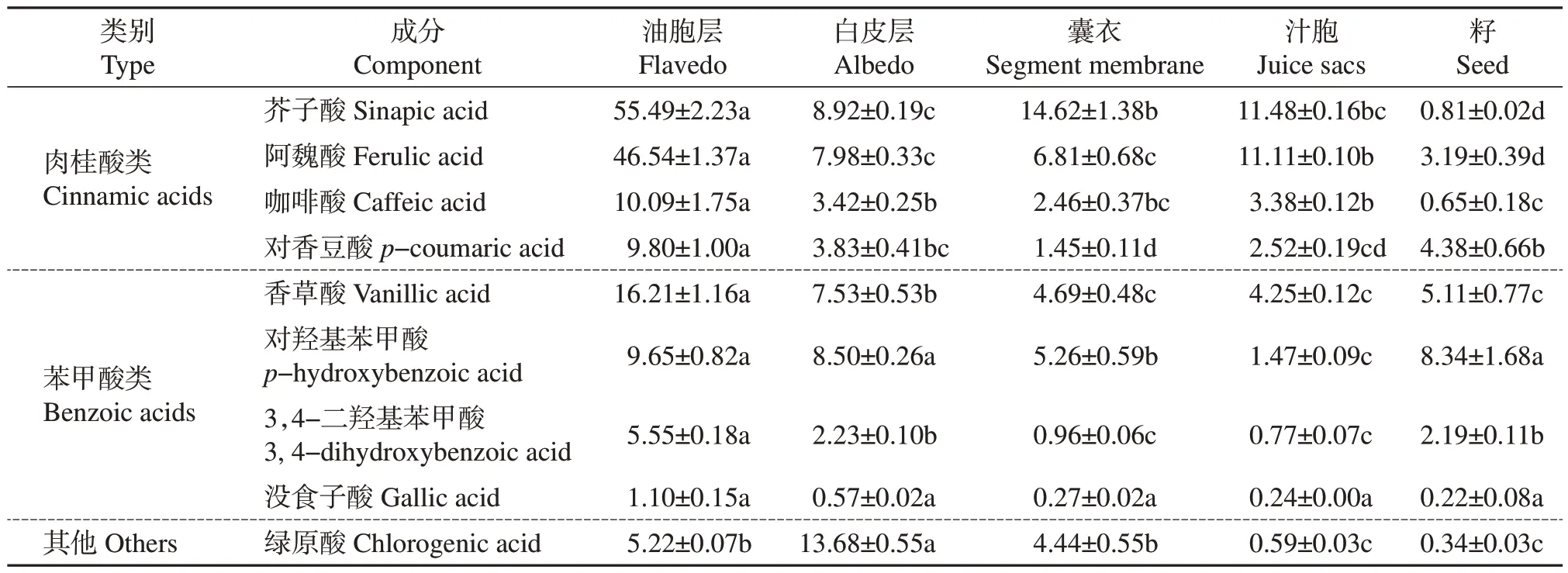
表2 常山胡柚果实不同部位的酚酸类含量(按干质量计)Table 2 Phenolic acid contents in different parts of Citrus×aurantium L. Changshanhuyou fruits (by dry mass) μg/g
2.3 常山胡柚果实不同部位的果胶多糖组成及其性质比较
本研究比较了常山胡柚果实不同部位的果胶多糖得率,由图2 可知,油胞层、白皮层、囊衣AESE样品的果胶多糖得率显著高于籽和汁胞,在白皮层中可达27.46%。张妍楠[30]采用EDTA-2Na溶剂提取法提取胡柚果皮中果胶,得率可达26.31%,且该果胶具有良好的乳化性和增稠性。WANG等[31]研究结果显示,超声波辅助提取的胡柚皮果胶得率最高可达27.34%。本研究结果与上述研究相近,说明采用AESE时,果胶提取效果优异。对各部位经淀粉酶辅助EDTA溶液提取后的沉淀采用NaOH溶液再次提取,发现仍能提取出多糖类物质,且得率较高,其中油胞层的NSE样品果胶多糖得率最高(11.30%),汁胞的NSE 样品果胶多糖得率最低(3.46%),说明AESE 仍不能完全提取出全部的细胞壁果胶多糖。因此,相较于单一提取法,顺序提取法更有利于提高果胶多糖的提取率。
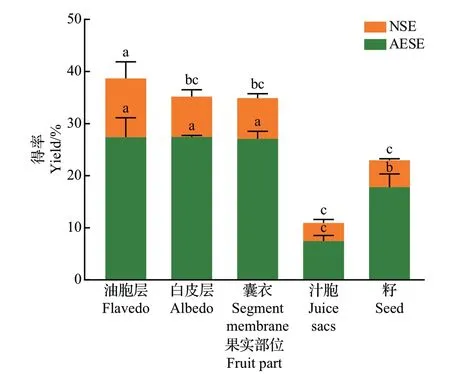
图2 常山胡柚果实不同部位的果胶多糖得率Fig.2 Yields of pectin polysaccharides in different parts of Citrus×aurantium L. Changshanhuyou fruits
比较常山胡柚5 个部位果胶多糖的单糖组成,结果(表3)发现,各部位果胶多糖在单糖组成上相似,主要为半乳糖醛酸、阿拉伯糖、鼠李糖、半乳糖和葡萄糖。其中,油胞层、白皮层、囊衣、籽NSE 样品的果胶多糖中半乳糖醛酸含量最高,其次为阿拉伯糖;而油胞层和汁胞AESE 样品的果胶多糖中阿拉伯糖含量高于半乳糖醛酸。不同于其他部位,汁胞AESE 样品的果胶多糖中葡萄糖含量最高,这可能与其中存在游离葡萄糖和淀粉干扰有关。比较不同部位果胶多糖中同型半乳糖醛酸聚糖(homogalacturonan, HG)和鼠李半乳糖醛酸聚糖Ⅰ型(rhamnogalacturonan-Ⅰ, RG-Ⅰ)结构域占比,发现白皮层AESE和NSE样品的果胶多糖具有最高的HG结构域占比,分别为31.65%和39.45%(表3)。本研究中胡柚5个部位AESE和NSE样品的果胶多糖RG-Ⅰ结构域占比多在40%~60%,其中汁胞NSE 样品的果胶多糖中RG-Ⅰ结构域占比最高,为73.28%。上述结果表明,采用AESE 和NSE 方法得到的胡柚不同部位的果胶多糖具有半乳糖醛酸含量不高、中性糖侧链较多的特点。结合得率来看,如需获得高RG-Ⅰ结构域占比的果胶多糖,油胞层和囊衣是较好的提取部位。

表3 常山胡柚果实不同部位果胶多糖的单糖组成Table 3 Monosaccharide compositions of pectin polysaccharides in different parts of Citrus×aurantium L. Changshanhuyou fruits%
高分子的分子量表示方法中,重均分子量(Mw)和数均分子量(Mn)最为常用。如表4 所示,胡柚油胞层、白皮层、囊衣NSE 样品果胶多糖的上述分子量都小于AESE样品,但籽中的结果却大部分相反。AESE 和NSE 方法提取的油胞层的果胶多糖重均分子量均最高,分别为6.888×105g/mol 和2.343×105g/mol,而囊衣、汁胞和籽中的果胶多糖重均分子量相近。多糖一般都是多分散的化合物,具有较宽的分子量分布。重均分子量与数均分子量的比值称为多分散指数(Mw/Mn),用来表征聚合物分子量分布宽度,其比值越大表明分子量分布越宽[18]。油胞层和籽NSE 样品的果胶多糖具有较大的多分散指数,说明该类聚合物分子量分布较宽、成分较复杂。均方根旋转半径(Rz)可以衡量分子尺寸,Rz越小,表明分子尺寸越小、分子结合越紧密[18]。与NSE样品的果胶多糖相比,AESE样品的果胶多糖具有更大的均方根旋转半径。这说明NSE样品的果胶多糖分子结构更加紧密,这可能与其丰富的中性糖侧链和复杂的结构有关。综上所述,胡柚皮的油胞层和白皮层的果胶多糖性质差异较大,若作为果胶加工原料,宜将油胞层和白皮层分开后再分别进行果胶提取。
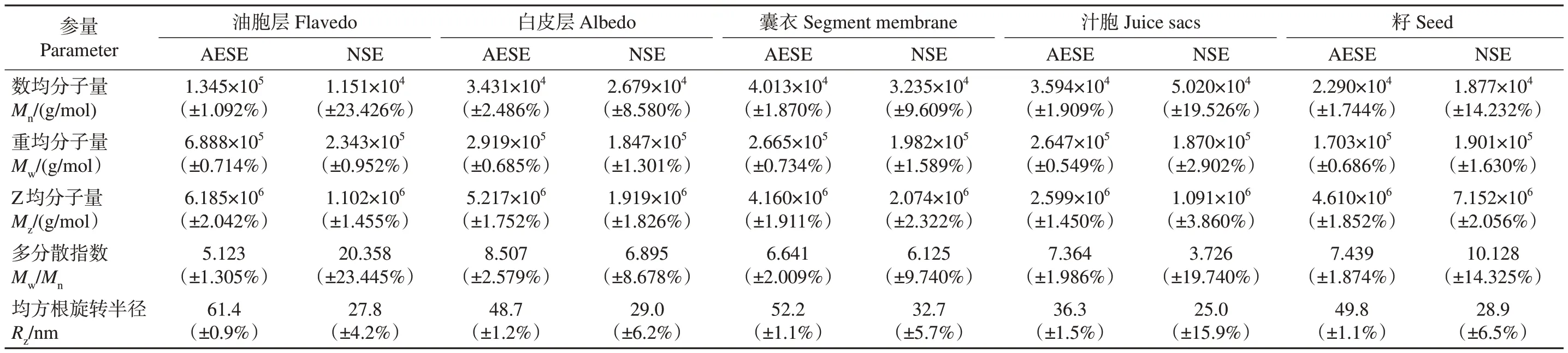
表4 常山胡柚果实不同部位果胶多糖的分子量Table 4 Molecular weights of pectin polysaccharides in different parts of Citrus×aurantium L.Changshanhuyou fruits
3 结论
本研究全面分析了常山胡柚果实油胞层、白皮层、囊衣、汁胞和籽5 个部位中黄酮类化合物、酚酸类、果胶多糖组成。超高效液相色谱-串联质谱法可同步快速检测胡柚不同部位中30 种柑橘多酚类物质。本研究表明胡柚各部位黄酮类化合物以黄烷酮类为主,与前人研究结果一致。胡柚油胞层、白皮层和囊衣中含有丰富的新北美圣草苷、新橙皮苷、柚皮芸香苷、圣草次苷、柚皮苷、橙皮苷、槲皮苷,尤其是白皮层中的新北美圣草苷、新橙皮苷含量较高。采用淀粉酶辅助EDTA 溶液-NaOH 溶液顺序提取法提取胡柚各部位果胶多糖,发现油胞层、白皮层、囊衣的果胶多糖得率较高;AESE 和NSE 2种方法得到的果胶多糖均主要由半乳糖醛酸和阿拉伯糖组成,其中油胞层和汁胞的果胶多糖中RG-Ⅰ结构域占比均大于50%。由此可见,常山胡柚油胞层、白皮层和囊衣可作为黄酮类化合物和果胶的加工来源,分离纯化后的常山胡柚黄酮类化合物可进一步开发为功能产品及药物原料。胡柚加工过程中伴随大量加工副产物产生,若能结合现代高新技术加以充分利用,不仅能够提高胡柚加工产业的经济效益,而且可以减少环境污染。
